Возможности патогенетической терапии новой коронавирусной инфекции
DOI: 10.32364/2587-6821-2020-4-4-192-198
Цель исследования: оценить клиническую эффективность азоксимера бромида для включения в комплексную терапию госпитализированных пациентов с COVID-19.
Материал и методы: в исследование были включены 20 пациентов в возрасте от 16 до 65 лет с подтвержденным диагнозом новой коронавирусной инфекции средней степени тяжести, находившиеся на стационарном лечении. Пациенты были разделены на 2 группы: основную (n=10 человек), в комплексную терапию которых был включен азоксимера бромид, и группу сравнения (n=10 человек), которые получали только стандартную терапию без применения иммунокоррекции. В качестве критериев оценки эффективности терапии оценивали динамику основных симптомов заболевания, динамику рентгенологической картины заболевания, а также динамику лабораторных показателей, характеризующих воспаление.
Результаты исследования: включение азоксимера бромида в состав комплексного лечения новой коронавирусной инфекции позволяет быстрее купировать основные симптомы заболевания (кашель, отделение мокроты, лихорадку, частоту дыхания) по сравнению с пациентами, в лечении которых не применялся данный препарат (р<0,05). На фоне применения азоксимера бромида отмечается более быстрое уменьшение объема поражения паренхимы легких по данным мультиспиральной компьютерной томографии: процент поражения паренхимы легких уменьшился до 5% на 14-й день лечения при применении азоксимера бромида, в группе сравнения процент поражения паренхимы легких на 14-й день снизился до 10–12%, р<0,05), а также положительная динамика лабораторных признаков воспаления (отмечено снижение количества лейкоцитов до нормы и уменьшение значения СОЭ, р<0,05).
Заключение: включение азоксимера бромида в комплексную терапию больных новой коронавирусной инфекцией сопровождалось положительной клинической динамикой, проявляющейся более быстрым купированием общевоспалительного синдрома и синдрома поражения легочной ткани по сравнению с пациентами, которые находились только на стандартной терапии, без применения иммунокоррекции. Побочных эффектов при применении препарата не отмечалось.
Ключевые слова: коронавирусная инфекция, SARS-CoV2, COVID-19, пневмония, иммунокоррекция, патогенетическая терапия, азоксимера бромид.
Для цитирования: Мухамадиева Л.Р., Мавзютова Г.А., Тюрина Е.Б., Кузовкина О.З. Возможности патогенетической терапии новой коронавирусной инфекции. РМЖ. Медицинское обозрение. 2020;4(4):192-198. DOI: 10.32364/2587-6821-2020-4-4-192-198.
L.R. Mukhamadieva1, G.A. Mavzyutova1, E.B. Tyurina2, O.Z. Kuzovkina2
1Bashkir State Medical University, Ufa, Russian Federation
2City Clinical Hospital No. 5 of the city of Ufa, Ufa, Russian Federation
Aim: to assess clinical efficacy of azoximer bromide in the complex inpatient treatment for COVID-19.
Patients and Methods: the study included 20 patients aged 16–65 years with verified moderate novel coronavirus infection who received inpatient care. All patients were divided into two groups. Study group patients (n=10) received complex treatment that included azoximer bromide. Control group patients (n=10) received standard therapy only. The criterion of treatment efficacy was the improvement of major disease symptoms, radiographic manifestations, and pro-inflammatory laboratory tests.
Results: azoximer bromide as a component of the treatment for novel coronavirus infection provides more rapid symptom relief (i.e., cough, sputum, fever, respiratory rate) compared to the standard therapy (p<0.05). azoximer bromide also provides more rapid radiographic improvement as demonstrated by helical computed tomography, i.e., by day 14, the percentage of lung parenchyma involved was 5% in the study group and 10–12% in the control group (p<0.05). In addition, the improvement of pro-inflammatory laboratory tests (i.e., normal WBC count, decrease in ESR) was revealed as well (p<0.05).
Conclusion: azoximer bromide as a component of the complex treatment for novel coronavirus infection is associated with the clinical improvement that manifests with more rapid relief of inflammation and lung parenchyma involvement as compared with the standard therapy. N o adverse reactions were reported.
Keywords: coronavirus infection, SARS-CoV2, COVID-19, pneumonia, immune correction, pathogenetically-oriented therapy, azoximer bromide.
For citation: Mukhamadieva L.R., Mavzyutova G.A., Tyurina E.B., Kuzovkina O.Z. Pathogenetically-oriented therapy for novel coronavirus infection. Russian Medical Inquiry. 2020;4(4):–198. DOI: 10.32364/2587-6821-2020-4-4-192-198.
Введение
Известно, что особенностью иммунного ответа на коронавирусы является чрезмерная активация иммунной системы («цитокиновый шторм»), которая приводит к повреждению клеток и тканей организма. Коронавирус вызывает гибель Т-лимфоцитов. Поздние стадии инфекции характеризуются истощением Т-клеточного звена иммунной системы, что приводит к задержке элиминации вируса из организма [1]. «Цитокиновый шторм» сопровождается выбросом в циркулирующую кровь ряда провоспалительных цитокинов, таких как интерлейкин ИЛ-6, ИЛ-1 и фактор некроза опухоли альфа (ФНО-α). Вместе с тем наблюдается супрессия иммунных механизмов, отвечающих за ограничение воспалительной реакции, снижается количество иммунных клеток [1, 2]. В исследованиях, проведенных нами, у пациентов с тяжелой внебольничной пневмонией (ВП) было показано, что применение азоксимера бромида позволяет снизить концентрацию ИЛ-6 в 1,6 раза по сравнению с группой, которая не применяла этот препарат (37 против 59 пг/мл, p<0,05), также нами отмечено и снижение уровня ФНО-α у этих пациентов [3].
Показано, что одним из факторов, приводящих к усилению симптомов интоксикации и воспаления, а также ведущих к увеличению тяжести течения инфекционного заболевания, является образование нейтрофильных внеклеточных ловушек (НВЛ) [4, 5]. При встрече с возбудителем заболевания нейтрофил выбрасывает во внеклеточное пространство сети, состоящие из ДНК, гистонов и содержимого секреторных гранул. Образуется подобие трехмерной сети-ловушки, в которую должен попасть патоген и погибнуть под воздействием токсических веществ. При этом вещества, содержащиеся в НВЛ, токсичны не только для инфекционных агентов, но и для собственных клеток организма. В результате усугубляется повреждение слизистой оболочки, увеличивается количество слизи, что может привести к обструкции дыхательных путей, а также к формированию биопленок и присоединению в дальнейшем бактериальной инфекции. Формирование НВЛ в капиллярах повышает вязкость крови и приводит к образованию тромбов. В недавно завершенных исследованиях было обнаружено, что у пациентов с COVID-19 в крови повышены специфические маркеры образования НВЛ по сравнению со здоровыми добровольцами [6]. Кроме того, количество этих маркеров повышается у пациентов с тяжелым течением заболевания по сравнению с пациентами с более легким течением. Авторы исследования сделали вывод, что уровень образования НВЛ при COVID-19 может быть связан с тяжестью течения заболевания. В исследованиях in vitro показано, что азоксимера бромид способен подавлять формирование НВЛ, активируя при этом фагоцитоз [4].
Эффективность и безопасность азоксимера бромида подтверждены клиническими исследованиями. Так, в 2017 г. завершено исследование PASS (Post Autho-risation Safety Study) — многоцентровое проспективное открытое неинтервенционное пострегистрационное исследование безопасности азоксимера бромида в Европе (Словакия). В исследовании приняли участие 502 пациента в 15 исследовательских центрах. В исследование были включены пациенты со следующими заболеваниями: хроническая рецидивирующая бактериальная инфекция (n=194), хроническая рецидивирующая вирусная инфекция (n=209), острая бактериальная инфекция (n=18), острая вирусная инфекция (n=23) и аллергические заболевания, сопровождающиеся вторичным иммунодефицитом (n=58). 90% участников исследования отметили улучшение состояния во время лечения. Профиль безопасности был подтвержден у всех категорий пациентов [7].
В 2019 г. опубликован метаанализ данных клинических исследований эффективности азоксимера бромида в лечении инфекционно-воспалительных заболеваний дыхательных путей у детей в возрасте от 3 до 18 лет. Всего проанализированы данные 5 клинических исследований с участием 542 пациентов. Метаанализ показал, что добавление азоксимера бромида к терапии инфекционно-воспалительных заболеваний дыхательных путей способствует сокращению срока нормализации температуры тела (по сравнению с приемом плацебо или стандартной терапией без добавления азоксимера бромида), продолжительности симптомов интоксикации, симптомов острого воспаления верхних дыхательных путей [5].
С учетом спектра свойств азоксимера бромида (иммуномодулирующее, детоксицирующее, антиоксидантное, противовоспалительное и мембранопротекторное свойства) данный препарат представляется перспективным для применения в комплексной терапии новой коронавирусной инфекции.
Уже есть первый успешный опыт применения азоксимера бромида в Словакии при новой коронавирусной инфекции SARS-CoV-2, на основании которого он внесен в клинические рекомендации этой страны по лечению пациентов с COVID-19 [8].
Одобрено Министерством здравоохранения РФ и начато международное многоцентровое двойное слепое плацебо-контролируемое адаптивное рандомизированное сравнительное исследование эффективности и безопасности азоксимера бромида лиофилизата для приготовления раствора для инъекций 6 мг в терапии госпитализированных пациентов с COVID-19 в России.
Цель исследования: оценить клиническую эффективность азоксимера бромида для включения в комплексную терапию госпитализированных пациентов с COVID-19.
Материал и методы
Дизайн исследования
Под наблюдением находилось 20 пациентов, проходивших лечение в стационаре на базе ГБУЗ РБ ГКБ № 5 г. Уфы, в отделении по лечению новой коронавирусной инфекции COVID-19.
При поступлении пациенты предъявляли жалобы на острое начало заболевания, появление озноба, повышение температуры, кашель, появление боли и ощущение заложенности в грудной клетке, одышки, болезненные ощущения в мышцах.
Критерии включения в исследование:
возраст от 18 до 65 лет;
диагноз: новая коронавирусная инфекция COVID-19 (подтвержденная), среднетяжелая форма. Внебольничная вирусно-бактериальная двусторонняя полисегментарная пневмония средней степени тяжести. Дыхательная недостаточность II степени. Степень выявленных изменений по данным мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки — КТ-2 (визуальный объем поражения легких — от 25 до 50%).
Критерии невключения в исследование:
возраст моложе 16 лет и старше 65 лет;
беременность и лактация;
туберкулез легких;
рак легких;
иммуномодифицирующие заболевания (хроническая обструктивная болезнь легких, заболевания почек, печени, эндокринных органов, гематологические заболевания, болезни суставов и соединительной ткани).
У всех пациентов, включенных в исследование, получено информированное согласие на проведение обследования и лечения.
Комплексное обследование всех пациентов проводилось дважды — в день поступления больных в стационар и через 14 дней после начала лечения. Общеклиническое обследование больных проводили в соответствии с медико-экономическими стандартами:
общий анализ крови;
общий анализ мочи;
биохимический анализ крови;
определение методом полимеразной цепной реакции (ПЦР) в мазках со слизистой оболочки носоглотки РНК коронавируса (SARS-CoV-2);
пульсоксиметрия;
мультиспиральная компьютерная томография (МСКТ) органов грудной клетки в динамике;
электрокардиография (ЭКГ).
Клиническая характеристика больных
Средний возраст больных, включенных в исследование и находившихся на стационарном лечении, составил 43±1,3 года. Среди исследуемых больных было 10 мужчин (50%) и 10 женщин (50%). При поступлении на стационарное лечение пациенты предъявляли жалобы на кашель в 100% случаев, одышку (60%), боль в грудной клетке (70%), высокую температуру тела (100%), слабость (100%).
Повышение температуры тела беспокоило всех больных, однако температурная реакция была различна: у 8 человек она была субфебрильной (до 38 °С), у 8 носила умеренно лихорадочный характер (38–39 °С), у 4 больных была высоколихорадочной (39–41 °С). Характер кашля был разнообразным: сухой кашель наблюдался у 6 (30%) больных, влажный со слизистой мокротой — у 11 (55%), влажный с гнойной мокротой — у 3 (15%).
В настоящем исследовании больным проводилась МСКТ органов грудной клетки (ОГК) в динамике: до начала лечения (в день поступления больного в стационар), на 12–14-й день лечения и далее по показаниям. Объем поражения легочной ткани соответствовал степени тяжести пневмонии. У больных на МСКТ в первые дни пребывания в стационаре в большинстве случаев было зарегистрировано полисегментарное двустороннее поражение легких. Процент поражения паренхимы легких в среднем составлял 44% (КТ-2).
При поступлении в стационар лейкоциты были повышены у 5 пациентов до 15,9×109/л (норма — 4–9×109/л), у 3 пациентов наблюдалась лейкопения — 2,6×109/л, у остальных пациентов уровень лейкоцитов составлял 5,9×109/л. Повышение скорости оседания эритроцитов (СОЭ) выше 40 мм/ч (норма — 2–15 мм/ч) отмечалось у всех пациентов.
В биохимическом анализе крови отмечалась качественная положительная реакция на С-реактивный белок (СРБ +++) у 20 (100%) больных, повышение уровня фибриногена выше 5 г/л (норма — 2–4 г/л) — у 6 (30%) больных, у остальных пациентов уровень фибриногена был повышен до 6,5 г/л.
Таким образом, у пациентов отмечались выраженный синдром интоксикации, общевоспалительные изменения, полисегментарное двустороннее поражение легочной ткани. По данным ПЦР, определена РНК коронавируса SARS-CoV-2 в мазках со слизистой оболочки носоглотки.
При госпитализации пациентам назначалась антибактериальная терапия (цефотаксим по 1 г внутримышечно 2 р./сут № 7, азитромицин по 500 мг по 1 таблетке в день № 7), лопинавир + ритонавир 400/100 мг 2 р./сут № 10, с целью дезинтоксикации проводились внутривенные инфузии 0,9% раствора NaCl, глюкозы, раствора Рингера, дозы и кратность вливания зависели от степени тяжести, возраста и показателей гемодинамики. Проводилось также патогенетическое лечение — применялись муколитики (амброксол, бромгексин, алтея лекарственного травы экстракт).
Наблюдаемые пациенты были разделены на 2 группы: основную (n=10), в комплексное лечение которой был включен азоксимера бромид, и группу сравнения (n=10), получавшую только стандартную терапию (без применения иммунокоррекции). Пациенты обеих групп были сопоставимы по полу, возрасту и степени тяжести течения заболевания.
В основной группе пациентам назначался азоксимера бромид в дозе 6 мг внутримышечно 1 р./сут, 3 дня подряд, затем через день. Курс лечения — 10 инъекций.
Статистическая обработка данных проводилась методами описательной, параметрической и непараметрической статистики. Определяли среднюю арифметическую (М), стандартную ошибку средней арифметической (m). Оценку значимости различий показателей проводили с использованием критерия Манна — Уитни для независимых выборок и парного Т-критерия Вилкоксона для зависимых выборок. Применялся дисперсионный анализ и множественные сравнения с поправкой Бонферрони. Различия считали статистически значимыми при р<0,05.
Результаты исследования
У пациентов основной группы отмечалась нормализация частоты дыхания (ЧД), исчезновение таких симптомов, как кашель, отделение мокроты, повышенная температура тела, в среднем на 2 дня раньше, чем в группе сравнения (р<0,05). Снижение количества лейкоцитов и СОЭ на фоне лечения наблюдалось в основной группе, получавшей азоксимера бромид: уровень лейкоцитов при поступлении повышался до 15,9×109/л, СОЭ — до 48 мм/ч, после лечения уровень лейкоцитов в основной группе составил 6,3×109/л, СОЭ — 18,6 мм/ч, в группе сравнения после терапии уровень лейкоцитов — 8,1×109/л, СОЭ — 20,6 мм/ч (р<0,05). У 3 пациентов с лейкопенией при поступлении в стационар уровень лейкоцитов 2,6×109/л в основной группе на фоне комплексной терапии с включением азоксимера бромида достиг уровня нормы и составил 5,1×109/л, СОЭ — 20,6 мм/ч. У больных основной группы на МСКТ на фоне комплексной терапии процент поражения паренхимы легких уменьшился до 5% на 14-й день лечения. В группе сравнения у 4 пациентов процент поражения паренхимы легких на 14-й день лечения, по данным МСКТ, составил до 12%, у остальных пациентов в группе сравнения — до 10% (р<0,05).
Средний срок госпитализации пациентов основной группы и группы сравнения составил 14 дней. Все пациенты хорошо перенесли терапию с включением азоксимера бромида, побочных эффектов не отмечалось.
Клиническое наблюдение
Больной Г., 1975 г. р., поступил 14.04.2020 в приемное отделение с жалобами на боль в грудной клетке, кашель с гнойной мокротой и прожилками крови, слабость, озноб, одышку в покое, предположительный диагноз: новая коронавирусная инфекция COVID-19, среднетяжелая форма.
Из анамнеза известно, что начало болезни отмечает с 10.04.2020, когда появился кашель, повысилась температура тела (39 °С), стали беспокоить одышка, боль в грудной клетке и выраженная слабость. Больной вызвал участкового терапевта на дом 14.04.2020, до этого дня никакого лечения не получал. Врач оценил состояние больного как среднетяжелое, подозрение на новую коронавирусную инфекцию, была вызвана бригада скорой медицинской помощи, доставившая больного в стационар. Пациент находился в командировке 10 дней назад в г. Москве. В молодости больной дважды переносил пневмонию, из других заболеваний отмечает тонзиллэктомию по поводу хронического тонзиллита.
Больной работает менеджером в частном предприятии. Не курит, алкоголь употребляет умеренно. Наследственность не отягощена.
Объективное исследование: вес — 75 кг, рост — 178 см, правильного телосложения. При поступлении в стационар больной находится в сознании, несколько заторможен. Кожные покровы бледные, влажные, акроцианоз, отмечается гипертермия (t=39 °С). Периферические лимфоузлы не увеличены. Костная система без патологии. ЧД 32 в минуту. Дистанционные хрипы не слышны. Тоны сердца приглушены во всех точках, ритмичны, частота сердечных сокращений 100 в минуту. Сатурация крови кислородом SpO2=94%. Пульс слабого наполнения, ритмичный. Артериальное давление на обеих руках 120/80 мм рт. ст. Язык влажный. Живот мягкий, безболезненный. Печень не выступает из-под края реберной дуги. Периферических отеков нет. Физиологические отправления не нарушены. Значение по шкале оценки тяжести пациента NEWS 6 баллов. Состояние больного оценено как среднетяжелое
Данные МСКТ ОГК при поступлении: диффузно в обоих легких субплеврально непротяженные зоны «матового стекла» на фоне тяжистых изменений. КТ-признаки двусторонней полисегментарной пневмонии. Степень вероятности вирусной пневмонии по КТ-признакам высокая. Процент поражения паренхимы легких — до 44%, присвоена категория КТ-2.
С первых часов нахождения больного в стационаре начато его обследование согласно медико-экономическому стандарту: выявление РНК (SARS-CoV-2), МСКТ ОГК, пульсоксиметрия, общий анализ крови, мочи, определение коагулограммы, биохимический анализ крови, ЭКГ, взяты образцы мокроты для бактериологического исследования. Проведено исследование иммунного статуса больного (в т. ч. цитокинового профиля) в 1-й и 13-й дни лечения. Результаты лабораторных обследований пациента и измерения SpO2 представлены в таблице 1.
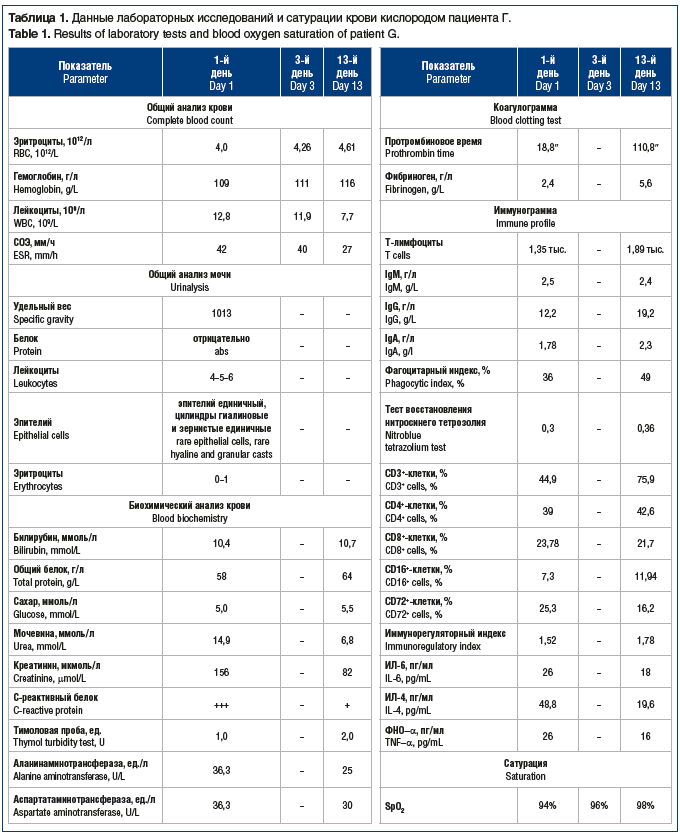
По данным ЭКГ: в 1-й день: синусовая тахикардия с ЧСС 100 в минуту, умеренные неспецифические изменения миокарда заднедиафрагмальной области; на 13-й день: ритм синусовый, улучшение процессов реполяризации.
Данные МСКТ ОГК на 13-й день: процент поражения паренхимы легких уменьшился до 5%.
Больному с первых часов пребывания в стационаре была назначена терапия: цефотаксим по 1 г внутримышечно 2 р./сут № 7, азитромицин по 500 мг 1 р./сут № 7, лопина-вир + ритонавир 400/100 мг 2 р./сут № 10, 5% раствор глюкозы, солевые растворы внутривенно капельно; для коррекции дыхательной недостаточности — бронхолитик, дыхательные аналептики, с целью коррекции нарушений в свертывающей системе крови — гепарин натрия подкожно, также больному назначались витамины, муколитики. С учетом нарушений иммунного статуса пациенту назначен азоксимера бромид в дозе 6 мг, курс — 3 инъекции в/м ежедневно 1 р./сут, затем через день; всего 10 инъекций.
Улучшение состояния больного отмечено уже в 1-й день лечения. На 5-й день лечения больного не беспокоила одышка и боль в грудной клетке, температура нормализовалась полностью; на 7-й день поменялся характер мокроты с гнойного на слизистый. Больной был выписан
на 20-й день стационарного лечения с выздоровлением. Результат ПЦР в мазках со слизистой оболочки носоглотки РНК коронавируса (SARS-CoV-2) — отрицательный. Исследование на содержание антител к коронавирусу проводилось методом ИХЛА (модификация ИФА) от 04.05.2020 на тест-системах ARCHITECT SARS-Cov-2 IgG (Abbott, США), выявлены антитела класса IgG — 5,92 г/л (результат ≥1,4 г/л). При выписке больной жалоб не предъявлял, в легких выслушивалось везикулярное дыхание, хрипов не было.
Заключительный клинический диагноз: Новая коронавирусная инфекция COVID-19 (подтвержденная), среднетяжелая форма. Внебольничная вирусно-бактериальная двусторонняя полисегментарная пневмония на основании данных исследования мокроты, средней степени тяжести, дыхательная недостаточность II степени.
Таким образом, у больного на фоне комплексного лечения с включением иммуномодулятора азоксимера бромида наблюдалась положительная клиническая динамика, нормализация иммунологических параметров (восстановление уровня Т-лимфоцитов, снижение уровня провоспалительных цитокинов).
Обсуждение
Учитывая положительный клинико-иммунологический эффект терапии с включением азоксимера бромида в лечение пациентов с новой коронавирусной инфекцией COVID-19, можно провести параллель c другими заболеваниями, которые сопровождались иммуносупрессией с одновременным повышением ИЛ-6 и в лечении которых также использовался этот препарат. По данным наших предыдущих исследований, при включении азоксимера бромида в комплексную терапию тяжелой формы ВП, которая сопровождается иммуносупрессией и неконтролируемыми иммунологическими процессами, отмечается стимулирующее действие на факторы естественной резистентности (фагоцитоз, натуральные киллеры (CD16+) и клеточные механизмы защиты (повышение значения общих Т-лимфоцитов (CD3+), Т-хелперов-индукторов (CD4+) и регулирующее влияние на воспалительную активность цитокинов, что сопровождается снижением ИЛ-4, -6, ФНО-α. В то же время в группе пациентов с тяжелой ВП в группе сравнения статистически значимого снижения содержания цитокинов в сыворотке не наблюдалось, а у большинства больных сохранялись нарушения Т-лимфоцитарного звена. Кроме того, у пациентов, в лечении которых применялся азоксимера бромид, отмечалась более быстрая динамика клинических симптомов: более раннее нивелирование кашля, прекращение выделения мокроты (на 2,4±0,1 дня, р<0,05); нормализация ЧД (на 1,3±0,1 дня, р<0,05), температуры тела (на 1,2±0,5 дня, р<0,05) [3, 9].
Кроме того, применение азоксимера бромида у пациентов с острым панкреонекрозом (как вариант органной недостаточности), острыми постпневмоническими абсцессами, аппендикулярным перитонитом сопровождалось выраженным патогенетическим эффектом, который проявлялся в снижении концентрации ИЛ-6, повышении уровня лимфоцитов, усилении активности фагоцитоза, что сопровождалось уменьшением тяжести течения заболевания и снижением смертности [10–12].
Таким образом, как показывают наблюдения, патогенетическая терапия является не менее важным компонентом терапии COVID-19, чем этиотропное лечение. Применение азоксимера бромида позволяет облегчить течение заболевания и ускорить купирование его симптомов. Не менее важным является тот факт, что при применении данного препарата не отмечено значимых побочных эффектов, а также развития такого нежелательного явления, как «цитокиновый шторм».
Заключение
Включение азоксимера бромида в комплексную терапию больных новой коронавирусной инфекцией сопровождалось положительной клинической динамикой, проявляющейся более быстрым купированием симптомов заболевания, общевоспалительного синдрома и синдрома поражения легочной ткани по сравнению с пациентами, которые находились только на стандартной терапии, без применения иммунокоррекции. На фоне применения препарата отмечается более быстрая динамика в уменьшении поражения паренхимы легких, положительная динамика лабораторных признаков воспаления. Также при его применении не отмечено побочных эффектов, развития «цитокинового шторма» и других нежелательных явлений. С учетом полученных нами результатов азоксимера бромид может быть рекомендован для применения в комплексной терапии новой коронавирусной инфекции.
Сведения об авторах:
Мухамадиева Ляйсан Рамилевна — к.м.н., ассистент кафедры факультетской терапии, ФГБОУ ВО БГМУ Минздрава России, 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0002-7391-5960.
Мавзютова Гузель Анваровна — д.м.н., профессор кафедры факультетской терапии, ФГБОУ ВО БГМУ Минздрава России, 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0003-2098-1435.
Тюрина Елена Борисовна — к.м.н., врач приемного отделения, ГБУЗ РБ ГКБ № 5 г. Уфа, 450005, Россия, г. Уфа,
ул. Пархоменко, д. 93; ORCID iD 0000-0002-8493-3929.
Кузовкина Оксана Зульфаровна — к.м.н., заведующая отделением паллиативной медицинской помощи, ГБУЗ РБ ГКБ № 5 г. Уфа, 450005, Россия, г. Уфа, ул. Пархоменко, д. 93; ORCID iD 0000-0003-4314-7304.
Контактная информация: Мухамадиева Ляйсан Рамилевна, e-mail: leisyan.ae@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 17.07.2020, поступила после рецензирования 09.08.2020, принята в печать 12.08.2020.
About the authors:
Lyaysan R. Mukhamadieva — Cand. of Sci. (Med.), assistant of the Department of Faculty Therapy, Bashkir State Medical University, 3, Lenin str., Ufa, 450000, Russian Federation; ORCID iD 0000-0002-7391-5960.
Guzel’ A. Mavzyutova — Dr. of Sci. (Med.), professor of the Department of Faculty Therapy, Bashkir State Medical University, 3, Lenin str., Ufa, 450000, Russian Federation; ORCID iD 0000-0003-2098-1435.
Elena B. Tyurina — Cand. of Sci. (Med.), therapist of the E.R., City Clinical Hospital No. 5 of the city of Ufa, 93, Parkhomenko str., Ufa, 450005, Russian Federation; ORCID iD 0000-0002-8493-3929.
Oksana Z. Kuzovkina — Cand. of Sci. (Med.), Head of Department of Palliative Care, City Clinical Hospital No. 5 of the city of Ufa, 93, Parkhomenko str., Ufa, 450005, Russian Federation; ORCID iD 0000-0003-4314-7304.
Contact information: Lyaysan R. Mukhamadieva, e-mail: leisyan.ae@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 17.07.2020, revised 09.08.2020, accepted 12.08.2020.
2. Remy K.E., Brakenridge S.C., Francois B. et al. Immunotherapies for COVID-19: lessons learned from sepsis. Lancet Respir Med. 2020; S2213–2600 (20) 30217–4. DOI: 10.1016/S2213-2600 (20) 30217-4.
3. Мухамадиева Л.Р., Мавзютова Г.А., Фазлыева Р.М., Бикметова Н.Р. Клинико-иммунологическая эффективность имунофана и полиоксидония в комплексной терапии внебольничной пневмонии. Медицинская иммунология. 2009;11(1):57–62.
4. Пинегин Б.В., Дагиль Ю.А., Воробьева Н.В., Пащенков М.В. Влияние азоксимера бромида на формирование внеклеточных нейтрофильных ловушек. РМЖ. 2019;1(II):42–46.
5. Караулов А.В., Горелов А.В. Применение азоксимера бромида в терапии инфекционно-воспалительных заболеваний органов дыхания у детей: метаанализ контролируемых клинических исследований. Журнал инфектологии. 2019;11(4):31–41.
6. Zuo Y., Yalavarthi S., Shi Н. et al. Neutrophil extracellular traps in COVID-19. JCI Insight. 2020;5(11): e138999. DOI: 10.1172/jci.insight.138999.
7. Pružinec P., Chirun N., Sveikata A. The safety profile of Polyoxidonium in daily practice: results from postauthorization safety study in Slovakia. Immunotherapy. 2018;10(2):131–137. DOI: 10.2217/imt-2017-0116.
8. Vyšetrovací algoritmus a medikamentózna liečba pacientov nad 65 rokov, pacientov so závažným priebehom a polymorbídnych pacientovpočas hospitalizácie na infekčnom oddelení. (Электронный ресурс). URL: https://standardnepostupy.sk/_files/200000421–45c4245c44/COVID-19%20hospitalizovan%C3%AD%20pacientiv.... Дата обращения: 13.07.2020.
9. Мавзютова Г.А., Мухамадиева Л.Р., Фазлыева Р.М. и др. Рациональная иммунокоррекция в комплексной терапии внебольничной пневмонии. Медицинский совет. 2015;16:68–73.
10. Аверкиев В.Л., Тарасенко В.С., Латышева Т.В. и др. Коррекция иммунологических нарушений у больных панкреонекрозом. Иммунология. 2002;6:359–363.
11. Мавзютова Г.А., Мухамадиева Л.Р., Авзалетдинов А.М. и др. Иммунологические нарушения при острых постпневмонических абсцессах и их коррекция. Медицинский бюллетень Башкортостана. 2010;5(2):19–24.
12. Гаврилюк В.П., Конопля А.И. Влияние иммуномодулирующих препаратов на течение аппендикулярного перитонита у детей. Детская хирургия. 2012;4:36–38.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
