Сравнительная характеристика и особенности клинической картины заболевания взрослых больных муковисцидозом с хроническим инфицированием нижних дыхательных путей Pseudomonas aeruginosa и другой грамотрицательной неферментирующей флорой
DOI: 10.32364/2587-6821-2020-4-4-186-191
Введение: в России показатель ожидаемой продолжительности жизни пациентов с муковисцидозом (МВ) с 2011 по 2017 г. вырос более чем на 10 лет и составил 55,49 года на 2017 г., увеличилось число пациентов с хроническим инфицированием неферментирующей грамотрицательной флорой (НФГФ) — Burkholderia cepacia, Achromobacter spp.
Цель исследования: оценить разницу нутритивного, функционального статуса, тяжести мутаций в группах больных МВ с хронической синегнойной инфекцией и с НФГФ, определить чувствительность синегнойной палочки у пациентов с МВ к тобрамицину в Северо-Западном регионе РФ.
Материал и методы: обследована группа, включавшая 31 пациента с МВ в возрасте от 18 до 43 лет, из них мужчин — 18 (58,1%), женщин — 13 (41,9%). Длительность исследования составила 12 мес. Проведена оценка показателей спирометрического, антропометрического обследования, посевов мокроты.
Результаты исследования: преобладающим патогеном была Pseudomonas aeruginosa в монокультуре 18 больных (58%), Achromobacter spp. — у 9 больных (29%), Burkholderia spp. — у 4 больных (13%). Пациенты были разделены на 2 группы: 1-я группа — с хронической синегнойной инфекцией (18 пациентов (58%)), из них 10 — с мукоидным штаммом P. aeruginosa; 2-я группа — с хронической НФГФ (13 пациентов (42%)). В 1-й группе медиана возраста составила 27 лет, мода — 27 лет; во 2-й группе медиана возраста — 24 года, мода — 22 года. Было установлено, что пациенты с МВ и хроническим инфицированием НФГФ имеют достоверно более низкий нутритивный статус (p<0,05), чем группа пациентов с хроническим инфицированием P. aeruginosa, и не имеют достоверных различий в функциональном статусе и тяжести мутации гена МВТР. У пациентов с хроническим инфицированием Р. aeruginosa выявлена высокая чувствительность к тобрамицину (94,4%).
Выводы: Burkholderia cepacia, Achromobacter spp. составляют значительную часть (41,9%) среди грамотрицательной флоры, выявляемой у больных с МВ и хроническим инфицированием нижних дыхательных путей, и требуют дальнейшего изучения и мониторирования лекарственной чувствительности.
Ключевые слова: муковисцидоз, ДНК-диагностика, хроническое инфицирование Pseudomonas aeruginosa, Burkholderia cepacia, Achromobacter spp., неферментирующая грамотрицательная флора, мутация МВТР, нутритивный статус, функция внешнего дыхания, ингаляционная антибактериальная терапия.
Для цитирования: Махмутова В.Р., Гембицкая Т.Е., Черменский А.Г., Титова О.Н., Кузубова Н.А., Степаненко Т.А. Сравнительная характеристика и особенности клинической картины заболевания взрослых больных муковисцидозом с хроническим инфицированием нижних дыхательных путей Pseudomonas aeruginosa и другой грамотрицательной неферментирующей флорой. РМЖ. Медицинское обозрение. 2020;4(4):186-191. DOI: 10.32364/2587-6821-2020-4-4-186-191.
Comparative characteristics and clinical presentation of cystic fibrosis
in adults with chronic lower respiratory tract infections with Pseudomonas aeruginosa and other non-fermenting gram-negative bacilli
V.R. Makhmutova1, T.E. Gembitskaya2, A.G. Chermenskiy2, O.N. Titova2, N.A. Kuzubova2, T.A. Stepanenko1
1City Multidisciplinary Hospital No. 2, St. Petersburg, Russian Federation
2Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, St. Petersburg, Russian Federation
Background: in Russia, the life expectancy of cystic fibrosis (CF) patients increased by 10 years in 2011–2017 being 55.49 years in 2017. However, the number of patients with the chronic infection caused by non-fermenting gram-negative bacilli (NFGNB), e.g., Burkholderia cepacia, Achromobacter spp. etc., increased as well.
Aim: to evaluate the differences in the nutritional and functional status and the severity of mutations in CF patients with chronic Pseudomonas infection or NFGNB infection and to assess the sensitivity of P. aeruginosa to tobramycin in CF patients in the Northwest region of Russia.
Patients and Methods: 31 patients with CF aged 18–43 years (18 men and 13 women) were examined. The duration of the study was 12 months. Spirometry, anthropometry, and sputum culture were performed.
Results: P. aeruginosa alone was isolated in 18 patients (58%), Achromobacter spp. in 9 patients (29%), and Burkholderia spp. in 4 patients (13%). The patients were divided into two groups, i.e., patients with chronic Pseudomonas infection (group 1, n=18, 10 out of 18 patients with mucoid strains of P. aeruginosa) or chronic NFGNB infection (group 2, n=13). The median age and the mode age were 27 years and 27 years, respectively, in group 1 and 24 years and 22 years, respectively, in group 2. It was demonstrated that CF patients with chronic NFGNB infection are characterized by poorer nutritional status (p<0.05) but similar functional status and the severity of CFTR gene mutation compared to CF patients with chronic Pseudomonas infection. It was also shown that Р. aeruginosa is highly sensitive to tobramycin (94.4%).
Conclusions: in CF patients, chronic lower respiratory tract infections with Burkholderia cepacia and Achromobacter spp. account for 41.9% of gram-negative rod infections. Further studies and drug sensitivity monitoring are needed.
Keywords: cystic fibrosis, DNA test, chronic infection with Pseudomonas aeruginosa, Burkholderia cepacia, Achromobacter spp, non-fermenting gram-negative bacilli, CFTR mutation, nutritional status, pulmonary function tests, inhaled antibiotic therapy.
For citation: Makhmutova V.R., Gembitskaya T.E., Chermenskiy A.G. et al. Comparative characteristics and clinical presentation of cystic fibrosis in adults with chronic lower respiratory tract infections with Pseudomonas aeruginosa and other non-fermenting gram-negative bacilli. Russian Medical Inquiry. 2020;4(4):186–191. DOI: 10.32364/2587-6821-2020-4-4-186-191.
Введение
Муковисцидоз (МВ) — генетически обусловленное, моногенное, прогрессирующее заболевание, характеризующееся поражением экзокринных желез жизненно важных органов с нарушением функции ионных каналов и формированием обезвоженного вязкого секрета.
В патологический процесс при МВ вовлекаются органы респираторной системы, желудочно-кишечного тракта, семявыносящие протоки у мужчин. Ген муковисцидоза
МВТР кодирует муковисцидозный трансмембранный регулятор проводимости — трансмембранный белок, который располагается на поверхности апикальной мембраны эпителиальных клеток и функционирует как хлорный канал. Мутации гена МВТР приводят к нарушению функции белка в эпителиальных клетках бронхиального дерева, к блокаде транспорта ионов хлора и увеличению абсорбции ионов натрия, что сопровождается дегидратацией апикальной поверхности клеток эпителия, увеличением вязкости слизи, которая инфицируется, вызывает обструкцию, ухудшение функции легких и развитие дыхательной недостаточности [1].
Клинические проявления МВ отличаются полиморфизмом, в большинстве случаев МВ начинается в раннем детском возрасте. Тяжесть заболевания и продолжительность жизни больного МВ определяются в первую очередь состоянием бронхолегочной системы — более 90% пациентов умирают от болезней легких [2].
Основная причина осложнений при МВ — хронические инфекции дыхательных путей, при которых чаще всего выделяют Pseudomonas aeruginosa, Staphylococcus aureus, Haemophilus influenzae [3]. В 2017 г. в Регистре больных МВ были суммированы сведения о 3096 пациентах, средний возраст которых составил 12,1±9,4 года, медиана возраста — 9,7 года (интерквартильный размах — 11,9 года). Отмечена тенденция к увеличению числа больных МВ старше 18 лет: по данным регистра, они составили 22,3% [4]. Частота хронического инфицирования дыхательных путей различной флорой, по данным регистра, в 2017 г. составила: S. aureus — 57,1%, P. aeruginosa (хроническое инфицирование) — 32,4%, P. aeruginosa (интермиттирующий высев) — 14,9%, Burkholderia cepacia complex — 6,2%, Achromobacter spp. — 4,6%, метициллинрезистентный золотистый стафилококк — 4,0%, Stenotrophomonas maltophilia — 3,5%. В 14,1% случаев дыхательные пути больных хронически инфицированы другой грамотрицательной флорой (без учета Achromobacter spp.). Ингаляционные антибиотики для терапии осложнений со стороны органов дыхания применялись у 48,5% больных [4].
Взросление больного МВ сопровождается снижением респираторной функции, сменой микрофлоры дыхательных путей на более агрессивную [3, 5]. При оценке микробиологического профиля респираторного тракта во всех странах зафиксирован рост частоты высева грамотрицательной флоры с увеличением возраста больных. Наибольшая частота инфицирования P. aeruginosa в РФ выявляется у пациентов старше 24 лет — 57,3%, инфицирование больных МВ Achromobacter spp. по стране составляет 4,4% [6].
При оценке динамики роста ожидаемой продолжительности жизни пациентов с МВ в РФ с 2011 по 2017 г. отмечено, что показатель вырос более чем на 10 лет и составил 55,49 года на 2017 г. [6]. За последние 2 десятилетия увеличилось число пациентов с МВ, которые переходят из педиатрической во взрослую пульмонологическую сеть здравоохранения.
Общая численность населения Северо-Западного федерального округа — 13,8 млн человек, что составляет 9,8% от всего населения РФ. Около половины из них живут в Санкт-Петербурге и Ленинградской области.
Пациенты с МВ старше 18 лет, проживающие в г. Санкт-Петербурге и Ленинградской области, а также в других городах Северо-Западного региона РФ, наблюдаются в 2 центрах МВ Санкт-Петербурга.
Следует подчеркнуть, что взрослые больные МВ, проживающие в Санкт-Петербурге, наблюдались согласно стандартам диагностики, лечения и преемственности, а структура и особенности пациентов с МВ в Северо-Западном регионе РФ, в т. ч. Ленинградской области, изучены недостаточно.
Цель исследования: оценить разницу нутритивного, функционального статуса, тяжести мутаций в группах больных МВ с хронической синегнойной инфекцией и с неферментирующей грамотрицательной флорой (НФГФ), определить чувствительность синегнойной палочки у пациентов с МВ к тобрамицину в Северо-Западном регионе РФ.
Материал и методы
Критерии включения в исследование: пациенты старше 18 лет, проживающие в Санкт-Петербурге и Ленинградской области, с установленным диагнозом МВ согласно диагностическим критериям ECFS (European Cystic Fibrosis Society — Европейское общество муковисцидоза) и хроническим инфицированием P. aeruginosa или НФГФ (Achromobacter spp. и Burkholderia spp.) (критерии Lee et al.) [5] на январь 2020 г. Всего включен 31 пациент, из них мужчин — 18 (58,1%), женщин — 13 (41,9%). Длительность исследования составила 12 мес. (с апреля 2019 г. по март 2020 г.).
Методы исследования:
Функциональное обследование для оценки состояния функции внешнего дыхания, выявления степени обструктивных нарушений дыхательных путей. Спирометрия, бодиплетизмография, выполненная с использованием MasterScreen Body Care Fusion (Jager, США).
Микробиологическое обследование образцов свободно отделяемой мокроты или промывных вод бронхов на неспецифическую флору, в т. ч. НФГФ.
Антропометрическое обследование для оценки нутритивного статуса пациента. Нутритивный статус оценивался по показателю индекса массы тела (ИМТ): более 18,5 кг/м2 — норма; менее 18,5 кг/м2, но более 16 кг/м2 — дефицит массы тела; менее 16 кг/м2 — выраженный дефицит массы тела.
Генетическое исследование гена МВТР. 100% включенных пациентов генетически обследованы: использовано генотипирование наиболее распространенных мутаций (30 частых мутаций в Санкт-Петербурге) или полноэкзомное секвенирование гена МВТР в случае выявления только одной мутации (метод Сэнгера). Мутации МВТР I–III классов отнесены к «тяжелым» мутациям, мутации IV–V классов — к «мягким» мутациям (критерии ERCF 2001 г.).
Методы микробиологического обследования респираторных образцов больных МВ в исследовании. Исследовалась свободно отделяемая мокрота как оптимальный биоматериал для микробиологического исследования респираторных инфекций [7], сбор и транспортировка образцов биоматериала проводились согласно методическим указаниям [8].
Частота микробиологического обследования респи-раторных инфекций у пациентов с МВ составляла 1 раз в 3 мес. Основным методом диагностики хронической респираторной инфекции являлся культуральный метод с посевом респираторных образцов на неселективные, селективные и хромогенные питательные среды (рекомендуемые питательные среды для основных этиологически значимых микроорганизмов респираторных инфекций при МВ [9]). Выявление грамотрицательных бактерий, идентификация которых может вызывать трудности: Achromobacter spp., Burkholderia spp., проводилось методами молекулярной идентификации (времяпролетная масс-спектрометрия MALDI-TOF MS) согласно рекомендациям [10]. Определение чувствительности микроорганизмов, выделенных от пациентов с МВ, к антибактериальным препаратам и интерпретацию результатов проводили в соответствии с клиническими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам» [11].
Статистическая обработка данных проводилась с использованием программы SPSS Statistic (версия 17.0 от 30.11.2018) с применением методов параметрической и непараметрической статистики. Межгрупповое сравнение полученных данных проводилось по критерию Стьюдента. Различия между выборками считались статистически достоверными при значении альфа-ошибки менее 0,05.
Результаты и обсуждение
В исследуемой группе медиана возраста составила 27 лет. Распределение больных МВ по возрастным группам было следующим: 18–22 года — 9 пациентов (29,1%), 23–27 лет — 12 (38,8%), 28–32 года — 6 (19,1%), 33–37 лет — 2 (6,5%), 38 и старше — 2 (6,5%). К концу исследования живы 29 пациентов, умерли 2.
У всех исследуемых больных МВ в течение более чем 1 года наблюдения определялась хроническая инфекция в нижних отделах дыхательных путей. Преобладающим патогеном была P. aeruginosa в монокультуре у 18 больных (58%), что соответствует средним значениям по РФ (57%), Achromobacter spp. — у 9 больных (29%), это выше, чем в среднем по РФ (8,8%), Burkholderia spp. — у 4 (13%) (по РФ — 12,9%) [4].
Пациенты были разделены на 2 группы: 1-я группа включала больных с хронической синегнойной инфекцией — 18 (58%), из них 10 — с мукоидным штаммом P. aeruginosa, 2-я группа с хронической НФГФ — 13 пациентов (42%), из них 4 — с хроническим инфицированием Burkholderia spp., 9 — с хроническим инфицированием Achromobacter spp.
В 1-й группе медиана возраста составила 27 лет, мода — 27 лет; во 2-й группе медиана возраста — 24 года, мода — 22 года. Возраст инфицирования в группах был представлен в разных интервалах: в 1-й группе — от 0 до 41 года, средний возраст — 15,6 года, медиана возраста — 10 лет, мода — 17 лет. Во 2-й группе возраст инфицирования — от 9 до 27 лет, средний возраст — 27 лет, медиана возраста — 17 лет, мода — 22 года. Таким образом, возраст инфицирования во 2-й группе выше, чем в 1-й группе.
При оценке функции внешнего дыхания у пациентов обеих групп установлено отсутствие обструктивных нарушений у 7 человек (22,6%), легкие нарушения выявлены у 2 (6,5%), умеренные — в 1 случае (3,2%). Обструктивные нарушения функции внешнего дыхания наблюдались у большинства исследуемых — у 21 (67,7%), из них у 7 пациентов (22,6%) — резкие, у 14 пациентов (45,1%) — крайне резкие (рис. 1).
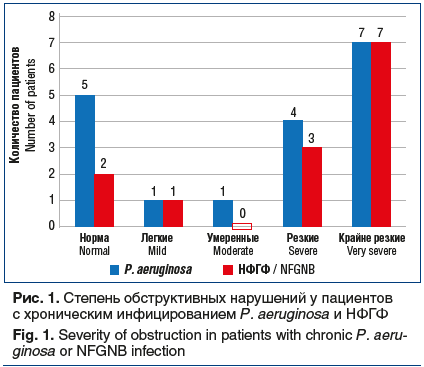
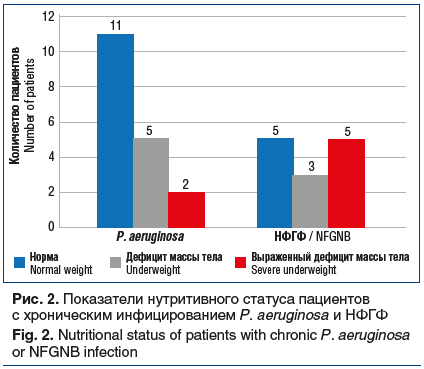
Нутритивный статус больных МВ во многом определяет прогноз заболевания. Низкий нутритивный статус у данных пациентов связан с тяжелым течением бронхолегочного процесса. Панкреатическая недостаточность у них обычно купируется адекватно подобранной заместительной терапией. У исследованных больных о состоянии питания судили на основании ИМТ, показатели которого были нормальными у 16 пациентов (51,6%), в подавляющем большинстве это были больные с хронической синегнойной инфекцией. Недостаточный ИМТ выявлен у 8 (25,8%), а выраженный дефицит встретился у 7 (22,6%) больных, в этой группе преобладали больные с НФГФ (рис. 2). Таким образом, более выраженные нарушения нутритивного статуса отмечались у взрослых пациентов с МВ и НФГФ, что связано с более тяжелым течением бронхолегочного процесса у этих больных.
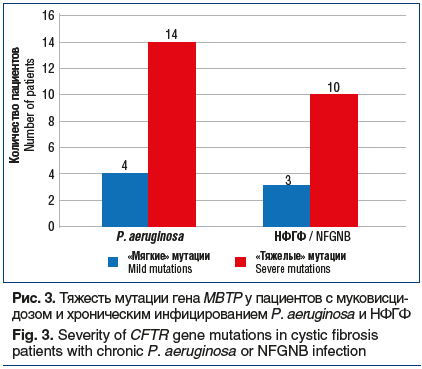
При генетическом исследовании больных выявлено 26 различных мутаций гена МВТР. Преобладающей по частоте мутацией является мутация F508del, которая определена у 74% больных. В гомозиготном состоянии F508del была у 4 пациентов (12,9%). Аллельная частота мутаций в порядке убывания следующая: F508del — 74%, 2143delT — 6,4%, 2184insA и 3849+10kbC>T — по 4,8%, R334W — 3,2%. После определения аллельной частоты всех обнаруженных мутаций идентифицировалась степень тяжести генотипа. Для «тяжелого» обязательно наличие мутации I–III класса, для «мягкого» — хотя бы одна мутация IV–V класса. «Мягкий» генотип был выявлен у 25,0% больных.
В настоящее время описано около 2000 мутаций в гене МВТР, из них более 300 — клинически значимые [6]. По данным Регистра больных МВ, в России частота мутации F508del составляет 52,81%, CFTRdele2,3 — 6,21%, E92K — 3,00% [4].
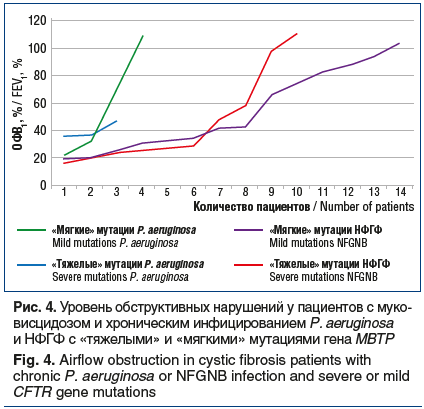
При сравнении группы больных с НФГФ и хроническим инфицированием синегнойной палочкой не было выявлено достоверных различий их генотипа, что может быть объяснено влиянием целого ряда других факторов, прежде всего — лечения, на течение болезни (рис. 3). В двух обследуемых группах не выявлена зависимость обструктивных нарушений от тяжести мутаций (рис. 4). Оценка функционального статуса проводилась по параметру ОФВ1 — объем форсированного выдоха за 1 с.
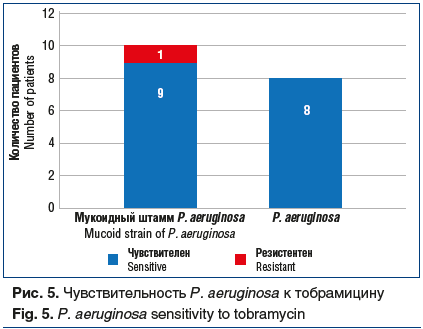
В Санкт-Петербурге на базе СПб ГБУЗ «ГМПБ № 2» оказывается помощь больным МВ, согласно клиническим рекомендациям, как в рамках диспансерного наблюдения, так и в стационаре. В процессе наблюдения за больными установлена высокая чувствительность штаммов синегнойной палочки к тобрамицину — 94,4% (рис. 5), что привело к значительной частоте применения ингаляционных антибактериальных препаратов тобрамицина у больных МВ для лечения инфекционного процесса в легких. Указанные данные совпадают с результатами работы по определению чувствительности штаммов синегнойной палочки к ингаляционному тобрамицину с помощью метода контрольных точек, предложенных группой MENSURA (Испанский комитет по антибиотикограммам), 95,1% штаммов P. aeruginosa были чувствительны к тобрамицину как при использовании метода разбавления агара, так и Е-теста [12]; при использовании значений CLSI (Комитет для клинических и лабораторных стандартов) эти показатели были меньше (79,1% и 81,1% соответственно) [12]. Ингаляционная антибактериальная терапия применялась у всех больных с синегнойной палочкой в исследуемой выборке, внутривенная терапия назначалась 100% больных при обострении, требующем стационарного лечения. Ингаляционные формы высококонцентрированных растворов тобрамицина (300 мг тобрамицина в 4 мл физиологического раствора) используются в Санкт-Петербурге с 2010 г. Применение новых лекарственных форм антибактериальных препаратов и методов их доставки позволяет сократить количество курсов внутривенной терапии в стационаре и сроков госпитализации.
Выводы
Обследование групп пациентов с МВ и Р. aeruginosa и пациентов с МВ и НФГФ (Achromobacter spp., Burkholderia spp.) в Санкт-Петербурге и Ленинградской области подтверждает общемировую тенденцию роста грамотрицательной флоры с возрастом.
В Санкт-Петербурге пациенты с МВ и хроническим инфицированием НФГФ (Achromobacter spp. и Burcholderia spp.) имеют достоверно более низкий нутритивный статус, чем группа пациентов с хроническим инфицированием P. aeruginosa.
В обеих обследуемых группах не выявлена зависимость обструктивных нарушений функции внешнего дыхания от тяжести мутаций гена МВТР.
В группе НФГФ не выявлено увеличение числа «тяжелых» мутаций гена МВТР по сравнению с группой больных МВ с хроническим инфицированием P. aeruginosa.
В Санкт-Петербурге пациенты с МВ и хроническим инфицированием Р. aeruginosa имеют высокую чувствительность к тобрамицину (94,4%).
Грамотрицательная флора нижних дыхательных путей пациентов с МВ требует дальнейшего изучения и мониторирования лекарственной чувствительности.
Сведения об авторах:
Махмутова Виктория Ринатовна — врач-пульмонолог пульмонологического отделения № 2, СПб ГБУЗ «ГМПБ № 2», 194354, Россия, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0002-1105-1204.
Гембицкая Татьяна Евгеньевна — д.м.н., профессор, руководитель отдела терапевтической пульмонологии, НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург, ул. Рентгена, д. 12, к. 44; ORCID iD 0000-0002-2293-3739.
Черменский Алексей Георгиевич — к.м.н., старший научный сотрудник, НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург, ул. Рентгена, д. 12, к. 44; ORCID iD 0000-0003-1487-4182.
Титова Ольга Николаевна — д.м.н., директор, НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург, ул. Рентгена, д. 12, к. 44; ORCID iD 0000-0003-4678-3904.
Кузубова Наталия Анатольевна — д.м.н., руководитель отдела хронической обструктивной патологии легких, заместитель директора по научной работе, НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург,
ул. Рентгена, д. 12, к. 44; ORCID iD 0000-0002-1166-9717.
Степаненко Татьяна Александровна — к.м.н., заведующая пульмонологическим отделением № 2, СПб ГБУЗ «ГМПБ № 2», 194354, Россия, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0002-6509-172X.
Контактная информация: Махмутова Виктория Ринатовна, e-mail: eladaspb@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 01.06.2020, поступила после рецензирования 15.06.2020, принята в печать 27.06.2020.
About the authors:
Viktoriya R. Makhmutova — pulmonologist of the Department of Pulmonology No. 2, City Multidisciplinary Hospital No. 2. 5, Uchebnyy Lane, St. Petersburg, 194354, Russian Federation; ORCID iD 0000-0002-1105-1204.
Tat’yana E. Gembitskaya — Dr. of Sci. (Med.), Professor, Head of the Department of Therapeutic Pulmonology, Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-2293-3739.
Aleksey G. Chermenskiy — Cand. of Sci. (Med.), senior researcher, Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-1487-4182.
Olga N. Titova — Dr. of Sci. (Med.), Director, Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Nataliya A. Kuzubova — Dr. of Sci. (Med.), Head of the Division of Chronic Obstructive Pulmonary Pathologies, Deputy Director for Scientific Work, Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Tat’yana A. Stepanenko — Cand. of Sci. (Med.), Head of the Department of Pulmonology No. 2, City Multidisciplinary Hospital No. 2, 5, Uchebnyy Lane, St. Petersburg, 194354, Russian Federation; ORCID iD 0000-0002-6509-172X.
Contact information: Viktoriya R. Makhmutova, e-mail: eladaspb@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 01.06.2020, revised 15.06.2020, accepted 27.06.2020.
2. Castellani C., Cuppens H., Macek M. Jr. et al. Consensus on the use and interpretation of cystic fibrosis mutation analysis in clinical practice. J. Cyst. Fibros. 2008;7(3):179–196. DOI: 10.1016/j.jcf.2008.03.009.
3. Puma J.J. The chanding microbial epidemiology in cystic fibrosis. Clinical Microbiology reviews. 2010;23(2):299–323. DOI: 10.1128/CMR.00068-09.
4. Регистр больных муковисцидозом в Российской Федерации. 2017 год. Под ред. А.Ю. Воронковой, Е.Л. Амелиной, Н.Ю. Каширской и др. М.: ИД «Медпрактика-М»; 2019.
5. Lee T.W.R., Brownlee K.G., Conway S.P. et al. Evaluation of a new defnition for chronic Pseudomonas aeruginosa in cystic fibrosis patients. J. Cyst Fibros. 2003;2(1):29–34. DOI: 10.1016/S1569-1993(02)00141-8.
6. Национальный консенсус по муковисцидозу. Муковисцидоз: определение, диагностические критерии, терапия. Под ред. Кондратьевой Е.И., Каширской Н.Ю., Капранова Н.И. М.; 2016.
7. Kerem E., Conway S., Elborn S., Heijerman H. Standards of care for patients with cystic fibrosis: a European consensus. J Cyst Fibros. 2005;4(1):7–26. DOI: 10.1016/j.jcf.2004.12.002.
8. МУ 4.2.2039–05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории». (Электронный ресурс). URL: https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=4750. Дата обращения: 12.05.2020.
9. СП 1.2.036–95 «Порядок учета, хранения, передачи и транспортировки микроорганизмов I–IV групп патогенности». (Электронный ресурс). URL: http://docs.cntd.ru/document/901799960. Дата обращения: 12.05.2020.
10. Чернуха М.Ю., Аветисян Л.Р., Шагинян И.А. и др. Алгоритм микробиологической диагностики хронической инфекции легких у больных муковисцидозом. Клиническая микробиология и антимикробная химиотерапия. 2014;16(4):276–290.
11. Клинические рекомендации. Определение чувствительности микроорганизмов к антимикробным препаратам (2018 г.). (Электронный ресурс). URL: http://www.antibiotic.ru/minzdrav/clinical-recommendations. Дата обращения: 12.05.2020.
12. Morosini M.I., García-Castillo M., Loza E. et al. Breakpoints for predicting Pseudomonas aeruginosa susceptibility to inhaled tobramycin in cystic fibrosis patients: use of high-range Etest strips. J Clin Microbiol. 2005;43(9):4480–4485. DOI: 10.1128/JCM.43.9.4480-4485.2005.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
