Роль окислительного стресса в патогенезе кальций-оксалатного уролитиаза
Благодаря стремительному технологическому прогрессу в арсенале уролога есть множество методов оперативного лечения мочекаменной болезни (МКБ). При этом удаление конкрементов из мочевых путей является симптоматическим лечением МКБ, т. к. не устраняет непосредственную причину камнеобразования. Одним из факторов патогенеза кальций-оксалатного уролитиаза является свободнорадикальная стрессовая нагрузка. Повышение концентрации активных форм кислорода на фоне окислительного стресса приводит к повреждению почечных канальцев и избыточной секреции ионов кальция в районе петли Генле.
Цель исследования: изучить влияние антиоксидантных свойств комплекса биологически активных веществ на снижение уровня свободнорадикальной нагрузки в зоне формирования бляшек Рэндалла и возможность его использования для метафилактики МКБ.
Материал и методы: антиоксидантную активность комплекса биологически активных веществ из натуральных растительных компонентов (экстракт корней марены красильной, экстракт листьев ортосифона тычиночного, экстракт травы эпимедиума, экстракт корней родиолы розовой, экстракт корней солодки голой, экстракт листьев гинкго билоба), содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, измеряли методом хемолюминесценции на хемилюминометре Lum-1200 («ДИСофт», Россия). Антиоксидантную активность комплекса биологически активных веществ определяли по активности ресвератрола. В процессе исследования измеряли концентрацию потенциальных маркеров МКБ (бикунин, остеопонтин) на разных этапах наблюдения. Активность камнеобразования измеряли с помощью литос-теста.
Результаты исследования: антиоксидантная активность комплекса биологически активных веществ составляла 23,66±1,18 мкМ
(в тролоксовых единицах), что является средней антиоксидантной активностью. Применение комплекса биологически активных веществ, содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, позволило снизить активность камнеобразования, по данным литос-теста, она достоверно уменьшилась до минимальных значений у 42 пациентов из 45 (р<0,05).
Заключение: антиоксидантная активность комплекса биологически активных веществ из натуральных растительных компонентов может компенсировать свободнорадикальную нагрузку, предупреждая развитие кальций-оксалатного уролитиаза.
Ключевые слова: мочекаменная болезнь, рецидивирующий уролитиаз, комплекс биологически активных веществ, содержащий биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, антиоксидантная активность, окислительный стресс.
Для цитирования: Камалов А.А., Охоботов Д.А., Низов А.Н., Стригунов А.А., Афанасьевская Е.В. Роль окислительного стресса в патогенезе кальций-оксалатного уролитиаза. РМЖ. Медицинское обозрение. 2019;27(11):2-6.
The role of oxidative stress in the pathogenesis of calcium oxalate urolithiasis
A.A. Kamalov, D.A. Okhobotov, A.N. Nizov, A.A. Strigunov, E.V. Afanas’evskaya
Lomonosov Moscow State University
Dramatic technological progress has provided urologists with a myriad of surgical techniques for urolithiasis. Urinary stone removal is, however, symptomatic treatment since it does not address the immediate cause of stone formation. Free radical stress is one of the pathogenic factors of calcium oxalate urolithiasis. Increased levels of reactive oxygen species resulting from oxidative stress leads to renal tubule damage and over-secretion of calcium ions in Henle’s loop.
Aim: to assess the effect of biologically active ingredient complex in terms of reducing free radical load in the area of Randall’s plaque formation and its potential use for metaphylaxis of urolithiasis.
Patients and Methods: antioxidant activity of bioactive substance complex containing natural plant components (i.e., anthraquinones, resveratrol, glycyrrhizinic acid, salidrosides, and icariin — Rubia tinctorum root extract, Orthosiphon is staminei leaf extract, Epimedium extract, Rhodíola rósea root extract, Glycyrrhiza glabra root extract, and Ginkgo biloba leaf extract) was measured by chemiluminescence using Lum-1200 chemiluminometer (DISoft, Russian Federation). Antioxidant activity of bioactive substance complex was evaluated by resveratrol activity. The levels of potential urolithiasis markers (i.e., bikunin and osteopontin) were measured several times at various steps. Stone formation activity was measured by lithos-test.
Results: antioxidant activity of bioactive substance complex was 23.66±1.18 μmole (in trolox units). Biologically active ingredient complex containing anthraquinones, resveratrol, glycyrrhizinic acid, salidrosides, and icariin has reduced stone formation activity measured by lithos-test (decrease to minimum values in 42 out of 45 patients, р < 0.05).
Conclusion: antioxidant activity of bioactive substance complex containing natural plant components bioactive food additive potentially compensates free radical load thus preventing calcium oxalate urolithiasis.
Keywords: urolithiasis; recurrent urolithiasis; bioactive substance complex containing anthraquinones, resveratrol, glycyrrhizinic acid, salidrosides, and icariin; antioxidant activity; oxidative stress.
For citation: Kamalov A.A., Okhobotov D.A., Nizov A.N. et al. The role of oxidative stress in the pathogenesis of calcium oxalate urolithiasis. RMJ. 2019;11:2–6.
Введение
Мочекаменная болезнь (МКБ) является давно известным, описанным еще врачами древности заболеванием, но и спустя многие сотни лет неизвестны все звенья патогенеза [1]. Распространенность МКБ зависит от множества различных факторов: географических, климатических, генетических, этнических, от особенностей питания. Распространенность МКБ по всему миру составляет от 1 до 20%, однако в некоторых странах отмечается значительный прирост за последние годы [2]. Тенденция к росту заболеваемости МКБ наблюдается независимо от пола, возраста и расовой принадлежности [3]. При этом отмечается высокая частота рецидивирования заболевания, достигающая 50–75% в интервале 5–10 лет [4]. Сложность лечения данного заболевания заключается в предотвращении рецидива уролитиаза, потому что хирургическое лечение устраняет только симптомы заболевания, а не его причины [5]. Среди многих важных факторов патогенеза исследования последних лет установили роль активных форм кислорода в формировании камней оксалатно-кальциевой природы [6].
Оксалатные камни в почках образуются при избыточном накоплении солей в зоне петли Генле (бляшки Рэндалла) в виде субэпителиальных первичных центров кристаллизации с дальнейшей инвазией в чашечно-лоханочную систему на поверхности почечных сосочков. Основой оксалатных камней являются различные кальцийсодержащие кристаллы, образующиеся в моче [7]. С химической точки зрения кристаллы оксида кальция могут быть представлены тремя формами: моногидратом, дигидратом и тригидратом оксалата кальция. Наиболее литогенной из них является моногидрат. Процесс литогенеза имеет две фазы: первая — это зарождение новых кристаллов, вторая — их рост [8]. Производство активных форм кислорода (АФК) вызывает дифференцировку эпителиальных/эндотелиальных клеток в клетки, похожие на остеобласты, и отложение фосфата кальция в базальной мембране почечных канальцев или сосудов. Избыток кристаллов вреден для клеток почечных канальцев, т. к. приводит к их повреждению. Очаг воспаления является местом прикрепления и удержания кристаллов, которые затем увеличиваются в размерах путем дальнейшей кальцификации интерстициального коллагена и мембранных везикул. Агрегация и слияние кристаллов фосфата кальция приводят к образованию основы будущего конкремента. Как только вновь образовавшийся камень начинает контактировать с мочой, поверхностные слои фосфата кальция заменяются оксидом кальция [9]. Доказательства этой теории были продемонстрированы как в естественных, так и в экспериментальных условиях [10, 11].
Окислительный стресс (ОС) в современной научной литературе зачастую рассматривают как один из наиболее общих патологических процессов, сущностью которого является разбалансировка состояния про- и антиоксидантных систем клеток, тканей, органов. Всем аэробным организмам необходим кислород для их метаболизма, главным образом, чтобы генерировать аденозинтрифосфат через цепь переноса электронов [12]. Полное восстановление O2 до H2О требует поэтапного добавления 4 электронов, и, соответственно, поэтапно образуются 3 активные формы кислорода: супероксидный анион (•O2-), перекись водорода (H2O2) и гидроксильный радикал (•OH) [13]. Около 95% поступающего в организм кислорода в процессе окислительного фосфорилирования восстанавливается в митохондриях до воды. Оставшиеся 5% преобразуются в высокотоксичные для клеток продукты — АФК [14]. ОС — это состояние организма, когда образование свободных радикалов выходит из-под контроля антиоксидантных систем, что приводит к их неконтролируемому росту и повреждению биомолекул [12]. Патогенез ОС впервые был описан немецким врачом Helmut Sies в 1985 г. [15]. В организме существует 6 основных источников АФК: цепь тканевого дыхания (утечка электронов с восстановленного убихинона KoQH2 на кислород); реакции, катализируемые оксидазами, гемопротеинами, цитохромом Р450; реакции окисления в лейкоцитах, макрофагах и пероксисомах; радиолиз воды; воздействие ксенобиотиков, пестицидов; реакции самопроизвольного (неферментативного) окисления ряда веществ [16]. В противовес прооксидантам в организме есть антиоксидантные системы, которые борются с АФК, тем самым предотвращая развитие заболеваний, ассоциированных с ОС [12]. Одна часть системы направлена на предотвращение влияния свободных радикалов на клетки, вторая борется с последствиями такого влияния [17]. Сигнальным путем, который регулирует цитопротективный ответ на АФК, является ядерный фактор, связанный с эритроидным фактором 2 (Nuclear factor erythroid 2-related factor 2, Nrf2). Следовательно, активацию пути Nrf2 и применение антиоксидантов можно рассматривать как попытку уменьшения ОС, задержки старения и снижения риска заболеваний, связанных с ОС [18]. Образование АФК является одним из стандартных метаболических процессов в организме. Однако если АФК образуются в избытке и антиоксидантные системы декомпенсированы, то свободные радикалы непосредственно воздействуют на клеточные биомолекулы, вызывая повреждение тканей. Это в конечном итоге приводит к патологическим процессам в органах и тканях [19].
Существует множество состояний, при которых происходит гиперпроизводство свободных радикалов. Например, потребление калорийной пищи напрямую увеличивает
аэробный метаболизм и, следовательно, окислительное фосфорилирование, приводящее к увеличению продукции АФК в митохондриях. Тяжелый труд, курение, сахарный диабет также увеличивают выработку АФК через метаболические реакции [8]. К таким же последствиям приводит воздействие ионизирующего (рентгеновские, гамма-лучи) и неионизирующего (ультрафиолет) излучения [20]. Чрезмерная активация фагоцитарных клеток в очаге воспаления приводит к локальному респираторному выбросу с образованием супероксид-аниона, перекиси водорода и хлорноватистой кислоты (HOCl) [21]. При хирургических вмешательствах, направленных на восстановление кровотока, развивается реперфузия с выбросом большого количества свободных радикалов, вызывающих ОС [22]. Снижение содержания антиоксидантов в организме связано с неадекватным их потреблением, мутациями и истощением клеточного глутатиона в результате детоксикации большого количества ксенобиотиков [18].
Избыточная кристаллизация в почечной паренхиме вызывает выработку АФК в клетках почечных канальцев, что приводит к ОС и их повреждению. Кристаллы также индуцируют выработку и высвобождение медиаторов воспаления, активируют воспалительный ответ, что еще больше усиливает повреждение. Как ОС, так и воспаление вызывают выделение различных биологически активных веществ, создавая порочный круг усиления литогенеза. Агрегация кристаллов является одним из важнейших этапов литогенного процесса. Если этого не произойдет, литогенез не завершится. Исследования показывают, что связывание кристаллов будущего камня требует биологического «клея» — каменной матрицы [23]. В исследовании C. Boonla (2018) было показано, что у пациентов с нефролитиазом постоянно наблюдается повышенное количество свободных радикалов на фоне паренхиматозного воспаления в почках, и эти патологические изменения способствуют развитию почечной недостаточности [18].
Экспериментально доказано, что применение антиоксидантов ингибирует отложение кристаллов оксида кальция и, соответственно, снижает риск развития рецидива нефролитиаза [24]. В связи с этим можно предположить, что некоторые лекарственные растения с антиоксидантными свойствами [25], которые традиционно используются для профилактики МКБ, могут компенсировать ОС и снизить риск рецидива нефролитиаза [26, 27].
Цель исследования — изучить влияние антиоксидантных свойств комплекса биологически активных веществ из натуральных растительных компонентов, содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, и оценить возможности его использования в рамках профилактики рецидивов МКБ на основе изменений концентрации маркеров камнеобразования (бикунина, остеопонтина).
Материал и методы
В 2018 г. в МНОЦ МГУ им. М.В. Ломоносова было проведено исследование применения комплекса биологически активных веществ из натуральных растительных компонентов, содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин (БАД НефраДоз®) в качестве средства профилактики рецидивов МКБ у пациентов с кальций-оксалатным уролитиазом. Согласно инструкции рекомендован прием этого комплекса по 1 капсуле (300 мг) 2 р./сут во время еды. В состав комплекса входят травы, обладающие уросептическим, спазмолитическим, диуретическим и антиоксидантным эффектами: экстракт корней марены красильной, экстракт листьев ортосифона, экстракт травы эпимедиума (горянка), экстракт корней родиолы розовой, экстракт корней солодки, ресвератрол, экстракт листьев гинкго билоба, а также лактоза.
В исследование были включены 90 пациентов (мужчины и женщины в возрасте от 18 лет), имеющие рецидивирующее течение МКБ (больше 1 рецидива в анамнезе), с кальций-оксалатным уролитиазом, подтвержденным спектроскопией конкремента. Критерием исключения были вторичные формы МКБ, когда основной причиной камнеобразования является системный патологический процесс (синдром мальабсорбции, первичный гиперпаратиреоз) ввиду заведомой неэффективности лечения подобных пациентов. Все пациенты были разделены поровну на 2 группы, сопоставимые по возрасту, режиму труда и отдыха, алиментарным привычкам, региону проживания. Разделение по группам осуществлялось с использованием рандомайзера. 1-я группа (основная) получала комплекс биологически активных веществ в качестве добавки к ежедневным приемам пищи, 2-я группа (контрольная) находилась под динамическим наблюдением. Период наблюдения составил 6 мес. Контрольное обследование проводилось каждые 3 мес. и включало литос-тест, определение концентрации маркеров МКБ (бикунин, остеопонтин) в моче и определение суточной концентрации ионов кальция и оксалатов.
Антиоксидантную активность препарата определяли методом активированной хемилюминесценции в системе генерации свободных радикалов 2,2’-азобис(2-амидинопропан) дигидрохлорида (АБАП, Sigma) в присутствии активатора хемилюминесценции люминола (Sigma). Методика основана на определении площади «провала» после добавления антиоксиданта к системе. В качестве контроля для определения антиоксидантной активности использовали тролокс — 2,5,7,8-тетраметил-2(2’-карбоксиэтил)-6-гидроксихроман, производное витамина Е (Sigma). Его активность условно принимали за единицу, а антиоксидантная активность исследуемого вещества выражалась в эквивалентных молях тролокса на массу образца — стандартизованных единицах — Trolox equivalent antioxidant capacity (мкмоль/мг, мкМ). Помимо тролокса антиоксидантную активность комплекса биологически активных веществ сравнивали с ресвератролом — природным фенольным стилбеноидным соединением с доказанной антиоксидантной активностью (Sigma) [28].
Достоверность различий полученных результатов определяли по критерию Стьюдента с уровнем значимости не более 0,05.
Результаты исследования
Градуировочную зависимость строили как по тролоксу, общепринятому стандартному антиоксидантному соединению [29], которое реагирует со свободными радикалами в соотношении 1:1, так и по ресвератролу, природному антиоксиданту, для которого характерны кривые другого вида (рис. 1 А, Б). На рисунке 1 видно время выхода фоновой антиоксидантной активности тролокса и ресвератрола на исходный уровень после подавления блокатором люминолом (стрелкой показано время начала ответа после принудительного подавления антиоксидантной активности).
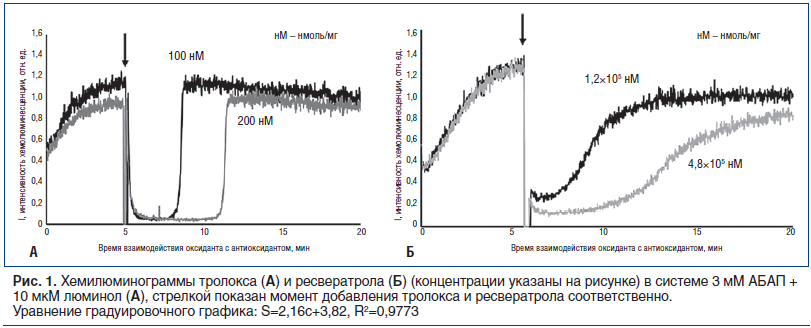
Антиоксидантная активность комплекса биологически активных веществ из натуральных растительных компонентов (экстракт корней марены красильной, экстракт листьев ортосифона тычиночного, экстракт травы эпимедиума, экстракт корней родиолы розовой; экстракт корней солодки голой, экстракт листьев гинкго билоба), содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, определяется главным образом ресвератролом, содержащимся в нем, и компонентами, подобными ресвератролу по антиоксидантной активности.
Это убедительно подтверждается полученными в эксперименте хемилюминесцентными кривыми (рис. 2). Подобные кривые характерны для природных антиоксидантов средней силы [28], кинетические константы перехвата свободных радикалов таких антиоксидантов составляют порядка единицы.
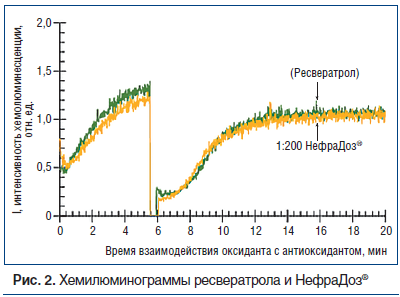
Проведено сравнение активности 1 капсулы БАД НефраДоз® и концентрации ресвератрола из расчета 10 мг (столько ресвератрола содержится в 1 капсуле препарата): при растворении 10 мг ресвератрола в 1,0 мл ацетона получен раствор с концентрацией вещества 44 мМ. Антиоксидантная активность данной концентрации ресвератрола оценивается в 19 мкМ в единицах тролокса, активность 1 капсулы препарата (300 мг) несколько выше — 23,66±1,18 мкМ в единицах тролокса (добавочный антиоксидантный эффект других растительных компонентов препарата).
Тролоксовый эквивалент (ТЭ) можно применить для количественной оценки — определить активность антиоксиданта, выраженную в концентрационных единицах тролокса. Именно ТЭ лежит в основе теста ORAC (Oxygen radical absorb capacity), который используют для оценки и сравнения антиоксидантных свойств объектов сложного состава, таких как растительные препараты. Антиоксидантный эффект комплекса биологически активных веществ из натуральных растительных компонентов, содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, можно считать обоснованным и доказанным.
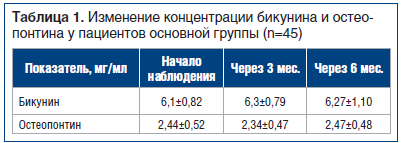
В процессе исследования измеряли концентрацию потенциальных маркеров МКБ (бикунин, остеопонтин) на разных этапах наблюдения. Активность камнеобразования измеряли с помощью литос-теста (от 0 до 3, где 3 — самая высокая степень активности камнеобразования), по результатам которого была подтверждена эффективность комплекса биологически активных веществ в отношении уменьшения активности МКБ. Концентрация вышеуказанных маркеров достоверно не изменилась на фоне приема комплекса в течение всего периода лечения (p>0,05) (табл. 1).
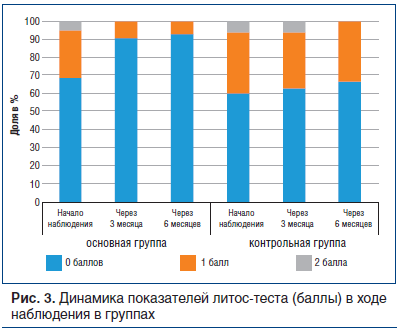
Количество пациентов с нулевой степенью активности камнеобразования в процессе лечения статистически значимо увеличилось от 31 до 42 (t-критерий Стьюдента = 4,31>1,992 при степени свободы 78, р<0,05). Исследование маркеров рецидивного камнеобразования и активности камнеобразования по данным литос-теста (рис. 3) выявило отсутствие маркерной манифестации в течение 6 мес. у 42 пациентов из 45 в этой группе (p>0,05).
Обсуждение результатов
Исходя из того, что активности свободных радикалов отводится отдельное место в патогенезе рецидивного камнеобразования [30], эффект ресвератрола как одного из компонентов БАД может компенсировать дисфункцию локальных антиоксидантных систем. Отсутствие маркеров камнеобразования в течение 6 мес. у 42 из 45 наблюдаемых (p>0,05) говорит об увеличении безрецидивного периода у пациентов после удаления конкрементов. Одна капсула БАД НефраДоз® имеет антиоксидантную активность, равную 23,7 мкМ тролоксового эквивалента, что обеспечивает компенсаторное и корригирующее действие при локальной дисфункции антиоксидантных систем. Вышеперечисленные эффекты увеличивают длительность ремиссии после удаления конкрементов.
ОС является важным отягчающим компонентом камнеобразования, прежде всего из-за наличия нескольких важных фармакологических мишеней в данном механизме [30]. Аналогичный эффект не исключен у некоторых лекарственных препаратов, таких как ингибиторы АПФ, витамин Е и др., однако эффективность их действия должна быть проверена в дальнейших исследованиях.
Заключение
Назначение комплекса биологически активных веществ из натуральных растительных компонентов (экстракт корней марены красильной, экстракт листьев ортосифона тычиночного, экстракт травы эпимедиума, экстракт корней родиолы розовой, экстракт корней солодки голой, ресвератрол, экстракт листьев гинкго билоба), содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, пациентам с кальций-оксалатным уролитиазом в качестве патогенетически обоснованного средства приводит к достоверному уменьшению активности МКБ, при этом максимальный эффект регистрируется через 3–6 мес. применения. Антиоксидантная активность определяется прежде всего ресвератролом и другими компонентами препарата, подобными ему по антиоксидантной активности. Компенсируя локальную активность свободных радикалов в точках кристаллизации, они усиливают вероятность длительной ремиссии МКБ. Таким образом, БАД НефраДоз® можно использовать с целью профилактики рецидива кальций-оксалатного уролитиаза.
Благодарность
Публикация осуществлена при поддержке компании «ШТАДА Арцнаймиттель АГ» в соответствии с внутренней политикой и действующим законодательством РФ. «ШТАДА Арцнаймиттель АГ», ее работники либо представители не принимали участия в написании настоящей статьи, не несут ответственности за содержание статьи, а также за любые возможные относящиеся к данной статье договоренности либо финансовые соглашения с любыми третьими лицами. Мнение «ШТАДА Арцнаймиттель АГ» может отличаться от мнения авторов и редакции.
2. Grases F. Epidemiology of renal lithiasis and associated factors. MedClin (Barc). 2017 Nov 9;149(9):397–398. DOI: 10.1016/j.medcli.2017.04.003.
3. Аполихин О.И., Сивков А.В., Комарова В.А. и др. Заболеваемость мочекаменной болезнью в Российской Федерации (2005–2016 гг.). Экспериментальная и клиническая урология. 2018;4:4–14. [Apolikhin O.I., Sivkov A.V., Komarova V.A. et al. The incidence of urolithiasis in the Russian Federation (2005–2016). Experimental and clinical urology. 2018;4:4–14 (in Russ.)].
4. Scales C.D., Smith A.C., Hanley J.M., Saigal C.S. Prevalence of kidney stones in the United States. EurUrol. 2012;62:160–165. DOI: 10.1016/ j.eururo.2012.03.052.
5. Ivanov A.V., Bartosch B., Isaguliants M.G. Oxidative stress in infection and consequent disease. Oxidative Medicine and Cellular Longevity. 2017;2017:3496043 DOI: 10.1155/2017/3496043.
6. Khan S.R. Reactive oxygen species as the molecular modulators of calcium oxalate kidney stone formation: evidence from clinical and experimental investigations. J Urol. 2013;189(3):803–811. DOI: 10.1016/j.juro.2012.05.078.
7. Baumann J.M., Casella R. Prevention of Calcium Nephrolithiasis: The Influence of Diuresis on Calcium Oxalate Crystallization in Urine. AdvPrev Med. 2019;2019:3234867. DOI: 10.1155/2019/3234867.
8. Kattoor A.J., Pothineni N.V.K., Palagiri D., Mehta J.L. Oxidative Stress in Atherosclerosis. Curr Atheroscler Rep. 2017;19(11):42. DOI: 10.1007/s11883-017-0678-6.
9. Bird V.Y., Khan S.R. How do stones form? Is unification of theories on stone formation possible? Arch Esp Urol. 2017;70(1):12–27.
10. Matlaga B.R., Coe F.L., Evan A.P., Lingeman J.E. The role of Randall’s plaques in the pathogenesis of calcium stones. J Urol. 2007;177:31–38.
11. Thamilselvan S., Khan S.R., Menon M. Oxalate and calcium oxalate mediated free radical toxicity in renal epithelial cells: effect of antioxidants. Urol Res. 2003;31(1):3.
12. Moldogazieva N.T., Mokhosoev I.M., Mel’nikova T.I. et al. Oxidative Stress and Advanced Lipoxidation and Glycation End Products (ALEs and AGEs) in Aging and Age-Related Diseases. Oxid Med Cell Longev. 2019;2019:3085756. DOI: 10.1155/2019/3085756.
13. Bisht S., Faiq M., Tolahunase M., Dada R. Oxidative stress and male infertility.Nat Rev Urol. 2017;14(8):470–485. DOI: 10.1038/nrurol.2017.69.
14. Кашкалда Д.А., Бориско Г.А. Окислительно-антиоксидантный гомеостаз у подростков, рожденных в семьях ликвидаторов последствий аварии на ЧАЭС. Современная педиатрия. 2008;3:11–14. [Kashkalda D.A., Borisko G.A. Oxidative-antioxidant homeostasis in adolescents born in the families of the liquidators of the consequences of the Chernobyl accident. Modern pediatrics. 2008;3:11–14 (in Russ.)].
15. Sies H. Oxidative Stress: Introductory Remarks. In: Oxidative Stress. London: Academic Press; 1985.
16. Лелевич В.В. Биологическая химия. Гродно: ГрГМУ; 2009. [Lelevich V.V. Biological chemistry. Grodno: State State Medical University; 2009 (in Russ.)].
17. Birben E., Sahiner U.M., Sackesen C. et al. Oxidative stress and antioxidant Defense. World Allerg Organiz J. 2012;5(1):9–19.
18. Boonla C. Oxidative Stress in Urolithiasis Reactive Oxygen Species (ROS) in Living Cells. 2018. DOI:10.5772/intechopen.75366.
19. Islam M.O., Bacchetti T., Ferretti G. Alterations of Antioxidant Enzymes and Biomarkers of Nitro-oxidative Stress in Tissues of Bladder Cancer. Oxid Med Cell Longev. 2019;2019:2730896. DOI: 10.1155/2019/2730896.
20. Саенко Ю.В., Шутов А.М., Абакумова Т.В. и др. Рентгеновское излучение индуцирует митохондриально-зависимый оксидативный стресс в клетках лейкемии К562. Фундаментальные исследования. 2012;9(1):60–64. [Saenko Yu.V., Shutov A.M., Abakumova T.V. and other. X-ray radiation induces a mitochondria-dependent oxidative stress in K562 leukemia cells. Basic research. 2012;9(1):60–64 (in Russ.)].
21. Bhattacharyya A., Chattopadhyay R., Mitra S., Crowe S.E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiological Reviews. 2014;94(2):329–354.
22. Salvadori M., Rosso G., Bertoni E. Update on ischemia-reperfusion injury in kidney transplantation: Pathogenesis and treatment. World J Transplant. 2015;5(2):52–67. DOI: 10.5500/wjt.v5.i2.52.
23. Sandersius S., Rez P. Morphology of crystals in calcium oxalate monohydrate kidney stones. Urol Res. 2007;35(6):287–293.
24. Naghii M.R., Eskandari E., Mofid M. et al. Antioxidant therapy prevents ethylene glycol-induced renal calcium oxalate crystal deposition in Wistar rats. Inter Urol Nephrol. 2014;46(6):1231–1238.
25. Benzie I.F., Choi S.W. Antioxidants in food: content, measurement, significance, action, cautions, caveats, and research needs.Adv Food Nutr Res. 2014;71:1–53. DOI: 10.1016/B978-0-12-800270-4.00001-8.
26. Butterweck V., Khan S.R. Herbal medicines in the management of urolithiasis: Alternative or complementary? Planta Medica. 2009;75(10):1095–1103.
27. Mina Cheraghi Nirumand, Marziyeh Hajialyani, Roja Rahimi, Mohammad Hosein Farzaei, Stéphane Zingue, Seyed Mohammad Nabavi, Anupam Bishayee. Int Dietary Plants for the Prevention and Management of Kidney Stones: Preclinical and Clinical Evidence and Molecular Mechanisms. J Mol Sci. 2018;19(3):765.
28. Won Young Oh, Fereidoon Shahidi, Antioxidant activity of resveratrol ester derivatives in food and biological model systems. Food Chem. 2018;261:267–273.
29. Измайлов Д.Ю., Проскурнина Е.В., Демин Е.М., Владимиров Ю.А. Действие антиоксидантов на образование свободных радикалов в пероксидазной реакции комплекса цитохрома с кардиолипином: опыт применения математического моделирования. Технологии живых систем. 2018;15:51–57. [Izmailov D.Yu., Proskurnina E.V., Demin E.M., Vladimirov Yu.A. The effect of antioxidants on the formation of free radicals in the peroxidase reaction of a complex of cytochrome with cardiolipin: the experience of mathematical modeling. Technologies of living systems. 2018;15:51–57 (in Russ.)].
30. Khan S.R. Hyperoxaluria-induced oxidative stress and antioxidants for renal protection. Urol Res. 2005;33:349–357.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
