Нейропатический компонент боли у больных остеоартритом
DOI: 10.32364/2587-6821-2022-6-3-113-119
Введение: хроническая суставная боль при остеоартрите (ОА) является важным фактором дезадаптации. Согласно современным представлениям при данной патологии чаще всего присутствуют два варианта боли: ноцицептивная и ноципластическая. О вкладе нейропатического компонента (НК) в формирование болевого синдрома известно гораздо меньше.
Цель исследования: изучить особенности болевого синдрома у пациентов с ОА, в том числе выявить НК у таких больных, оценить его влияние на качество жизни.
Материал и методы: в проспективное исследование включен 31 пациент (средний возраст 62,9±6,7 года, 26 (83,9%) женщин) с ОА коленного и/или тазобедренного сустава I–III стадии. Стаж суставного синдрома соответствовал продолжительности болевого синдрома и варьировал от 2 мес. до 30 лет, составив в среднем 10,6±9,9 года. Все пациенты проходили общеклиническое обследование. Для обнаружения НК боли (НКБ) проводилось неврологическое обследование с применением опросников DN4 и painDETECT. Уровень качества жизни определяли по опроснику EQ-5D.
Результаты исследования: НКБ был обнаружен почти у половины (48%) обследованных. При этом выраженность рентгенологических изменений в суставах не зависела от его наличия. Однако в присутствии нейропатической составляющей достоверно чаще встречались следующие проявлени df в зоне наиболее пораженного сустава (p<0,05): жжение, онемение, чувство удара электрическим током, пониженная чувствительность к покалыванию, пощипывание, чувство ползания мурашек и/или покалывание. Такой симптом, как зуд, практически не встречался, а частота пониженной чувствительности к прикосновению в группах достоверно не отличалась. Согласно опроснику EQ-5D более низкие показатели наблюдались у пациентов с наличием НКБ, у них достоверно хуже была оценка подвижности, повседневная активность. У таких больных также чаще наблюдались тревожно-депрессивные симптомы (p<0,05).
Заключение: для адекватного лечения болевого синдрома нужно определять у пациентов с ОА наличие НКБ и использовать в комплексной терапии антидепрессанты и антиконвульсанты.
Ключевые слова: остеоартрит, хронический болевой синдром, ноцицептивная боль, ноципластическая боль, нейропатический компонент боли, качество жизни.
Для цитирования: Филимонова О.Г. Нейропатический компонент боли у больных остеоартритом. РМЖ. Медицинское обозрение. 2022;6(3):113-119. DOI: 10.32364/2587-6821-2022-6-3-113-119.
O.G. Filimonova
Kirov State Medical University, Kirov, Russian Federation
Background: chronic joint pain in osteoarthritis (OA) is an important factor of maladaptation. According to modern concepts, there are two variants presented in this pathology: nociceptive and nociplastic. Much less is known about the contribution of the neuropathic component (NC) to the pain syndrome formation.
Aim: to study the pain syndrome patterns in patients with OA, as well as to identify NC in such patients and its impact on the life quality.
Patients and Methods: the prospective study included 31 patients (mean age — 62.9±6.7 years, 26 (83.9%) women) with stage I–III OA of the knee and/or hip joint. The course of the articular syndrome corresponded to the pain syndrome course and ranged from 2 months to 30 years, averaging 10.6±9.9 years. All patients underwent general clinical examination. To detect neuropathic pain component (NPC), a neurological examination was performed using the DN4 and painDETECT questionnaires. The level of life quality was determined by the EQ-5D questionnaire.
Results: NPC was detected in almost half (48%) of the examined patients. At the same time, the severity of radiological changes in the joints did not depend on its presence. However, in the presence of NC, the following manifestations were significantly more common in the area of the most affected joint (p<0.05): burning, numbness, electric shock, hypoesthesia, tingling, a feeling of crawling and/or tingling. There was practically no such symptom as itching, while the frequency of hypoesthesia in the groups did not significantly differ. According to the EQ-5D questionnaire, lower indicators were observed in patients with the NPC, their mobility assessment and daily activity were significantly worse. Mixed anxiety–depressive disorder were also observed (p<0.05) in such patients.
Conclusion: for adequate treatment of pain syndrome, it is necessary to determine the presence of NPC in patients with OA and use antidepressants and anticonvulsants in complex therapy.
Ke ywords: osteoarthritis, chronic pain syndrome, nociceptive pain, nociplastic pain, neuropathic pain component, life quality.
For citation: Filimonova O.G. Neuropathic pain component in patients with osteoarthritis. Russian Medical Inquiry. 2022;6(3):113–119 (in Russ.). DOI: 10.32364/2587-6821-2022-6-3-113-119.
Введение
Наиболее распространенным заболеванием опорно-двигательного аппарата является остеоартрит (ОА), который часто ограничивает повседневную активность и снижает качество жизни пациентов [1]. В настоящее время наблюдается опасная тенденция к увеличению заболеваемости ОА среди трудоспособного населения. По данным Минздрава России, за период с 2013 по 2017 г. количество больных ОА возросло на 3,7%. На сегодняшний день в Российской Федерации данным заболеванием страдают более 4 млн человек [2]. В связи с тем, что принимают во внимание именно обнаруженные и зафиксированные случаи ОА, можно предположить, что данные показатели не отражают истинного числа больных. По оценкам масштабных исследований распространенности нозологий за 2019 г., ОА страдают около 7% населения планеты, в общей сумме это более 500 млн больных [3].
Именно суставная боль при данной патологии является важным фактором дезадаптации [4]. У 40% больных ОА с рентгенологическими изменениями в суставах практически отсутствует болевой синдром, тогда как у других пациентов отмечается выраженная боль при отсутствии явных изменений в пораженных суставах [5].
Источником боли при данной патологии являются нехрящевые элементы сустава, в том числе костные структуры, синовиальная оболочка и околосуставные ткани. При повреждении клеточных структур происходит раздражение периферических ноцицепторов биологическими веществами. Во внеклеточную среду из клеток тканей выделяются гистомин, серотонин, лейкотриены, эндотелины, интерлейкин-1, фактор некроза опухоли α, простагландины, оксид азота. Локально в области повреждения с болевыми рецепторами взаимодействуют брадикинин и каллидин, поступающие из плазмы крови в ткани сустава.
Однако при патологических влияниях на афферентные терминали ноцицепторы также могут возбуждаться. Тогда в поврежденных структурах обнаруживаются нейрокинины (например, субстанция Р, кальцитонин ген-связанный пептид), которые выделяются из поверхностных нервных окончаний С-волокон. Вследствие этого повышается проницаемость стенок кровеносных сосудов с увеличением их просвета. Нейрокинины способствуют высвобождению из макрофагов и эндотелия тканевых раздражителей, в результате чего развивается воспаление неинфекционного нейрогенного генеза с возбуждением ноцицептивных окончаний [6].
Согласно современным данным при ОА чаще всего отмечаются два варианта хронической боли. Не вызывает сомнения, что наиболее часто встречается ноцицептивная боль, возникающая в основном при воспалении тканей сустава в результате раздражения болевых рецепторов на периферии, она играет охранительную роль [7, 8]. Главное значение в появлении при дегенеративных и изменениях ноципластической боли, ранее имевшей название дисфункциональной, центральной сенситизации, придают усилению в ЦНС сигналов с развитием гиперчувствительности вследствие подавления нисходящих ингибирующих путей и повышенной активности систем восприятия болевых ощущений [9, 10]. Однако в последнее время появились исследования, показывающие наличие у значительно го количества пациентов с ОА и нейропатической составляющей болевого синдрома, который появляется из-за повреждения отделов центральной или периферической нервной системы, а не из-за раздражения болевых рецепторов [4, 8].
В исследовании J.R. Hochman et al. [11] было обнаружено, что 34% больных ОА коленных суставов предъявляют жалобы нейропатического характера. При объективном обследовании у таких пациентов находят следующие нейропатические составляющие: чувствительность к небольшому давлению, возникновение боли в ответ на нетипичный раздражитель, снижение порога болевой чувствительности. Также было показано, что у 28% пациентов с ОА коленных суставов встречается именно нейропатическая боль, причем ее выраженность коррелирует с тяжестью ОА, количеством болезненных суставов, проявлениями депрессии [12].
Эти исследования немногочисленны, а в клинической практике врачу часто приходится иметь дело со смешанным характером боли у лиц, страдающих ОА, что требует определения ее характера для назначения адекватной патогенетической терапии [13].
Цель исследования: изучить особенности болевого синдрома у пациентов с ОА, в том числе выявить нейропатический компонент (НК) у таких больных, оценить его влияние на качество жизни.
Материал и методы
В проспективное исследование был включен 31 пациент с подтвержденным диагнозом ОА коленных и тазобедренных суставов. При наличии нескольких пораженных суставов оценивали наиболее беспокоящий. Все пациенты проходили курс лечения по поводу ОА в терапевтическом отделении ЧУЗ «КБ «РЖД-медицина» г. Кирова». Показаниями к госпитализации служили выраженный болевой синдром или его усиление на фоне амбулаторного лечения, синовит или рецидивирующий синовит, выраженные нарушения функции.
Критерии включения: достоверный диагноз ОА согласно классификационным критериям АСR; I–III рентгенологическая стадия ОА коленных или тазобедренных суставов; возраст от 25 до 80 лет; подписанное пациентом информированное согласие.
Критерии невключения: наличие у пациента с ОА сопутствующего ревматического воспалительного заболевания, в том числе аутоиммунного, психической патологии; IV рентгенологическая стадия ОА коленных или тазобедренных суставов; инфекционные заболевания; беременность и лактация.
Включенным в исследование пациентам было проведено общеклиническое обследование, измерение объема движений в суставах в градусах. Выраженность болевого синдрома оценивали по стандартной визуальной аналоговой шкале (ВАШ).
С целью выявления НК боли 8 (НКБ) проводили клинико-неврологическое обследование с применением диагностических опросников DN4 и painDETECT.
Для того чтобы обнаружить боль нейропатического генеза, существуют различные комбинированные шкалы и специфические опросники, позволяющие оценить объективные неврологические симптомы и жалобы субъективного характера. Самым удобным для практического применения считается опросник DN4 [14], включающий 10 вопросов. Если общая сумма баллов (количество ответов «да») составляет 4 и более, это говорит о том, что выявленный болевой синдром у пациента — нейропатического вида или присутствует НК (при гетерогенной ноцицептивно-нейропатической боли). Чувствительность данного опросника DN4 — 82,9%[15], что позволяет применять его для скринингового обнаружения болевых синдромов нейропатического характера.
Опросник painDETECT [16] создан для использования медицинским персоналом. Он представляет собой схематическое изображение расположения болевых нарушений с ВАШ и дополнительный опросник для выявления спонтанных и спровоцированных симптомов боли нейропатического характера. С помощью рисунка также можно оценить особенности боли: непрерывная, приступообразная, непрерывная с приступами и др. Данный опросник в полном объеме описывает разнообразные характеристики боли и помогает оценить динамику болевых ощущений на фоне терапии. Вопросы опросника оцениваются по 5-балльной шкале. Отрицательный результат фиксируется при количестве баллов от 0 до 12, неопределенный (НК может присутствовать) — при 13–18 баллах, вероятность наличия НК 90% — при 19–38 баллах [17]. Диагностическая значимость данной методики равна 83%. Опросник painDETECT, как и DN4, адаптирован для русского языка и прошел лингвистическую валидацию.
Для изучения качества жизни пациентов использовали удобную в применении шкалу EQ-5D, состоящую из двух частей [18]. Основная часть включает 5 показателей, характеризующих ежедневную активность человека: 1 — свобода перемещения в пространстве (MO — mobility); 2 — способность к самообслуживанию (SF — self care); 3 — привычная деятельность в повседневной жизни (UA— usually activity); 4 — наличие боли или дискомфорта (PD — pain and discomfort); 5 — присутствие симптомов тревоги и депрессии (AD — anxiety and depression). По каждому показателю можно определить 3 варианта изменений: 1 балл — нет нарушений, 2 балла — нарушения выражены умеренно, 3 балла — нарушения явно выражены.
При анализе данного опросника можно выявить более 200 вариаций, выраженных 5-значным кодом (например, 22112). Следующая часть опросника — ВАШ, представляющая собой линейку-вертикаль с делениями от 0 до 100, которая отображает общее состояние здоровья пациента. Значение «0» говорит о самом плохом его состоянии, «100» — о максимально хорошем самочувствии. Данные показатели оцениваются в момент заполнения опросника.
Всем пациентам были назначены нестероидные противовоспалительные препараты (НПВП) парентерально или перорально, физиотерапевтическое лечение, у некоторых пациентов применялась местная терапия с использованием локальных форм глюкокортикоидов.
Для анализа полученных показателей использовали компьютерные программы Excel 7.0 и специализированный статистический пакет SPSS 17.0. Достоверность различий определяли с помощью методов описательной статистики, использовали критерий Стьюдента, Манна — Уитни. При р<0,05 различия считали статистически значимыми.
Результаты исследования
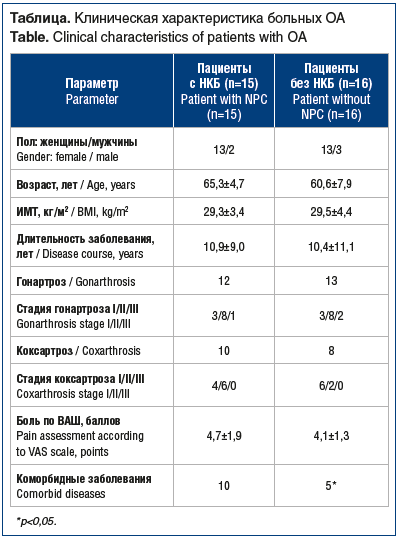
Большинство обследованных составили женщины — 26 (83,9%), возраст пациентов находился в пределах от 28 до 79 лет (в среднем 62,9±6,7 года). Стаж суставного синдрома соответствовал продолжительности болевого синдрома и варьировал от 2 мес. до 30 лет (в среднем 10,6±9,9 года). У большинства пациентов гонартроз и коксартроз соответствовали I и II стадии по Kellgren — Lawrence. Средние значения индекса массы тела (ИМТ) составили 29,4±3,9 кг/м2, что соответствует избыточной массе тела.
При анализе выраженности болевого синдрома по ВАШ было выявлено, что в основном у пациентов преобладала умеренно выраженная боль (4,4±1,2 балла). После изучения данных анкетирования по опроснику DN4 все больные были разделены на 2 группы. В первую группу вошли 15 человек с суммой баллов 4 и более (НКБ присутствует), во вторую группу — 16 человек с количеством баллов менее 4 (НКБ не обнаружен). Таким образом, НКБ был выявлен у 48% пациентов.
Сравнительный анализ показал, что группы статистически значимо не различались по возрасту пациентов, показателям длительности суставного синдрома и ИМТ (см. таблицу). III стадия коксартроза зафиксирована не была, III стадия гонартроза наблюдалась в единичных случаях (1 человек в группе с НКБ и 2 — в группе без НКБ), т. е. наличие нейропатических симптомов не влияло на тяжесть рентгенологических изменений. Уровень боли по ВАШ в суставах в группе НКБ был выше на 13%, однако достоверных различий не выявлено.
Из сопутствующей патологии в обеих группах наиболее часто встречалась гипертоническая болезнь: у 7 (46,7%) пациентов с НКБ и у 4 (25%) пациентов без НКБ. Также были зафиксированы единичные случаи хронического бронхита, хронического гастрита, дивертикулярной болезни кишечника вне обострения. В целом количество пациентов с коморбидной патологией было выше в группе НКБ (p<0,05).
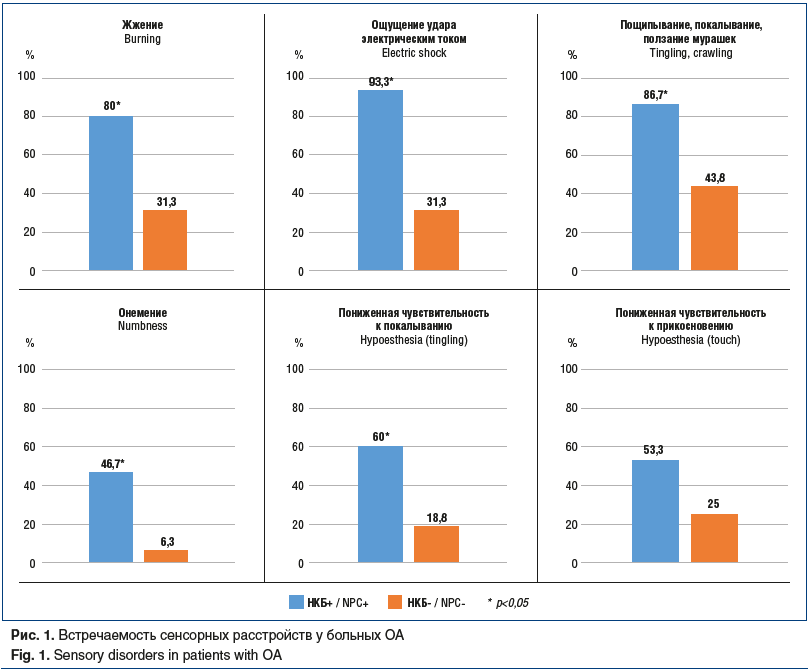
При изучении данных по опроснику DN4 было выявлено, что у пациентов с НКБ статистически значимо чаще (p<0,05) встречались следующие проявления в зоне наиболее пораженного сустава: жжение, онемение, ощущение удара электрическим током, сниженная чувствительность к покалыванию, пощипывание, чувство ползания мурашек и/или покалывание. Такой симптом, как зуд практически не встречался, а частота пониженной чувствительности к прикосновению в группах достоверно не отличалась (рис. 1).
При анализе показателей опросника painDETECT у пациентов с наличием НКБ наблюдалась более высокая встречаемость вызванной боли при нажатии и иррадиации болевых ощущений без достоверных различий. Интенсивность боли в настоящий момент была умеренной, выраженность наиболее сильного приступа за 4 нед., предшествовавшие госпитализации, соответствовала очень сильной боли, по данным показателям группы статистически значимо не отличались.
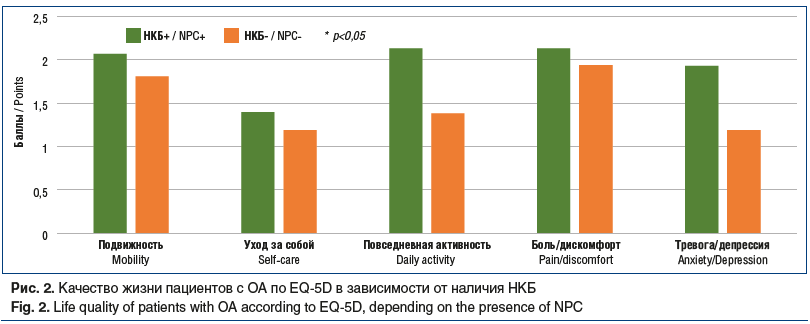
При изучении качества жизни по шкалам EQ-5D обнаружены нарушения различной выраженности в повседневной деятельности больных. Ярко выраженные нарушения в группе НКБ присутствовали у 3 (20%) человек: 2 пациента испытывали крайне сильную боль, 1 — максимальную тревогу и депрессию. В группе без НКБ 3-балльные показатели зафиксированы у 2 человек: у 1 — в повседневной деятельности, у 1 — в психоэмоциональной сфере. Достоверных различий в максимальной степени изменения здоровья между группами не выявлено. Умеренно выраженные нарушения подвижности и ежедневной рутинной деятельности наблюдались у всех пациентов с НКБ, нарушения способности к самообслуживанию — у 14 (93,3%) человек. Умеренно выраженную боль испытывали 13 (86,7%) человек с НКБ, умеренную тревогу или депрессию — 5 (33,3%). В группе без НКБ умеренные изменения при перемещении в пространстве отметили 15 (93,8%) пациентов, при самообслуживании — 13 (81,3%), в ежедневной активности — 14 (87,5%). У всех пациентов данной группы боль была умеренно выраженной, у 37,5% отмечались средневыраженные нарушения в психической сфере.
В целом, согласно опроснику EQ-5D, более низкие показатели наблюдались у пациентов с НКБ. В группе пациентов с НКБ достоверно хуже была оценка подвижности, повседневная активность. У таких больных также чаще наблюдались тревожно-депрессивные симптомы (рис. 2). Исключение составили изменения по SF- и PD-показателям опросника (р>0,05).
Обсуждение
Хронической болью называют боль, которая продолжается 3 мес. и более или сохраняется после восстановления поврежденных тканей. Однако часто распознавание и устранение причин повреждения не приводят к купированию болевых ощущений, не всегда наблюдается положительная корреляция болевого синдрома с тяжестью изменений в архитектонике тканей или данная связь определенного характера не имеет [19].
В последнее время широко высказывается мнение, что боль хронического характера является не патогномоничным симптомом какого-либо заболевания, а отдельной нозологией, часто требующей специфической комбинированной терапии, которая направлена и на этиологические, и на патогенетические факторы [7]. Почему же происходит хронизация боли, а боль хронического характера трудно поддается лечению традиционными обезболивающими препаратами? Объяснением может служить патофизиологический механизм развития различных нозологий, который имеет сложный, комплексный характер.
Обнаружена четкая корреляция между индивидуальной выраженностью, переносимостью болевого синдрома и психической сферой пациента. Значимое влияние на ощущение боли оказывают состояние стресса, неактивные способы уменьшения боли, проблемы в семье или на работе, инсомния. Дополнительными факторами, определяющими воздействие на выраженность боли и результативность назначаемого лечения, являются собственные взгляды и принципы пациента, стереотипы его поведения и понимание особенностей получаемой терапии [6, 19].
При объективном обследовании больных с болями ноцицептивного характера практически всегда выявляются области первичной и вторичной гипералгезии (зоны с более высокой чувствительностью болевых рецепторов). Гипералгезия первичного генеза возникает в участке повреждЦ 5ния структур тканей, область гипералгезии вторичного характера часто находится в близко лежащих зонах без повреждения. Явление сенситизации ноцицепторов, т. е. увеличение их чувствительности к воздействию температурных и механических раздражителей, считается ключевым механизмом возникновения первичной гипералгезии [20]. Этот вид сенситизации отмечается при раздражении ноцицептивных С-волокон, выделяющих нейропептиды, которые, в свою очередь, провоцируют бурные биохимические реакции после соединения с определенными рецепторными терминалями на афферентных ноцицептивных волокнах. Таким образом, нервное окончание становится гораздо более чувствительным к внешним раздражителям и возбуждается при воздействии меньшей силы.
В настоящее время нет единого мнения о том, имеет ли хроническая суставная боль при ОА нейропатический характер [21]. Присутствие НК говорит о том, что повреждены нервные окончания, находящиеся в тканях сустава, что само по себе вызовет болевые ощущения. Это имеет большое значение, так как механизмы развития и принципы лечения болевого синдрома ноцицептивного и нейропатического генеза различаются.
Единичные исследования, посвященные изучению экспериментального ОА у животных, подтвердили наличие нейропатической составляющей боли, так как у них была обнаружена патология малых чувствительных окончаний [22].
В последнее время опубликованы исследования, выявляющие роль НК в формировании болевого синдрома при ОА [20, 23]. В патогенезе такой боли кроме механического фактора и воспаления, видимо, играют роль пол, возраст, стаж суставного синдрома, национальность, социальное и семейное положение, ожирение, психоэмоциональное состояние [19]. Активно изучаются особенности их влияния на выраженность хронического болевого синдрома.
По данным литературы, НКБ встречается у больных ОА с высокой частотой. В исследовании Е.Ф. Туровской и соавт. [20] из 80 пациентов с ОА коленных суставов симптомы сенсорной боли встречались у 30% больных. Наличие НКБ у таких пациентов было связано с выраженностью боли по ВАШ, данными шкалы WOMAC, уровнем тревоги по опроснику HADS. Также зависимость между структурными изменениями сустава и преобладанием одного компонента боли показали данные УЗИ коленных суставов и рентгенографии. Присутствие НКБ сопровождалось более частыми ощущениями пощипывания, удара током, онемения, зуда. При объективном обследовании пациентов с НКБ обнаружены вызванные нейропатические симптомы, такие как гиперпатия (высокая чувствительность к давлению), гипералгезия (низкий болевой порог чувствительности) или аллодиния (боль появляется в ответ на раздражитель неболевого характера).
Е.С. Филатова и соавт. [8] при обследовании 160 пациентов с ОА выявили, что НКБ присутствует у 37,5% больных. У этих пациентов также наблюдался более высокий балл по ВАШ, больший индекс WOMAC и более низкое качество жизни по опроснику EQ-5D (p<0,001). При клинико-неврологическом обследовании поражения соматосенсорной нервной системы обнаружено не было. При анализе чувствительных нарушений у пациентов с НКБ выявлено, что у большей части из них (86,7%) имелись гипералгезия, гипестезия, аллодиния. Причем данные проявления зафиксированы не только в области больных суставов, но и в районе бедра, голени в разных комбинациях [8].
Настоящее исследование было направлено на выявление НКБ у пациентов с ОА коленных или тазобедренных суставов, находившихся на стационарном лечении. НКБ был выявлен с еще более высокой частотой — почти у половины (48,4%) больных ОА. Это может быть связано с тем, что на лечении находились пациенты с выраженной болью, у которых предшествующая терапия на амбулаторном этапе была неэффективной. При выявлении симптомов нейропатической боли у пациентов наблюдалось более низкое качество жизни и повышение выраженности симптомов депрессии и/или тревоги. Также у пациентов с НКБ преобладали изменения чувствительности нервных окончаний, в том числе онемение, жжение, ощущение удара электрическим током, пощипывание, ползание мурашек и понижение чувствительности к покалыванию.
Предполагалось, что возраст коррелирует с более высокой частотой НКБ из-за большей продолжительности заболевания. Однако в исследовании J.R. Hochman et al. [11] пациенты из группы с нейропатической составляющей боли были моложе остальных [11]. По нашим данным, пациенты с НКБ были старше пациентов без НКБ на 7,5%, однако достоверными эти различия не были. Выявленные несоответствия требуют дальнейшего изучения.
Заключение
В нашем исследовании подтверждено, что хроническая боль при поражении суставов у пациентов с ОА часто имеет смешанный характер. Наряду с преобладающим ноцицептивным компонентом присутствуют явления центральной сенситизации, а также нейропатический вариант боли. При наличии НКБ появляются изменения чувствительных окончаний в области пораженного сустава, не соответствующие воспалительным и структурным изменениям, снижается качество жизни пациентов и возрастает уровень тревожности.
Следовательно, назначенная терапия в основном оказывает действие на болевой синдром ноцицептивного характера (НПВП), тогда как на нейропатические проявления влияние будет недостаточным. Можно предположить, что при обнаружении НКБ у больных ОА для повышения эффективности терапии необходимо применять антидепрессанты или антиконвульсанты.
Сведения об авторе:
Филимонова Оксана Григорьевна — к.м.н., доцент кафедры внутренних болезней ФГБОУ ВО Кировский ГМУ Минздрава России; 610027, Россия, г. Киров, ул. К. Маркса, д. 112; ORCID iD 0000-0002-3604-3358.
Контактная информация: Филимонова Оксана Григорьевна, e-mail: fioks24@mail.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 20.01.2022.
Поступила после рецензирования 14.02.2022.
Принята в печать 14.03.2022.
About the author:
Oksana G. Filimonova — C. Sc. (Med.), Associate Professor of the Department of Internal Diseases, Kirov State Medical University; 112, Karl Marks str., Kirov, 610027, Russian Federation; ORCID iD 0000-0002-3604-3358.
Contact information: Oksana G. Filimonova, e-mail: fioks24@mail.ru.
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 20.01.2022.
Revised 14.02.2022.
Accepted 14.03.2022.
2. Балабанова Р.М., Дубинина Т.В. Динамика пятилетней заболеваемости болезнями костно-мышечной системы и их распространенности среди взрослого населения России за 2013–2017 гг. Современная ревматология. 2019;13(4):11–17. DOI: 10.14412/1996-7012-2019-4-11-17.
3. Лила А.М., Алексеева Л.И., Таскина Е.А., Кашеварова Н.Г. Остеоартрит как междисциплинарная проблема: алгоритм лечения для терапевтов и врачей общей практики. Современная ревматология. 2021;15(5):68–75. DOI: 10.14412/1996-7012-2021-5-68-75.
4. Филатова Е.С. Анализ болевого синдрома у больных ревматоидным артритом и остеоартритом коленных суставов. РМЖ. 2018;7:23–27.
5. Nidhi S., Ejindu V., Kiely P. What makes osteoarthritis painful? The evidence for Local and Central pain processing. Rheumatology (Oxford). 2011;50(12):2157–2165. DOI: 10.1093/rheumatology/ker283.
6. Кукушкин М.Л. Механизмы развития хронической боли. Подходы к профилактике и лечению. Consilium Medicum. 2017;19(2):110–117.
7. Kosek E., Cohen M., Baron R. et al. Do we need a third mechanistic descriptor for chronic pain states? Pain. 2016;157(7):1382–1386. DOI: 10.1097/j.pain.0000000000000507.
8. Филатова Е.С., Лила А.М. Вклад нейрогенных механизмов в патогенез хронической суставной боли. Современная ревматология. 2021;15(2):43–49. DOI: 10.14412/1996-7012-2021-2-43-49.
9. Trouvin A.P., Perrot S. New concepts of pain. Best Pract Res Clin Rheumatol. 2019;33(3):101415. DOI: 10.1016/j.berh.2019. 04.007.
10. Yunus M.B. Editorial review: An update on central sensitivity syndromes and the issues of nosology and psychobiology. Curr Rheumatol Rev. 2015;11(2):70–85. DOI: 10.2174/157339711102150702112236.
11. Hochman J.R., French M.R., Bermingham S.L. The nerve of osteoarthritis pain. Arthritis Care Res (Hoboken). 2010;62(7):1019–1023. DOI: 10.1002/acr.20142.
12. Hochman J.R., Gagliese L., Davis A.M., Hawker G.A. Neuropathic pain symptoms in a community knee OA cohort. Osteoarthritis Cartilage. 2011;19(6):647–654. DOI: 10.1016/j.joca.2011.03.007.
13. Freynhagen R., Arevalo Parada H., Calderon-Ospina C.A. et al. Current understanding of the mixed pain concept: a brief narrative review. Curr Med Res Opin. 2019;35(6):1011–1018. DOI: 10.1080/ 03007995.2018.1552042.
14. Bouhassira D., Attal N., Alchaar H. et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain. 2005;114(1–2):29–36. DOI: 10.1016/j.pain.2004.12.010.
15. Данилов Ан.Б., Данилов Ал.Б. Управление болью. Карманные рекомендации по диагностике и фармакотерапии. Приложение к журналу «Медицинский совет». №17/2017. М.: ООО «Группа Ремедиум»; 2018.
16. Freynhagen R., Baron R., Gockel U., Tolle T. painDETECT: a new screening questionnaire to detect neropathic components in patients with back pain. Curr Med Res Opin. 2006;22(10):1911–1920. DOI: 10.1185/030079906X132488.
17. Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. 3-е изд. М.: Медицина; 2018.
18. Акулова А.И., Гайдукова И.З., Ребров А.П. Валидация версии 5L опросника EQ-5D в России. Научно-практическая ревматология. 2018;56(3):351–355. DOI: 10.14412/1995-4484-2018-351-355.
19. Lim A.Y., Doherty L. What of guidelines for osteoarthritis? Int J Rheum Dis. 2011;14(2):136–144. DOI: 10.1111/j.1756-185X.2011.01609.x.
20. Туровская Е.Ф., Алексеева Л.И., Филатова Е.Г. Механизмы хронической боли при остеоартрозе коленного сустава. Научно-практическая ревматология. 2014;52(5):526–529. DOI: 10.14412/1995-4484-2014-526-529.
21. Soni A., Batra R.N., Gwilym S.E. et al. Neuropathic features of joint pain: a community-based study. Arthritis Rheum. 2013;65(7):1942–1949. DOI: 10.1002/art.37962.
22. McDougall J.J., Andruski B., Schuelert N. et al. Unravelling the relationship between age, nociception and joint destruction in naturally occurring osteoarthritis of Dunkin Hartley guinea pigs. Pain. 2009;141(3):222–232. DOI: 10.1016/j.pain.2008.10.013.
23. Gwilym S.E., Keltner J., Warnaby C.E. et al. Psychophysical and functional imaging evidence supporting the presence of central sensitization in a cohort of osteoarthritis patients. Arthritis Rheum. 2009;61(9):1226–1234. DOI: 10.1002/art.24837.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
