Причинно-значимые аллергены и спектр сенсибилизации детей, перенесших пищевую анафилаксию
Цель исследования: изучить спектр сенсибилизации и выявить причинно-значимые аллергены у детей г. Екатеринбурга, перенесших пищевую анафилаксию (ПАн), для снижения числа жизнеугрожающих эпизодов пищевой аллергии (ПА) у данных детей.
Материал и методы: в исследование включено 60 детей в возрасте от 4 мес. до 16 лет, проживающих в г. Екатеринбурге, — 36 (60,0%) мальчиков и 24 (40,0%) девочки. Все дети имели эпизоды ПАн в анамнезе. Детям проведены: клинический осмотр, сбор аллергологического анамнеза и компонентное обследование на мультиплексной панели на 112 аллергокомпонентов.
Результаты исследования: изучена сенсибилизация и выявлены причинно-значимые аллергены в 100% случаев. ПАн у 31 (51,67%) ребенка была инициирована молочными протеинами (Bos d4, Bos d5, Bos d8), у 10 (16,67%) — куриным яйцом (Gal d2, Gal d1), у 10 (16,67%) — грецким орехом (Jug r1, Jug r2, Jug r3), у 9 (15,00%) — рыбой (Gad c1), у 7 (11,67%) — киви (Act d1), у 7 (11,67%) — арахисом (Ara h1, Ara h2, Ara h3, Ara h6), у 20 (33%) — различными видами орехов (Ber e1, Ana o2, Cora 9, Cora 8). Повышение уровня специфического иммуноглобулина Е (sIgE) установлено: у 39 (65,00%) пациентов к аллергенам березы (Bet v1), у 41 (68,33%) — к аллергенам кошки (Fel d1, Fel d2, Fel d4), у 24 (40,0%) — к аллергенам собаки (Can f1, Can f2, Can f3, Can f5), у 10 (16,6%) — к аллергенам тимофеевки (Phl p1, Phl p4, Phl p5), у 8 (13,3%) — к полыни (Art v1), у 2 (3,33%) — к клещам домашней пыли. Респираторные симптомы у сенсибилизированных детей с ПАн появлялись в четырех из пяти случаев.
Заключение: для снижения числа жизнеугрожающих эпизодов ПА у детей с ПАн на пищу следует выявлять и изучать весь спектр сенсибилизации, устанавливать причинно-значимые аллергены и триггеры возможных анафилактических реакций для дальнейшей разработки элиминационной диеты и индивидуального плана ведения пациента.
Ключевые слова: пищевая аллергия, пищевая анафилаксия, дети, аллергены, сенсибилизация.
Для цитирования: Лепешкова Т.С. Причинно-значимые аллергены и спектр сенсибилизации детей, перенесших пищевую анафилаксию. РМЖ. Медицинское обозрение. 2023;7(2):75-80. DOI: 10.32364/2587-6821-2023-7-2-75-80.
T.S. Lepeshkova
Ural State Medical University, Yekaterinburg, Russian Federation
Aim: to assess the spectrum of sensitization and reveal causative allergens in Ekaterinburg children with the clinical history of food-induced anaphylaxis (FIA) for reducing the number of life-threatening food allergy (FA) episodes in these children.
Patients and Methods: the study included 60 children — 36 (60.0%) boys and 24 (40.0%) girls aged from 4 months to 16 years who lived in Yekaterinburg. All children had (FIA) episodes in their clinical histories. The children underwent physical examination, and their allergy-focused clinical history was taken. Also, the ISAC-112 ImmunoCAP assay, a multiplex test with allergen components, was used.
Results: the sensitization was assessed, and the causative allergens were identified in 100% of cases. In 31 children (51.67%) FIA was initiated by milk proteins (Bos d4, Bos d5, Bos d8); in 10 (16.67%) – chicken egg (Gal d2, Gal d1); in 10 (16.67%) – walnut (Jug r1, Jug r2, Jug r3); in 9 (15.00%) – fish (Gad c1); in 7 (11.67%) – kiwi (Act d1); in 7 (11.67%) – peanut (Ara h1, Ara h2, Ara h3, Ara h6); and in 20 (33%) – by different nuts (Ber e1, Ana o2, Cora 9, Cora 8). Elevated specific immunoglobulin E (sIgE) levels for birch tree allergens (Bet v1) were found in 39 (65.00%) patients, cat allergens (Fel d1, Fel d2, Fel d4) – in 41 (68.33%), dog allergens (Can f1, Can f2, Can f3, Can f5) – in 24 (40.0%), timothy allergens (Phl p1, Phl p4, Phl p5) – in 10 (16.6%), artemisia allergens (Art v1) – in 8 (13.3%), and house dust mites in 2 (3.33%). Respiratory symptoms in sensitized children with FIA developed in 4 of 5 cases.
Conclusion: to reduce the number of life-threatening FA episodes in children with FIA it is necessary to reveal and assess the entire spectrum of sensitization, identify the causative allergens and triggers of potential anaphylactic reaction for the further development of an elimination diet and individualized patient management plan.
Keywords: food allergy, food-induced anaphylaxis, children, allergens, sensitization.
For citation: Lepeshkova T.S. Causative allergens and sensitization spectrum in children with the history of food-induced anaphylaxis. Russian Medical Inquiry. 2023;7(2):75–80 (in Russ.). DOI: 10.32364/2587-6821-2023-7-2-75-80.
Введение
Анафилаксия — это жизнеугрожающая системная реакция гиперчувствительности, характеризующаяся быстрым развитием потенциально жизнеугрожающих изменений гемодинамики и/или нарушений со стороны дыхательной системы [1]. Известно, что развитие анафилаксии возможно без гемодинамических и дыхательных нарушений с поражением кожи, слизистых оболочек и желудочно-кишечного тракта1 [2]. Показано, что в детском возрасте именно продукты питания часто становятся причиной развития пищевой анафилаксии (ПАн) [1]. При ПАн проведение проспективных исследований невозможно [3], в этой связи ретроспективный сбор аллергоанамнеза с дальнейшим проведением мультиплексных обследований следует рассматривать как единственную возможность выявить причинно-значимые пищевые аллергены [4].
Известно, что практически любая пища может стать причиной ПАн у детей [5]. Изучение молекулярных основ пищевых аллергенов, повинных в острых проявлениях пищевой аллергии (ПА), показало, что для разных территорий, расположенных в различных климатических зонах даже одной страны, пищевые аллергены будут различаться [6]. Так, аллергенность растительного пищевого продукта будет зависеть от географической зоны произрастания и способа его кулинарной обработки [1]. Точечное (локальное) изучение пищевых аллергенов, значимых для конкретной местности, обусловлено необходимостью разработки терапевтических мероприятий, направленных на снижение числа жизнеугрожающих эпизодов ПА в отдельно взятом городе, субъекте федерации или стране [7]. В этой связи проведение подобных работ приобретает важность и в нашей стране.
Цель исследования: изучить спектр сенсибилизации и выявить причинно-значимые аллергены у детей г. Екатеринбурга, перенесших ПАн, для снижения числа жизнеугрожающих эпизодов ПА у данных детей.
Материал и методы
В проспективное открытое исследование вошли 60 пациентов: 36 (60,0%) мальчиков и 24 (40,0%) девочки в возрасте от 4 мес. до 16 лет, проживающих в г. Екатеринбурге. Всем детям проведены стандартный клинический осмотр, сбор аллергологического анамнеза и аллергологическое обследование: мультиплексное исследование на 112 аллергокомпонентов из 51 источника на панели аллергочип ISAC-112 (ImmunoCAP, Thermo Fisher Scientific/Phadia (Uppsala, Швеция)). Изучали уровень специфического иммуноглобулина Е (sIgE), результат выражался в единицах ISAC: менее 0,3 ISU-E — необнаруживаемый; 0,3–0,9 ISU-E — низкий; 1,0–14,9 ISU-E — умеренный/высокий; более 15,0 ISU-E — очень высокий.
Исследование одобрено локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России (протокол № 10 от 15.12.2017). Родители больных при включении в исследование подписывали стандартное согласие на участие в данной работе и проведение всех необходимых манипуляций.
Обработка данных проводилась методами математической статистики. Нормальность распределения результатов проверяли графически. Распределение отличалось от нормального, что потребовало для представления показателей использовать медиану и квартили (Ме [Q1; Q3], min–max). Для статистического изучения связи между различными явлениями использовался коэффициент ранговой корреляции Спирмена.
Результаты исследования
Проведенное молекулярное обследование установило, что пациенты с системными проявлениями ПА имели поливалентную сенсибилизацию и были суммарно сенсибилизированы к 102 молекулам из 112 компонентов аллергенов. В 100% случаев удалось выявить сенсибилизацию к молекуле(ам) пищевого(ых) аллергена(ов), вызвавшего(их) системную аллергическую реакцию у детей (рис. 1).
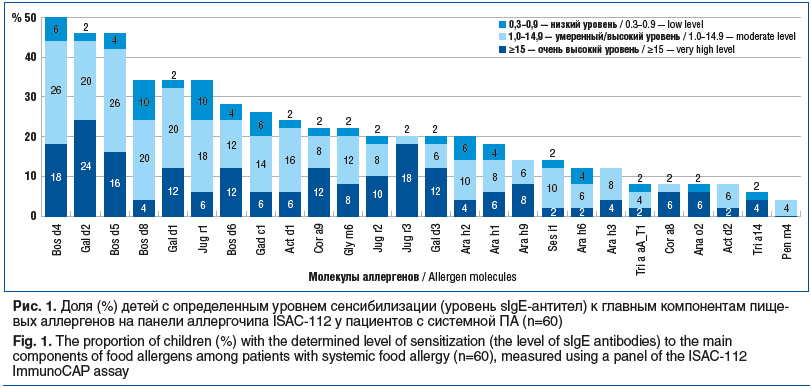
Клинических случаев ПАн у детей г. Екатеринбурга по вине молочных протеинов (Bos d4, Bos d5, Bos d8) произошло больше, чем по причине других аллергенов. Вторым продуктом по частоте анафилактических реакций стало куриное яйцо (Gal d2, Gal d1), третьим оказался грецкий орех (Jug r1, Jug r2, Jug r3). ПАн развивалась также на рыбу (Gad c1), киви (Act d1), различные орехи деревьев (Cora 8, Cora 9) и арахис (Ara h1, Ara h2, Ara h3, Ara h6).
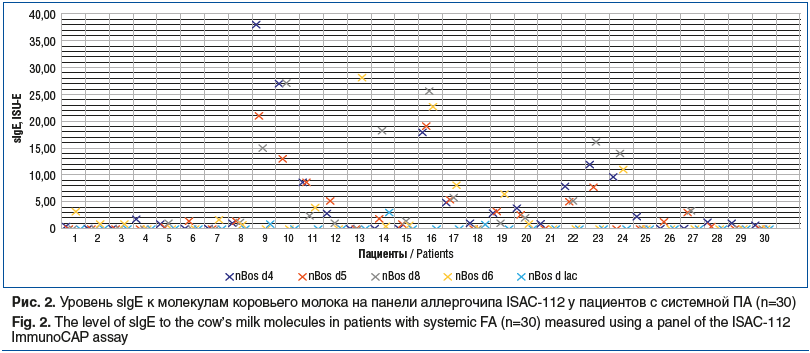
Симптомы ПАн как реакции на белки коровьего молока (БКМ) выявлены у 31 (51,67%) ребенка. Анафилактические реакции вызывали как сывороточные белки, так и казеиновая фракция: Bos d4 (0,00 [0,00; 1,09], 0,00–38,00), Bos d5 (0,00 [0,00; 1,38], 0,00–27,00), Bos d8 (0,00 [0,00; 1,15], 0,00–27,00), Bos d6 (0,00 [0,00; 0,67], 0,00–28,00). Гиперчувствительность к одной молекуле молока была установлена у 8 (13,33%) пациентов, к двум — у 6 (10,0%), к трем — у 9 (15,00%), к четырем — у 8 (13,33%) больных. Уровень sIgE к БКМ (Bos d4, Bos d5, Bos d8, Bos d6, Bos d lac) варьировал в широком диапазоне (рис. 2).
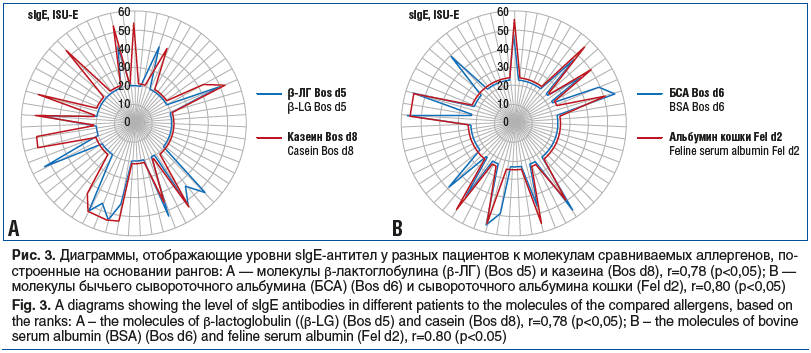
Корреляционный анализ, проведенный между молекулами ISAC-112 внутри группы детей с ПАн, выявил высокие по шкале Чеддока положительные корреляционные связи между молекулой казеина (Bos d8) и молекулой β-лактоглобулина (Bos d5) (r=0,78, р<0,05) (рис. 3А), а также между молекулой бычьего сывороточного альбумина (Bos d6, ISU-E), молекулой сывороточного альбумина кошки (Fel d2) (r=0,80, р<0,05) (рис. 3B) и молекулой сывороточного альбумина собаки (Can f3) (r=0,77, р<0,05).
Пищевая анафилаксия на куриное яйцо развилась у 10 (16,67%) детей, а еще 18 (30%) имели в анамнезе ангиоотеки слизистой оболочки полости рта, лица и конечностей и острую кожную реакцию по типу крапивницы при контакте с нативным куриным яйцом. Системная аллергическая реакция на яйцо была обусловлена сенсибилизацией детей к овомукоиду (Gal d1) (0,00 [0,00; 1,00], 0,5–9,0 ISU-E) и/или овальбумину (Gal d2) (0,00 [0,00; 1,07], 0,50–9,60 ISU-E). Сенсибилизация к молекулам куриного яйца установлена у 33 (55,00%) пациентов, иногда к двум молекулам одновременно: к Gal d2 — у 46%, к Gal d1 — у 34% (см. рис. 1).
Пищевая анафилаксия на рыбу развилась у 9 (15,00%) детей, у всех пациентов подтверждена сенсибилизация к молекуле трески (Gad c1) (0,00 [0,00; 0,63], 0,4–100,0 ISU-E). Еще у одного пациента сенсибилизация к рыбе оказалась латентной. Клинических симптомов на морепродукты у детей г. Екатеринбурга, перенесших ПАн, зарегистрировано не было. Латентной оказалась сенсибилизация у 2 пациентов, имеющих повышенные уровни sIgE к саркоплазматическому кальцийсвязывающему белку креветки (Pen m4) (min–max: 1,3–2,78 ISU-E).
Мультиплексное обследование детей, перенесших ПАн, выявило 6 пациентов с сенсибилизацией к молекулам пшеницы. Среди наших пациентов ПАн на пшеницу ни у кого не развилась, реакции проявлялись в виде тяжелого течения атопического дерматита. Корреляционный анализ установил высокие положительные корреляционные связи двух разных молекул пшеницы между собой: омега-5 глиадин (Tri a19.0101) и альфа-амилаза / ингибитор трипсина (Tri a aA_TI) (r=0,72, р<0,05), а также между пшеницей (Tri a14) и молекулой платана (Pla a3) (r=0,77, р<0,05); между пшеницей (Tri a14) и молекулой оливы (Ole e7) (r=0,71, р<0,05), являющихся представителями одного семейства — липид-транспортных протеинов.
Сенсибилизация к белкам грецкого ореха (Jug r1, Jug r2, Jug r3) (min–max: 0,34–100,0 ISU-E) установлена у 23 (38,33%) наших пациентов. ПАн на грецкий орех (ангиоотек, крапивница, ринорея, бронхоспазм, плач, рвота) без падения артериального давления развилась у 8 (13,3%) детей. Еще у 2 (3,33%) пациентов развился анафилактический шок. У 4 детей аллергическая реакция на грецкий орех была в виде локального ангиоотека и крапивницы, для купирования которых потребовался прием антигистаминных препаратов и парентеральное введение глюкокортикостероидов. У 9 больных сенсибилизация к грецкому ореху оставалась латентной. Молекулы грецкого ореха (Jug r1 и Jug r2) демонстрировали высокую положительную статистически значимую корреляционную связь между собой (r=0,94, р<0,05), кроме того, молекула грецкого ореха (Jug r3) имела высокую положительную корреляцию с молекулами персика (Pru p3) (r=0,87, р<0,05), арахиса (Ara h9) (r=0,73, р<0,05), платана (Pla a3) (r=0,73, р<0,05) и полыни (Art v3) (r=0,73, р<0,05), относящихся как Jug r3 к липид-транспортным белкам.
Системные жизнеугрожающие реакции на смеси орехов, требовавшие госпитализации и введения адреналина, перенесли 20 (33%) детей. Ни пациенты, ни их родители точно не знали, какой из орехов был повинен в симптомах системной аллергии, но присутствие в смеси грецкого ореха они отрицали. Компонентная диагностика установила следующую сенсибилизацию: у 4 больных — к кешью (Ana o2, белок хранения, 11S глобулин) (min–max: 0,52–73,0 ISU-E); у 2 детей — к бразильскому ореху (Ber e1, белок хранения, 2S альбумин) (min–max: 0,6–0,8 ISU-E); у 14 — к молекулам фундука (Cor a9, 11 S глобулин, белок хранения и Cor a8, белок переносчик липидов) соответственно min–max: 0,8–24,0 и 0,6–42,0 ISU-E. Корреляционный анализ, проведенный при помощи рангового коэффициента Спирмена, показал, что у детей с системными проявлениями ПА молекула бразильского ореха (Ber e1) сильно коррелировала с пыльцой оливы (Ole e7) (r=0,70, р<0,05).
Сенсибилизация к арахису выявлена у 26 (43,33%) детей, при этом симптомы ПАн имели 7 (11,67%) пациентов после употребления ядер арахиса. Пациенты, перенесшие ПАн, были сенсибилизированы именно к белкам хранения (Ara h1, Ara h2, Ara h3, Ara h6) (min–max: 0,4–100,0 ISU-E). Больные, сенсибилизированные к PR-10 протеину арахиса Ara h8 (min–max: 0,6–23,0 ISU-E), испытывали исключительно локальные оральные симптомы, которые не требовали неотложной медицинской помощи. Установлена высокая статистически значимая положительная корреляционная связь между белками хранения арахиса: Ara h2 и Ara h6 (r=0,77, р<0,05), а также Ara h3 и Ara h6 (r=0,84, р<0,05).
Клиническую реакцию по типу ПАн на киви перенесли 6 (10%) пациентов, еще у 3 больных развились симптомы ангиоотека губ и языка, а сенсибилизированными к молекулам киви оказались 17 (28,33%) пациентов: 9 пациентов были сенсибилизированы к цистеинпротеазе (Act d1, min–max: 0,7–17,0 ISU-E) и/или к кивеллину киви (Act d5, min–max: 0,6–1,5 ISU-E). Сенсибилизация к молекуле киви (Act d8), относящейся к PR-10 протеинам (min–max: 0,4–12,00 ISU-E), серьезных реакций у детей не вызывала, как и молекула киви Act d2 (тауматинподобный белок) (min–max: 0,6–1,80 ISU-E).
Двое из наших пациентов предъявляли жалобы на выраженные ангиоотеки слизистой оболочки полости рта, возникавшие на персик. Они имели умеренный/высокий уровень антител к молекуле Pru p3 (min–max: 1,0–2,7 ISU-E). Молекула персика Pru p3 демонстрировала высокую положительную статистически значимую корреляционную связь с молекулой платана (Pla a3) (r=0,84, р<0,05). Пациенты, исключительно сенсибилизированные к Pru p1 (min–max: 0,3–4,8 ISU-E), имели слабо выраженные оральные симптомы, которые купировались антигистаминными препаратами. Протеин персика из семейства PR-10 (Pru p1) показал весьма высокую положительную статистически значимую корреляционную связь с другими PR-10 протеинами: молекулами яблока (Mal d1) (r=0,91, р<0,05), арахиса (Ara h8) (r=0,80, р<0,05), фундука (Cor a1 0401) (r=0,86, р<0,05), ольхи (Aln g1) (r=0,74, р<0,05), пыльцы орешника (Cor a1 0101) (r=0,85, р<0,05), которые так же, как Pru p1, являются Bet v1-подобными протеинами.
Клинические симптомы на сырые фрукты и овощи, содержащие PR-10 протеины, у детей с системными реакциями были незначительными и проявлялись минимальными локальными симптомами в ротовой полости. Сенсибилизация к PR-10 белкам установлена: к молекуле фундука (Cora1.0401) — у 50,0% пациентов, к молекуле яблока (Mal d1) — у 45,0%; к молекуле персика (Pru p1) — у 45,0%, к молекуле арахиса (Ara h8) — у 33,33%, к молекуле киви (Act d8) — у 13,33%, к молекуле сельдерея (Api g1) — у 16,66%, к молекуле соевых бобов (Gly m4) — у 20,0% пациентов. Следует заметить, что сенсибилизация к мажорной молекуле березы Bet v1 (3,90 [0,00; 18,00], 0,30–104,31 ISU-E) найдена у 39 (65,0%) детей, к ольхе (Aln g1) (min–max: 0,3–100,0 ISU-E) — у 30,0%, к орешнику (Cor a 1.0101) (min–max: 0,3–43,0 ISU-E) — у 35% детей с системными проявлениями ПА. Клинически симптомы поллиноза имели 34 (56,67%) ребенка. Установлена высокая положительная статистически значимая корреляционная связь между Bet v1-подобными протеинами ингаляционных аллергенов: молекулой ольхи (Aln g1) и пыльцой орешника (Cor a 1.0101) (r=0,77, р<0,05).
Стоит заметить, что у детей с системными проявлениями ПА быстро формировалась не только сезонная, но и круглогодичная респираторная аллергия. Выявлено, что сенсибилизацию к различным аллергенам кошки имел 41 (68,33%) пациент с ПАн. Так, у 29 (48,33%) обнаруживалась сенсибилизация к утероглобину кошки (Fel d1) (min–max: 0,8–100,0 ISU-E); у 11 (18,33%) — к сывороточному альбумину кошки (Fel d2) (min–max: 0,7–100,0 ISU-E) и у 15 (25,00%) — к липокалину кошки (Fel d4) (min–max: 0,6–56,32 ISU-E). Корреляционный анализ показал весьма высокую положительную связь между сывороточным альбумином кошки (Fel d2) и сывороточным альбумином собаки (Can f3) (r=0,96, р<0,05); между сывороточным альбумином кошки (Fel d2) и сывороточным альбумином лошади (Equ c3) (r=0,83, р<0,05), а также между сывороточным альбумином собаки (Can f3) и сывороточным альбумином лошади (Equ c3) (r=0,88, р<0,05). Перечисленные связи обнаружены между сывороточными альбуминами животных и бычьим сывороточным альбумином (Bos d6) (см. рис. 3B).
Сенсибилизация к аллергенам собаки (Can f1, Can f2, Can f3, Can f5) сформировалась у 24 (40,0%) больных, она найдена к Can f1 (min–max: 0,7–100,0 ISU-E) у 30,0% больных, к Can f2 (min–max: 0,4–18,0 ISU-E) — у 10,0%, к Can f3 (min–max: 1,12–100,0 ISU-E) — у 16,66%, к Can f5 (min–max: 0,4–31,0 ISU-E) — у 8,33%.
Сенсибилизация к мажорному аллергену полыни (Art v1) (min–max: 0,6–100,0 ISU-E) установлена у 8 (13,3%) пациентов с системными проявлениями ПА, а к аллергенам тимофеевки (Phl p1, Phl p4, Phl p5) — у 10 (16,6%), что достоверно меньше, чем частота сенсибилизации к березе — у 39 (65,0%) детей (р=0,000).
Сенсибилизация к клещам домашней пыли была только у 2 (3,33%) пациентов с ПАн: к Dermatophagoides farinae (3,85 и 42,0 ISU-E соответственно) и Dermatophagoides pteronyssinus (14,78 и 18,0 ISU-E соответственно). Сенсибилизация к другим молекулам пищевых продуктов и респираторных аллергенов у детей с системными проявлениями ПА обнаруживалась в единичных случаях и имела диагностическое значение только для конкретного больного.
Обсуждение
Известно, что молочные белки являются одной из наиболее частых причин ПА и ПАн у детей [8]. По нашему мнению, с ПА к молочным протеинам формируется дальнейшая сенсибилизация к другим продуктам, и число реакций на молочные протеины является доминирующим по отношению к другим пищевым аллергенам у детей, проживающих в г. Екатеринбурге. Полученные данные полностью согласуются с мнением коллег [1, 7]. Яйцо, наряду с БКМ, также частый аллерген, провоцирующий симптомы анафилаксии у детей [9]. Как было описано выше, главные аллергены куриного яйца могут вызывать ПАн у детей и выступать как анафилактогены, что ранее было установлено и описано в литературе [10].
Данные Европейского регистра анафилаксии свидетельствуют о том, что при ПАн к рыбе наиболее часто первые реакции фиксируются в дошкольном возрасте [11]. Парвальбумин — основной аллерген рыбы — способен инициировать анафилаксию [12] и был выявлен в качестве триггера системных реакций у детей г. Екатеринбурга, вызывая развитие немедленных проявлений аллергии как при пероральном, так и при ингаляционном контакте, зачастую неоднократно.
Известно, что пациенты с гиперчувствительностью к белкам хранения (проламины и купины) часто страдают тяжелыми системными реакциями, связанными с высокой устойчивостью данных протеинов к термическому и пепсиновому воздействию [13]. Клинические проявления аллергии на белки хранения грецкого ореха были системными и потенциально опасными для жизни. По мнению Всемирной аллергологической организации (WAO), повышенную чувствительность к молекулам грецкого ореха (Jug r1, Jug r2, Jug r3) следует рассматривать как фактор риска развития анафилаксии [12], данная сенсибилизация была установлена и у наших пациентов.
В настоящее время установлено, что в состав арахиса входит не менее 32 различных молекул, обладающих аллергенными свойствами, но наиболее значимыми для клинической диагностики с точки зрения анафилаксии являются Ara h1, Ara h2, Ara h3, Ara h6, Ara h7, Ara h9 [4]. Высокая корреляционная связь, обнаруженная между аллергенами арахиса, дает основание полагать, что сенсибилизация к одной молекуле запаса арахиса будет способствовать формированию сенсибилизации и к другим молекулам, относящимся к этой группе, делая арахис потенциально опасным для жизни сенсибилизированных пациентов.
Зарубежными исследователями показано, что подавляющее большинство больных, имевших системные реакции к персику, были сенсибилизированы к молекуле Pru p3, относящейся к белкам — переносчикам липидов [14]. В проведенном нами исследовании большинство пациентов были сенсибилизированы к Pru p1 по причине проживания в умеренной климатической зоне, где сенсибилизация к персику в основном обусловлена PR-10 протеином (Pru p1) и возникает как перекрестная реакция к мажорной молекуле березы Bet v1.
Заключение
Таким образом, компонентная диагностика установила, что пациенты с системными проявлениями ПА полисенсибилизированы. Системная реакция на пищевые аллергены у детей г. Екатеринбурга была вызвана: молочными протеинами (Bos d4, Bos d5, Bos d8) — у 31 (51,67%) пациента, куриным яйцом (Gal d2, Gal d1) — у 10 (16,67%), грецким орехом (Jug r1, Jug r2, Jug r3) — у 10 (16,67%), рыбой (Gad c1) — у 9 (15,00%), киви (Act d1) — у 7 (11,67%), арахисом (Ara h1, Ara h2, Ara h3, Ara h6) — у 7 (11,67%) и различными видами орехов деревьев (Ber e1, Ana o2, Cora 9, Cora 8) — у 20 (33%).
Для снижения числа жизнеугрожающих эпизодов ПА у детей с ПАн в анамнезе следует выявлять и изучать весь спектр сенсибилизации, устанавливать причинно-значимые аллергены и возможные триггеры анафилактических реакций для разработки элиминационной диеты и индивидуального плана ведения пациента.
1 Федеральные клинические рекомендации. Анафилактический шок. М.; 2020. 34 с.
Сведения об авторе:
Лепешкова Татьяна Сергеевна — к.м.н., доцент кафедры поликлинической педиатрии ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; ORCID iD 0000-0002-0716-3529.
Контактная информация: Лепешкова Татьяна Сергеевна, e-mail: levlpa@mail.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.01.2023.
Поступила после рецензирования 21.02.2023.
Принята в печать 21.03.2023.
About the author:
Tatyana S. Lepeshkova — C. Sc. (Med.), associate professor of the Department of Polyclinic Pediatrics, Ural State Medical University; 3, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-0716-3529. Contact information: Tatyana S. Lepeshkova, e-mail: levlpa@mail.ru.
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 27.01.2023.
Revised 21.02.2023.
Accepted 21.03.2023.
2. Фролова Э.В., Гмошинский И.В., Лысиков Ю.А. и др. Диагностика аллергической энтеропатии у детей. Педиатрия. Журнал им. Г.Н. Сперанского. 2001;2:19–22. [Frolova E.V., Gmoshinsky I.V., Lysikov Y.A. et al. Diagnosis of allergic enteropathy in children. Pediatriya. Zhurnal im. G.N. Speranskogo. 2001;(2):19–22 (in Russ.)].
3. Umasunthar T., Leonardi-Bee J., Turner P.J. et al. Incidence of food anaphylaxis in people with food allergy: a systematic review and meta-analysis. Clin Exp Allergy. 2015;45:1621–1636. DOI: 10.1111/cea.12477.
4. Giovannini M., Comberiati P., Piazza M. et al. Retrospective definition of reaction risk in Italian children with peanut, hazelnut and walnut allergy through component-resolved diagnosis. Allergol Immunopathol. 2019;47(1):73–78. DOI: 10.1016/j.aller.2018.03.009.
5. Tejedor Alonso M.A., Moro M., Mugica Garcia M.V. et al. Epidemiology of anaphylaxis. Clin Exp Allergy. 2015;45:1027–1039. DOI: 10.1111/cea.12418.
6. Scala E., Abeni D., Cecchi L. et al. Molecular recognition profiles and clinical patterns of PR-10 sensitization in a birch-free Mediterranean area. Int Arch Allergy Immunol. 2017;173:138–146. DOI: 10.1159/000477565.
7. Sooyung L. Food allergy and food-induced anaphylaxis in children: an increasing critical public health issue. Korean J Pediatr. 2019;62(12):431– 432. DOI: 10.3345/kjp.2019.00493.
8. Bartuzi Z., Cocco R.R., Muraro А., Nowak-Wegrzyn A. The contribution of the analysis of molecular allergens in the diagnosis of аllergy to milk. Curr Allergy Asthma Rep. 2017;17(7):46. DOI: 10.1007/s11882-017-0716-z.
9. Ko J., Zhu S., Alabasteret A. et al. Prehospital treatment and emergency department outcomes in young children with food allergy. J Allergy Clin Immunol Pract. 2020;14(20):30353–30356. DOI: 10.1016/j.jaip.2020.03.047.
10. Petrosino M.I. Usefulness of molecular diagnosis in egg allergic children. Arch Med Sci. 2018;14(1):132–137. DOI: 10.5114/aoms.2016.58796.
11. Grabenhenrich L.B., Dölle S., Moneret-Vautrin A. et al. Anaphylaxis in children and adolescents: The European Anaphylaxis Registry. J Allergy Clin Immunol. 2016;1(4):1128–1137. DOI: 10.1016/j.jaci.2015.11.015.
12. Steering Committee Authors, Review Panel Members. A WAO — ARIA — GA2LEN consensus document on molecular-based allergy diagnosis (PAMD@): Update 2020. World Allergy Organ J. 2020;13(2):100091. DOI: 10.1016/j.waojou.2019.100091.
13. Satoh R., Teshima R. Allergen analysis in plants and use in the assessment of genetically modified plants. In: Genetically modified organ isms in food. Production, Safety, Regulation and Public Health. Watson R.R., Preedy V.R., eds. Academic Press. 2016:455–463. DOI: 10.1016/B978012802259700040-3.
14. García-Sellés F.J., Díaz-Perales A., Sánchez-Monge R. et al. Patterns of reactivity to lipid transfer proteins of plant foods and Artemisia pollen: an in vivo study. Int Arch Allergy Immunol. 2002;128(2):115–122. DOI: 10.1159/000059401.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
