Микроэлементозы как предикторы иммунологических нарушений у детей с гипофункцией щитовидной железы, проживающих в районах с различным уровнем техногенного загрязнения
Цель исследования: изучение состояния гуморального иммунитета во взаимосвязи с содержанием некоторых химических элементов (ХЭ) у детей дошкольного возраста с гипофункцией щитовидной железы (ЩЖ), проживающих в различных по уровню и специфике техногенного загрязнения районах.
Материал и методы: обследовано 340 детей в возрасте от 4 до 7 лет. Проведены медосмотры в детских садах в одном из сельскохозяйственных районов Ростовской области, в промышленном районе г. Ростова-на-Дону (далее Ростов), в г. Шахты, расположенном в угольно-добывающем районе области, и в пригородном дачном районе Ростова, удаленном от индустриальных объектов. В сельскохозяйственном районе осмотрено 105 человек (1-я группа), в Ростове — 125 (2-я группа), в Шахтах — 90 (3-я группа); 20 здоровых детей, проживающих в пригородном дачном районе Ростова, составили 4-ю (контрольную) группу. Проведен анализ данных управления Роспотребнадзора по Ростовской области об особенностях техногенного загрязнения среды на территориях проживания обследуемых детей. Всем детям было проведено клинико-лабораторное обследование.
Результаты исследования: в сельскохозяйственном районе в ряду техногенных загрязнителей превалируют хлориды, нитраты, фосфорные соединения, входящие в состав минеральных удобрений и пестицидов. В районах локализации детских садов г. Ростова степень ксеногенной нагрузки идентифицирована как напряженная, а наиболее выраженная ксеногенная нагрузка имела место на территории г. Шахты. У детей 1–3-й групп показатели свободного Т4 (сТ4) и свободного Т3 (сТ3) были более низкими по сравнению с аналогичными показателями других групп, а уровень тиреотропного гормона (ТТГ) — наиболее высоким. У детей 1–3-й групп определялось увеличение сывороточных IgM, IgG и суммарных IgE, снижение уровня IgA, при этом самые существенные отклонения отмечались у детей 3-й группы, проживавших в районе с наиболее выраженной степенью экологического неблагополучия. В этой группе отмечена достоверная прямая корреляционная связь между уровнями IgM и ТТГ (r=0,59, р=0,03), IgA и сТ4 (r=0,47, р=0,04), а также достоверная обратная корреляционная связь между уровнями сывороточного IgG и сТ4 (r=-0,49, р=0,04). У детей 1–3-й групп уровни свинца в моче были выше, чем в группе сравнения, особенно высокие у детей 3-й группы, проживавших в районе с наиболее выраженной степенью экологического неблагополучия. В этой группе отмечена достоверная прямая корреляционная связь между уровнями свинца и ТТГ (r=0,62, р=0,02), IgA и цинка (r=0,51, р=0,03), селена и сТ4 (r=0,45, р=0,04), а также достоверная обратная корреляционная связь между уровнями свинца и сТ4 (r=-0,54, р=0,03), свинца и IgA (r=-0,41, р=0,045). Соотношение параметров селена и свинца у детей 3-й группы было значительно меньше, чем у детей 1-й и 2-й групп, а также 4-й группы.
Заключение: у детей с гипофункцией ЩЖ отмечались явления напряженности гуморального иммунитета, наиболее выраженные патологические изменения регистрировались у детей, проживающих на территории с особенно высоким уровнем техногенного загрязнения. У детей из экологически неблагополучных районов выявлены сниженные показатели селена и цинка при повышенном уровне свинца в утренней моче, коррелировавшие со снижением уровней сТ4 и сТ3 в крови.
Ключевые слова: щитовидная железа, гуморальный иммунитет, химические элементы, микроэлементоз, йод, йододефицит, ксеногенная нагрузка.
Для цитирования: Попова В.А., Пузикова О.З., Кожин А.А., Чурюкина Э.В., Московкина А.В., Галкина Г.А., Созаева Д.И., Кравченко Л.В., Зулпикарова М.Ю. Микроэлементозы как предикторы иммунологических нарушений у детей с гипофункцией щитовидной железы, проживающих в районах с различным уровнем техногенного загрязнения. РМЖ. Медицинское обозрение. 2023;7(2):81-88. DOI: 10.32364/2587-6821-2023-7-2-81-88.
V.A. Popova1, O.Z. Puzikova1, A.A. Kozhin1, E.V. Churyukina1,2, A.V. Moskovkina1, G.A. Galkina1, D.I. Sozaeva1, L.V. Kravchenko1, M.Y. Zulpikarova3
1Rostov State Medical University, Rostov-on-Don, Russian Federation
2Kuban State Medical University, Krasnodar, Russian Federation
3Dagestan State Medical University, Makhachkala, Russian Federation
Aim: to assess relationship between the humoral immunity status and the amounts of chemical elements (CE) in schoolchildren with hypothyroidism living in the regions with different levels and characteristics of technogenic environmental pollution.
Patients and Methods: this study included 340 children 4–7 years old. The children underwent medical examination in the kindergartens located in a rural area of Rostov Region; industrial district of Rostov-on-Don (hereinafter referred to as Rostov); Shakhty, a city located in the coal mining area of the region; and in a dacha village in Rostov suburbs located distantly fr om the industrial facilities. In the rural area 105 children (group 1) were examined, in Rostov City — 125 children (group 2), in Shakhty — 90 (group 3). Group 4 (control) included 20 healthy children living in a dacha village of Rostov suburbs. The authors analyzed the Federal Service for Surveillance on Consumer Rights Protection and Human Well-being (Rospotrebnadzor) data characterizing the technogenic environmental pollution in the areas of residence of the studied children. Clinical laboratory tests were performed in all children.
Results: such components of mineral fertilizers and pesticides as chlorides, nitrates, and phosphorus compounds prevailed among the technogenic contaminants in the rural regions. An intense xenogeneic burden was identified in the Rostov areas wh ere kindergartens were located, while the highest xenogeneic burden was found in Shakhty. In groups 1, 2 and 3, free Т4 (fТ4) and free Т3 (fТ3) concentrations were lower than those in other groups. Moreover, the children of the first three groups had the highest thyrotropin (TSH) levels. In groups 1,2 and 3, serum IgM, IgG and total IgE levels were increased, and IgA level was decreased, while the most significant deviations from the normal values were found in the group 3 children who lived in the area with the highest adverse environmental impact. A positive statistically significant correlation was found between IgM and TSH levels (r=0,59, р=0,03) and between IgA и fТ4 levels (r=0.47, р=0.04). In addition, a negative statistically significant correlation was found between IgG и fТ4 levels (r=-0.49, р=0.04). In the group 1, 2 and 3 children, lead levels in the urine were higher than in the comparison group, and particularly high lead levels were detected in the group 3 children who lived in the area with the worst adverse environmental impact. In the same group, a positive statistically significant correlation was found between lead and TSH levels (r=0.62, р=0.02), between IgA and zinc (r=0.51, р=0.03), as well as between selenium and fТ4 (r=0.45, р=0.04). Also, a negative statistically significant correlation was determined between lead and fТ4 (r=-0.54, р=0.03) and between lead and IgA levels (r=-0.41, р=0.045). The ratio of selenium and lead in the group 3 children was significantly lower than in groups 1, 2 and 4.
Conclusion: indicators demonstrating the intensity of humoral immunity were found in children with hypothyroidism, and the mostly pronounced pathological changes were reported in children living in the area with the highest technogenic environmental pollution. Reduced selenium and zinc levels along with increased lead concentrations in the morning sample of urine which correlated with decreased fТ4 and fТ3 levels in blood were found in children from the areas with adverse environmental conditions.
Keywords: thyroid, humoral immunity, chemical elements, microelementosis, iodine, iodine deficiency, xenogeneic burden.
For citation: Popova V.A., Puzikova O.Z., Kozhin A.A. et al. Microelementoses as predictors of immunological disorders in children with hypothyroidism living in the regions with different levels of technogenic pollution. Russian Medical Inquiry. 2023;7(2):81–88 (in Russ.). DOI: 10.32364/2587-6821-2023-7-2-81-88.
Введение
Ксеногенное загрязнение окружающей среды индуцирует ослабление неспецифической резистентности организма, особенно у детей [1]. Это послужило основанием для появления нового научного направления — «экологическая педиатрия». Описан синдром экологической дезадаптации у детей раннего возраста [2]. Следует отметить, что он отличается большим латентным периодом, что затрудняет его этиологическую диагностику.
Техногенное загрязнение биосферы привело также к учащению случаев микроэлементозов. Одним из наиболее распространенных микроэлементозов является йододефицит, отличающийся полиморфными нейроэндокринными нарушениями, в частности развитием гипотиреоза. Установлено, что в его развитии дефицит йода не является единственной причиной. Развитию йододефицита способствует депонирование в тканях организма, и в том числе в ткани щитовидной железы (ЩЖ), тяжелых металлов, блокирующих взаимодействие йода со специфическими рецепторами, в результате чего нарушается секреция энзимов, обеспечивающих синтез тиреоидных гормонов. Развитие гипофункции ЩЖ у детей не только индуцирует разнообразные аномалии онтогенеза, отставание в психофизическом развитии, но и способствует возникновению вторичного иммунодефицита.
В этиологии микроэлементозов определенную роль играет дисбаланс в организме некоторых химических элементов (ХЭ) — антагонистов тяжелых металлов [3]. К наиболее известным функциональным антагонистам относятся пары: свинец — цинк, кадмий — цинк, свинец — селен, свинец — йод и ряд других. Перечисленные ХЭ оказывают противоположное влияние на иммунную систему, нейроэндокринные комплексы [4].
Перечисленные эссенциальные и токсичные ХЭ являются неотъемлемыми компонентами геохимического пейзажа каждого региона [5]. При их постоянных количествах в определенных соотношениях нейтрализуется негативное влияние токсичных ХЭ на гомеостаз. У местного населения эволюционно вырабатывается адаптация к биогеохимическому фону, минеральным компонентам, входящим в трофологические цепи. Однако быстро меняющиеся качественные и количественные параметры антропогенной нагрузки изменяют привычные для организма параметры ХЭ, многие из которых входят в структуру различных энзимов, поэтому возникают иммунологические и обменно-эндокринные дисфункции, в том числе дисфункия ЩЖ.
Очевидна актуальность разработки технологий ранней диагностики микроэлементозов, являющихся предикторами эндокринных дисфункций, сопровождающихся иммунологическими нарушениями. Для этого необходимо создание банков информации о региональных нормативах иммунобиохимических и микроэлементных переменных, особенно у детей как наиболее оседлой части населения, проживающих в различных по своим биогеохимическим парадигмам районах.
Цель исследования: изучение состояния гуморального иммунитета во взаимосвязи с содержанием некоторых ХЭ у детей дошкольного возраста с гипофункцией ЩЖ, проживающих в различных по уровню и специфике техногенного загрязнения районах.
Материал и методы
В общей сложности было обследовано 340 детей в возрасте от 4 до 7 лет, из них 168 мальчиков и 172 девочки. Информированное согласие родителей на обследование детей было получено.
Проводили медосмотры в детских садах в Шолоховском районе Ростовской области (один из сельскохозяйственных районов), в промышленном районе г. Ростова-на-Дону (далее — Ростов), в г. Шахты, расположенном в угольно-добывающем районе области, и в пригородном дачном районе Ростова, удаленном от индустриальных объектов. Родители детей из промышленного района г. Ростова работали в основном в сфере обслуживания и на предприятиях легкой промышленности. Родители детей, проживающих в г. Шахты, в основном длительно работали в профессионально неблагоприятных условиях. Родители детей из пригородного района Ростова работали в основном в благоприятных условиях.
В Шолоховском районе осмотрено 105 человек (1-я группа), в Ростове — 125 (2-я группа), в Шахтах — 90 (3-я группа); 20 здоровых детей, проживающих в пригородном дачном районе Ростова, составили 4-ю группу, являвшуюся контрольной. У детей не было врожденных пороков развития, все родились доношенными, антропометрические показатели при рождении соответствовали общепринятым нормативам. Группы были сопоставимы по половозрастному составу.
Был проведен анализ данных управления Роспотребнадзора по Ростовской области об особенностях техногенного загрязнения среды проживания обследуемых детей, изучена информация о структуре заболеваемости детей обследуемых групп.
Всем детям проведено клинико-лабораторное обследование, включающее:
-
сбор и анализ данных анамнеза, сравнительное изучение антропометрических параметров;
-
клинический анализ крови;
-
биохимическое исследование содержания в крови С-реактивного белка, малонового диальдегида (МДА), каталазы, общего холестерина методом ИФА;
-
определение в сыворотке крови свободного Т4 (сТ4), свободного Т3 (сТ3), тиреотропного гормона (ТТГ) методом ИФА на анализаторе Alisei Q.S. (Radium, Италия);
-
определение содержания иммуноглобулинов методом ИФА на анализаторе Tecan Austria Sunrise (Tecan Austria GmbH, Австрия);
-
определение концентрации ХЭ в утренней порции мочи атомно-абсорбционным методом на приборе «Квант-Z» (ООО «Кортек», Россия);
-
ультрасонографическое исследование ЩЖ у детей.
Результаты биомедицинских исследований обрабатывали с помощью лицензионного пакета Statistica 6,0 в среде MeoCape 11.4.2, непараметрического корреляционного анализа по Спирмену. Достоверность показателей определялась по коэффициенту Стьюдента (t), данные имели нормальное распределение. За критический уровень значимости принято значение p <0,05.
Результаты исследования
При изучении материалов управления Роспотребнадзора по Ростовской области об особенностях загрязнения среды районов, в которых проживали обследуемые дети, было установлено, что наиболее выраженная ксеногенная нагрузка имела место на территории г. Шахты, вокруг которого находятся несколько действующих угольно-добывающих предприятий. По уровню загрязнения техногенную нагрузку атмосферы, почвы, воды расценивали как кризисную. В почве, воздухе, воде города обнаружены высокие концентрации тяжелых металлов (свинец, хром, кадмий, мышьяк), нефтепродуктов, превышающие предельно допустимые концентрации (ПДК) в 2–3 раза. В воздушных массах периодически регистрировали наличие метана, сернистого газа.
В районах локализации детских садов г. Ростова степень ксеногенной нагрузки идентифицирована как напряженная. Загрязнители среды были аналогичными, но концентрации перечисленных выше ксенобиотиков были ниже и только периодически превышали ПДК, что объясняется меньшими потоками грузового транспорта и удаленностью промпредприятий. Превышение ПДК чаще наблюдалось зимой из-за повышенных выбросов ксенобиотиков в атмосферу во время отопительного сезона.
При обследовании среды, окружающей детские сады Шолоховского района, отмечено, что в этих местах в ряду техногенных загрязнителей превалируют хлориды, нитраты, фосфорные соединения, входящие в состав минеральных удобрений и пестицидов. Соединений тяжелых металлов в концентрациях, превышающих ПДК, не обнаружено. Район отличается обилием агросельскохозяйственных предприятий, в технологических процессах которых постоянно и в больших количествах применяются синтетические вещества, содержащие перечисленные химические продукты.
В питьевых источниках указанных городов содержание йода можно отнести к разряду умеренного йододефицита (12–15 мкг/л). В Шолоховском районе концентрация йода в водных источниках была несколько выше, чем в пробах из городов, на уровне нижней границы нормы (около 20 мкг/л).
Была проанализирована структура заболеваемости детей с учетом данных ксеногенного фона территорий проживания. При анализе данных статистических отчетов местных органов здравоохранения отмечено, что у всех детей обследуемых групп чаще всего возникали болезни органов дыхания, которые занимали 1-е ранговое место в структуре заболеваемости. На 2-м ранговом месте у детей 1-й группы были заболевания ЖКТ, у детей 2-й группы — болезни мочевыделительной системы, у детей 3-й группы — аллергическая патология (особенно органов дыхания). На 3-м ранговом месте у детей 1-й группы были аллергические заболевания, 2-й группы — ЛОР-заболевания, 3-й группы — патологические процессы эндокринной системы.
В ходе комплексного обследования все дети повторно были осмотрены педиатром, неврологом и детским эндокринологом, принимавшими активное участие в оценке, сопоставлении, комплексном анализе лабораторных и клинических показателей в рамках соматического, неврологического и эндокринологического статуса.
При проведении антропометрических исследований показано, что у детей обследуемых групп отставаний по массо-ростовым показателям не было. Однако повышенная масса тела (+1,0 до +2,0 SDS ИМТ) была зарегистрирована у 18 (17,1%) детей 1-й группы, у 27 (21,6%) — 2-й группы и у 22 (24,4%) — 3-й группы, тогда как в 4-й группе детей с повышенной массой тела не было.
В процессе изучения показателей УЗИ, с учетом региональных и возрастных нормативов объема ЩЖ, обнаружены признаки ее увеличения у 12 (11,4%) детей 1-й группы, у 16 (12,8%) — 2-й группы и у 20 (22,2%) — 3-й группы. Показатели УЗИ у детей 4-й группы были в пределах нормы.
Осмотр детского эндокринолога у большинства детей всех групп не выявил четких клинических признаков нарушения функции ЩЖ. Однако при изучении гормональных показателей было установлено, что у детей 1–3-й групп показатели сТ4, сТ3 были более низкими по сравнению с аналогичными показателями в других группах, а уровень ТТГ — наиболее высоким (табл. 1).
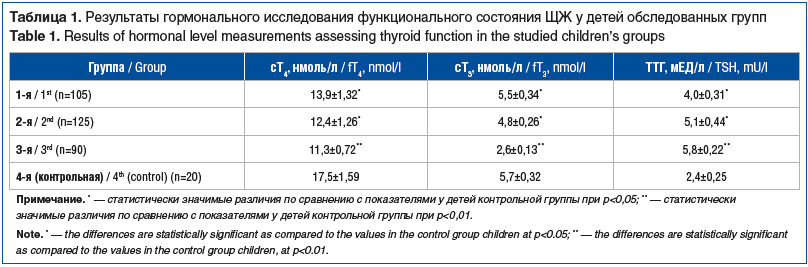
Анализ индивидуальных показателей тиреоидного гомеостаза выявил погранично сниженный уровень сТ4 (10,5±0,62 нмоль/л) у 22 (24,4%) детей 3-й группы при среднем значении ТТГ 6,9±0,45 нмоль/л, что позволило установить у них диагноз субклинического гипотиреоза. Этим детям был назначен левотироксин натрия в индивидуально подобранных дозировках. Случаи нормальных значений сТ4, сопровождавшихся повышением уровня ТТГ в пределах верхненормативных возрастных значений, расценивались как проявления минимальной тиреоидной дисфункции, определявшейся у 23 (21,9%) детей 1-й группы, 39 (31,2%) — 2-й группы и 38 (42,2%) — 3-й группы. В 4-й группе проявлений минимальной тиреоидной дисфункции не отмечено.
О функциональном состоянии неспецифической резистентности детей судили по интегральным биохимическим данным. У детей 1-й и 2-й групп изменений уровней МДА и каталазы не отмечалось по сравнению с аналогичными показателями в 4-й группе. У детей 3-й группы с лабораторными признаками гипофункции ЩЖ в сравнении с детьми 4-й группы были обнаружены более высокие значения МДА (6,6±0,84 ммоль/л против 2,6±0,31 ммоль/л соответственно, p<0,01) и сниженная активность каталазы (6,8±0,6 ммоль/л против 10,1±1,5 ммоль/л соответственно, р<0,05).
Выявлено, что у детей с повышенным ИМТ из экологически неблагополучных районов были повышены показатели общего холестерина: в 1-й группе — 5,1±0,3 ммоль/л, во 2-й — 5,8±0,5 ммоль/л, в 3-й — 6,3±0,6 ммоль/л, в 4-й — 4,4±0,3 ммоль/л; наиболее существенными были отличия между показателями детей 3-й группы и 4-й группы (р<0,05).
В лейкоцитарной формуле обращали на себя внимание более высокие показатели лимфоцитов у детей 3-й группы по сравнению с таковыми у детей 2-й и 1-й групп, а также 4-й группы (64,5±2,2, 50,8±2,1, 41,3±1,8 и 34,8±1,2% соответственно). Признаков воспалительных процессов у детей при обследовании выявлено не было. Это также подтверждалось концентрацией С-реактивного белка в плазме: в 1–3-й группах она варьировала от 3,5 до 5,1 мг/л, в 4-й группе была равна 4,1±0,3 мг/л, т. е. достоверные отличия отсутствовали.
При анализе показателей гуморального иммунитета установлено, что у детей 1–3-й групп определялось увеличение сывороточных IgM, IgG и суммарных IgE, снижение уровня IgA (табл. 2).
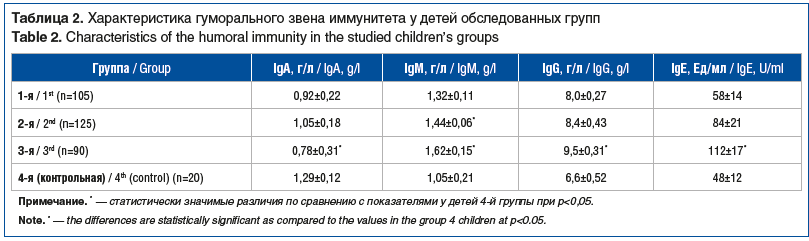
Самые существенные отклонения отмечались у детей 3-й группы, проживающих в районе с наиболее выраженной степенью экологического неблагополучия. В этой группе отмечена достоверная прямая корреляционная связь между уровнями IgM и ТТГ (r=0,59, р=0,03), IgA и сТ4 (r=0,47, р=0,04), а также достоверная обратная корреляционная связь между уровнями сывороточного IgG и сТ4 (r=-0,49, р=0,04).
Анализ концентраций ХЭ выявил, что у детей 1–3-й групп показатели свинца были выше, чем в группе сравнения (табл. 3).
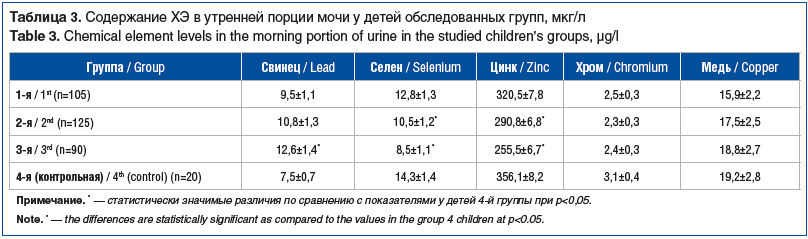
Наиболее выраженные отклонения отмечались у детей 3-й группы, проживающих в районе с наиболее выраженной степенью экологического неблагополучия. В этой группе отмечена достоверная прямая корреляционная связь между уровнями свинца и ТТГ (r=0,62, р=0,02), IgA и цинка (r=0,51, р=0,03), селена и сТ4 (r=0,45, р=0,04), а также достоверная обратная корреляционная связь между уровнями свинца и сТ4 (r=-0,54, р=0,03), свинца и IgA (r=-0,41, р=0,045).
Соотношение параметров селена и свинца — ХЭ-антагонистов — у детей 3-й группы было значительно меньше, чем у детей 1-й и 2-й групп, а также группы сравнения (3-я группа — 0,66 относительной единицы (отн. ед.), 1-я группа — 1,34 отн. ед., 2-я группа — 0,97 отн. ед. и 4-я группа — 1,90 отн. ед.). Такие же изменения наблюдались и в соотношениях цинка и меди, которые также являются антагонистами свинца в его биологических эффектах. В большей степени изменение баланса цинк/свинец наблюдалось у детей 3-й группы (1-я группа — 33,7 отн. ед., 2-я группа — 26,4 отн. ед., 3-я группа — 20,2 отн. ед., 4-я группа — 47,4 отн. ед.). Уровень меди у детей всех групп не имел достоверных отличий.
Обсуждение
При изучении гормональных показателей установлено, что у детей 1–3-й групп, т. е. групп экологического риска, показатели тиреоидных гормонов были более низкими, а ТТГ — более высоким, что указывало на более низкий уровень тиреоидной активности в этих группах с преобладанием повышенной частоты субклинического гипотиреоза и минимальной тиреоидной дисфункции, особенно в 3-й группе. Возможно, это было следствием накопления в тканях ЩЖ детей этой группы ксенобиотиков, уровень которых был особенно высок в районе их проживания. Этот процесс, как известно, сопровождается инактивацией энзимов, участвующих в процессах органификации йода и интратиреоидного синтеза T3 и T4. Несколько повышенный уровень лимфоцитов у детей 3-й группы, вероятно, был следствием большего количества перенесенных ранее респираторных заболеваний различной этиологии. Это сопровождалось изменениями других показателей неспецифической резистентности — повышением уровня МДА и снижением активности каталазы в крови детей этой группы.
Выявленные изменения в показателях гуморального звена иммунного статуса в виде возрастания сывороточных IgM, IgG и суммарных IgE и снижения уровня IgA указывали на напряженность неспецифической резистентности, ослабление местного иммунитета, а также определенную степень сенсибилизации организма. При этом наиболее выраженные отклонения отмечались у детей, проживающих в районе с наибольшей степенью экологического неблагополучия.
Приведенные данные позволяют обсуждать вероятное снижение адаптационных резервов у детей из группы экологического риска с гипофункцией ЩЖ. Видимо, в связи с этим в 3-й группе было много часто болеющих детей.
Ведущим фактором возникновения гипофункции ЩЖ, снижения неспецифической резистентности у детей из групп экологического риска может быть дисбаланс ХЭ в организме. Чаще всего это происходит вследствие стремительного техногенного загрязнения окружающей среды, что приводит к изменению минерального состава звеньев трофологических цепей, к которому не успевает сформироваться эволюционно вырабатываемая адаптация. Это обусловливает полиморфные девиации в регуляторных механизмах, временно компенсированные напряжением метаболических реакций.
При изучении содержания в утренней моче детей ряда ХЭ, участвующих в регуляции иммунонейроэндокринной системы, и в частности функции ЩЖ, а также распространенного в окружающей среде токсичного ХЭ — свинца, было выявлено существенное повышение уровня свинца при снижении концентраций селена и хрома. При этом наиболее существенные отклонения отмечались у детей, проживающих в районе с наибольшей степенью экологического неблагополучия. Соотношение параметров селена и свинца как ХЭ-антагонистов у детей 3-й группы было значительно меньше, чем у детей других групп. Видимо, не случайно в этой группе концентрации сТ4 и сТ3 были наиболее низкими. Следовательно, дисбаланс селена и свинца мог способствовать нарушению синтеза гормонов ЩЖ. Это указывало на то, что высокая антропогенная нагрузка на данной территории негативно отразилась на гомеостазе детского организма. Повышенные концентрации свинца в тканях могли способствовать, по данным литературы, возникновению эндокринных дисфункций, нарушениям неспецифической резистентности, о чем свидетельствовали и установленные сильные корреляционные связи между содержанием микроэлементов и характерными изменениями показателей иммуноглобулинов, а также содержанием тиреоидных гормонов [5–7].
Всех детей обследуемых групп объединяла тенденция к более низким показателям хрома, чем у детей контрольной группы. По данным литературы, хром участвует в углеводном и жировом обмене, поэтому его неадекватное содержание может вызывать склонность к ожирению. В различных исследованиях показана связь инсулинорезистентности с уровнем хрома и селена, продемонстрирован положительный эффект от их включения в диету при лечении ожирения вследствие улучшения метаболических эффектов инсулина [8–10]. Из этого следует, что более низкие уровни хрома у детей обследуемых групп могли способствовать повышению ИМТ у детей с гипофункцией ЩЖ.
Из сказанного можно заключить, что антагонистический элемент-специфический принцип регуляции некоторых эндокринных функций организма, сформировавшийся эволюционно, в условиях техногенного загрязнения среды недостаточно эффективен.
Проведенные фундаментальные и прикладные исследования междисциплинарного характера показали, что в условиях антропогенного загрязнения среды или резкого изменения места жительства эволюционно выработанные количественные соотношения между параметрами ХЭ, обеспечивающие оптимальное развитие физиологических систем организма в конкретных климатогеографических условиях, нарушаются. Это детерминирует возникновение мономикроэлементоза, преморбидного состояния, постепенно переходящего в специфический патологический процесс от минимальной тиреоидной дисфункции до субклинического гипотиреоза. Следовательно, микроэлементозы можно рассматривать в качестве триггера дизрегуляторной патологии иммуноэндокринной системы, которая стартует еще на ранних этапах онтогенеза и сопровождается полиморфными физиологическими дисфункциями.
Очевидно, что иммунокоррекция и реабилитация часто болеющих детей, проживающих в неблагоприятных экологических условиях, имеет большое медико-социальное и экономическое значение. В настоящее время единого подхода к выбору иммунокорригирующих средств и мероприятий нет. Дискутабельным остается вопрос назначения препаратов микробного происхождения, интерферонов, интерфероногенов и антиоксидантов.
Однако можно выделить общие принципы восстановительной терапии, которые заключаются в соблюдении лечебно-охранительного режима, сбалансированном питании и умеренных физических нагрузках, различных физиотерапевтических процедурах и мероприятиях, направленных на психологическую адаптацию ребенка.
Медикаментозное лечение при этом должно быть индивидуальным (в зависимости от диагноза и состояния ребенка) и сводиться к необходимому минимуму.
Витамино- и фитотерапии отводится особая роль в реабилитации часто болеющих детей, так как дефицит витаминов, микро- и макронутриентов, нередко встречающийся в педиатрической практике, способствует росту заболеваемости, более тяжелому течению и хронизации патологических процессов, а также возникновению их осложнений [11].
Биологически активная добавка «Кидз (Kidz) Крепкий иммунитет» российского производителя ООО «ВТФ» содержит йод, биодоступный цинк в форме бисглицината, β-каротин, витамины C, D3, E, K1, биотин и растительные экстракты. Комплекс предназначен для детей начиная с трех лет, выпускается в форме желейных батончиков и может стать инструментом нутритивной поддержки иммунитета в рамках реабилитации часто болеющих детей, проживающих на территориях с высокой ксеногенной нагрузкой.
Полученные материалы убеждают нас, что использованный дизайн исследований и вычисление параметров соотношений пар специфических ХЭ-антагонистов как объективного маркера микроэлементной этиологии патологических изменений актуальны для алгоритма изучения проблем экологической педиатрии и патофизиологии человека. Это связано с тем, что элементная система является палеобазисом для всех современных механизмов регуляции у высших организмов (нервных, эндокринных, иммунных), которые по отношению к ней являются своеобразной надстройкой [12, 13].
Заключение
Особенности иммунитета у детей дошкольного возраста с тиреоидной дисфункцией, проживающих в зонах с избыточной антропогенной нагрузкой, характеризуются повышением содержания IgM и IgG, IgE, что свидетельствует о напряженности гуморального звена иммунной системы, определенной ее сенсибилизации. Эти изменения иммунитета, несомненно, связаны (а возможно, и обусловлены?) в том числе с микроэлементным дисбалансом, нарастающим по мере усугубления экологического неблагополучия региона проживания. Установлено, что у детей с гипофункцией ЩЖ отмечались явления напряженности гуморального иммунитета в виде возрастания уровней сывороточных IgM, IgG и суммарных IgE, снижения уровня IgA. Наиболее выраженные патологические изменения регистрировались у детей, проживающих в г. Шахты, где уровень техногенного загрязнения особенно высок. У детей из районов экологического неблагополучия выявлены сниженные показатели селена и цинка при повышенном уровне свинца в утренней моче, коррелировавшие со снижением уровней сТ4 и сТ3 в крови. Результаты работы обосновывают включение в программу скрининговых обследований детей групп экологического риска исследования показателей тиреоидного профиля, иммунологических показателей, микроэлементного состава для ранней диагностики и превентивной коррекции формирующихся отклонений.
Выявленные особенности этиопатогенетических парадигм гипофункции ЩЖ являются основанием для модификации алгоритма скринингового обследования детей, проживающих в районах экологического неблагополучия. Оптимальное соотношение ХЭ, регулируемое заместительной терапией соответствующими нутриентами, может способствовать коррекции сбоев регуляции ксеногенной этиологии, тем самым стабилизируя гомеостаз.
Сведения об авторах:
Попова Виктория Александровна — д.м.н., главный научный сотрудник педиатрического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0001-5329-7336.
Пузикова Олеся Зиновьевна — д.м.н., ведущий научный сотрудник педиатрического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0002-2868-0664.
Кожин Александр Алексеевич — д.м.н., профессор, профессор кафедры патологической физиологии ФГБОУ ВО РостГМУ Минздрава России, заслуженный деятель науки РФ; 344022, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0003-1470-6074.
Чурюкина Элла Витальевна — к.м.н., доцент, начальник отдела аллергических и аутоиммунных заболеваний ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, Нахичеванский пер., д. 29; доцент кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0001-6407-6117.
Московкина Анжела Владимировна — д.м.н., ведущий научный сотрудник акушерско-гинекологического отдела ФГБОУ ВО РостГМУ Минздрава России (НИИАП); 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0003-3784-2159.
Галкина Галина Александровна — д.м.н., профессор кафедры эндокринологии с курсом детской эндокринологии, заведующая отделением детской эндокринологии ФГБОУ ВО РостГМУ Минздрава России (НИИАП); 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0001-6809-0995.
Созаева Диана Исмаиловна — д.м.н., научный сотрудник педиатрического отдела, доцент кафедры нервных болезней и нейрохирургии ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29.
Кравченко Лариса Вахтанговна — д.м.н., ведущий научный сотрудник педиатрического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29.
Зулпикарова Мадина Юсуповна — аспирант кафедры эндокринологии ФГБОУ ВО ДГМУ Минздрава России; 367012, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD 0000-0002-9221-8757.
Контактная информация: Попова Виктория Александровна, e-mail: vait49@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 25.01.2023.
Поступила после рецензирования 17.02.2023.
Принята в печать 17.03.2023.
About the authors:
Victoria A. Popova — Dr. Sc. (Med.), chief researcher of the Pediatric Department, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0001-5329-7336.
Olesya Z. Puzikova — Dr. Sc. (Med.), leading researcher of the Pediatric Department, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0002-2868-0664.
Aleksandr A. Kozhin — Dr. Sc. (Med.), Professor, Professor of the Department of Pathological Physiology, Honored Scientist
of Russian Federation, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0003-1470-6074.
Ella V. Churyukina — C. Sc. (Med.), associate professor of the Department of Allergic and Autoimmune Diseases, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; associate professor of the Department of Clinical Immunology, Allergology and Laboratory Diagnostics, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0001-6407-6117.
Anzhela V. Moskovkina — Dr. Sc. (Med.), leading researcher of the Obstetrics and Gynecology Department, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0003-3784-2159.
Galina A. Galkina — Dr. Sc. (Med.), Professor of the Department of Endocrinology with the course of pediatric endocrinology, Head of the Department of Children's Endocrinology, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0001-6809-0995.
Diana I. Sozaeva — Dr. Sc. (Med.), researcher of the Pediatric Department, associate professor of the Department of Neurologic Diseases and Neurosurgery, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation.
Larisa V. Kravchenko — Dr. Sc. (Med.), leading researcher of the Pediatric Department, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation.
Madina Yu. Zulpikarova — postgraduate student of the Department of Endocrinology, Dagestan State Medical University; 1, V.I. Lenin sq., Makhachkala, 367012, Russian Federation; ORCID iD 0000-0002-9221-8757.
Contact information: Victoria A. Popova, e-mail: vait49@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 25.01.2023.
Revised 17.02.2023.
Accepted 17.03.2023.
2. Попова В.А., Кожин А.А., Друккер Н.А. и др. Гормонально-микроэлементный гомеостаз мальчиков с ожирением и задержкой полового развития. Медицинский алфавит. 2020;5:46–50. DOI: 10.33667/2078-5631-2020-5-46-50.
3. Оберлис Д., Харланд Б., Скальный А.В. Биологическая роль макро- и микроэлементов у человека и животных. М.: Наука; 2008.
4. Агаджанян Н.А., Скальный А.В., Детков В.Ю. Элементный портрет человека: заболеваемость, демография и проблема управления здоровьем человека. Экология человека. 2013;11:3–12. DOI: 10/33396/1728-0869-2013-11-3-12.
5. Rasmussen L., Schomburg L., Kohrle J. et al. Selenium status, thyroid volume, and multiple nodule formation in an area with mild iodine deficiency. Eur J Endocrinol. 2011;164(4):585–590. DOI: 10.1530/EJE-10-1026.
6. Vigeh M., Smith D.R., Hsu P.C. How does lead induce male infertility? Iran J Reprod Med. 2011;9(1):1–8. PMID: 25356074.
7. Calsolaro V., Pasqualetti G., Niccolai F. et al. Thyroid Disrupting Chemicals. Int J Mol Sci. 2017;18(12):2583. DOI: 10.3390/ijms18122583.
8. Wang Y., Lin M., Gao X. et al. High dietary selenium intake is associated with less insulin resistance in the Newfoundland population. PLoS One. 2017;12(4):e0174149. DOI: 10.1371/journal.pone.0174149.
9. Winther K.H., Rayman M.P., Bonnema S.J., Hegedüs L. Selenium in thyroid disorders — essential knowledge for clinicians. Nat Rev Endocrinol. 2020;16(3):165–176. DOI: 10.1038/s41574-019-0311-6.
10. Vincent J.B. Elucidating a biological role for chromium at a molecular level. Acc Chem Res. 2000;33(7):503–510. DOI: 10.1021/ar990073r.
11. Жерносюк В.Ф. Дефицит витаминов и минералов у детей и способы его коррекции. Медицинские новости. 2015;9:27–31.
12. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Пробиотики и функциональное питание. М.: ГРАНТ; 2001:360–415.
13. Churyukina E.V., Puzikova O.Z., Popova V.A. et al. Cytokine profile disorders in thyroid dysfunction of adolescents living in ecologically unfavorable regions. Abstracts from the European Academy of Allergy and Clinical Immunology Hybrid Congress, 2021. Allergy. 2021;76 Suppl 110:5–661. doi: 10.1111/all.15093.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

