Антибиотикорезистентность основных возбудителей ЛОР-заболеваний
В данном обзоре проводится анализ состояния антибиотикорезистентности основных бактериальных возбудителей инфекций ЛОР-органов — Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae и Moraxella catarrhalis, выделенных в РФ за период с 1999 по 2018 г. Использованные данные многоцентровых микробиологических исследований (ПеГАС, CERBERUS, SOAR и др.) и «Карты антибиотикорезистентности России» позволяют определить тенденции развития резистентности и выявить антибиотики, сохраняющие максимальную активность против респираторных патогенов.
В настоящее время высокую активность против всех перечисленных возбудителей сохраняют амоксициллин / амоксициллин + [клавулановая кислота], парентеральные цефалоспорины III поколения (цефотаксим и цефтриаксон), респираторные фторхинолоны (левофлоксацин и моксифлоксацин). В последние годы отмечены тревожные тенденции, связанные с антибиотикорезистентностью указанных возбудителей, а именно: 1) постепенный рост резистентности S. pyogenes к макролидам; 2) увеличение числа β-лактамазапродуцирующих штаммов H. influenzae, резистентных к незащищенным аминопенициллинам; 3) рост резистентности пневмококков к макролидам; 4) распространение штаммов S. pneumoniae со сниженной чувствительностью к пенициллину, а также появление и распространение в отдельных регионах пенициллинрезистентных пневмококков. Необходимо проведение дальнейшего постоянного эпидемиологического надзора за антибиотикорезистентностью основных бактериальных возбудителей инфекций ЛОР-органов в России.
Ключевые слова: Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae, Moraxella catarrhalis, антибиотикорезистентность, амоксициллин, амоксициллин / амоксициллин + [клавулановая кислота], макролиды, цефтриаксон, левофлоксацин, моксифлоксацин, инфекции ЛОР-органов.
Для цитирования: Стецюк О.У., Андреева И.В., Егорова О.А. Антибиотикорезистентность основных возбудителей ЛОР-заболеваний. РМЖ. Медицинское обозрение. 2019;3(9(II)):78-83.
В обзоре проводится анализ состояния антибиотикорезистентности основных бактериальных возбудителей инфекций ЛОР-органов — Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae и Moraxella catarrhalis, выделенных в РФ
Введение
Антибиотикорезистентность (устойчивость бактериальных возбудителей инфекций к антибиотикам) в настоящее время становится одной из наиболее серьезных угроз для здоровья человечества [1]. Устойчивость к антибиотикам может затронуть любого человека, в любом возрасте и в любой стране. Распространение антибиотикорезистентности существенно затрудняет выбор эффективного антибиотика и может приводить к ухудшению исходов и росту затрат на лечение инфекций.
Согласно принципам проведения рациональной антибактериальной терапии (АБТ), сформулированным российскими экспертами в данной области, при назначении антибиотиков следует обязательно учитывать уровень резистентности основных патогенов в России и в конкретном регионе, а также индивидуальные факторы риска наличия резистентной флоры (устойчивых к лекарствам и β-лактамазапродуцирующих возбудителей) [2, 3].
Основные бактериальные возбудители инфекций лор-органов
Среди многочисленных микроорганизмов, обитающих в рото- и носоглотке, наиболее частыми возбудителями инфекций у человека являются Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae и Moraxella catarrhalis [4]. Присутствие этих бактерий может обнаруживаться как при бессимптомном носительстве, так и при инфекциях ЛОР-органов: тонзиллофарингите (S. pyogenes), среднем отите и риносинусите (S. pneumoniae, H. influenzae и M. catarrhalis).
Данные микробиологических исследований при среднем отите и риносинусите показывают, что вероятность самопроизвольной эрадикации без антибактериальной терапии штаммов H. influenzae и M. catarrhalis составляет около 50–80%, в то время как пневмококка — всего 16–30% [5, 6]. Однако помимо прямой роли в патогенезе инфекций ЛОР-органов H. influenzae и M. сatarrhalis, вырабатывающие β-лактамазы, также способны защищать пиогенный стрептококк и пневмококк от воздействия пенициллинов путем инактивации антибиотиков [7, 8]. Эффективность антибиотиков при ЛОР-инфекциях также может снижаться при наличии бактериальных биопленок, которые часто формируются при полимикробных инфекциях [9]. Кроме того, биопленки способствуют горизонтальной передаче генов резистентности между различными видами микроорганизмов, особенно при воздействии антибиотиков [9].
Появление и распространение резистентных штаммов в значительной степени затрудняет лечение инфекций — у пациентов с инфекциями, вызванными резистентными микроорганизмами, выше вероятность неэффективности антибактериальной терапии и удлинения сроков купирования симптомов заболевания [10].
«Устойчивость к противомикробным препаратам — это один из наиболее высоких рисков нашего времени, угрожающих свести на нет прогресс в медицине, достигнутый за столетие» Генеральный директор ВОЗ Тедрос Аданом Гебрейесус
Антибиотикорезистентность (АБР) может существенно различаться в разных странах и географических регионах, что во многом зависит от практики применения антибиотиков, вакцинации, климатических и миграционных факторов [11–13]. В данном обзоре будут представлены данные по антибиотикорезистентности основных бактериальных возбудителей ЛОР-заболеваний в Российской Федерации.
Следует отметить, что определение чувствительности респираторных возбудителей (прежде всего S. pneumoniae и H. influenzae) к антибиотикам имеет определенные методологические особенности и не всегда выполнимо в практических микробиологических лабораториях. Получение достоверных данных по АБР этих микроорганизмов в РФ возможно только в рамках многоцентровых исследований с централизованным определением чувствительности выделенных возбудителей референтным методом (методом микроразведений).
Эпидемиологические исследования АБР респираторных патогенов в РФ
Эпидемиологические исследования АБР респираторных патогенов (S. pyogenes, S. pneumoniae и H. influenzae) — проект ПеГАС — проводятся в РФ под эгидой Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и НИИ антимикробной химиотерапии с 1999 г. В отдельных этапах исследования принимали участие более 30 центров из различных городов России. Для всех неповторяющихся клинических изолятов трех вышеперечисленных видов бактерий проводилась повторная идентификация и определение чувствительности методом микроразведений с последующим анализом данных в лаборатории НИИАХ (г. Смоленск). Результаты данного исследования были представлены в центральной печати [15–17]. Однако, учитывая длительный временной промежуток между сбором штаммов и подготовкой публикации к печати, что приводило к устареванию данных об АБР к моменту их опубликования, НИИАХ И МАКМАХ инициировали онлайн-проект «Карта антибиотикорезистентности России» — AMRmap (map.antibiotic.ru) [18], позволивший существенно сократить сроки между сбором штаммов и представлением результатов. Далее будут представлены данные анализа AMRmap о резистентности основных респираторных возбудителей за период с 2013 по 2018 г., а также других публикаций по данной проблеме за указанный период времени.

АБР штаммов S. pyogenes, выделенных в РФ
За период с 2013 по 2018 г. был собран и протестирован 601 штамм S. pyogenes, выделенный при инфекциях дыхательных путей и ЛОР-органов в 14 городах РФ. Все изоляты β-гемолитического стрептококка серогруппы А (БГСА) были чувствительны к пенициллину (и ко всем другим β-лактамным антибиотикам), к ванкомицину и линезолиду (рис. 1). Максимальная резистентность была отмечена к препаратам тетрациклинового ряда (15% нечувствительных штаммов) и к макролидам (около 11% штаммов, нечувствительных к эритромицину). Примечательно, что линкосамиды (клиндамицин) сохраняли активность против 98,5% выделенных штаммов, что косвенно свидетельствует о распространенности М-фенотипа резистентности к макролидам (эффлюкс). В то же время в публикации об уровне АБР S. pyogenes, выделенных у детей в Москве в 2013–2015 гг., общий уровень резистентности к макролидам составил 13%, при этом у 10 макролидрезистентных штаммов БГСА определяли механизмы устойчивости к АБП группы макролидов-линкосамидов-стрептограминов (MLS); все эти изоляты оказались устойчивыми ко всем макролидам и линкозамидам (MLS-фенотип резистентности) [19].
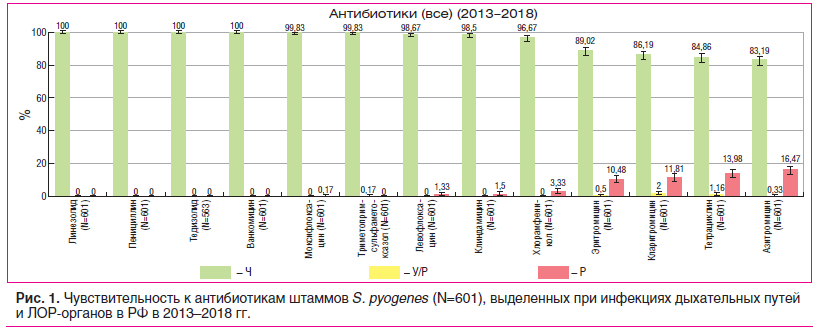
По сравнению с данными проекта ПеГАС за период с 1999 по 2009 г. [16], когда устойчивость БГСА к эритромицину составляла 3%, и данными исследования CERBERUS 2008–2012 гг. [20], в котором уровень резистентности к макролидам у пиогенного стрептококка составил 8,6%, в последние годы отмечается постепенное увеличение резистентности S. pyogenes к макролидам, что требует динамического наблюдения за данным показателем.
АБР штаммов H. influenzae, выделенных в РФ
Культивирование и определение чувствительности штаммов гемофильной палочки сопряжено с существенными методологическими сложностями (необходимость использования специальных питательных сред и ростовых добавок), поэтому количество штаммов, собранных в многоцентровых микробиологических исследованиях в РФ, обычно невелико.
Максимальное количество штаммов было протестировано в исследовании ПеГАС, в котором за период с 2004 по 2009 г. в 10 городах РФ был выделен 691 штамм H. influenzae [17]. Чувствительность выделенных штаммов к амоксициллину в 2004–2005 гг. составила 94,6%, в 2006–2009 гг. — 97,2%. Амоксициллин / амоксициллин + [клавулановая кислота] был активен в отношении 100% штаммов гемофильной палочки, такую же активность демонстрировали цефалоспорины III поколения (цефотаксим и цефтриаксон) и респираторные фторхинолоны (левофлоксацин и моксифлоксацин). Высокую активность in vitro продемонстрировали также хлорамфеникол и тетрациклин (≥95% чувствительных штаммов). Чувствительность к современным макролидам составила: к кларитромицину — 89,5–99,5%, к азитромицину — 98,4–100% за период 2004–2005 гг. и 2006–2009 гг. соответственно. В то же время следует помнить, что активность макролидов против H. influenzae существенно ниже по сравнению с активностью β-лактамов и фторхинолонов, что необходимо учитывать при назначении азитромицина или кларитромицина для лечения инфекций, вызванных гемофильной палочкой. Наиболее высокие цифры резистентности были отмечены к котримоксазолу — к данному препарату были нечувствительны около 30% всех протестированных штаммов.
В исследовании CERBERUS было изучено 85 штаммов гемофильной палочки, выделенных в РФ в 2008–2012 гг. [20]. Резистентными к ампициллину были 11,8% штаммов H. influenzae, но только 1,2% были устойчивы к амоксициллину / амоксициллин + [клавулановая кислота],
что косвенно свидетельствует о продукции β-лактамаз у 10,5% изолятов гемофил в РФ в данный период времени. Показатели чувствительности H. influenzae к другим антибиотикам в исследовании CERBERUS были аналогичны данным исследования ПеГАС за 2004–2009 гг.
В 2018 г. были опубликованы результаты международного исследования АБР — SOAR (Survey of Antibiotic Resistance) [21], в котором были протестированы 279 штаммов H. influenzae, выделенных в РФ в 2014–2016 гг. Устойчивыми к амоксициллину оказались 19% изолятов, при этом продукция β-лактамаз была выявлена у 15,4% штаммов, а чувствительными к амоксициллину / амоксициллин + [клавулановая кислота] оказались ≥97,5% гемофил. В данном исследовании впервые были обнаружены штаммы (4 изолята), нечувствительные к фторхинолонам (по критериям ЕUCAST).
В исследовании SOAR интерпретация результатов определения чувствительности микроорганизмов проводилась по трем различным методикам: 1) по рекомендациям EUCAST (European Committee on Antimicrobial Susceptibility Testing — Европейский комитет по определению чувствительности к антибиотикам); 2) по стандартам CLSI (Clinical Laboratory Standards Institute — Институт по клиническим лабораторным стандартам, США) и 3) по критериям прогнозируемой эффективности на основании данных фармакодинамики и фармакокинетики (ФК/ФД) антибиотиков [21]. По результатам анализа оказалось, что наибольшей активностью против H. influenzae обладают цефтриаксон, фторхинолоны и амоксициллин / амоксициллин + [клавулановая кислота] (табл. 1). Макролиды (кларитромицин и азитромицин) были расценены как неактивные/неэффективные препараты против гемофильной палочки при использовании более строгих критериев оценки EUCAST и анализа ФК/ФД параметров. Прогнозируемая эффективность амоксициллина и цефуроксима оказалась субоптимальной.
![Таблица 1. Чувствительность к антибиотикам штаммов H. influenzae (N=279) по критериям CLSI, EUCAST и ФК/ФД [21] Таблица 1. Чувствительность к антибиотикам штаммов H. influenzae (N=279) по критериям CLSI, EUCAST и ФК/ФД [21]](/upload/medialibrary/946/78-2.png)
При анализе динамики АБР штаммов H. influenzae, выделенных в РФ в 2004–2009 гг. (исследование ПеГАС), в 2008–2012 гг. (CERBERUS) и в 2014–2016 гг. (SOAR), невозможно не отметить негативные тенденции — увеличение частоты резистентности к незащищенным аминопенициллинам (ампициллину и амоксициллину) с 3% до 19%, преимущественно за счет продукции β-лактамаз, а также появление единичных штаммов, устойчивых к фторхинолонам. В то же время амоксициллин / амоксициллин + [клавулановая кислота] и цефалоспорины III поколения (цефтриаксон) сохраняют стабильно высокую активность против изолятов гемофильной палочки.
АБР штаммов S. pneumoniae, выделенных в РФ
Как уже было отмечено выше, пневмококк — наиболее клинически значимый возбудитель инфекций ЛОР-органов, в отношении которого должна проводиться максимально эффективная терапия.
Результаты исследования ПеГАС за период с 1999 по 2009 г. демонстрировали достаточно стабильную ситуацию с АБР пневмококков, выделенных в РФ [15, 22]. За указанный период в различных городах Центрального, Северо-Западного, Южного, Приволжского, Уральского, Сибирского и Дальневосточного федеральных округов (ФО) России было собрано 2419 штаммов S. pneumoniae. Отмечалась высокая активность β-лактамных антибиотиков: устойчивость пневмококков к пенициллину, амоксициллину, цефтриаксону/цефотаксиму не превышала 11, 0,4 и 1% соответственно. Резистентность к 14-, 15- и 16-членным макролидам в течение указанного периода была относительно стабильной и составляла не более 8,2, 8,2 и 6,3% соответственно. Частота выделения изолятов, нечувствительных к клиндамицину, варьировала от 2,9% в 1999–2003 гг. до 4,5% в 2006–2009 гг. Все изученные штаммы были чувствительны к респираторным фторхинолонам (левофлоксацину и моксифлоксацину). Высокие цифры устойчивости пневмококков были отмечены к тетрациклину (около 25% нечувствительных штаммов) и котримоксазолу (>30% резистентных изолятов) [15].
При анализе данных за 2006–2009 гг. по отдельным ФО уже были отмечены «горячие точки» АБР пневмококков. Так, например, при средней по России частоте выделения штаммов с промежуточной резистентностью (У/Р) и высокой резистентностью (Р) к пенициллину 9,1% и 2,1% соответственно, в Дальневосточном ФО эти показатели составили 17,6% и 7,4%, а в Уральском ФО — 13,9% и 2,8% соответственно [22]. В то же время амоксициллин / амоксициллин + [клавулановая кислота] сохраняли высокую активность против S. pneumoniae: частота выделения нечувствительных (У/Р) изолятов в среднем по РФ составила 0,4%; в Уральском ФО — 2,8%, в Дальневосточном ФО — 2,9%, резистентных штаммов не было выявлено [22].
В исследовании CERBERUS (2008–2012 гг.) было протестировано 954 штамма изолята S. pneumoniae. Пенициллин, амоксициллин, цефтриаксон сохраняли высокую активность против пневмококков: к ним были чувствительны более 95% штаммов. Однако в данном исследовании были впервые отмечены тревожные тенденции, связанные с АБР S. pneumoniae в РФ: частота устойчивости к макролидам (эритромицину) в среднем по России превысила 15%, а к линкосамидам (клиндамицину) составила 9% [20]. Анализ данных по отдельным центрам показал, что максимальные цифры резистентности к макролидам были отмечены в Санкт-Петербурге (33,2%), Москве (19,6%) и Хабаровске (16,4%) [23]. В остальных центрах резистентность к макролидам варьировала от 0% (Томск) до 4,8% (Ярославль). Примечательно, что во всех центрах, кроме Санкт-Петербурга, была отмечена значительная перекрестная резистентность между макролидами и линкосамидами, что косвенно свидетельствует о распространенности MLS-фенотипа резистентности у пневмококков. В Санкт-Петербурге относительно часто встречался М-фенотип резистентности, при котором 14- и 15-членные макролиды утрачивают свою активность, но 16-членные макролиды и линкосамиды могут оставаться активными против таких штаммов S. pneumoniae.
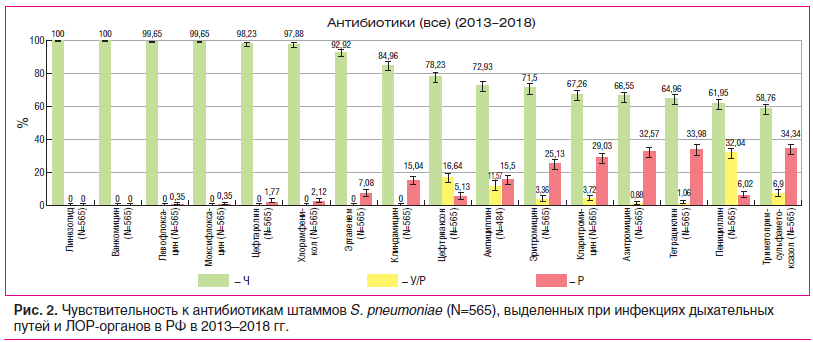
При анализе данных «Карты антибиотикорезистентности России» за 2013–2018 гг. отмечены существенные изменения в АБР пневмококков по сравнению с более ранними периодами времени (рис. 3). Так, существенно выросли показатели устойчивости S. pneumoniae к пенициллину: в среднем по России частота У/Р штаммов составляет более 30%, а резистентных — 6%. Распространение пенициллин-резистентных пневмококков сопровождается увеличением числа штаммов, нечувствительных к парентеральным цефалоспоринам III поколения (цефтриаксону) — 16,6% У/Р и 5,1% Р изолятов; частота перекрестной резистентности между пенициллином и цефтриаксоном составляет более 70%.
Частота резистентности к макролидам в среднем по РФ превысила 25%, при этом более 60% штаммов, устойчивых к макролидам, также нечувствительны к линкосамидам; общий уровень резистентности к клиндамицину составляет около 15% (рис. 2).
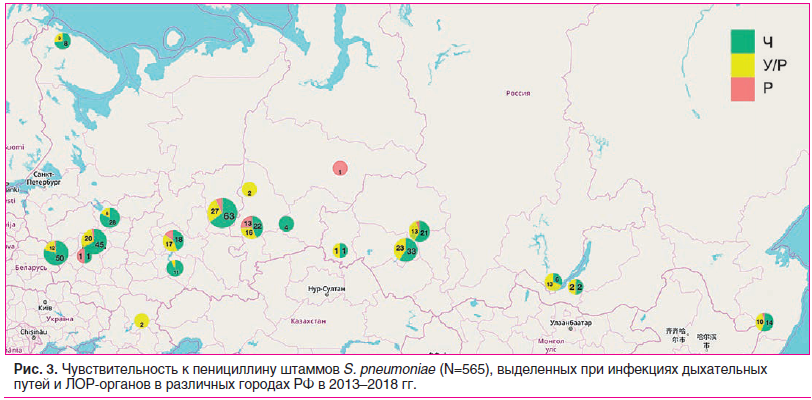
Анализ данных о распространении пенициллинрезистентных пневмококков в РФ показывает, что подобные штаммы могут быть выделены в любом регионе страны, при этом максимальное количество У/Р штаммов зарегистрировано в Иркутске, Казани, Новосибирске, Хабаровске (40–68%), а резистентных — в Екатеринбурге и Казани (25% и 14,6%) (рис. 3).
Штаммы пневмококка, резистентные и умеренно резистентные к макролидам (эритромицину), наиболее часто выделяются в Екатеринбурге (32% и 4% соответственно), Казани (34% и 0%) и Хабаровске (32% и 4%). Таким образом, в регионах с высокой частотой пенициллинрезистентных пневмококков также отмечается высокая частота устойчивости к макролидам.
Данные анализа «Карты антибиотикорезистентности России» хорошо согласуются с результатами исследования SOAR в РФ за 2014–2016 гг. [21]. Было протестировано 279 штаммов изолята S. pneumoniae. Чувствительными к пенициллину по критериям EUCAST были только 67% штаммов. Также отмечалась низкая чувствительность пневмококков к цефуроксиму, макролидам и котримоксазолу (85%, 68,8% и 67,7% соответственно). Респираторные фторхинолоны (левофлоксацин и моксифлоксацин) были активны против 100% выделенных штаммов, к амоксициллину / амоксициллин + [клавулановая кислота] и цефтриаксону были чувствительны 92,8% S. pneumoniae.
При анализе чувствительности пневмококков к антибиотикам с использованием различных критериев (EUCAST, CLSI и ФК/ФД) оказалось, что наибольшей активностью против S. pneumoniae обладают респираторные фторхинолоны, амоксициллин / амоксициллин + [клавулановая кислота] (табл. 2). Активность цефуроксима и цефтриаксона (по критериям EUCAST) определяется как субоптимальная, а макролиды не могут рассматриваться как антипневмококковые препараты из-за высокой частоты резистентности к ним.
![Таблица 2. Чувствительность к антибиотикам штаммов S. pneumoniae (N=279) по критериям CLSI, EUCAST и ФК/ФД [21] Таблица 2. Чувствительность к антибиотикам штаммов S. pneumoniae (N=279) по критериям CLSI, EUCAST и ФК/ФД [21]](/upload/medialibrary/d00/78-6.png)
Распространение в РФ пневмококков, нечувствительных к пенициллину (около 30% всех изолятов), является серьезной проблемой, т. к. для этих штаммов характерна сниженная чувствительность к другим классам антибиотиков (кроме фторхинолонов, амоксициллина / амоксициллин + [клавулановая кислота] и цефтриаксона), что существенно затрудняет выбор эффективной терапии и приводит к ухудшению результатов лечения [21] (рис. 4).
![Рис. 4. Активность антибиотиков против S. pneumoniae в зависимости от чувствительности к пенициллину [21] Рис. 4. Активность антибиотиков против S. pneumoniae в зависимости от чувствительности к пенициллину [21]](/upload/medialibrary/63b/78-7.png)
Данные по АБР штаммов M. catarrhalis
Moraxella catarrhalis может участвовать в патогенезе инфекций ЛОР-органов (острый средний отит, синусит), особенно у детей, обычно в комбинации с гемофильной палочкой и пневмококком. Известно, что более 90% всех изолятов M. catarrhalis, выделенных в России, продуцируют β-лактамазы [24], поэтому амоксициллин неэффективен при инфекциях, в развитии которых участвуют моракселлы. К амоксициллину / амоксициллин + [клавулановая кислота], цефалоспоринам III поколения, левофлоксацину были чувствительны все выделенные штаммы [24].
Общие выводы по АБР основных возбудителей ЛОР-заболеваний в России
На основании анализа российских данных по АБР основных бактериальных возбудителей ЛОР-заболеваний — S. pneumoniae, S. pyogenes, H. influenzae и M. catarrhalis — следует признать, что в настоящее время ситуация в РФ относительно благополучная. Высокую активность против всех перечисленных микроорганизмов сохраняют амоксициллин / амоксициллин + [клавулановая кислота], парентеральные цефалоспорины III поколения (цефотаксим и цефтриаксон), респираторные фторхинолоны (левофлоксацин и моксифлоксацин).
Однако в последние годы отмечаются тревожные тенденции АБР указанных возбудителей, а именно: 1) постепенный рост резистентности S. pyogenes к макролидам; 2) увеличение числа β-лактамазапродуцирующих штаммов H. influenzae, резистентных к незащищенным аминопенициллинам; 3) рост резистентности пневмококков к макролидам; 4) распространение штаммов S. pneumoniae со сниженной чувствительностью к пенициллину, а также появление и распространение в отдельных регионах пенициллинрезистентных пневмококков. Таким образом, необходим постоянный эпидемиологический надзор за АБР респираторных возбудителей в России с целью раннего выявления резистентных штаммов, принятия обоснованных решений при создании клинических рекомендаций по терапии инфекций и формировании политики рационального применения антибиотиков.
Заключение
Выявленные тенденции АБР потребовали изменения подходов к терапии инфекций ЛОР-органов. Вследствие высокой частоты резистентности возбудителей к макролидам этот класс антибиотиков в настоящее время не может рассматриваться в качестве стартовой эмпирической терапии, амоксициллин можно назначать только пациентам без факторов риска инфицирования лекарственноустойчивыми и/или β-лактамазапродуцирующими возбудителями, а при наличии таких факторов в качестве стартового препарата обычно используется амоксициллин / амоксициллин + [клавулановая кислота]. Главный фактор риска инфицирования резистентной флорой — прием антибиотиков в течение предшествующих 3 мес., другими факторами риска являются посещение детских дошкольных учреждений; контакт с детьми, посещающими дошкольные учреждения (для детей); госпитализация в течение предшествующих 3 мес.; пребывание в учреждениях длительного ухода, детских домах, интернатах; лечение в дневных стационарах поликлиник; заболевания/состояния, сопровождающиеся иммунодепрессией, множественная коморбидность, хронические заболевания органов дыхания (бронхиальная астма, ХОБЛ у взрослых), сахарный диабет, алкоголизм (у взрослых), гемодиализ, путешествия [2, 3]. При серьезных инфекциях или неэффективности стартовой терапии используются парентеральные цефалоспорины III поколения (цефотаксим или цефтриаксон) или у взрослых пациентов — респираторные фторхинолоны (левофлоксацин или моксифлоксацин).
2. Эмпирическая антибактериальная терапия инфекций дыхательных путей с учетом факторов риска резистентной флоры. Резолюция совета экспертов. Справочник поликлинического врача. 2018;1:6–10. [Empirical antibiotic therapy of respiratory tract infections, taking into account risk factors for resistant flora. Expert Council Resolution. Handbook of outpatient physician. 2018;1:6–10 (in Russ.)].
3. Резолюция экспертного совета «Принципы рациональной антибиотикотерапии респираторных инфекций у детей. Сохраним антибиотики для будущих поколений». Педиатрия. (Consilium Medicum). 2018;3:10–14. [Resolution of the Expert Council “Principles of rational antibiotic therapy of respiratory infections in children. Preserving antibiotics for future generations”. Pediatrics (Consilium Medicum). 2018;3:10–14 (in Russ.)].
4. Giménez M.J., Aguilar L, Granizo J.J. Revisiting cefditoren for the treatment of community-acquired infections caused by human-adapted respiratory pathogens in adults. Multidiscip Respir Med. 2018;13:40.
5. Dagan R., Leibovitz E. Bacterial eradication in the treatment of otitis media. Lancet Infect Dis. 2002;2:593–604.
6. Hadley J.A., Pfaller M.A. Oral beta-lactams in the treatment of acute bacterial rhinosinusitis. Diagn Microbiol Infect Dis. 2007;57(3):47–54.
7. Weimer K.E., Juneau R.A., Murrah K.A. et al. Divergent mechanisms for passive pneumococcal resistance to β-lactam antibiotics in the presence of Haemophilus influenzae. J Infect Dis. 2011;203:549–555.
8. Brook I. Treatment challenges of Group A Beta-hemolytic Streptococcal pharyngotonsillitis. Int Arch Otorhinolaryngol. 2017;21(3):286–296.
9. Sorg R.A., Lin L., van Doorn G.S. et al. Collective resistance in microbial communities by intracellular antibiotic deactivation. PLoS Biol. 2016;14:e2000631.
10. Van Hecke O,, Wang K., Lee J.J. et al. The implications of antibiotic resistance for patients’ recovery from common infections in the community: a systematic review and meta-analysis Clin Infect Dis. 2017;65:371–382.
11. Cizman M., Pokorn M., Seme K. et al. The relationship between trends in macrolide use and resistance to macrolides of common respiratory pathogens. J Antimicrob Chemother. 2001;47:475–477.
12. Baquero F., Baquero-Artigao G., Cantón R., García-Rey C. Antibiotic consumption and resistance selection in Streptococcus pneumoniae. J Antimicrob Chemother. 2002;50(2):27–37.
13. Gracia M., Díaz C., Coronel P. et al. Antimicrobial susceptibility of Streptococcus pyogenes in central, eastern, and Baltic European countries, 2005 to 2006: the cefditoren surveillance program. Diagn Microbiol Infect Dis. 2009;64:52–56.
14. Soriano F., Granizo J.J., Coronel P. et al. Antimicrobial susceptibility of Haemophilus influenzae, Haemophilus parainfluenzae and Moraxella catarrhalis isolated from adult patients with respiratory tract infections in four southern European countries. The ARISE project. Int J Antimicrob Agents. 2004;23:296–299.
15. Козлов Р.С., Сивая О.В., Кречикова О.И. и др. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. Клиническая микробиология и антимикробная химиотерапия. 2010;12(4):329–341. [Kozlov R.S., Sivaya O.V., Krechikova O.I. et al. Dynamics of Streptococcus pneumoniae resistance to antibiotics in Russia for the period 1999–2009 Clinical Microbiology Antimicrobial Chemotherapy. 2010;12(4):329–341 (in Russ.)].
16. Азовскова О.В., Иванчик Н.В., Дехнич А.В. и др. Динамика антибиотикорезистентности респираторных штаммов Streptococcus pyogenes в России за период 1999–2009 гг. Клиническая микробиология и антимикробная химиотерапия. 2012;14(4):309–321. [Azovskova O.V., Ivanchik N.V., Dehnich A.V. et al. Dynamics of antibiotic resistance of respiratory strains of Streptococcus pyogenes in Russia for the period 1999–2009. Clinical Microbiology Antimicrobial Chemotherapy. 2012;14(4):309–321 (in Russ.)].
17. Сивая О.В., Козлов Р.С., Кречикова О.И. и др. Антибиотикорезистентность Haemophilus influenzae в России: результаты многоцентрового проспективного исследования ПеГАС. Клиническая микробиология и антимикробная химиотерапия. 2014;16(1):57–69. [Sivaya O.V., Kozlov R.S., Krechikova O.I. et al. Antibiotic resistance of Haemophilus influenzae in Russia: results of a multicenter prospective PeGAS study. Clinical Microbiology Antimicrobial Chemotherapy. 2014;16(1):57–69 (in Russ.)].
18. Кузьменков А.Ю., Трушин И.В., Авраменко А.А. и др. AMRmap: Интернет-платформа мониторинга антибиотикорезистентности. Клиническая микробиология и антимикробная химиотерапия. 2017;19(2):84–90. [Kuzmenkov A.Yu., Trushin I.V., Avramenko A.A. et al. AMRmap: Online antibiotic resistance monitoring platform. Clinical Microbiology Antimicrobial Chemotherapy. 2017;19(2):84–90 (in Russ.)].
19. Катосова Л.К., Пономаренко О.А., Хохлова Т.А. и др. Рост резистентности к макролидам Streptococcus pyogenes и определяющие ее молекулярные механизмы. Клиническая микробиология и антимикробная химиотерапия. 2015;17(1):30. [Katosova L.K., Ponomarenko O.A., Khokhlova T.A. et al. Increased resistance to Streptococcus pyogenes macrolides and its molecular mechanisms that determine it. Clinical Microbiology Antimicrobial Chemotherapy. 2015;17(1):30 (in Russ.)].
20. Козлов Р.С., Сухорукова М.В., Сидоренко С.В. и др. Чувствительность основных возбудителей бактериальных инфекций к цефтаролину в Российской Федерации. Клиническая микробиология и антимикробная химиотерапия. 2015;17(3):217–226. [Kozlov R.S., Sukhorukova M.V., Sidorenko S.V. and others. The sensitivity of the main causative agents of bacterial infections to ceftaroline in the Russian Federation. Clinical Microbiology Antimicrobial Chemotherapy. 2015;17(3):217–226 (in Russ.)].
21. Torumkuney D., Mayanskiy N., Edelstein M. et al. Results from the Survey of Antibiotic Resistance (SOAR) 2014–2016 in Russia. J Antimicrob Chemother. 2018;73(suppl.5):v14–v21.
22. Козлов Р.С. Пневмококки: уроки прошлого — взгляд в будущее. Смоленск: МАКМАХ, 2010. [Kozlov R.S. Pneumococci: lessons of the past — a look into the future. Smolensk: MAKMAH, 2010 (in Russ.)].
23. Состояние антибиотикорезистентности штаммов S. pneumoniae, выделенных в РФ в 2008–2012 гг. Научный отчет НИИАХ СГМА, 2013 г. Неопубликованные данные. [The state of antibiotic resistance of S. pneumoniae strains isolated in the Russian Federation in 2008–2012. Scientific report of the NIIAH SSMA, 2013. Unpublished data (in Russ.)].
24. Боронина Л.Г., Саматова Е.В., Блинова С.М. Динамика антибиотикорезистентности у Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis, вызывающих ЛОР-патологию и внебольничные бронхолегочные заболевания у детей на Среднем Урале. Клиническая микробиология и антимикробная химиотерапия. 2017;19(2):168–175. [Boronina L.G., Samatova E.V., Blinova S.M. Dynamics of antibiotic resistance in Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis, causing ENT pathology and community-acquired bronchopulmonary diseases in children in the Middle Urals. Clinical Microbiology Antimicrobial Chemotherapy. 2017;19(2):168–175 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
