Ацетил-L-карнитин в лечении периферической нейропатической боли: систематический обзор и метаанализ рандомизированных контролируемых исследований (реферат)
Рубрика:
Неврология
Цель исследования: в ходе систематического обзора рандомизированных контролируемых исследований определить эффективность и безопасность ацетил-L-карнитина по сравнению с плацебо у пациентов с диабетической и недиабетической периферической нейропатией.
Материал и методы: выполнен поиск релевантных статей по базам данных MEDLINE (1996–2014), EMBase (1974–2014) и CENTRAL с использованием ключевых слов: «карнитин», «нейро», «нейропатическая боль» и «нейропатия». Статистический анализ осуществляли с помощью программного обеспечения Review Manager 5.2.7 (Копенгаген, Северный Кохрейновский центр, Кохрейновское сотрудничество, 2012). Для характеристики непрерывных данных для каждого исследования вычисляли среднее отклонение (MD) и 95% доверительный интервал (ДИ). Анализ по подгруппам проводили в зависимости от причины нейропатии (сахарный диабет или иное) и способа введения ацетил-L-карнитина.
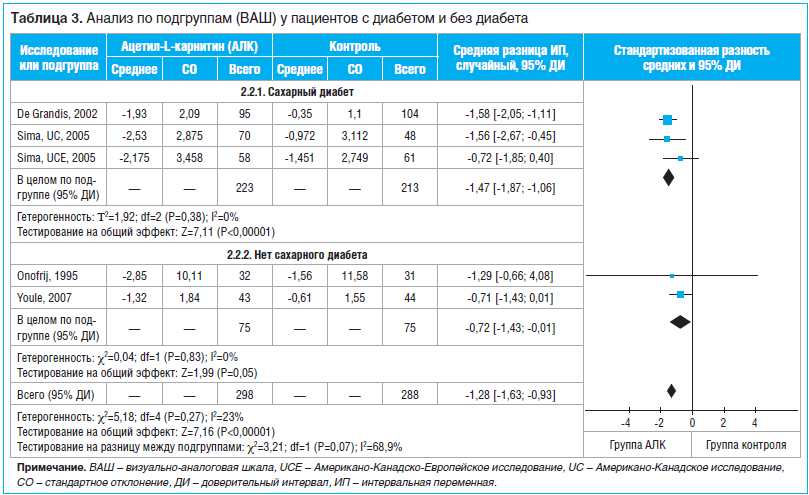
Результаты исследования: после скрининга подходящими были признаны 3 статьи, в которых сообщалось о 4 рандомизированных клинических исследованиях с участием 523 пациентов. Во всех 4 исследованиях влияние ацетил-L-карнитина на болевой синдром оценивали по визуальной аналоговой шкале (ВАШ). Совокупные результаты свидетельствуют о том, что ацетил-L-карнитин уменьшает болевой синдром по сравнению с плацебо, причем разница статистически достоверна (MD по ВАШ 1,20; 95% ДИ 0,68–1,72; P<0,00001). Результаты анализа свидетельствуют о том, что у пациентов с диабетом, получавших ацетил-L-карнитин, сумма баллов по ВАШ достоверно уменьшилась по сравнению с суммой баллов у пациентов из группы плацебо (MD 1,47; 95% ДИ 1,06–1,87; P<0,00001). У пациентов без диабета отмечено менее выраженное уменьшение суммы баллов по ВАШ (MD 0,71; 95% ДИ -0,01–1,43; P=0,05).
Выводы: ацетил-L-карнитин является эффективным и безопасным средством лечения периферической нейропатической боли, особенно на фоне сахарного диабета. Необходимы новые исследования с бóльшим объемом выборки, разнообразием популяций испытуемых и с более продолжительным периодом наблюдения.
Ключевые слова: периферическая нейропатическая боль, диабетическая и недиабетическая периферическая нейропатия, ацетил-L-карнитин.
Материал и методы: выполнен поиск релевантных статей по базам данных MEDLINE (1996–2014), EMBase (1974–2014) и CENTRAL с использованием ключевых слов: «карнитин», «нейро», «нейропатическая боль» и «нейропатия». Статистический анализ осуществляли с помощью программного обеспечения Review Manager 5.2.7 (Копенгаген, Северный Кохрейновский центр, Кохрейновское сотрудничество, 2012). Для характеристики непрерывных данных для каждого исследования вычисляли среднее отклонение (MD) и 95% доверительный интервал (ДИ). Анализ по подгруппам проводили в зависимости от причины нейропатии (сахарный диабет или иное) и способа введения ацетил-L-карнитина.
Результаты исследования: после скрининга подходящими были признаны 3 статьи, в которых сообщалось о 4 рандомизированных клинических исследованиях с участием 523 пациентов. Во всех 4 исследованиях влияние ацетил-L-карнитина на болевой синдром оценивали по визуальной аналоговой шкале (ВАШ). Совокупные результаты свидетельствуют о том, что ацетил-L-карнитин уменьшает болевой синдром по сравнению с плацебо, причем разница статистически достоверна (MD по ВАШ 1,20; 95% ДИ 0,68–1,72; P<0,00001). Результаты анализа свидетельствуют о том, что у пациентов с диабетом, получавших ацетил-L-карнитин, сумма баллов по ВАШ достоверно уменьшилась по сравнению с суммой баллов у пациентов из группы плацебо (MD 1,47; 95% ДИ 1,06–1,87; P<0,00001). У пациентов без диабета отмечено менее выраженное уменьшение суммы баллов по ВАШ (MD 0,71; 95% ДИ -0,01–1,43; P=0,05).
Выводы: ацетил-L-карнитин является эффективным и безопасным средством лечения периферической нейропатической боли, особенно на фоне сахарного диабета. Необходимы новые исследования с бóльшим объемом выборки, разнообразием популяций испытуемых и с более продолжительным периодом наблюдения.
Ключевые слова: периферическая нейропатическая боль, диабетическая и недиабетическая периферическая нейропатия, ацетил-L-карнитин.
Aim: to conduct a systematic review of randomized controlled clinical trials determining acetyl L-carnitine efficacy and safety compared with placebo in patients with diabetic and non-diabetic peripheral neuropathy.
Patients and Methods: a search for relevant articles in MEDLINE (1996–2014), EMBase (1974–2014) and CENTRAL databases was performed using the following keywords: “carnitine”, “neuro”, “neuropathic pain” and “neuropathy”. Statistical analysis was conducted using the Review Manager 5.2.7 software (Copenhagen, North Cochrane Center, Cochrane Collaboration, 2012). Mean deviation (MD) and 95% confidence interval (CI) were calculated to characterize the continuous data for each study. Subgroup analysis was performed depending on causes of neuropathy (diabetes mellitus or other) and the acetyl L-carnitine administration method.
Results: three articles, in which four randomized clinical trials involving 523 patients were reported, were deemed appropriate after the screening. The acetyl L-carnitine impact on pain syndrome was evaluated by VAS in all 4 clinical trials. Acetyl L-carnitine somehow reduces pain compared with placebo, with the difference being statistically significant (MD according to VAS — 1.20; 95% CI 0.68–1.72 with P<0.00001), according to the cumulative results. Also, the analysis results suggest that patients with diabetes who were prescribed with acetyl L-carnitine had significantly lower VAS scores compared with patients from the placebo group (MD — 1.47; 95% CI 1.06–1.87 with P<0.00001). A less pronounced VAS score decrease was observed in patients without diabetes (MD — 0.71; 95% CI -0.01–1.43, P=0.05).
Conclusions: acetyl L-carnitine is an effective and safe treatment for peripheral neuropathic pain, especially in the setting of diabetes. There is a need in new clinical trials with larger sample size and subjects’ population diversity with a longer follow-up period.
Keywords: peripheral neuropathic pain, diabetic and non-diabetic peripheral neuropathy, acetyl L-carnitine.
For citation: Acetyl L-carnitine in the peripheral neuropathic pain treatment: systematic review and meta-analysis of randomized controlled clinical trials (report). RMJ. Medical Review. 2019;4(II):43–48.
Представлены результаты систематического обзора рандомизированных контролируемых исследований, оценивающих эффективность и безопасность ацетил-L-карнитина по сравнению с плацебо у пациентов с диабетической и недиабетической периферической нейропатией.
Введение
Периферическая нейропатическая боль обусловлена поражением периферических нервов, которое может быть результатом осложнений сахарного диабета, побочного действия лекарственных препаратов или иных состояний. Периферическая нейропатическая боль, хотя и не угрожает жизни, существенно влияет на ее качество. Она ассоциирована с большой распространенностью депрессии [1] и других психических расстройств, которые могут усугублять основное заболевание.В настоящее время основную стратегию лечения периферической нейропатической боли составляет симптоматическая терапия [2]. Однако, несмотря на высокую стоимость медикаментов и их потенциальное побочное действие, во многих случаях подобное лечение оказывается малоэффективным [3]. Поэтому поиск новых препаратов для купирования периферической нейропатической боли весьма актуален.
Ацетил-L-карнитин играет фундаментальную роль в метаболизме жирных кислот в митохондриях и модулирует действие факторов роста нервов и нейротрансмиттеров в нервной системе [4]. Хотя в последние годы неоднократно предпринимались попытки использовать ацетил-L-карнитин для лечения диабетической и недиабетической периферической нейропатии, его эффекты остаются противоречивыми. Учитывая вышеизложенное, мы провели систематический обзор рандомизированных контролируемых испытаний (РКИ) с целью определить эффективность и безопасность ацетил-L-карнитина по сравнению с плацебо или другими активными препаратами у пациентов с диабетической и недиабетической периферической нейропатией.
Материал и методы
Методология настоящего исследования соответствует положениям инструкции «Предпочтительные параметры отчетности для систематических обзоров и метаанализа» (PRISMA).Поиск по базам данных
Выполнен поиск релевантных статей по базам данных MEDLINE (1996–2014), EMBase (1974–2014) и CENTRAL (May 2014) вплоть до 27 июня 2014 г. с использованием комбинаций следующих ключевых слов: «карнитин», «нейро», «нейропатическая боль» и «нейропатия». Кроме того, осуществлялся поиск вручную по списку литературы с целью обнаружения дополнительных потенциально значимых исследований. Публикации проверяли на дублирование. Также определяли наличие перекрывающихся публикаций. Популяции пациентов считали перекрывающимися, если они имели одинаковые критерии: больница, автор, период наблюдения и разновидность вмешательства. В случае дублированных или перекрывающихся популяций пациентов мы включали в метаанализ более информативные или более поздние публикации.
Критерии включения и исключения
Подходящие исследования должны были удовлетворять следующим критериям: 1) относились к РКИ; 2) включались пациенты с диабетом и без диабета с периферической нейропатической болью, диагностированной по клинической картине и/или нейрофизиологическим изменениям конечностей; 3) назначался ацетил-L-карнитин (любой способ введения); 4) в качестве контроля использовались плацебо или другие положительные контрольные препараты; 5) для оценки первичной конечной точки применялась визуально-аналоговая шкала (ВАШ), в качестве вторичных конечных точек выступали побочные эффекты.В метаанализ включали только публикации на английском языке. Мы исключали: тезисы конференций, не содержащие оригинальных данных; исследования без адекватного анализа конечных точек; дублированные и перекрывающиеся публикации.
Извлечение данных
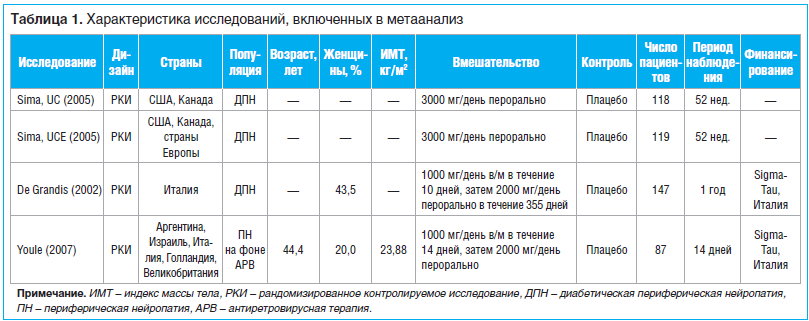
Два независимых исследователя (S.L. и Q.L.) просматривали все публикации, обнаруженные в ходе поиска. Разногласия устранялись путем консультации с третьим экспертом (H.T.). Данные из выделенных исследований отбирались независимым образом с использованием специальной формы. Регистрировались следующие характеристики исследований: первый автор, год публикации, название, дизайн, источник финансирования, страна, по пациентам — пол, средний возраст, индекс массы тела (ИМТ), вмешательство, численность в основной и контрольной группах, продолжительность периода наблюдения, критерии диагноза нейропатии, количество баллов по ВАШ и число побочных эффектов в каждой группе.Оценка риска смещения исследований
Два исследователя (S.L. и Q.L.) независимо оценивали риск смещения каждого из включенных исследований с помощью инструмента «оценка смещения» из рекомендаций Кохрейновского сотрудничества [5], который включает 7 доменов (генерация рандомизационных последовательностей, сокрытие распределения испытуемых в группы вмешательства, ослепление испытуемых и медицинских работников, ослепление экспертов, предоставление сведений о неполных исходах, предоставление сведений о селективных исходах и «другое»). Инструмент снабжен понятными и четкими инструкциями, которые помогают оценить риск смещения как «высокий», «низкий» или «неопределенный». Разногласия в оценке устранялись путем обсуждения.Статистический анализ
Статистический анализ осуществляли с помощью программного обеспечения Review Manager 5.2.7 (Копенгаген, Северный Кохрейновский центр, Кохрейновское сотрудничество, 2012). Для характеристики непрерывных данных для каждого исследования вычислялось среднее отклонение (MD) и 95% доверительный интервал (ДИ). Гетерогенность исследований изначально оценивалась графически путем анализа форест-графиков, а затем с использованием критерия однородности хи-квадрат (χ2) и индекса несовместимости (I2) [6]. Исследования считались статистически достоверно гетерогенными при Р<0,1 или I2>50%. Исследования объединялись в пул с помощью модели со случайными эффектами [7] при наличии статистической или иной гетерогенности или с помощью модели с фиксированными эффектами во всех иных случаях [8]. Анализ по подгруппам проводили в зависимости от причины нейропатии (сахарный диабет или иное) и способа введения ацетил-L-карнитина. Для оценки стабильности результатов анализировалась чувствительность путем исключения одного исследования за раз.Результаты исследования
На рисунке 1 представлены результаты отбора статей. После скрининга 717 статей подходящими были признаны 3 статьи [9–11], в которых сообщалось о 4 РКИ с участием 523 пациентов. В 3 исследованиях участвовали пациенты с диабетической периферической нейропатией [9, 10], а в одном — пациенты с периферической нейропатией, вызванной действием противовирусных препаратов [11]. Только в 1 исследовании [11] были представлены данные о возрасте испытуемых (в среднем 44,4 года) и ИМТ (в среднем 23,88 кг/м2, табл. 1). Во всех исследованиях эффекты ацетил-L-карнитина сравнивались с эффектами плацебо. В ходе 2 исследований [9] ацетил-L-карнитин вводился перорально, в ходе других 2 исследований [10, 11] — последовательно внутримышечно и перорально. Продолжительность периода наблюдения варьировала от 14 дней до одного года.Результаты оценки качества представлены на рисунке 1 и в таблице 2. Только 1 исследование [10] оказалось лишено всех вариантов смещения за исключением того смещения, о котором в нем сообщалось. Что касается других исследований [9, 11], то по ним остались вопросы относительно смещения отбора, смещения оценки, смещения обнаружения и селективного смещения.
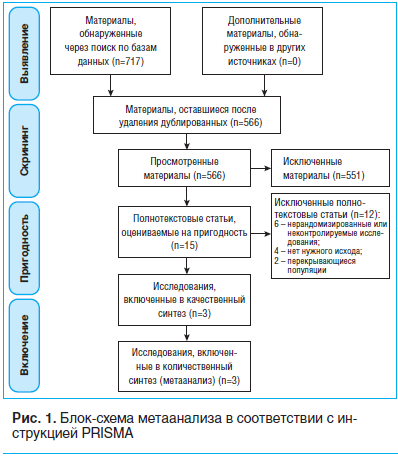
Влияние ацетил-L-карнитина на болевой синдром
Во всех 4 исследованиях [9–11] влияние ацетил-L-карнитина на болевой синдром оценивали по ВАШ. Несмотря на отсутствие статистически достоверной гетерогенности исследований, для анализа была использована модель со случайными эффектами, поскольку популяции испытуемых были разными. Совокупные результаты свидетельствуют о том, что ацетил-L-карнитин уменьшает болевой синдром по сравнению с плацебо, причем разница статистически достоверна (MD по ВАШ 1,20; 95% ДИ 0,68–1,72; P<0,00001; см. табл. 2). У пациентов, получавших ацетил-L-карнитин, отмечено гораздо более выраженное уменьшение суммы баллов по ВАШ по сравнению с пациентами, получавшими плацебо. Представленные данные демонстрируют изменение суммы баллов по ВАШ в сравнении с исходным значением.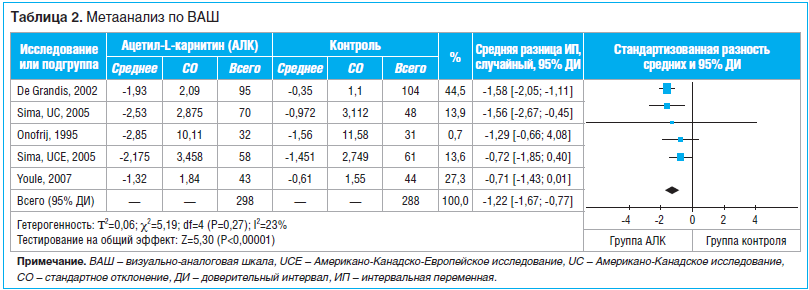
Анализ по подгруппам осуществляли путем РКИ в зависимости от генеза периферической нейропатии (диабетическая или недиабетическая). В 3 исследованиях [9, 10] участвовали пациенты с диабетической периферической нейропатией, в 1 исследовании [11] — пациенты с недиабетической периферической нейропатией. В подгруппе с диабетом не обнаружено достоверной гетерогенности исследований (I2=0%, P=0,38), в связи с чем была выбрана модель с фиксированными эффектами. Результаты анализа (табл. 3) свидетельствуют о том, что у пациентов с диабетом, получавших ацетил-L-карнитин, сумма баллов по ВАШ достоверно уменьшилась по сравнению с суммой баллов у пациентов из группы плацебо (MD -1,47; 95% ДИ -1,87; 1,06, P<0,00001). У пациентов без диабета отмечено менее выраженное уменьшение суммы баллов по ВАШ (MD -0,71; 95% ДИ -1,43; -0,01, P=0,05). Анализ проводился на основании диабетического или недиабетического генеза периферической нейропатической боли. У пациентов с диабетом сумма баллов по ВАШ была существенно меньше.
Также был проведен анализ по подгруппам в зависимости от способа введения ацетил-L-карнитина. В ходе 2 РКИ [10, 11] ацетил-L-карнитин вводили последовательно внутримышечно и перорально, в ходе 2 других [9] — только перорально. Влияние способа введения на сумму баллов по ВАШ оказалось одинаковым (MD 1,19; 95% ДИ 0,34–2,04; P=0,006 и MD 1,15; 95% ДИ 0,33–1,96; P=0,006).
Побочные явления
Между группами лечения не было выявлено статистически достоверной разницы по частоте встречаемости побочных эффектов (табл. 4).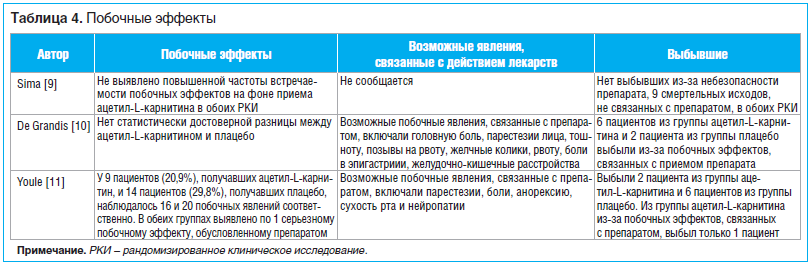
Обсуждение результатов
Периферической нейропатической боли придается особое значение в силу того, что она доставляет пациентам страдания, оказывая существенное влияние на качество жизни [12]. Одной из основных причин этого болевого синдрома является сахарный диабет. Примерно треть пациентов с сахарным диабетом испытывают нейропатические боли [13]. Хотя ацетил-L-карнитин часто назначают при периферической нейропатической боли, этот препарат не упоминается в большинстве современных руководств по лечению болевого синдрома на фоне диабетической нейропатии [14]. Мы не встречали среди научных публикаций ни одного систематического обзора, в котором рассматривалось бы влияние ацетил-L-карнитина на периферическую нейропатическую боль. Учитывая это, мы отобрали и проанализировали все значимые РКИ и выяснили, что ацетил-L-карнитин эффективно и безопасно облегчает болевой синдром при периферической нейропатии.Ацетил-L-карнитин необходим для метаболизма жирных кислот в митохондриях. Он способен повышать болевой порог за счет активации холинергических влияний [15], что, как считают, связано с экспрессией гена GRM2 [16]. Дефицит карнитина приводит к подавлению выработки энергии вследствие нарушения деградации жирных кислот [17] и, по сообщениям, ассоциирован с развитием сахарного диабета и его осложнений [18]. У пациентов с диабетической ретинопатией, диабетической нейропатией и сахарным диабетом в сочетании с гиперлипидемией существенно снижен уровень общего и свободного карнитина по сравнению с пациентами с диабетом без осложнений или сопутствующих заболеваний. Результаты ряда обсервационных исследованай свидетельствуют о явном облегчении симтоматики после назначения ацетил-L-карнитина пациентам с периферической нейропатической болью [19–21].
Как было продемонстрировано в ходе нашего метаанализа, ацетил-L-карнитин статистически достоверно уменьшает сумму баллов по ВАШ. И хотя подсчет суммы баллов по этой шкале субъективен, доказано, что ВАШ — это новый достоверный способ оценки симптоматики при периферической нейропатической боли, т. е. таким больным можно помочь путем назначения ацетил-L-карнитина. Результаты другого исследования [21], в котором использовали модифицированную краткую форму опросника боли Макгилла, свидетельствуют о значительном уменьшении болевого синдрома через 3 нед. после начала лечения ацетил-L-карнитином по сравнению с исходным уровнем. В ходе ряда других исследований [10, 21–23] в группах получавших ацетил-L-карнитин и плацебо сравнивали данные электромиографии — стандартного исследования при периферической нейропатической боли [14]. Данные электромиографии позволяют говорить о существенном повышении скорости проведения возбуждения по чувствительным и двигательным нервам на фоне лечения ацетил-L-карнитином. Абстрагируясь от периферической нейропатической боли, упомянем, что корешковую боль можно облегчить с помощью ацетил-L-карнитина [24, 25].
Согласно результатам анализа по подгруппам, пациенты с периферической нейропатической болью на фоне сахарного диабета, по-видимому, лучше реагируют на ацетил-L-карнитин, чем пациенты с болевым синдромом иного генеза, что соотносится с выводами последних систематических обзоров [26, 27]. Так, результаты одного из обзоров по диабетической нейропатии [26], который включал 2 РКИ [10, 28], свидетельствуют о том, что ацетил-L-карнитин облегчает болевой синдром при нейропатии. Впрочем, результаты другого обзора, по ВИЧ-ассоциированной нейропатии, который включал 1 РКИ [11], не демонстрируют превосходства ацетил-L-карнитина перед плацебо. Эту разницу можно объяснить восстановлением уровня карнитина у пациентов с периферической нейропатической болью диабетического генеза. Поскольку в обзоре ВИЧ-ассоциированной нейропатии [11] речь шла только об 1 РКИ, неэффективность ацетил-L-карнитина также может быть связана с ограничениями самого исследования, такими как низкая доза препарата и короткий период наблюдения. Как бы то ни было, выводы неоднозначны из-за ограниченного объема данных. Результаты другого анализа по подгруппам указывают на то, что пероральный прием ацетил-L-карнитина оказывает тот же эффект, что и последовательное применение (внутримышечное и пероральное), но пероральный прием удобнее.
Вопрос об эффективной дозе ацетил-L-карнитина пока остается открытым. Однако результаты исследований, включенных нами в метаобзор, демонстрируют больший эффект от дозировки более 2000 мг/день [9, 10], в то время как при дозе менее 1500 мг/день суммы баллов по шкале ВАШ (величина Р неизвестна) уменьшается не столь выраженно [9]. Необходимы новые исследования для подбора дозы ацетил-L-карнитина.
Поскольку химическая структура ацетил-L-карнитина идентична незаменимым компонентам организма, его введение не должно причинять вреда. Полученные нами результаты свидетельствуют о том, что ацетил-L-карнитин безопасен и не вызывает никаких побочных эффектов.
Приведенный метаанализ имеет некоторые ограничения, в частности непродолжительный период наблюдения.
Выводы
Таким образом, современные данные позволяют предполагать, что ацетил-L-карнитин является эффективным и безопасным средством лечения периферической нейропатической боли, особенно на фоне сахарного диабета. Рекомендован пероральный прием ацетил-L-карнитина, поскольку при сопоставимой эффекивности он более удобный. Впрочем, необходимы новые исследования с бóльшим объемом выборок, разнообразием популяций испытуемых и более продолжительным периодом наблюдения.Реферат подготовлен редакцией «РМЖ» по материалам статьи: Li S., Li Q., Li Y. et al. Acetyl-L-Carnitine in the Treatment of Peripheral Neuropathic Pain: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. PLoS One. 2015;10(3):e0119479. DOI: 10.1371/journal.pone.0119479.
Литература
1. Radat F., Margot-Duclot A., Attal N. Psychiatric co-morbidities in patients with chronic peripheral neuropathic pain: a multicentre cohort study. Eur J Pain. 2013;17:1547–1557. DOI: 10.1002/j.1532-2149. 2013.00334.x.
2. Brix Finnerup N., Sindrup S.H., Jensen T.S. Management of painful neuropathies. Handb Clin Neurol. 2013;115:279–290. DOI: 10.1016/B978-0-444-52902-2.00017-5.
3. Singh R., Kishore L., Kaur N. Diabetic peripheral neuropathy: current perspective and future directions. Pharmacol Res. 2014;80:21–35. DOI: 10.1016/j.phrs.2013.12.005.
4. Chiechio S., Copani A., Nicoletti F., Gereau R.W. 4th. L-acetylcarnitine: a proposed therapeutic agent for painful peripheral neuropathies. Curr Neuropharmacol. 2006;4:233–237.
5. Higgins J.P.T., Green S. (eds). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. (Electronic resource). URL: http://handbook-5–1.cochrane.org/ (access date: 09.04.2019).
6. Higgins J.P.T., Thompson S.G., Deeks J.J., Altman D.G. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557–560.
7. Der Simonian R., Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177–188.
8. Mantel N., Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst. 1959;22:719–748.
9. Sima A.A., Calvani M., Mehra M., Amato A. Acetyl-L-carnitine improves pain, nerve regeneration, and vibratory perception in patients with chronic diabetic neuropathy: an analysis of two randomized placebocontrolled trials. Diabetes Care. 2005;28:89–94.
10. De Grandis D., Minardi C. Acetyl-L-carnitine (levacecarnine) in the treatment of diabetic neuropathy. A long-term, randomised, double-blind, placebo-controlled study. Drugs R D. 2002;3:223–231.
11. Youle M., Osio M. A double-blind, parallel-group, placebo-controlled, multicentre study of acetyl L-carnitine in the symptomatic treatment of antiretroviral toxic neuropathy in patients with HIV-1 infection. HIV Med. 2007;8:241–250.
12. Jensen M.P., Chodroff M.J., Dworkin R.H. The impact of neuropathic pain on health-related quality of life: review and implications. Neurology. 2007;68:1178–1182.
13. Abbott C.A., Malik R.A., van Ross E.R. et al. Prevalence and characteristics of painful diabetic neuropathy in a large community-based diabetic population in the U.K. Diabetes Care. 2011;34:2220–2224. DOI: 10.2337/dc11-1108.
14. Bril V., England J., Franklin G.M. et al. Evidence-based guideline: Treatment of painful diabetic neuropathy: report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation. Neurology. 2011;76:1758–1765. DOI: 10.1212/WNL. 0b013e3182166ebe.
15. Curti D., Dagani F., Galmozzi M.R., Marzatico F. Effect of aging and acetyl-L-carnitine on energetic and cholinergic metabolism in rat brain regions. Mech Ageing Dev. 1989;47:39–45.
16. Onofrj M., Ciccocioppo F., Varanese S. et al. Acetyl-L-carnitine: from a biological curiosity to a drug for the peripheral nervous system and beyond. Expert Rev Neurother. 2013;13:925–936. DOI: 10.1586/14737175.2013.814930.
17. Fritz I.B. Action of carnitine on long chain fatty acid oxidation by liver. Am J Physiol. 1959;197:297–304.
18. Tamamogullari N., Silig Y., Icagasioglu S., Atalay A. Carnitine deficiency in diabetes mellitus complications. J Diabetes Complications. 1999;13:251–253.
19. Bianchi G., Vitali G., Caraceni A. et al. Symptomatic and neurophysiological responses of paclitaxel-or cisplatin-induced neuropathy to oral acetyl-L-carnitine. Eur J Cancer. 2005;41:1746–1750.
20. Hur J., Sullivan K.A., Callaghan B.C. et al. Identification of factors associated with sural nerve regeneration and degeneration in diabetic neuropathy. Diabetes Care. 2013;36:4043–4049. DOI: 10.2337/dc12-2530.
21. Osio M., Muscia F., Zampini L. et al. Acetyl-l-carnitine in the treatment of painful antiretroviral toxic neuropathy in human immunodeficiency virus patients: an open label study. J Peripher Nerv Syst. 2006;11:72–76.
22. Ulvi H., Aygul R., Demir R. Effect of L-carnitine on diabetic neuropathy and ventricular dispersion in patients with diabetes mellitus. Turk J Med Sci. 2010;40(2):169–175.
23. Mondal S., Choudhury K.B., Sharma S. et al. Comparative study among glutamine, acetyl-L-carnitine, vitamin-E and methylcobalamine for treatment of paclitaxel-induced peripheral neuropathy. Clin Cancer Investig J. 2014;3:213–219.
24. Onofrj M., Fulgente T., Melchionda D. et al. L-acetylcarnitine as a new therapeutic approach for peripheral neuropathies with pain. Int J Clin Pharmacol Res. 1995;15:9–15.
25. Memeo A., Loiero M. Thioctic acid and acetyl-L-carnitine in the treatment of sciatic pain caused by a herniated disc: a randomized, double-blind, comparative study. Clin Drug Investig. 2008;28:495–500.
26. Pittler M.H., Ernst E. Complementary therapies for neuropathic and neuralgic pain: systematic review. Clin J Pain. 2008;24:731–733. DOI: 10.1097/AJP.0b013e3181759231.
27. Phillips T.J., Cherry C.L., Cox S. et al. Pharmacological treatment of painful HIV-associated sensory neuropathy: a systematic review and meta-analysis of randomised controlled trials. PLoS One. 2010;5:e14433. DOI: 10.1371/journal.pone.0014433.
28. Quatraro A., Roca P., Donzella C. et al. Acetyl-L-carnitine for symptomatic diabetic neuropathy. Diabetologia. 1995;38:123.
2. Brix Finnerup N., Sindrup S.H., Jensen T.S. Management of painful neuropathies. Handb Clin Neurol. 2013;115:279–290. DOI: 10.1016/B978-0-444-52902-2.00017-5.
3. Singh R., Kishore L., Kaur N. Diabetic peripheral neuropathy: current perspective and future directions. Pharmacol Res. 2014;80:21–35. DOI: 10.1016/j.phrs.2013.12.005.
4. Chiechio S., Copani A., Nicoletti F., Gereau R.W. 4th. L-acetylcarnitine: a proposed therapeutic agent for painful peripheral neuropathies. Curr Neuropharmacol. 2006;4:233–237.
5. Higgins J.P.T., Green S. (eds). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. (Electronic resource). URL: http://handbook-5–1.cochrane.org/ (access date: 09.04.2019).
6. Higgins J.P.T., Thompson S.G., Deeks J.J., Altman D.G. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557–560.
7. Der Simonian R., Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177–188.
8. Mantel N., Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst. 1959;22:719–748.
9. Sima A.A., Calvani M., Mehra M., Amato A. Acetyl-L-carnitine improves pain, nerve regeneration, and vibratory perception in patients with chronic diabetic neuropathy: an analysis of two randomized placebocontrolled trials. Diabetes Care. 2005;28:89–94.
10. De Grandis D., Minardi C. Acetyl-L-carnitine (levacecarnine) in the treatment of diabetic neuropathy. A long-term, randomised, double-blind, placebo-controlled study. Drugs R D. 2002;3:223–231.
11. Youle M., Osio M. A double-blind, parallel-group, placebo-controlled, multicentre study of acetyl L-carnitine in the symptomatic treatment of antiretroviral toxic neuropathy in patients with HIV-1 infection. HIV Med. 2007;8:241–250.
12. Jensen M.P., Chodroff M.J., Dworkin R.H. The impact of neuropathic pain on health-related quality of life: review and implications. Neurology. 2007;68:1178–1182.
13. Abbott C.A., Malik R.A., van Ross E.R. et al. Prevalence and characteristics of painful diabetic neuropathy in a large community-based diabetic population in the U.K. Diabetes Care. 2011;34:2220–2224. DOI: 10.2337/dc11-1108.
14. Bril V., England J., Franklin G.M. et al. Evidence-based guideline: Treatment of painful diabetic neuropathy: report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation. Neurology. 2011;76:1758–1765. DOI: 10.1212/WNL. 0b013e3182166ebe.
15. Curti D., Dagani F., Galmozzi M.R., Marzatico F. Effect of aging and acetyl-L-carnitine on energetic and cholinergic metabolism in rat brain regions. Mech Ageing Dev. 1989;47:39–45.
16. Onofrj M., Ciccocioppo F., Varanese S. et al. Acetyl-L-carnitine: from a biological curiosity to a drug for the peripheral nervous system and beyond. Expert Rev Neurother. 2013;13:925–936. DOI: 10.1586/14737175.2013.814930.
17. Fritz I.B. Action of carnitine on long chain fatty acid oxidation by liver. Am J Physiol. 1959;197:297–304.
18. Tamamogullari N., Silig Y., Icagasioglu S., Atalay A. Carnitine deficiency in diabetes mellitus complications. J Diabetes Complications. 1999;13:251–253.
19. Bianchi G., Vitali G., Caraceni A. et al. Symptomatic and neurophysiological responses of paclitaxel-or cisplatin-induced neuropathy to oral acetyl-L-carnitine. Eur J Cancer. 2005;41:1746–1750.
20. Hur J., Sullivan K.A., Callaghan B.C. et al. Identification of factors associated with sural nerve regeneration and degeneration in diabetic neuropathy. Diabetes Care. 2013;36:4043–4049. DOI: 10.2337/dc12-2530.
21. Osio M., Muscia F., Zampini L. et al. Acetyl-l-carnitine in the treatment of painful antiretroviral toxic neuropathy in human immunodeficiency virus patients: an open label study. J Peripher Nerv Syst. 2006;11:72–76.
22. Ulvi H., Aygul R., Demir R. Effect of L-carnitine on diabetic neuropathy and ventricular dispersion in patients with diabetes mellitus. Turk J Med Sci. 2010;40(2):169–175.
23. Mondal S., Choudhury K.B., Sharma S. et al. Comparative study among glutamine, acetyl-L-carnitine, vitamin-E and methylcobalamine for treatment of paclitaxel-induced peripheral neuropathy. Clin Cancer Investig J. 2014;3:213–219.
24. Onofrj M., Fulgente T., Melchionda D. et al. L-acetylcarnitine as a new therapeutic approach for peripheral neuropathies with pain. Int J Clin Pharmacol Res. 1995;15:9–15.
25. Memeo A., Loiero M. Thioctic acid and acetyl-L-carnitine in the treatment of sciatic pain caused by a herniated disc: a randomized, double-blind, comparative study. Clin Drug Investig. 2008;28:495–500.
26. Pittler M.H., Ernst E. Complementary therapies for neuropathic and neuralgic pain: systematic review. Clin J Pain. 2008;24:731–733. DOI: 10.1097/AJP.0b013e3181759231.
27. Phillips T.J., Cherry C.L., Cox S. et al. Pharmacological treatment of painful HIV-associated sensory neuropathy: a systematic review and meta-analysis of randomised controlled trials. PLoS One. 2010;5:e14433. DOI: 10.1371/journal.pone.0014433.
28. Quatraro A., Roca P., Donzella C. et al. Acetyl-L-carnitine for symptomatic diabetic neuropathy. Diabetologia. 1995;38:123.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
