Клинические возможности комплексного подхода в лечении рецидива хронической боли в коленных суставах у пациентов с коморбидными заболеваниями
Рубрика:
Неврология
Цель исследования: оценить результаты комплексного подхода — медикаментозного (интермиттирующая схема парентерального введения хондроитина сульфата (ХС) и глюкозамина сульфата (ГС)) и немедикаментозного (ежедневная ходьба и комплекс физических упражнений) — у пациентов с рецидивом хронической боли в коленных суставах.
Материал и методы: исследование проведено как открытое проспективное сравнительное IV фазы. В скрининге участвовали 118 больных с хронической болью в спине и суставах. В исследование были включены 70 пациентов с остеоартритом коленных суставов II–III рентгенологической стадии по Kellgren — Lowrence и интенсивностью боли в коленных суставах >40 мм по визуальной аналоговой шкале, рандомизированные на 2 равные группы методом случайных чисел. Пациентам 1-й группы (n=35) была назначена интермиттирующая схема парентерального введения ХС (Хондрогард®) по 2,0 мл (200 мг) в/м № 20 через день и ГС (Сустагард® Артро) по 3,0 мл (200 мг/2,0 мл действующего вещества и 1,0 мл растворителя) в/м № 20 через день, а также индивидуальный комплекс упражнений для коленного сустава. В немедикаментозную программу была включена ежедневная ходьба с индивидуальной интенсивностью (5000–12 000 шагов в сутки), согласованная консилиумом специалистов. Пациентам 2-й группы (контроль, n=35) была назначена стандартная терапия нестероидными противовоспалительными препаратами (НПВП).
Результаты исследования: у пациентов 1-й группы при использовании комплексной программы (интермиттирующей схемы парентерального введения ХС и ГС в совокупности с ежедневной ходьбой и индивидуальным комплексом физических упражнений) наблюдалось более значимое уменьшение боли в коленных суставах (p<0,05) в сравнении с пациентами 2-й группы — на 25,7 и 16,5% соответственно.
Выводы: комплексное лечение пациентов с рецидивом хронической боли в коленных суставах оказалось высокоэффективным и безопасным, что позволяет рекомендовать его как альтернативу терапии НПВП у коморбидных пациентов с ограничениями или противопоказаниями к последним.
Ключевые слова: остеоартрит, рецидив хронической боли, комплексный подход, Хондрогард, Сустагард Артро, немедикаментозная терапия.
Материал и методы: исследование проведено как открытое проспективное сравнительное IV фазы. В скрининге участвовали 118 больных с хронической болью в спине и суставах. В исследование были включены 70 пациентов с остеоартритом коленных суставов II–III рентгенологической стадии по Kellgren — Lowrence и интенсивностью боли в коленных суставах >40 мм по визуальной аналоговой шкале, рандомизированные на 2 равные группы методом случайных чисел. Пациентам 1-й группы (n=35) была назначена интермиттирующая схема парентерального введения ХС (Хондрогард®) по 2,0 мл (200 мг) в/м № 20 через день и ГС (Сустагард® Артро) по 3,0 мл (200 мг/2,0 мл действующего вещества и 1,0 мл растворителя) в/м № 20 через день, а также индивидуальный комплекс упражнений для коленного сустава. В немедикаментозную программу была включена ежедневная ходьба с индивидуальной интенсивностью (5000–12 000 шагов в сутки), согласованная консилиумом специалистов. Пациентам 2-й группы (контроль, n=35) была назначена стандартная терапия нестероидными противовоспалительными препаратами (НПВП).
Результаты исследования: у пациентов 1-й группы при использовании комплексной программы (интермиттирующей схемы парентерального введения ХС и ГС в совокупности с ежедневной ходьбой и индивидуальным комплексом физических упражнений) наблюдалось более значимое уменьшение боли в коленных суставах (p<0,05) в сравнении с пациентами 2-й группы — на 25,7 и 16,5% соответственно.
Выводы: комплексное лечение пациентов с рецидивом хронической боли в коленных суставах оказалось высокоэффективным и безопасным, что позволяет рекомендовать его как альтернативу терапии НПВП у коморбидных пациентов с ограничениями или противопоказаниями к последним.
Ключевые слова: остеоартрит, рецидив хронической боли, комплексный подход, Хондрогард, Сустагард Артро, немедикаментозная терапия.
A.V. Naumov, O.N. Tkacheva, N.O. Khovasova
Pirogov Russian National Research Medical University, Moscow
Aim: to evaluate the comprehensive approach results: with medication (an intermittent regimen with CS and GS parenteral administration) and without (daily walking and an exercise set) in patients with chronic knee pain relapse.Patients and methods: an open prospective comparative phase IV study was conducted. 118 patients with chronic back and joint pain underwent the screening. The study included 70 patients with the knee osteoarthritis radiograph of grade 2–3 according to Kellgren–Lawrence (KL) classification and the knee pain intensity >40 mm determined by visual analog scale (VAS). These patients were randomized into two equal groups by random numbers. Group 1 (n=35) was prescribed an intermittent regimen with parenteral administration of: CS № 20 (Chondroguard®) 2.0 ml (200 mg) i.m. on alternate days, GS № 20 (Sustaguard® Artro) 3.0 ml i.m. (200 mg/2.0 ml of active substance and 1.0 ml of solvent) on alternate days and an individual exercises set for the knee joint. The non-medication regimen included daily individual walking (5000–12 000 steps per day), agreed by the case conference. Group 2 (control, n=35) was prescribed standard therapy with NSAIDs.
Results: In group 1, which used the comprehensive program (the intermittent regimen with CS+GS parenteral administration in conjunction with daily walking and the individual exercise set), there was a more significant knee pain reduction (p<0.05) in comparison with group 2 — by 25.7% and 16.5%, respectively.
Conclusion: comprehensive treatment of patients with chronic knee pain relapse has proved to be highly effective and safe, which allows to recommend it as an alternative to the therapy with NSAIDs in patients with comorbid diseases, who have restrictions or contraindications for the latter.
Keywords: osteoarthritis, chronic pain relapse, comprehensive approach, Chondroguard, Sustaguard Artro, non-medication therapy.
For citation: Naumov A.V., Tkacheva O.N., Khovasova N.O. Clinical possibilities of a comprehensive approach in the chronic knee pain relapse treatment in patients with comorbid diseases. RMJ. Medical Review. 2019;4(II):36–42.
В статье представлены результаты оригинального исследования, посвященного оценке результатов комплексного подхода — медикаментозного (интермиттирующая схема парентерального введения хондроитина сульфата и глюкозамина сульфата) и немедикаментозного (ежедневная ходьба и комплекс физических упражнений) — у пациентов с рецидивом хронической боли в коленных суставах.
Актуальность проблемы
Важной тенденцией клинической медицины в XXI в. стала глобальная распространенность коморбидной патологии. Результаты масштабного исследования были опубликованы в журнале The Lancet в 2015 г. Группа ученых во главе с Тео Вос из университета Вашингтона (Сиэтл) для исследования глобального уровня заболеваний в мире проанализировала источники информации о проблемах здоровья за 1990–2013 гг. Полученные данные продемонстрировали значительное увеличение доли коморбидных больных, а также увеличение количества заболеваний, приходящихся на одного больного (индекса коморбидности). Каждый третий человек страдает пятью заболеваниями и более. Причем чем старше человек, тем индекс коморбидности выше, а чем выше индекс коморбидности, тем хуже прогноз. Так, при 3–4 хронических заболеваниях риск смерти составляет 25%, а при 5 и более — 80%.Сегодня коморбидность не может рассматриваться только как некая суммация нозологических единиц. Множество патофизиологических процессов, одновременно протекающих в организме, обусловливает развитие определенного набора заболеваний, которые взаимно отягощают друг друга, что приводит к снижению качества жизни либо к ее сокращению. Подобный подход отражен в обзоре R. Yancik (рис. 1) [1].
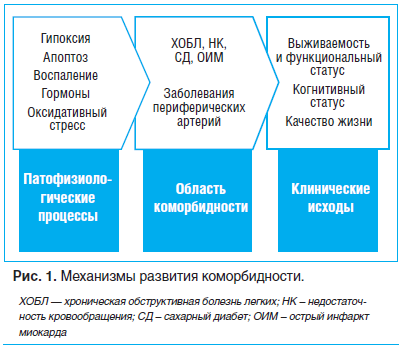
Такой взгляд на развитие коморбидности позволяет объяснить столь частое и типичное сочетание некоторых заболеваний, например кардиоваскулярных болезней и болезней костно-суставной системы, в частности остеоартрита (ОА). Так, исследование, проведенное в Южной Корее, показало, что распространенность ОА коленного сустава у пациентов с артериальной гипертензией (АГ) была значительно выше, чем у пациентов без АГ (ОШ=1,26, 95% ДИ 1,08–1,48). Такая же закономерность прослеживалась и у пациентов с сахарным диабетом (СД) 2 типа (ОШ=1,19, 95% ДИ 1,00–1,41) [2].
Центральным патогенетическим звеном в развитии и прогрессировании как ОА, так и кардиоваскулярных заболеваний является системное воспаление. В ответ на эндотелиальную дисфункцию, нестабильность атеросклеротических бляшек, гипергликемию, повышение артериального давления (АД) происходит избыточный синтез провоспалительных цитокинов. Провоспалительные цитокины активируют рецепторы на хондроците, что, в свою очередь, приводит к синтезу металлопротеиназ, ИЛ-1, 6, 8, ФНО-a, молекул оксида азота и в итоге — к деградации хряща, апоптозу хондроцитов и новому синтезу провоспалительных медиаторов. Исследователи M.Y. Lee et al. выделили трансмембранный белок Z39Ig из атеросклеротической бляшки сонной артерии, а также синовиальной жидкости сустава у пациентов с ОА, что также подтверждает единство механизмов повреждений [3]. Было показано, что у пациентов с СД 2 типа хондроциты при гипергликемии не способны регулировать перенос глюкозы глюкозным транспортером типа 1 (GLUT-1). Нарушение регуляции GLUT-1, в свою очередь, ведет к дегенерации хондроцитов, тем самым ускоряя прогрессирование ОА у пациентов с СД 2 типа [4].
Кроме того, синовиальная оболочка способна депонировать липопротеины низкой плотности, так же как и эндотелий сосудов, что инициирует развитие воспаления и боли — значимого клинического симптома, который, с одной стороны, выполняет защитную функцию, свидетельствуя о неблагополучии. С другой стороны, при длительном сохранении боли защитный механизм переходит в патологический процесс.
Боль — особенно неблагоприятный фактор для коморбидных пациентов с сердечно-сосудистыми заболеваниями (ССЗ). Известно, что хроническая боль активирует симпатоадреналовые реакции. Клинически это проявляется увеличением частоты сердечных сокращений, повышением АД. Если лечение болевого синдрома не будет адекватным и своевременным, то возрастет риск развития кардиоваскулярных осложнений. Данные, опубликованные в Европейском журнале сердца, демонстрируют увеличение рисков развития инфаркта миокарда с ОШ 3,09, 95% ДИ (2,69–3,54); инсульта 2,47 (2,22–2,75); хронической сердечной недостаточности (ХСН) 2,40 (2,06–2,79) и кардиоваскулярной летальности 1,71 (1,49–1,98) у пациентов с ОА [5].
Безусловно, при обсуждении купирования боли в суставах препаратами выбора являются нестероидные противовоспалительные препараты (НПВП). Однако в лечении болевого синдрома у коморбдных пациентов с ССЗ не все так однозначно, и прежде всего потому, что все НПВП за счет своего действия на ЦОГ-1 и ЦОГ-2 опосредованно изменяют соотношение антитромбогенных и протромбогенных факторов в сторону увеличения последних, тем самым повышая кардиоваскулярный риск. Например, риск сердечно-сосудистых осложнений составляет 1,09 (1,02–1,16) для напроксена, 1,17 (1,08–1,27) для целекоксиба, 1,2 (1,07–1,33) для мелоксикама и 2,05 (1,45–2,88) для эторикоксиба [6]. Еще больше кардиоваскулярный риск возрастает при совместном приеме НПВП и антиагрегантов или антикоагулянтов. Так, при добавлении НПВП к ацетилсалициловой кислоте риск сердечно-сосудистых осложнений возрастает на 46%, к клопидогрелю — на 75%. Наиболее высокий риск отмечен при применении комбинации оральных антикоагулянтов (ОАК) и диклофенака. На сегодняшний день применение ОАК, двойной или тройной антиагрегантной терапии, а также анамнестические данные о перенесенном ранее оперативном вмешательстве на крупных артериях являются противопоказаниями к применению НПВП. С другой стороны, хорошо известна гастро-, гепато- и нефротоксичность НПВП. Все это крайне сужает возможности применения НПВП у пациентов с ОА и коморбидными ССЗ.
Возникает вопрос: как лечить рецидив болевого синдрома при ОА у коморбидного пациента? Европейские, американские и российские рекомендации единогласно говорят о необходимости использования немедикаментозных методов, включающих аэробику, упражнения на растяжку, бальнеотерапию, лечебную ходьбу. При этом разные коллективы ученых показали, что аэробика имеет более высокий эффект обезболивания по сравнению с НПВП (0,67 и 0,29 соответственно) [7]. Показательны данные Кохрейновских систематических обзоров 2015 г.: уменьшение болевого синдрома по сравнению с исходным уровнем составляет 10% при медикаментозной терапии, тогда как на фоне лечебной физкультуры — 12% [8]. Этот эффект имеет патогенетическое обоснование. Как известно, суставной хрящ в своем строении лишен кровеносных сосудов, и весь метаболизм осуществляется посредством циркулирующей синовиальной жидкости. Чем активнее сустав, тем лучше циркуляция жидкости, а значит, и метаболизм в хряще. Таким образом, поступление питательных веществ и лекарственных препаратов в хрящевую ткань прямо пропорционально объему двигательной активности суставов, достигаемой ходьбой в объеме не менее 10 тыс. шагов в день и регулярными физическими упражнениями.
Еще одну интервенцию, которую надо обсуждать при ОА, особенно у пациентов, имеющих противопоказания к НПВП, — это назначение симптоматических медленно действующих препаратов. M.C. Hochberg в проведенном им исследовании показал сопоставимую с эффектом НПВП анальгетическую эффективность комбинированного применения хондроитина сульфата (ХС) и глюкозамина сульфата (ГС) в течение 6 мес. [9]. Чуть позже, в 2015 г., был опубликован систематический Кохрейновский обзор, продемонстрировавший превосходство комбинации ХС и ГС над плацебо по влиянию на боль в суставах при ОА [10]. V. Calamia et al. (2010) в исследовании, проведенном на культуре хондроцитов, показали синергетический эффект ХС и ГС: определенные белки (HSPB1, DPYL2, PGAM1, TAGL2), отвечающие за передачу сигнала, энергетический потенциал клетки, синтез, окислительно-восстановительные и обменные процессы в хондроцитах, синтезируются только при совместном использовании ХС и ГС [11].
Таким образом, совместное применение немедикаментозных методов и комбинации ХС и ГС у пациентов с коморбидными кардиоваскулярными заболеваниями имеет патогенетическое обоснование [12–15]. Это и явилось поводом для проведения исследования.
Цель исследования: оценить результаты комплексного подхода — медикаментозного (интермиттирующая схема парентерального введения ХС и ГС) и немедикаментозного (ежедневная ходьба и комплекс физических упражнений) — у пациентов с рецидивом хронической боли в коленных суставах.
Материал и методы
Исследование проведено как открытое проспективное сравнительное IV фазы. Из участвовавших в скрининге 118 человек с хронической болью в спине и суставах в исследование были отобраны 70 больных, которые соответствовали критериям включения и исключения. Они были рандомизированы на 2 равные группы методом случайных чисел.Критерии включения: ОА коленных суставов II–III рентгенологической стадии по Kellgren — Lowrence; интенсивность боли в коленных суставах по визуальной аналоговой шкале (ВАШ) >40 мм; готовность отказаться от приема иных обезболивающих препаратов, кроме назначенных в исследовании; согласие следовать требованиям протокола в течение всего периода исследования, в т. ч. быть доступными для консультаций и наблюдения в течение всего периода исследования начиная с момента включения в него; подписание информированного согласия на участие в исследовании.
Критерии исключения: отчетливый невропатический и/или психогенный компонент болевого синдрома; онкологические заболевания любой локализации; СД 1 типа; хроническая болезнь почек с выраженной почечной недостаточностью (уровень креатинина ≥180 ммоль/л, скорость клубочковой фильтрации <30 мл/мин); тяжелые заболевания печени; болезни крови; злоупотребление алкоголем (в среднем ≥20 г чистого этанола в день); психические заболевания; вторичный артроз (инфекционный, подагра); гиперурикемия, которая не объясняется метаболическим синдромом; асептический некроз мыщелков бедренной и большеберцовой костей; операции на коленном суставе или позвоночнике в анамнезе; внутрисуставное введение любых препаратов в течение 6 нед. до начала исследования.
Для изучения эффективности и безопасности комплексного применения медикаментозной (интермиттирующая схема парентерального введения ХС и ГС) и немедикаментозной (ежедневная ходьба и комплекс физических упражнений) терапии у пациентов с рецидивом хронической боли в коленных суставах были определены следующие первичные и вторичные точки оценки.
Первичные точки: доля пациентов с ответом на терапию в виде уменьшения боли по общепринятой стандартной оценке (уменьшение боли по ВАШ на ≥50%); оценка динамики боли по ВАШ; сроки наступления обезболивания, удовлетворяющего пациента.
Вторичные точки: изменение качества жизни; влияние на основные биохимические параметры (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), глюкоза крови, креатинин крови), динамика уровня С-реактивного белка (СРБ) в 1-й группе, частота нежелательных явлений (НЯ).
Пациенты были разделены на 2 равные по численности группы. Пациентам 1-й группы (n=35) была назначена интермиттирующая схема парентерального введения ХС (Хондрогард®1) по 2,0 мл (200 мг) в/м № 20 через день и ГС (Сустагард® Артро2) по 3,0 мл (200 мг на 2,0 мл действующего вещества и 1,0 мл растворителя) в/м № 20 через день. Препараты вводили в режиме чередования по дням: 1, 3, 5, 7-й и т. д. — ХС; 2, 4, 6-й и т. д. — ГС. Консилиумом терапевта, реабилитолога и врача лечебной физкультуры (ЛФК) разработаны индивидуальные комплексы упражнений для коленного сустава. Первые 10 занятий проходили в клинике, далее до конца исследования упражнения выполнялись под контролем инструктора ЛФК. Также в немедикаментозную программу была включена ежедневная ходьба с индивидуальной интенсивностью (от 5000 до 12 000 шагов в сутки), согласованная консилиумом специалистов. У большинства пациентов данную физическую нагрузку корректировали в зависимости от переносимости с минимумом 10 000 шагов в сутки к концу 3-й нед. терапии.
Пациентам 2-й группы (контроль, n=35) была назначена стандартная терапия НПВП, подобранными с учетом клинического и фармакологического анамнеза. Два (5,7%) пациента этой группы, имевшие противопоказания к НПВП (ОАК для профилактики тромботических осложнений при неклапанной фибрилляции предсердий), получали парацетамол в дозе до 3 г/сут. Остальным пациентам были назначены следующие НПВП: кетопрофен — 7 (35%) пациентам, лорноксикам — 8 (22,9%), диклофенак — 10 (28,6%), ибупрофен — 8 (22,9%). Дозы определяли индивидуально и титровали в зависимости от чувствительности и переносимости. Терапию НПВП и парацетамолом продолжали до достижения обезболивающего эффекта, удовлетворяющего больного, что соответствует стандартным амбулаторным стратегиям лечения обострений болевого синдрома. Для профилактики НПВП-гастропатии назначали пантопразол 20 мг/сут.
Клинические данные, характеристика болевого синдрома и тяжесть ОА больных представлены в таблице 1, из которой видно, что обе группы были сопоставимы по полу и возрасту, антропометрическим и клиническим показателям, а также по коморбидным заболеваниям.
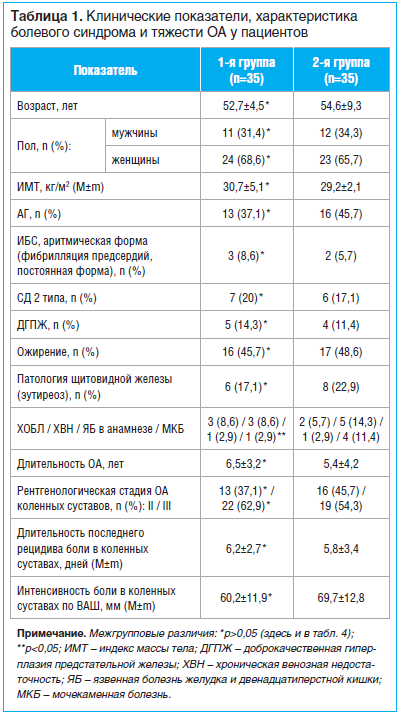
Пациенты также были сопоставимы по характеристикам болевого синдрома и тяжести ОА.
В начале исследования, на 10-й, 20-й дни, через 6 нед. и через 6 мес. от начала исследования оценивали эффективность лечения по ВАШ 100 мм; тяжесть ОА коленных суставов — по валидизированной шкале WOMAC; качество жизни — по валидизированной русскоязычной версии общего опросника EuroQol-5D.
Для анализа безопасности терапии в начале и в конце исследования были изучены уровни глюкозы в крови натощак, АЛТ, АСТ, креатинина. Кроме того, регистрировали частоту любых НЯ. У пациентов 1-й группы дополнительно изучали уровень СРБ в сыворотке крови.
База данных создана в программе Microsoft Eсxel 2011 для MacOS. Вычисляли средние значения и стандартные отклонения. Достоверность различий оценивали по критерию Стьюдента (двухпарный с неравным отклонением). Анализ данных проводили в программах Microsoft Exсel.
Результаты исследования
Все пациенты полностью закончили исследование. К 10-му дню терапии у пациентов обеих групп отмечено отчетливое улучшение. Однако, как показано в табл. 2, у пациентов 1-й группы при использовании комплексной программы (интермиттирующая схема парентерального введения ХС и ГС в совокупности с ежедневной ходьбой и индивидуальным комплексом физических упражнений) наблюдалось более значимое уменьшение боли в коленных суставах (p<0,05) в сравнении с пациентами 2-й группы — на 25,7 и 16,5% соответственно.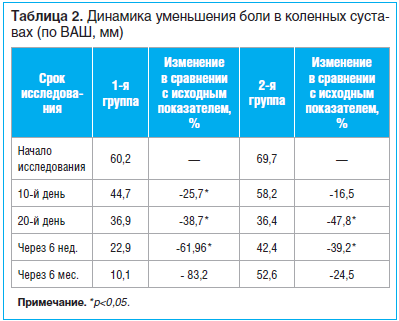
У пациентов 2-й группы НПВП отменены в среднем через 17,6±4,7 дня. Два пациента принимали парацетамол на протяжении 6 нед. исследования. К концу приема НПВП боль в суставах уменьшилась на 47,8% (p<0,05). При этом у 22 (62,9%) больных к концу лечения отмечено уменьшение боли в среднем на 56,4%, а у 13 — лишь на 39,2%. Таким образом, добиться эффективного обезболивания удалось у 62,9% пациентов 2-й группы. Однако к концу наблюдения (6 мес.) у этих пациентов отмечено недостоверное увеличение болевого синдрома в коленных суставах (рис. 2).
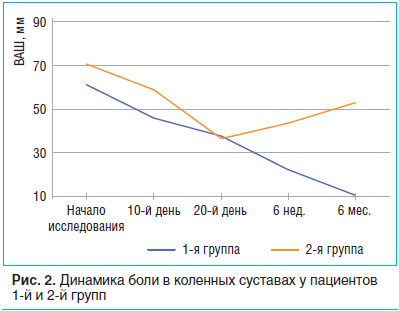
Межгрупповая разница в уменьшении боли к 6-й нед. наблюдения в коленных суставах составила 22,7% (p<0,05). Срок наступления обезболивающего эффекта, удовлетворяющего пациента, составил 23,1±3,9 дня в 1-й группе. У большинства пациентов 2-й группы НПВП отменены в среднем через 17,6±4,7 дня.
К 6-му мес. наблюдения сохранялось снижение интенсивности болевого синдрома по ВАШ: 10,1 мм — средний показатель в 1-й группе, 52,6 мм — во 2-й группе. В группе контроля 6 пациентам потребовалось возобновление приема НПВП. Полученные данные демонстрируют сохранение эффекта терапии на протяжении полугода, что позволяет рекомендовать интермиттирующую схему терапии ХС и ГС курсовыми приемами 2 р./год.
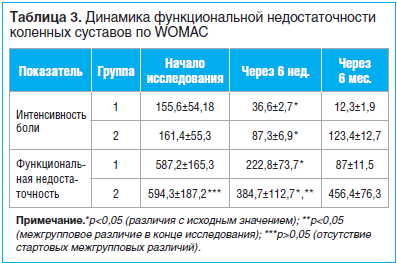
Интенсивность боли и степень функциональной недостаточности коленных суставов, оцененные по опроснику WOMAC в начале и в конце исследования, имели достоверные различия в обеих группах (табл. 3). Так, на 6-й нед. исследования в 1-й группе наблюдалось снижение интенсивности боли на 76,5% (p<0,05), во 2-й — на 45,9% (p<0,05), степень функциональной недостаточности уменьшилась на 62,1 и 35,3% соответственно (p<0,05 для обеих групп). Через 6 мес. в 1-й группе отмечалось снижение интенсивности боли на 91,9% (p<0,05), во 2-й — на 45,9% (p<0,05), степень функциональной недостаточности уменьшилась на 62,1 и 35,3% соответственно (p<0,05 для обеих групп).
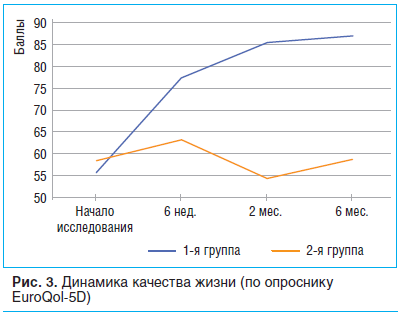
Динамика показателя качества жизни по валидизированной русскоязычной версии общего опросника EuroQol-5D показала его прирост на 39,1% к концу инъекционного курса в 1-й группе и на 8,2% — в группе контроля (p<0,05, межгрупповое различие). У пациентов 2-й группы в последующие визиты выявлено снижение этого показателя (рис. 3), тогда как у пациентов 1-й группы при последующих визитах наблюдалась положительная динамика показателя качества жизни: в конце 2-го мес. он составил 85,7±9,4, в конце 6-го мес.— 87,2±10,8 (р<0,05 по сравнению со стартом).
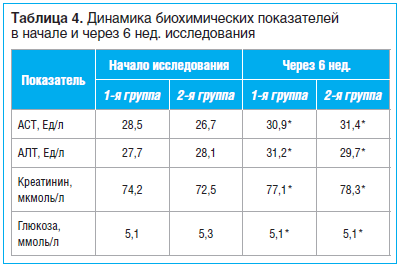
На фоне терапии лекарственными препаратами контролировались основные биохимические показатели, значимых изменений не отмечено (табл. 4). Отдельно была проанализирована динамика уровня глюкозы в крови натощак у 7 пациентов с СД 2 типа: в начале и конце исследования не отмечено достоверных изменений (6,4±0,7 и 6,2±0,4 ммоль/л соответственно). Это свидетельствует об отсутствии влияния интермиттирующей схемы ХС и ГС на развитие гипергликемии, что благоприятно для коморбидных пациентов с ОА и СД 2 типа.
Интенсивность системного воспаления на фоне проводимой терапии у пациентов 1-й группы определяли по концентрации СРБ, было отмечено ее снижение на 25,5% (p<0,05). У 11 (31,4%) пациентов этой группы стартовый уровень СРБ превышал референсные значения, и в среднем его концентрация составила 12,6±2,3 мг/л. К окончанию активной терапии концентрация СРБ у них снизилась до 4,8±3,1 мг/л (на 38,1%).
У больных 1-й группы не выявлено серьезных НЯ. Три (8,6%) пациента отметили дискомфорт в месте инъекций, однако это не послужило поводом для отмены терапии. Во 2-й группе 6 (17,1%) пациентов указали на дискомфорт в эпигастральной области, что потребовало увеличения дозы пантопразола до 40 мг/сут. У 2 больных, которым в начале исследования был назначен ибупрофен, к 5-му дню лечения эффект отсутствовал, и они были переведены на терапию диклофенаком натрия.
Заключение
Таким образом, комплексный подход (медикаментозный — интермиттирующая схема парентерального введения препаратов Хондрогард® и Сустагард® Артро и немедикаментозный — ежедневная ходьба и комплекс физических упражнений) у пациентов с рецидивом хронической боли в коленных суставах оказался высокоэффективным, безопасным, что позволяет рекомендовать его как альтернативу НПВП у коморбидных пациентов с ограничениями или противопоказаниями к приему последних. А сохраняющийся до 6 мес. после лечения обезболивающий эффект позволит уменьшить риски, связанные с полипрагмазией у пациентов с коморбидной отягощенностью.1 Фармакопейная субстанция CS-Bioactive©, Биоиберика С.А.У., Испания, — препарат Хондрогард® (Сотекс).
2 Фармакопейная субстанция Биоиберика С.А.У., Испания, — препарат Сустагард® Артро (Сотекс).
Литература
1. Yancik R. Cancer burden in the aged: an epidemiologic and demographic overview. Cancer. 1997;80(7):1273–1283. DOI: 10.1002/ (sici) 1097-0142 (19971001) 80:7<1273:: aid-cncr13>3.0.co;2-4.
2. Kim H.S., Shin J.-S., Lee J. et al. Association between Knee Osteoarthritis, Cardiovascular Risk Factors, and the Framingham Risk Score in South Koreans: A Cross-Sectional Study. PLoS One. 2016;11(10): e0165325. DOI: 10.1371/journal.pone.0165325.
3. Lee M.Y., Kim W.J., Kang Y.J. et al. Z39Ig is expressed on macrophages and may mediate inflammatory reactions in arthritis and atherosclerosis. J Leukoc Biol. 2006;80:922–928.
4. Rosa S.C., Goncalves J., Judas F. et al. Impaired glucose transporter-1 degradation and increased glucose transport and oxidative stress in response to high glucose in chondrocytes from osteoarthritic versus normal human cartilage. Arthritis Res Ther. 2009;11: R80.
5. Cheng K.H., Chu C.S., Lee K.T. et al. Osteoarthritis is an independent risk factor for major adverse cardiovascular events-nationwide case-control studies. European Heart Journal. 2013;34(1):5173.
6. Association of NSAID Use With Risk of Bleeding and Cardiovascular Events in Patients Receiving Antithrombotic Therapy After Myocardial Infarction. JAMA. 2015;313(8):805–814.
7. Zhang Y., Huang L., Su Y. The Effects of Traditional Chinese Exercise in Treating Knee Osteoarthritis: A Systematic Review and Meta-Analysis. PLoS One. 2017;12(1): e0170237. DOI: 10.1371/journal.pone.0170237.
8. Hansen J.B., Juhl C.B., Boutron I. et al. Assessing bias in osteoarthritis trials included in Cochrane reviews: protocol for a meta-epidemiological study. BMJ Open. 2014;4(10): e005491. DOI: 10.1136/bmjopen-2014-005491.
9. Hochberg M.C., Martel-Pelletier J., Monfort J. et al. Combined chondroitin sulfate and glucosamine for painful knee osteoarthritis: a multicentre, randomized, double-blind, non-inferiority trial versus celecoxib. Ann Rheum Dis. 2016;75(1):37–44. DOI: 10.1136/annrheumdis-2014-206792. Epub 2015 Jan 14.
10. Singh J.A., Noorbaloochi S., MacDonald R., Maxwell L.J. The Cochrane Collaboration Chondroitin for osteoarthritis (Review) Cochrane Libr; 2015.
11. Calamia V., Ruiz-Romero C., Rocha B. et al. Pharmacoproteomic study of the effects of chondroitin and glucosamine sulfate on human articular chondrocytes. Arthritis Res. Ther. 2010;12(4):138.
12. Вакуленко О.Ю., Жиляев Е.В. Остеоартроз: современные подходы к лечению. РМЖ. 2016;22:1494–1498. [Vakulenko O. Yu., Zhilyaev E.V. Osteoarthritis: modern approaches to treatment. RMJ. 2016;22:1494–1498 (in Russ.)].
13. Хитров Н.А. Остеоартроз и остеоартрит — патоморфоз названия и прогресс знаний о болезни. РМЖ. 2011;25:1525. [Khitrov N.A. Osteoarthritis and osteoarthritis — pathomorphosis of the name and the progress of knowledge about the disease. RMJ. 2011;25:1525 (in Russ.)].
14. Имаметдинова Г.Р., Чичасова Н.В. Хондроитина сульфат при заболеваниях опорно-двигательного аппарата: эффективность и безопасность с позиций доказательной медицины. РМЖ. 2016;22:1481–1488. [Imametdinova G.R., Chichasova N.V. Chondroitin sulfate in diseases of the musculoskeletal system: efficacy and safety from the standpoint of evidence-based medicine. RMJ. 2016;22:1481–1488 (in Russ.)].
15. Наумов А.В., Ховасова Н.О. К вопросу клинических рекомендаций по остеоартриту: почему в разных странах разные стратегии? РМЖ. 2017;24:1805–1811. [Naumov A.V., Hovasova N.O. On the question of clinical recommendations for osteoarthritis: why different countries have different strategies? RMJ. 2017;24:1805–1811 (in Russ.)].
2. Kim H.S., Shin J.-S., Lee J. et al. Association between Knee Osteoarthritis, Cardiovascular Risk Factors, and the Framingham Risk Score in South Koreans: A Cross-Sectional Study. PLoS One. 2016;11(10): e0165325. DOI: 10.1371/journal.pone.0165325.
3. Lee M.Y., Kim W.J., Kang Y.J. et al. Z39Ig is expressed on macrophages and may mediate inflammatory reactions in arthritis and atherosclerosis. J Leukoc Biol. 2006;80:922–928.
4. Rosa S.C., Goncalves J., Judas F. et al. Impaired glucose transporter-1 degradation and increased glucose transport and oxidative stress in response to high glucose in chondrocytes from osteoarthritic versus normal human cartilage. Arthritis Res Ther. 2009;11: R80.
5. Cheng K.H., Chu C.S., Lee K.T. et al. Osteoarthritis is an independent risk factor for major adverse cardiovascular events-nationwide case-control studies. European Heart Journal. 2013;34(1):5173.
6. Association of NSAID Use With Risk of Bleeding and Cardiovascular Events in Patients Receiving Antithrombotic Therapy After Myocardial Infarction. JAMA. 2015;313(8):805–814.
7. Zhang Y., Huang L., Su Y. The Effects of Traditional Chinese Exercise in Treating Knee Osteoarthritis: A Systematic Review and Meta-Analysis. PLoS One. 2017;12(1): e0170237. DOI: 10.1371/journal.pone.0170237.
8. Hansen J.B., Juhl C.B., Boutron I. et al. Assessing bias in osteoarthritis trials included in Cochrane reviews: protocol for a meta-epidemiological study. BMJ Open. 2014;4(10): e005491. DOI: 10.1136/bmjopen-2014-005491.
9. Hochberg M.C., Martel-Pelletier J., Monfort J. et al. Combined chondroitin sulfate and glucosamine for painful knee osteoarthritis: a multicentre, randomized, double-blind, non-inferiority trial versus celecoxib. Ann Rheum Dis. 2016;75(1):37–44. DOI: 10.1136/annrheumdis-2014-206792. Epub 2015 Jan 14.
10. Singh J.A., Noorbaloochi S., MacDonald R., Maxwell L.J. The Cochrane Collaboration Chondroitin for osteoarthritis (Review) Cochrane Libr; 2015.
11. Calamia V., Ruiz-Romero C., Rocha B. et al. Pharmacoproteomic study of the effects of chondroitin and glucosamine sulfate on human articular chondrocytes. Arthritis Res. Ther. 2010;12(4):138.
12. Вакуленко О.Ю., Жиляев Е.В. Остеоартроз: современные подходы к лечению. РМЖ. 2016;22:1494–1498. [Vakulenko O. Yu., Zhilyaev E.V. Osteoarthritis: modern approaches to treatment. RMJ. 2016;22:1494–1498 (in Russ.)].
13. Хитров Н.А. Остеоартроз и остеоартрит — патоморфоз названия и прогресс знаний о болезни. РМЖ. 2011;25:1525. [Khitrov N.A. Osteoarthritis and osteoarthritis — pathomorphosis of the name and the progress of knowledge about the disease. RMJ. 2011;25:1525 (in Russ.)].
14. Имаметдинова Г.Р., Чичасова Н.В. Хондроитина сульфат при заболеваниях опорно-двигательного аппарата: эффективность и безопасность с позиций доказательной медицины. РМЖ. 2016;22:1481–1488. [Imametdinova G.R., Chichasova N.V. Chondroitin sulfate in diseases of the musculoskeletal system: efficacy and safety from the standpoint of evidence-based medicine. RMJ. 2016;22:1481–1488 (in Russ.)].
15. Наумов А.В., Ховасова Н.О. К вопросу клинических рекомендаций по остеоартриту: почему в разных странах разные стратегии? РМЖ. 2017;24:1805–1811. [Naumov A.V., Hovasova N.O. On the question of clinical recommendations for osteoarthritis: why different countries have different strategies? RMJ. 2017;24:1805–1811 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
