Роль матриксной металлопротеиназы 9 в ремоделировании миокарда левого желудочка
Несмотря на используемые в настоящее время схемы консервативного лечения, примерно у каждого четвертого пациента после инфаркта миокарда развивается хроническая сердечная недостаточность (ХСН), имеющая высокие показатели 5-летней смертности (более 50%). Именно поэтому изучение и понимание механизмов развития сердечной недостаточности является крайне актуальным. Матриксные металлопротеиназы (ММП) являются ключевыми ферментами, участвующими в ремоделировании миокарда левого желудочка. В то же время остаются не до конца решенными вопросы влияния ММП на базальные мембраны кардиомиоцитов. Именно базальные мембраны являются связующим звеном между внеклеточным матриксом и кардиомиоцитами, участвуя в передаче силы сокращений во время систолы. Одной из наиболее хорошо изученных является матриксная ММП-9. Более четкое понимание роли этой ММП, особенно в отношении разрушения коллагена IV типа в базальных мембранах кардиомиоцитов, возможно, позволит оптимизировать стратегию лечения ХСН после инфаркта миокарда и будет способствовать улучшению прогноза у этой тяжелой категории пациентов. Настоящий обзор посвящен изучению влияния ММП-9 на ремоделирование миокарда левого желудочка.
Ключевые слова: матриксные металлопротеиназы, сердечная недостаточность, коллаген IV типа, ремоделирование миокарда левого желудочка, инфаркт миокарда, сердечная недостаточность.
Для цитирования: Шумаков Д.В., Зыбин Д.И., Попов М.А. Роль матриксной металлопротеиназы 9 в ремоделировании миокарда левого желудочка. РМЖ. Медицинское обозрение. 2020;28(10):17-19.
Matrix metalloproteinase 9 in the left ventricular remodeling
D.V. Shumakov, D.I. Zybin, M.A. Popov
Moscow Regional Clinical Research Institute named after M.F. Vladimirsky, Moscow
Nowadays, chronic heart failure after myocardial infarction (MI) develops approximately in one of four patients and has a high five-year mortality rate (more than 50%), despite modern conservative treatment regimens. That is why understanding the mechanisms of heart failure is extremely relevant. Matrix metalloproteinases are key enzymes involved in left ventricular remodeling. At the same time, an issue concerning the effect of metalloproteinases on the basal cardiomyocyte membranes remains incompletely resolved. It is the basal membranes that are the link between the extracellular matrix and cardiomyocytes, participating in the transmission of the force of contractions during systole. One of the most well-studied is matrix metalloproteinase 9 (MMP-9). A more comprehensive study of MMP-9, especially in relation to the type IV collagen destruction in the basal cardiomyocyte membranes, may help to optimize the chronic heart failure treatment tactics after MI and to improve the prognosis for difficult-to-treat patients. This review is devoted to the study of the MMP-9 effect on left ventricular remodeling.
Keywords: matrix metalloproteinases, heart failure, type IV collagen, left ventricular remodeling, myocardial infarction.
For citation: Shumakov D.V., Zybin D.I., Popov M.A. Matrix metalloproteinase 9 in the left ventricular remodeling. RMJ. 2020;10:17–19.
Актуальность
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти и инвалидизации населения во всем мире, несмотря на значительные успехи в лечении и профилактике [1]. В то же время хроническая сердечная недостаточность (ХСН), развивающаяся вследствие раннего постинфарктного ремоделирования левого желудочка (ЛЖ), занимает одно из первых мест в структуре смертности от ССЗ. Ремоделирование миокарда, возникающее после инфаркта миокарда (ИМ), обусловлено изменением структуры внеклеточного матрикса (ВКМ) [2]. В свою очередь, повышение уровня матриксных металлопротеиназ (ММП) взаимосвязано с ремоделированием ЛЖ, его дисфункцией и, как следствие, развитием ХСН.
Характер ремоделирования миокарда после ИМ зависит от степени поражения артериального русла, выраженности воспалительного ответа и многих других процессов, которые происходят во время формирования рубцовой зоны. В ответ на повреждение кардиомиоцитов запускается ряд защитных механизмов — воспаление, пролиферация и созревание клеток [3]. Каждый из них вносит свой вклад во временные изменения уровней ММП в миокарде. ММП в зоне формирования рубца секретируются различными клетками: нейтрофилами, макрофагами, эндотелиальными клетками, поврежденными кардиомиоцитами и фибробластами. Процессы, происходящие в некротизированном и ишемизированном миокарде, делают MMП ключевыми медиаторами в прогрессирующем ремоделировании миокарда ЛЖ [4–7].
Внеклеточный матрикс и процесс ремоделирования миокарда ЛЖ
Внеклеточный матрикс составляет основу соединительной ткани, обеспечивающей механический каркас клеток и транспорт химических веществ (табл. 1) [8].
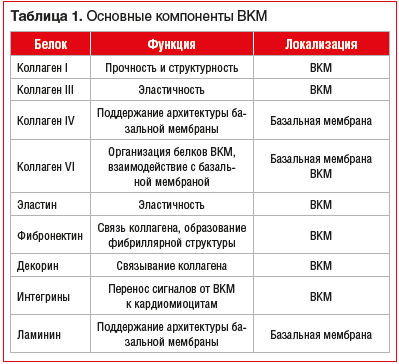
Благодаря трехмерно организованной структуре, которая взаимосвязана с волокнами миокарда, достигается прочность и эластичность ВКМ. Коллаген I типа составляет примерно 70–85% общей массы ВКМ и обеспечивает его прочность. Коллаген III типа составляет около 10% общего сердечного коллагена, обеспечивая эластичность ВКМ [9–13].
Ремоделирование миокарда при ИМ патофизиологически обусловлено гибелью кардиомиоцитов в результате длительной ишемии, которая приводит к активации ММП, что в свою очередь становится причиной деградации ВКМ, нарушающей структурную целостность. Все это в конечном счете приводит к снижению как систолической (из-за гибели кардиомиоцитов), так и диастолической (деградация ВКМ) функции [14].
Ремоделирование миокарда ЛЖ в области ИМ проходит в несколько этапов [15, 16]. Эти этапы (воспаление, пролиферация и отложение коллагена) последовательны и важны для ограничения зоны инфаркта. Исход ремоделирования миокарда зависит от выраженности каждого из этих этапов и их соотношения.
Гомеостаз кардиомиоцитов ухудшается сразу после ишемии, и уже через 30 мин клетки погибают, что в свою очередь провоцирует активацию нейтрофилов и макрофагов, т. е. острую воспалительную реакцию [17–19]. Нейтрофилы и макрофаги, проникая в область ИМ, высвобождают медиаторы воспаления, в т. ч. ММП и тканевой ингибитор металлопротеиназ. Примерно на 5-й день после ИМ начинает формироваться рубец, богатый коллагеном, восполняющий потерю кардиомиоцитов в области инфаркта [20].
Базальная мембрана кардиомиоцитов
В дополнение к коллагенам I и III типов, формирующим основу ВКМ, существуют белки, находящиеся в базальной мембране кардиомиоцитов: коллаген IV, V, VII, X и XIV типов, а также ламинин [10–13].
Базальная мембрана представляет собой плотную сеть различных белков, которая окружает кардиомиоциты, включает ламинин, коллаген IV типа и ряд протеогликанов [21, 22]. Она рассматривается как самостоятельная форма ВКМ, поскольку содержит коллаген IV типа, обнаруженный только в базальной мембране, и является слоем, отграничивающим ВКМ от кардиомиоцитов.
Фрагментация базальной мембраны происходит уже через 1 ч после ИМ и продолжается до 7 дней после реперфузии [23]. В исследованиях было показано увеличение толщины базальной мембраны, что способствует нарушению диффузии кислорода и возникновению гипоксического стресса [24]. Кроме того, после начала ИМ начинают вырабатываться антитела против коллагена IV типа, что также приводит к нарушению структурной целостности базальной мембраны и, следовательно, дисфункции эндотелиальных клеток [25]. В свою очередь, белки, образующиеся после распада ламинина, стимулируют заживление зоны некроза и ангиогенез [26]. Белки, являющиеся результатом деградации коллагена IV типа, напротив, играют критическую роль в подавлении ангиогенеза, нарушении структурной целостности сосудов и межклеточных взаимодействий после ишемического повреждения миокарда [27].
Матриксные металлопротеиназы
ММП представляют собой семейство цинкзависимых эндопептидаз, которые регулируют обмен белков соединительной ткани, а также влияют на процесс нормального развития и ремоделирования ВКМ. ММП широко изучаются в качестве маркеров для прогнозирования ремоделирования ЛЖ после ИМ и развития СН [28, 29]. Большое количество публикаций подчеркивают важность этого фермента в списке перспективных и важных биомаркеров, которые могут быть использованы для улучшения диагностики и повышения эффективности лечения ССЗ [30].
В таблице 2 перечислены наиболее изученные ММП и их биологические функции [8].
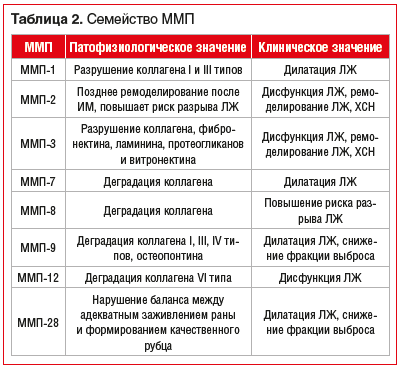
ММП-9, или желатиназа B, — одна из наиболее хорошо изученных протеаз, регулирующих патологические процессы ремоделирования. MMП-9 играет главную роль в деградации ВКМ при различных физиологических и патофизиологических процессах, которые включают ремоделирование ткани.
ММР-9 секретируется большим количеством клеток, включая кардиомиоциты, эндотелиальные клетки, нейтрофилы, макрофаги и фибробласты [30]. S. Blankenberg et al. первыми стали использовать ММП-9 в качестве нового прогностического биомаркера развития дисфункции ЛЖ и поздней выживаемости [31]. Вместе с другими исследователями [32] они показали взаимосвязь повышенного содержания MМП-9 с высокой концентрацией интерлейкина 6, C-реактивного белка и фибриногена в плазме, что свидетельствует о высоком прогностическом значении ММП-9.
I.B. Squire et al. [33] продемонстрировали, что увеличение содержания MMП-9 ассоциируется с большими объемами ЛЖ и дисфункцией ЛЖ после ИМ. Оценив количественный уровень ММП-9 в течение 5 дней после ИМ у 60 пациентов, авторы пришли к выводу, что, опираясь на уровень ММП-9, можно судить о характере ремоделирования миокарда после ИМ: чем он выше, тем хуже прогностический результат.
ММП-9 регулирует ремоделирование миокарда, непосредственно разрушая ВКМ и активируя цитокины и хемокины [30]. Воздействие ММП-9 является как вредным, так и полезным для регенерации зоны инфаркта. С одной стороны, под действием ММП-9 снижается фагоцитоз макрофагов и пролонгируется воспалительный ответ нейтрофилов, что приводит к увеличению ЛЖ после ИМ [34]. С другой стороны, происходит расщепление остеопонтина, что сопровождается образованием двух биологически активных пептидов, которые увеличивают скорость миграции фибробластов сердца, что, в свою очередь, ускоряет заживление инфарцированной зоны [35]. По этой причине использование ММП-9 в качестве диагностического маркера в различные дни после ИМ может помочь в прогнозировании и предотвращении дисфункции ЛЖ после ИМ.
Отдельно стоит отметить роль ММП-9 в разрушении коллагена базальных мембран кардиомиоцитов, в частности коллагена IV типа. В недавно опубликованной работе авторы, используя иммуногистохимический метод исследования, показали накопление ММП-9 в цитоплазме кардиомиоцитов, которое сочеталось с частичным или полным разрушением базальных мембран кардиомиоцитов, образованных коллагеном IV типа [36].
Заключение
ССЗ являются наиболее распространенной причиной смерти в развитых странах [37], а ИМ вносит значительный вклад в смертность от ССЗ [38]. По разным оценкам, распространенность ССЗ увеличится на 10% в течение следующих 20 лет и к 2030 г. станет причиной 23,6 млн смертей ежегодно во всем мире [39]. Кроме того, расходы на общественное здравоохранение в связи с ИМ увеличатся в 3 раза в течение следующих двух десятилетий [40].
После ИМ ЛЖ претерпевает ряд изменений на молекулярном и клеточном уровнях. Изменяется и ВКМ, со временем изменяя геометрию ЛЖ и нарушая его функцию [41]. Деградация ВКМ определяет прогноз в раннем и отдаленном периодах после ИМ [42]. Оценка ВКМ в различные периоды после ИМ может дать ранние диагностические или прогностические показатели ремоделирования ЛЖ и позволить группировать пациентов, учитывая их индивидуальные риски и дальнейшее лечение. В настоящее время используются различные биомаркеры для своевременной диагностики ИМ, однако их применение ограниченно
из-за отсутствия специфичности и селективности [43].
Определение роли MMП-9 в ремоделировании после ИМ является важной задачей [44]. Лучшее понимание патофизиологических процессов, в т. ч. биологической функции ММП-9, возможно, позволит разработать новые стратегии диагностики и лечения для пациентов, перенесших ИМ.
Биомаркеры ремоделирования ВКМ, которые возможно обнаружить при структурных изменениях во время ИМ, могут помочь в прогнозировании дальнейшего развития ХСН. В частности, одним из таких маркеров может выступать коллаген IV типа, находящийся в базальных мембранах кардиомиоцитов и разрушающийся под воздействием ММП-9. Одновременный анализ уровня ММП-9 и содержания коллагена IV типа в миокарде позволит ввести критерии прогноза выживаемости данной группы больных, определения тактики лечения, а также лучшего понимания процессов ремоделирования.
2. Cohn J.N., Ferrari R., Sharpe N. Cardiac remodeling–concepts and clinical implications: A consensus paper from an international forum on cardiac remodeling. Behalf of an international forum on cardiac remodeling. J Am Coll Cardiol. 2000;35:569–582. DOI: 10.1016/s0735-1097(99)00630-0.
3. Ertl G., Frantz S. Healing after myocardial infarction. Cardiovasc Res. 2005;66:22–32. DOI: 10.1016/j.cardiores.2005.01.011.
4. Lindsey M., Wedin K., Brown M.D. et al. Matrix-dependent mechanism of neutrophil-mediated release and activation of matrix metalloproteinase 9 in myocardial ischemia/reperfusion. Circulation. 2001;103:2181–2187.
5. Coker M.L., Jolly J.R., Joffs C. et al. Matrix metalloproteinase expression and activity in isolated myocytes after neurohormonal stimulation. Am J Physiol Heart Circ Physiol. 2001;281:H543–551.
6. Lindsey M.L., Escobar G.P., Mukherjee R. et al. Matrix metalloproteinase-7 affects connexin-43 levels, electrical conduction, and survival after myocardial infarction. Circulation. 2006;113:2919–2928. DOI: 10.1161/CIRCULATIONAHA.106.612960.
7. Heymans S., Luttun A., Nuyens D. et al. Inhibition of plasminogen activators or matrix metalloproteinases prevents cardiac rupture but impairs therapeutic angiogenesis and causes cardiac failure. Nat Med. 1999;5:1135–1142.
8. DeLeon-Pennell K.Y., Meschiari C.A., Jung M., Lindsey M.L. Matrix Metalloproteinases in Myocardial Infarction and Heart Failure. Prog Mol Biol Transl Sci. 2017;147:75–100. DOI: 10.1016/bs.pmbts.2017.02.001.
9. Bishop J.E., Laurent G.J. Collagen turnover and its regulation in the normal and hypertrophying heart. Eur Heart J. 1995;16(Suppl C):3844. DOI: 10.1093/eurheartj/16.suppl_c.38.
10. Bosman F.T., Stamenkovic I. Functional structure and composition of the extracellular matrix. J Pathol. 2003;200:423–428. DOI: 10.1002/path.1437.
11. Brown R.D., Ambler S.K., Mitchell M.D., Long C.S. The cardiac fibroblast: therapeutic target in myocardial remodeling and failure. Annu Rev Pharmacol Toxicol. 2005;45:657–687.
12. Paulssons M., Saladin K. Mouse heart laminin. Purification of the native protein and structural comparison with Engelbreth-Holm-Swarm tumor laminin. J Biol Chem. 1989;264:18726–18732.
13. Yang H., Borg T.K., Liu H., Gao B.Z. Interactive relationship between basement-membrane development and sarcomerogenesis in single cardiomyocytes. Exp Cell Res. 2015;330:222–232. DOI: 10.1016/j.yexcr.2014.08.020.
14. Van den Borne S.W.M., Diez J., Blankesteijn W.M. et al. Myocardial remodeling after infarction: the role of myofibroblasts. Nat Rev Cardiol. 2010;7:30–37. DOI: 10.1038/nrcardio.2009.199.
15. Spinale F.G., Frangogiannis N.G., Hinz B. et al. Crossing into the next frontier of cardiac extracellular matrix research. Circ Res. 2016;119:1040–1045. DOI: 10.1161/CIRCRESAHA.116.309916.
16. Díez J., Querejeta R., López B. et al. Losartan-dependent regression of myocardial fibrosis is associated with reduction of left ventricular chamber stiffness in hypertensive patients. Circulation. 2002;105:2512–2517.
17. Frangogiannis N.G. The extracellular matrix in myocardial injury, repair, and remodeling. J Clin Invest. 2017;127:1600–1612. DOI: 10.1172/JCI87491.
18. Ueland U., Laugsand L.E., Vatten L.J. et al. Extracellular matrix markers and risk of myocardial infarction: The HUNT Study in Norway. Eur J Prev Cardiol. 2017;24:1161–1167. DOI: 10.1177/2047487317703826.
19. Francis Stuart S.D., De Jesus N.M., Lindsey M.L., Ripplinger C.M. The crossroads of inflammation, fibrosis, and arrhythmia following myocardial infarction. J Mol Cell Cardiol. 2016;91:114–122. DOI: 10.1016/j.yjmcc.2015.12.024.
20. Ma Y., Halade G.V., Lindsey M.L. Extracellular matrix and fibroblast communication following myocardial infarction. J Cardiovasc Trans. Res. 2012;5:848–857. DOI: 10.1007/s12265-012-9398-z.
21. Yang H., Borg T.K., Wang Z. et al. Role of the basement membrane in regulation of cardiac electrical properties. Ann Biomed. Eng. 2014;42:1148–1157. DOI: 10.1007/s10439-014-0992-x.
22. Pozzi A., Yurchenco P.D., Iozzo R.V. The nature and biology of basement membranes Matrix Biol. 2017;57–58:1–11. DOI: 10.1016/j.matbio.2016.12.009.
23. Dobaczewski M., Bujak M., Zymek P. et al. Extracellular matrix remodeling in canine and mouse myocardial infarcts. Cell Tissue Res. 2006:324:475–488. DOI: 10.1007/s00441-005-0144-6.
24. Begieneman M.P.V., van de Goot F.R.W., Krijnen P.A.J. et al. The basement membrane of intramyocardial capillaries is thickened in patients with acute myocardial infarction. J Vasc Res. 2010;47:54–60. DOI: 10.1159/000231721.
25. McLeod O., Dunér P., Samnegård A. et al. Autoantibodies against basement membrane collagen type IV are associated with myocardial infarction. IJC Hear. Vasc. 2015;6:42–47. DOI: 10.1016/j.ijcha.2014.12.003.
26. Malinda K.M., Wysocki A.B., Koblinski J.E. et al. Angiogenic laminin-derived peptides stimulate wound healing. Int J Biochem Cell Biol. 2008:40:2771–2780. DOI: 10.1016/j.biocel.2008.05.025.
27. Lauten A., Gerhard-Garcia A., Suhr F. et al. Impact of ischemia-reperfusion on extracellular matrix processing and structure of the basement membrane of the heart. PLoS One. 20104;9:e92833. DOI: 10.1371/journal.pone.0092833.
28. Lindsey M.L., Hall M.E., Harmancey R., Ma Y. Adapting extracellular matrix proteomics for clinical studies on cardiac remodeling post-myocardial infarction. Clin Proteom. 2016;13:19. DOI: 10.1186/s12014-016-9120-2.
29. Barallobre-Barreiro J., Didangelos A., Schoendube F.A. et al. Proteomics analysis of cardiac extracellular matrix remodeling in a porcine model of ischemia/reperfusion injury. Circulation. 2012;125:789–802. DOI: 10.1161/CIRCULATIONAHA.111.056952.
30. Yabluchanskiy A., Ma Y., Iyer R.P. et al. Matrix Metalloproteinase-9: Many Shades of Function in Cardiovascular Disease. Physiology (Bethesda). 2013;28(6):391–403. DOI: 10.1152/physiol.00029.2013.
31. Blankenberg S., Rupprecht H.J., Poirier O. et al. Plasma concentrations and genetic variation of matrix metalloproteinase 9 and prognosis of patients with cardiovascular disease. Circulation. 2003;107:1579–1585. DOI: 10.1161/01.CIR.0000058700.41738.12.
32. Kelly D., Cockerill G., Ng L.L. et al. Plasma matrix metalloproteinase-9 and left ventricular remodelling after acute myocardial infarction in man: A prospective cohort study. Eur Heart J. 2007;28:711–718. DOI: 10.1093/eurheartj/ehm003.
33. Squire I.B., Evans J., Ng L.L. et al. Plasma mmp-9 and mmp-2 following acute myocardial infarction in man: Correlation with echocardiographic and neurohumoral parameters of left ventricular dysfunction. J Card Fail. 2004;10:328–333. DOI: 10.1016/j.cardfail.2003.11.003.
34. DeLeon-Pennell K.Y., Tian Y., Zhang B. et al. Cd36 is a matrix metalloproteinase-9 substrate that stimulates neutrophil apoptosis and removal during cardiac remodeling. CircCardiovasc Genet. 2016;9:14–25. DOI: 10.1161/CIRCGENETICS.115.001249.
35. Lindsey M.L., Zouein F.A., Tian Y. et al. Osteopontin is proteolytically processed by matrix metalloproteinase 9. Can J Physiol. Pharmacol. 2015;93:879–886. DOI: 10.1139/cjpp-2015-0019.
36. Попов М.А., Шумаков Д.В., Зыбин Д.И. и др. Феномен роли коллагена IV типа и матриксной металлопротеиназы 9 типа в ремоделировании миокарда левого желудочка при ишемической болезни сердца. Российский кардиологический журнал. 2019;24(8):83–87. [Popov M.A., Shumakov D.V., Zybin D.I. et al. Role of type IV collagen and matrix metalloproteinase-9 in remodeling of the left ventricular in coronary artery disease. Russian Journal of Cardiology. 2019;24(8):83–87]. DOI: 10.15829/1560-4071-2019-8-83-87.
37. Heidenreich P.A., Trogdon J.G., Khavjou O.A. et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation. 2011;123(8):933–944. DOI: 10.1161/CIR.0b013e31820a55f5.
38. Mozaffarian D., Benjamin E.J., Go A.S. et al. Heart disease and stroke statistics-2015 update: a report from the American Heart Association. Circulation. 2015;131(4):e29–322. DOI: 10.1161/CIR.0000000000000152.
39. Mathers C.D., Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med. 2006;3:e442. DOI: 10.1371/journal.pmed.0030442.
40. Heidenreich P.A., Trogdon J.G., Khavjou O.A. et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation. 2011;123:933–944. DOI: 10.1161/CIR.0b013e31820a55f5.
41. Ma Y., Halade G.V., Zhang J. et al. Matrix metalloproteinase-28 deletion exacerbates cardiac dysfunction and rupture after myocardial infarction in mice by inhibiting M2 macrophage activation. Circ Res. 2013;112:675–688. DOI: 10.1161/CIRCRESAHA.111.300502.
42. Spinale F.G., Frangogiannis N.G., Hinz B. et al. Crossing into the next frontier of cardiac extracellular matrix research. Circ Res. 2016; 119:1040–1045. DOI: 10.1161/CIRCRESAHA.116.309916.
43. Lindsey M.L., Iyer R.P., Zamilpa R. et al. A novel collagen matricryptin reduces left ventricular dilation post-myocardial infarction by promoting scar formation and angiogenesis. J Am Coll Cardiol. 2015;66:1364–1374. DOI: 10.1016/j.jacc.2015.07.035.
44. DeLeon-Pennell K.Y., Meschiari C.A., Jung M., Lindsey M.L. Matrix Metalloproteinases in Myocardial Infarction and Heart Failure. Prog Mol Biol Transl Sci. 2017;147:75–100. DOI: 10.1016/bs.pmbts.2017.02.001.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
