Генетические факторы, ассоциированные с риском артериальной гипертензии, у больных COVID-19
Цель исследования: выявить патогенетическую и прогностическую значимость полиморфизмов генов для прогноза течения и оценки риска развития осложнения COVID-19 у пациентов с артериальной гипертензией (АГ).
Материал и методы: обследовано 153 пациента, перенесших COVID-19. У части из них (n=95) инфекционное заболевание протекало на фоне АГ, у остальных больных (n=58) АГ не было. У наблюдаемых пациентов исключалось наличие заболеваний, способных повлиять на течение АГ, а также вторичной АГ. Всем пациентам проведено комплексное обследование, которое включало определение однонуклеотидных генетических полиморфизмов анализируемых генов (rs1937506, rs662, rs5186, rs5918, rs1143623, rs1799983). В качестве группы популяционного контроля использовалась выборка из 360 популяционных образцов, исследованных до пандемии COVID-19 на базе этого же стационара.
Результаты исследования: аллели rs1937506-A, rs662-G, rs1143623-C и rs1799983-T чаще встречаются в группе пациентов с АГ. При этом частота встречаемости исследуемых аллелей в группе инфицированных SARS-CoV-2 сравнима с частотой в общей популяции, что указывает на то, что наследственная предрасположенность к АГ не является фактором, повышающим риск заболевания COVID-19, несмотря на патогенетические особенности SARS-CoV-2 и его взаимодействие с АСЕ2 рецептором. Обнаружено, что наличие аллеля rs1937506-A у носителей генотипов AG и AA повышает риск поражения нижних дыхательных путей при СOVID-19, а аллель rs5186-C, возможно, является протективным для обладателей генотипов АС и СС. Риск гиперпротромбин-емии снижен у носителей генотипов AA и AG локуса rs1937506, а у обладателей генотипа GG повышен риск тромбообразования.
Заключение: проведение исследований на наличие определенных в работе генетических полиморфизмов позволяет среди пациентов с АГ определить группы риска развития пневмонии при COVID-19, а также выявить лиц, нуждающихся в контроле показателей свертывающей системы крови после перенесенного СOVID-19.
Ключевые слова: артериальная гипертензия, генетические факторы, генетическая предрасположенность, SNP, SARS-CoV-2, COVID-19.
Для цитирования: Корчагин В.И., Миронов К.О., Гапонова И.И., Плоскирева А.А., Демина И.А., Комарова А.Г., Акимкин В.Г. Генетические факторы, ассоциированные с риском артериальной гипертензии, у больных COVID-19. РМЖ. Медицинское обозрение. 2022;30(5):2-6.
Genetic factors associated with the risk of hypertension in patients with COVID-19
V.I. Korchagin1, K.O. Mironov1, I.I. Gaponova1, A.A. Ploskireva1, I.A. Demina2, A.G. Komarova2, V.G. Akimkin1
1Central Research Institute of Epidemiology of the Federal Service on Customers’ Rights Protection and Human Well-being Surveillance, Moscow
2S.P. Botkin City Clinical Hospital, Moscow Aim: to identify the pathogenetic and prognostic significance of gene polymorphisms for the course prognosis and risk assessment of COVID-19 complications in patients with hypertension.
Patients and Methods: 153 patients with COVID-19 were examined. The infectious disease occurred in 95 patients during hypertension, in the remaining 58 patients there was no hypertension. In the observed patients, diseases that could affect the hypertension course, as well as secondary hypertension, were excluded. All patients underwent a complete check-up, which included, in particular, the determination of single-nucleotide polymorphisms of the analyzed genes (rs1937506, rs662, rs5186, rs5918, rs1143623, rs1799983). A sampling of 360 population specimen studied before the SARS-CoV-2 pandemic at the same hospital was used as a population-based control group.
Results: rs1937506-A, rs662-G, rs1143623-C and rs1799983-T alleles were more common in the group of patients with hypertension. At the same time, the occurrence rate of the studied alleles in the group with SARS-CoV-2 was comparable to the general population, which indicated that inherited predisposition to hypertension was not a factor that increased the risk of COVID-19 disease, despite the pathogenetic patterns of SARS-CoV-2 and its interaction with the ACE2 receptor. It was found that the presence of the rs1937506-A allele in carriers of the AG and AA genotypes increased the risk of lower respiratory tract disorders in COVID–19, and the rs5186-C allele was possibly protective for carriers of the AS and CC genotypes. The risk of hyperprothrombinemia was reduced in carriers of the AA and AG genotypes (rs1937506 locus), while the risk of thrombosis was increased in carriers of the GG genotype.
Conclusion: conducting trials to identify certain genetic polymorphisms allows patients with hypertension to determine the risk groups for developing pneumonia in COVID-19, as well as those who need to monitor the parameters of the blood coagulation system after COVID-19.
Keywords: hypertension, genetic factors, genetic predisposition, SNP, SARS-CoV-2, COVID-19.
For citation: Korchagin V.I., Mironov K.O., Gaponova I.I. et al. Genetic factors associated with the risk of hypertension in patients with COVID-19. RMJ. 2022;5:2–6.
Введение
Наследственные факторы играют важную роль в патогенезе целого ряда онкологических, сердечно-сосудистых, эндокринных, аутоиммунных и некоторых инфекционных болезней [1–6]. Артериальная гипертензия (АГ) относится к таким заболеваниям, при которых наличие генетических факторов риска определяет наследственную предрасположенность к заболеванию. АГ является мультифакторным заболеванием, что подразумевает сочетанное действие генетических причин и негативных влияний окружающей среды, приводящее к реализации генетической предрасположенности в виде манифестной клинической формы болезни.
В патогенезе COVID-19 этап проникновения в клетку человека вируса SARS-CoV-2 связан с взаимодействием с белком-рецептором — цинковой пептидазой ангиотензинпревращающего фермента 2 (АПФ2) [7]. АПФ2 относится к каскаду ренин-ангиотензин-альдостероновой системы [8], которая является ключевым звеном в регуляции уровня артериального давления (АД).
Все возрастные категории подвержены заболеванию COVID-19, имеющему высокие показатели летальности и риск осложнений, включая отдаленные последствия. Течение COVID-19 у больных АГ может характеризоваться развитием более тяжелых форм инфекции. До настоящего времени не определены факторы риска поражения нижних дыхательных путей, дыхательной недостаточности и тяжелого течения данной инфекции. Роль генетических полиморфизмов в патогенезе COVID-19, их влияние на течение и прогноз у больных АГ остаются неясными и неизученными. Появление новых штаммов, имеющийся уровень заболеваемости, slipping-эффект мутантных штаммов от имеющегося иммунитета (как естественного, так и искусственного) указывают на необходимость изучения COVID-19 у пациентов с АГ как у группы риска. Изучение и анализ генетических полиморфизмов позволят лучше понимать системные эффекты COVID-19, выделить группу риска пациентов, нуждающихся в особо тщательном контроле, и выбрать правильную тактику для персонифицированного подхода к их лечению и обследованию.
Цель исследования: выявить патогенетическую и прогностическую значимость полиморфизмов генов для прогноза течения и оценки риска развития осложнения COVID-19 у пациентов с АГ.
Материал и методы
На базе ГБУЗ ГКБ им. С.П. Боткина ДЗМ было проведено наблюдение за 153 больными, у которых было получено письменное информированное согласие на участие в исследовании. Наблюдались пациенты обоих полов в возрасте от 27 до 74 лет, перенесшие COVID-19 (с подтвержденным этиологическим диагнозом), из которых у 95 инфекция протекала на неблагоприятном преморбидном фоне в виде АГ I–II стадии, 1–3-й степени (основная группа), у 58 пациентов АГ не было (группа сравнения). В качестве контроля использовалась выборки из 360 популяционных образцов (популяционный контроль, ПК), собранных и охарактеризованных до пандемии SARS-CoV-2 на базе этого же стационара [9]. Исследование проводили после одобрения локального этического комитета при полном соответствии с требованиями Хельсинкской декларации Всемирной медицинской ассоциации (2000 г.) и биомедицинской этики согласно Женевской конвенции о правах человека (1997 г.).
В исследовании участвовали пациенты в соответствии с разработанными критериями включения и невключения. В обеих группах допускалось наличие сопутствующих заболеваний: ожирение не выше 2-й степени, метаболический синдром, нарушение толерантности к углеводам, сахарный диабет 2 типа, а также заболевания, не способные изменить течение АГ.
Критериями невключения были: ожирение 3-й степени, тиреотоксикоз, вторичная АГ, бронхообструктивный синдром, клинически выраженный атеросклероз любой локализации, манифестные формы ишемической болезни сердца, перенесенные в прошлом инфаркт миокарда или инсульт, хроническая сердечная недостаточность II–IV функционального класса по классификации Нью-Йоркской ассоциации сердца (NYHA), участие пациента в клинических исследованиях лекарственных препаратов.
Всем пациентам поводилось комплексное клинико-лабораторное обследование и определение маркеров генетической предрасположенности к АГ с помощью молекулярно-биологических методов.
Молекулярно-биологические исследования
В работе были использованы молекулярно-биологические методики для определения 6 однонуклеотидных полиморфизмов (ОНП), ассоциированных с различными патологическими процессами, приводящими к сердечно-сосудистым заболеваниям: rs1937506, расположенный в некодирующей области (13q21), ассоциирован с АГ [10]; rs662 в гене параоксоназы 1 (PON1), который связан с образованием низкоактивного фермента и ассоциирован с увеличением риска сердечно-сосудистых заболеваний [11]; rs5186 в гене рецептора I типа ангиотензина II (AGTR1), ассоциированный с повышенным риском АГ [12]; rs5918 в гене интегрина β3 (ITGB3), ассоциированный с нарушениями свертываемости крови и риском тромбозов [13]; rs1143623 в гене интерлейкина 1β (IL1B), ассоциированный с особенностями воспалительных процессов, предположительно связанных с повышенным риском повреждения сосудистой стенки [14]; rs1799983 в гене синтазы окиси азота 3 (NOS3), ассоциированный с риском АГ [15].
Определение аллелей ОНП проводили с использованием ПЦР в режиме реального времени. Характеристика ОНП и большая часть методик для их определения были описаны ранее [3, 16].
Все использованные реактивы и наборы реагентов для выделения ДНК и проведения ПЦР были разработаны в ФБУН ЦНИИ эпидемиологии Роспотребнадзора («АмплиСенс©», Россия), определение аллелей ОНП проводилось аналогично [13]. Методики для определения аллелей ОНП rs1937506 и rs1799983 входят в состав набора реагентов «АмплиСенс© Геноскрин Stroke SNP-FL» (регистрационное удостоверение № РЗН 2019/8874 от 05.09.2019).
Статистическая обработка данных
Анализ полученных данных проводили в среде R [17] с использованием встроенных функций и специализированных пакетов: для поиска ассоциации и расчета отношения шансов (ОШ) — SNPassoc [18], для расчета ОШ при отсутствии одной из гомозигот — Epitools [19]. Статистически значимыми считали результаты тестов при р<0,05. Для коррекции ошибки при множественном сравнении использовали поправку Холма — Бонферрони.
Результаты и обсуждение
Клинико-демографические характеристики пациентов основной группы и группы сравнения представлены в таблице 1.

В исследование включили 112 женщин, 41 мужчину. Группы не различались по половому составу (p=0,25), но женщины, входившие в состав основной группы, были статистически значимо старше женщин, входивших в группу сравнения. Для мужчин различие возраста между группами не достигает статистической значимости (p=0,08). За счет преобладания женщин в обеих группах наблюдается статистически значимое различие по возрасту между группами пациентов во всей выборке. При этом в обеих группах женщины статистически значимо старше мужчин.
Сравнение основной группы, группы сравнения и популяционного контроля не выявило статистически значимых различий между ними по частотам редких аллелей (табл. 2).
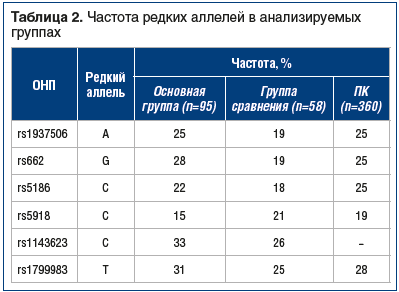
В основной группе и группе сравнения были определены частоты (%) редких аллелей (табл. 3). Аллели rs1937506-A, rs662-G, rs1143623-C и rs1799983-T встречаются в основной группе чаще, чем в группе сравнения, выявляется тенденция к ассоциации с повышенным риском развития АГ у носителей как в гомозиготном, так и в гетерозиготном состоянии (см. табл. 3). В то же время редкий аллель rs5918-C скорее имеет протективный характер. Однако найденные ассоциации не достигают статистической значимости из-за низкой частоты редкого аллеля в популяции и недостаточного размера выборки. В целом сравнение больных COVID-19 с ПК не выявило значимых различий между этими выборками, то есть частоты аллелей в группе инфицированных SARS-CoV-2 сравнимы с популяционными.
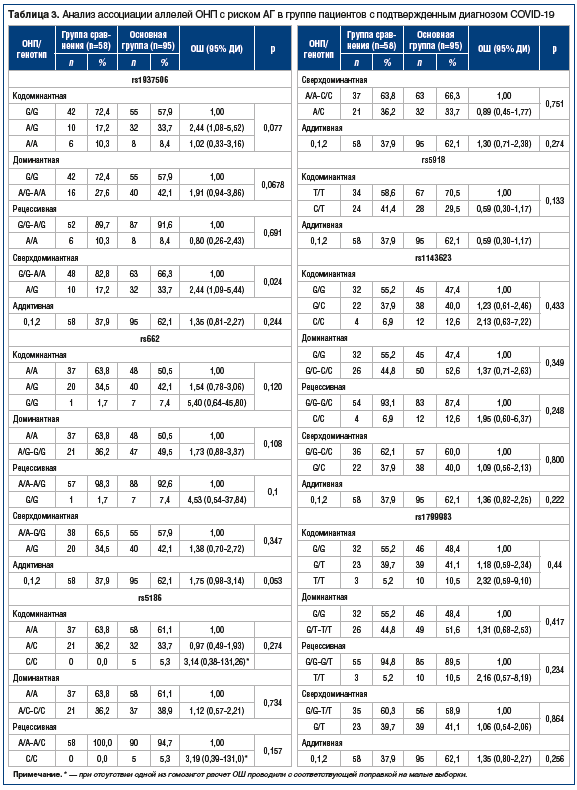
При анализе выборки женщин с подтвержденным диагнозом COVID-19 было обнаружено, что в основной группе частота носительства гетерозиготы rs1937506-AG значительно выше, чем в группе сравнения: 39% и 15% соответственно, за счет этого доля аллеля риска rs1937506-A оказалась выше в основной группе (притом что доли гомозигот rs1937506-AА в этих группах не различались). Расчет ОШ показал, что у женщин — носителей гетерозиготы rs1937506-AG он достигает 3,62 (p=0,0045) относительно носителей гомозигот (табл. 4). В связи с ограниченным числом мужчин в выборке провести анализ ассоциации у них не представилось возможным.
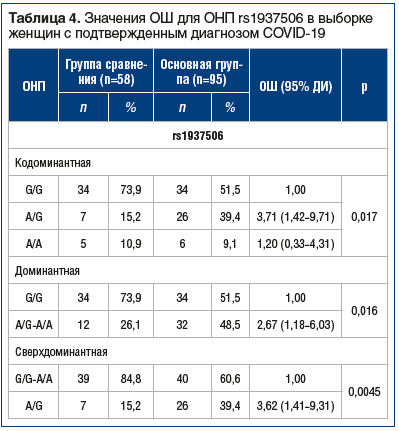
Дальнейшие исследования предполагают увеличение размера выборки, что в перспективе позволит оценить общий вклад инфекции SARS-CoV-2 и генетических факторов в риск развития АГ.
Связь генетических факторов и клинических наблюдений
Анализ выявленных генетических факторов и особенностей клинической картины проводился с учетом 4 параметров: уровня протромбина, развития и тяжести течения пневмонии, а также особенностей течения АГ.
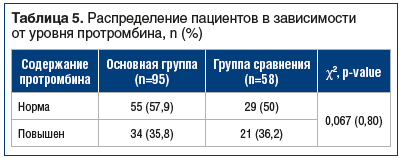
В группе пациентов с COVID-19 определяли содержание протромбина в сыворотке крови в период реконвалесценции. За повышенный уровень принимали концентрацию, превышающую 120%. Средний уровень протромбина составил у пациентов из основной группы и группы сравнения 100,7±41,8% и 116,4±20,0% соответственно. Между основной группой и группой сравнения не обнаружено статистически значимых различий (p>0,05) по данному параметру (табл. 5).
Анализ частот аллелей / генотипов ОНП в группах с нормальной и повышенной концентрацией протромбина выявил, что носители генотипов AA и AG локуса rs1937506 имеют более низкий риск повышения концентрации в доминантной модели (ОШ 0,37, 95% доверительный интервал (ДИ) 0,18–0,80, p=0,0087). При этом наблюдается статистически значимое повышение концентрации протромбина у носителей генотипа GG по сравнению с гетерозиготными пациентами (см. рисунок).
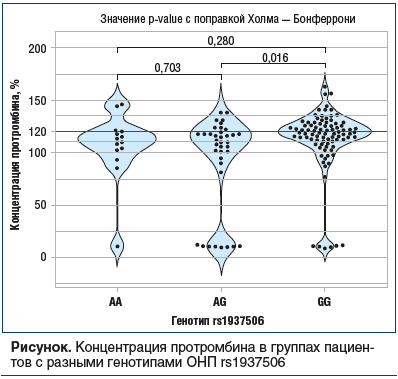
В среднем концентрация протромбина у носителей генотипов AA и AG (95,9%±41,8) оказалась на 16,5% (95% ДИ 4,2–28,7) ниже, чем у носителей GG (112,4%±31,2).
По результатам КТ 140 пациентов у 53 (38%) были диагностированы легкие (КТ-1, 24 пациента) или тяжелые и среднетяжелые (КТ-2 и КТ-3, 29 пациентов) формы пневмонии. Анализ частот аллелей / генотипов ОНП не обнаружил статистически значимых различий между формами пневмонии. При этом сравнение пациентов с тяжелой/среднетяжелой формой пневмонии с пациентами без пневмонии показало, что аллель rs5186-C, возможно, является протективным (для носителей генотипов АС и СС ОШ 0,34 (95% ДИ 0,12–0,91, p=0,0226)), в то же время редкий аллель rs1937506-A способен повышать риск развития пневмонии у носителей генотипов AG и AA (ОШ 2,51 (95% ДИ 1,06–5,65, p=0,036)). Однако для достоверной оценки влияния генетических полиморфизмов на риск развития таких многофакторных заболеваний необходимо учитывать влияние всего спектра факторов, что требует проведения анализа на крупных независимых выборках.
Из 140 обследованных пациентов с COVID-19 у 14 (10%) наблюдалось снижение АД, а у 26 (18%) отмечалась дестабилизация в сторону повышения АД на фоне перенесенной инфекции. Анализ частот аллелей / генотипов ОНП в этих группах по сравнению с пациентами, у которых не выявлено изменение АД (n=50, 36%), не позволило установить статистически значимые генетические предикторы, что связано с недостаточным объемом выборки.
Заключение
Проведенное исследование показало, что аллели rs1937506-A, rs662-G, rs1143623-C и rs1799983-T в группе больных АГ встречаются чаще, чем у пациентов без АГ. При этом отсутствие значимых различий в частотах исследуемых аллелей в группе инфицированных SARS-CoV-2 по сравнению с популяционными демонстрирует тот факт, что, несмотря на патогенетические особенности COVID-19, обусловленные взаимодействием с рецептором АПФ2, наличие наследственной предрасположенности к АГ не является фактором, повышающим риск COVID-19. В ходе исследования показано, что наличие редкого аллеля rs1937506-A может повышать риск развития пневмонии при COVID-19 у носителей генотипов AG и AA, а аллель rs5186-C, возможно, является протективным (для носителей генотипов АС и СС) в отношении развития пневмонии при данной инфекции. Проведенное исследование показало, что носители генотипов AA и AG локуса rs1937506 имеют более низкий риск повышения концентрации протромбина, в то время как статистически значимое повышение его концентрации отмечается у носителей генотипа GG по сравнению с гетерозиготными пациентами. Это является важным прогностическим критерием, позволяющим выделить целевую группу пациентов, требующих динамического контроля свертывания крови после перенесенной коронавирусной инфекции.
2. Кожанова Т.В., Неудахин Е.В., Жилина С.С. и др. Генетическая предрасположенность к развитию атеросклероза. Архивъ внутренней медицины. 2018;8(6):407–417. [Kozhanova T.V., Neudakhin E.V., Zhilina S.S. et al. The genetic susceptibility to atherosclerosis. The Russian Archives of Internal Medicine. 2018;8(6):407–417 (in Russ.)]. DOI: 10.20514/2226-67042018-8-6-407-417.
3. Корчагин В.И., Миронов К.О., Дрибноходова О.П. и др. Роль генетических факторов в формировании индивидуальной предрасположенности к ишемическому инсульту. Анналы клинической и экспериментальной неврологии. 2016;10(1):65–75. [Korchagin V.I., Mironov K.O., Dribnokhodova O.P. et al. A role of genetic factors in the development of individual predisposition to ischemic stroke. Annals of Clinical and Experimental Neurology. 2016;10(1):65–75 (in Russ.)].
4. Goodarzi M.O. Genetics of Common Endocrine Disease: The Present and the Future. J Clin Endocrinol Metab. 2016;101(3):787–794. DOI: 10.1210/jc.2015-3640.
5. Ramos P.S., Shedlock A.M., Langefeld C.D. Genetics of autoimmune diseases: insights from population genetics. J Hum Genet. 2015;60(11):657–664. DOI: 10.1038/jhg.2015.94.
6. Chapman S.J., Hill A.V.S. Human genetic susceptibility to infectious disease. Nat Rev Genet. 2012;13(3):175–188. DOI: 10.1038/nrg3114.
7. Lambert D.W., Yarski M., Warner F.J. et al. Tumor necrosis factor-alpha convertase (ADAM17) mediates regulated ectodomain shedding of the severe-acute respiratory syndrome-coronavirus (SARS-CoV) receptor, angiotensin-converting enzyme-2 (ACE2). J Biol Chem. 2005;280(34):30113–30119. DOI: 10.1074/jbc.M505111200.
8. Donoghue M., Hsieh F., Baronas E. et al. A novel angiotensin-converting enzyme-relatedcarboxypeptidase (ACE2) converts angiotensin I to angiotensin 1–9. Circ Res. 2000;87:E1–9. DOI: 10.1161/01.res.87.5.e1. Полный список литературы Вы можете найти на сайте http://www.rmj.ru
9. Дрибноходова О.П., Миронов К.О., Корчагин В.И. и др. Характеристика 48 полиморфных локусов — потенциальных маркеров риска развития ишемического инсульта. Генетика. 2017;53(6):716–721. [Dribnokhodova O.P., Mironov K.O., Korchagin V.I. Characteristics of 48 polymorphic loci as potential markers of the risk of ischemic stroke. Genetics. 2017;53(6):716–721 (in Russ.)]. DOI: 10.7868/S0016675817060042.
10. Wellcome Trust Case Control Consortium. Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature. 2007;447(7145):661–678. DOI: 10.1038/nature05911.
11. Serrato M., Marian A.J. A variant of human paraoxonase/arylesterase (HUMPONA) gene is a risk factor for coronary artery disease. J Clin Invest. 1995;96(6):3005–3008. DOI: 10.1172/JCI118373.
12. Bonnardeaux A., Davies E., Jeunemaitre X. et al. Angiotensin II type 1 receptor gene polymorphisms in human essential hypertension. Hypertension. 1994;24(1):63–69. DOI: 10.1161/01.hyp.24.1.63.
13. Weiss E.J., Bray P.F., Tayback M. et al. A polymorphism of a platelet glycoprotein receptor as an inherited risk factor for coronary thrombosis. N Engl J Med. 1996;334(17):1090–1094. DOI: 10.1056/NEJM199604253341703.
14. Zee R.Y., Hennessey H., Michaud S.E., Ridker P.M. Genetic variants within the interleukin-1 gene cluster, and risk of incident myocardial infarction, and ischemic stroke: a nested case-control approach. Atherosclerosis. 2008;201(1):124–129. DOI: 10.1016/j.atherosclerosis.2008.01.004.
15. Kingah P.L., Luu H.N., Volcik K.A. et al. Association of NOS3 Glu298Asp SNP with hypertension and possible effect modification of dietary fat intake in the ARIC study. Hypertens Res. 2010;33(2):165–169. DOI: 10.1038/hr.2009.198.
16. Корчагин В.И., Миронов К.О., Платонов А.Е. и др. Комплексная оценка вклада генетических факторов в развитие ишемического инсульта. Журнал неврологии и психиатрии им. C.C. Корсакова. 2017;117(12–2):11–18. [Korchagin V.I., Mironov K.O., Platonov A.E. et al. Complex assessment of the contribution of genetic factors to the risk of ischemic stroke. S.S. Korsakov Journal Of Neurology And Psychiatry. 2017;117(12–2):11–18 (in Russ.)]. DOI: 10.17116/jnevro201711712211-18.
17. R Core Team. R: The R Project for Statistical Computing. (Electronic resource). URL: https://www.R-project.org/ (access date: 25.03.2022).
18. González J.R., Armengol L., Solé X. SNPassoc: an R package to perform whole genome association studies. Bioinformatics. 2007;23(5):644–645. DOI: 10.1093/bioinformatics/btm025.
19. Aragon T.J., Wollschlaeger D., Omidpanah A. Epitools: Epidemiology Tools [R package epitools version 0.5–10.1] (Electronic resource.) URL: https://cran.r-project.org/package=epitools (access date: 25.03.2022).

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.