Особенности течения острого нарушения мозгового кровообращения у пациентов, перенесших новую коронавирусную инфекцию, по данным COVID-центра ГКБ им. С.П. Боткина
Введение: ишемический мозговой инсульт при отсутствии факторов риска развития сердечно-сосудистых событий, а также без клинически видимых симптомов инфекционного заболевания может быть первым клиническим проявлением новой коронавирусной инфекции, что подчеркивает важность оценки всех поступающих пациентов с острым нарушением мозгового кровообращения (ОНМК) как потенциально инфицированных или болеющих COVID-19, что, в свою очередь, обусловливает особенности организации оказания им медицинской помощи.
Цель исследования: определить клинические особенности течения ОНМК на фоне новой коронавирусной инфекции.
Материал и методы: за время функционирования COVID-центра на базе ГБУЗ ГКБ им. С.П. Боткина с 29 апреля по 7 июля 2020 г. было пролечено 52 пациента (36 женщин и 16 мужчин), перенесших одновременно ОНМК и новую коронавирусную инфекцию.
Результаты исследования: среди пациентов с ОНМК и новой коронавирусной инфекцией ишемический инсульт был верифицирован у 43 (82,7%) человек. В структуре причин смерти пациентов геморрагические инсульты в сочетании с COVID-19 составили 19,2%, а ишемические — 80,8%. У умерших пациентов выявлено многократное повышение уровня креатинфосфокиназы в крови в сравнении с выписанными пациентами. Нарушение функции печени может быть использовано в качестве индикатора для оценки прогноза пациентов с COVID-19 и должно тщательно контролироваться во время госпитализации. Среди умерших пациентов легкая степень тяжести пневмонии по данным компьютерной томографии (КТ) (КТ-0 / КТ-1) была диагностирована у 16 (61,5%) пациентов. Гипертоническая болезнь (в качестве сопутствующего заболевания) была диагностирована у 92% выписанных больных и у 96,2% умерших пациентов, сахарный диабет у выписанных встречался в 19,2% случаев, а у умерших — в 96,2%. У пациентов молодого и среднего возраста из сопутствующих заболеваний встречалась только гипертоническая болезнь и отсутствовали сахарный диабет, нарушение ритма сердца и стенозирующий атеросклероз магистральных артерий.
Заключение: высокая летальность при сочетании двух заболеваний повышает актуальность изучения данной проблемы, в связи с чем следует продолжить изучение причинно-следственной связи процессов, происходящих при ОНМК на фоне новой коронавирусной инфекции. ОНМК может являться атипичным симптомом COVID-19 и приводить к летальному исходу при отсутствии массивного поражения легких. Это, скорее всего, обусловлено микротромбозом, дестабилизацией атеросклеротической бляшки вследствие COVID-19.
Ключевые слова: COVID-19, инсульт, предикторы летальности, предикторы неблагоприятного исхода.
Для цитирования: Левин О.С., Комарова А.Г., Плоскирева А.А., Кривошеева Н.М., Литовченко К.О. Особенности течения острого нарушения мозгового кровообращения у пациентов, перенесших новую коронавирусную инфекцию, по данным COVID-центра ГКБ им. С.П. Боткина. РМЖ. Медицинское обозрение. 2022;30(5):7-11.
Patterns of acute cerebrovascular accident in patients who suffered COVID-19, according to the COVID Center of the S.P. Botkin City Clinical Hospital
O.S. Levin1,2, A.G. Komarova1, A.A. Ploskireva3, N.M. Krivosheeva1, K.O. Litovchenko1,2 1S.P. Botkin City Clinical Hospital, Moscow
2Russian Medical Academy of Continuous Professional Education, Moscow
3Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Moscow
Background: ischemic stroke in the absence of risk factors of cardiovascular events, as well as without clinically visible symptoms of an infectious disease, may be the first clinical manifestation of a new coronavirus infection (COVID-19), which underlines the importance of evaluating all incoming patients with acute cerebrovascular accident (CVA) as potentially infected or suffering from COVID-19, which in turn causes organizational characteristics of medical care.
Aim: to determine the clinical patterns of the CVA during COVID-19.
Patients and Methods: during the work of the COVID center on the basis of the S.P. Botkin City Clinical Hospital from April 29 to July 7, 2020, 52 patients were concurrently cured who suffered both CVA and COVID-19. Of these, there were 36 women and 16 men.
Results: among patients with CVA and COVID-19, ischemic stroke was verified in 43 (82.7%) patients. In the structure of dead patients, hemorrhagic strokes in combination with COVID-19 accounted for 19.2%, and ischemic strokes — 80.8%. There was a multiple increase in the level of creatine phosphokinase (CPK) in the blood of dead patients versus the discharged patients. Liver failure can be used as an indicator to assess the prognosis of patients with COVID-19, and should be carefully monitored during hospitalization. Among the dead patients, mild severity of pneumonia according to CT (CT 0/1) was diagnosed in 16 (61.5%) patients. Hypertension (as a concomitant disease) was diagnosed in 92% of discharged patients and in 96.2% of dead patients. Diabetes mellitus was found in 19.2% of discharged patients, and in 96.2% of dead patients. Of the concomitant diseases in young and middle-aged patients, only hypertension was found, while diabetes mellitus, hear t arrhythmia and carotid artery stenosis were absent.
Conclusion: the high mortality rate in the combination of two diseases increases the relevance of studying this problem, and therefore, it is necessary to continue studying the causal relationship of the processes occurring in CVA during COVID-19. CVA can be an atypical symptom of COVID-19 and lead to fatal outcome in the absence of massive lung damage. This is most likely due to microthrombosis, atherosclerotic plaque destabilization due to COVID-19.
Keywords: COVID-19, stroke, predictors of mortality, predictors of adverse outcome.
For citation: Levin O.S., Komarova A.G., Ploskireva A.A. et al. Patterns of acute cerebrovascular accident in patients who suffered COVID-19, according to the COVID Center of the S.P. Botkin City Clinical Hospital. RMJ. 2022;5:7–11.
Введение
Новая коронавирусная инфекция, вызываемая вирусом SARS-CoV-2, была зарегистрирована в Китае в конце декабря 2019 г., а в середине марта 2020 г. Всемирная организация здравоохранения объявила пандемию COVID-19. Симптомы COVID-19 довольно разнообразны: это катаральные явления, схожие с обычной острой респираторной вирусной инфекцией (лихорадка, кашель, одышка, общая слабость), в легких обнаруживаются двусторонние инфильтраты по типу «матового стекла», могут также встречаться менее типичные симптомы (диарея, миалгии, спутанность сознания, потеря обоняния и вкуса) [1–3]. COVID-19 — высококонтагиозное инфекционное заболевание, оказывающее системное воздействие на гемостаз и кроветворную систему. Вирус SARS-CoV-2 может напрямую поражать ткань не только легких, но и других органов, однако механизм воздействия и циркуляции по организму остается неясным. Помимо непосредственного повреждения вирусными частицами, COVID-19 индуцирует воспаление и запускает каскад реакций, приводящих к повышению свертываемости крови [4–6]. Экспрессия ангиотензинпревращающего фермента 2-го типа была выявлена как в артериальном, так и в венозном эндотелии легких и почек [4–7]. В результате воздействия инфекции происходит повреждение эндотелия, которое сопровождается местным повышением уровня фактора фон Виллебранда и эндотелиитом с увеличением количества активированных нейтрофилов и макрофагов. Это приводит к усиленной продукции тромбина, подавлению фибринолиза и запускает каскад комплемента, что приводит к образованию нейтрофильных внеклеточных ловушек (NETs) и микротромбов, а также к нарушению микроциркуляции [6, 8–15]. NETs способствует повреждению эндотелия и запускает внутренние и внешние механизмы коагуляции. В литературе имеются данные, что NETs выявлялись у пациентов с COVID-19 и имели положительную корреляцию с тяжестью течения заболевания [15]. Протромботическое состояние усугубляется развитием острой дыхательной недостаточности (гипоксия и активация фактора, индуцируемого гипоксией, 1α), что приводит к увеличению вязкости крови [16]. Таким образом, возникает дисбаланс гипер- и гипокоагуляционных механизмов [17–22].
NETs является патогенетическим звеном артериального и венозного тромбоза. Так, при венозном тромбозе активированный эндотелий высвобождает фактор фон Виллебранда и Р-селектин, привлекающие тромбоциты и нейтрофилы, которые высвобождают NETs и становятся каркасом для тромба и дальнейшей адгезии тромбоцитов. Также NETs способствуют расщеплению ингибитора тканевого фактора и стимуляции Xa-фактора [23]. При артериальном тромбозе NETs связываются с кристаллами холестерина, приводя к спонтанному запуску нетоза, что способствует задержке тромбоцитов, активации коагуляции и, как итог, тромбообразованию [24].
Ишемический мозговой инсульт может быть первым клиническим проявлением новой коронавирусной инфекции, даже при отсутствии факторов риска развития сердечно-сосудистых событий, а также без клинически видимых симптомов инфекционного заболевания, в связи с чем важно рассматривать пациентов, поступающих с острым нарушением мозгового кровообращения (ОНМК), как потенциально болеющих или инфицированных COVID-19, для правильной и своевременной организации оказания им медицинской помощи [25].
Цель исследования: определить клинические особенности течения ОНМК на фоне новой коронавирусной инфекции.
Материал и методы
На базе ГБУЗ ГКБ им. С.П. Боткина с 29 апреля по 7 июля 2020 г. работал COVID-центр. За указанный период было пролечено 52 пациента, перенесших одновременно ОНМК и новую коронавирусную инфекцию. Среди 52 пациентов, включенных в данное исследование, было 36 женщин и 16 мужчин. Пациенты были разделены на 2 группы: выписанные (n=26) и умершие (n=26). Средний возраст выписанных пациентов составил 76,6±2,1 года, умерших — 75,7±2,7 года.
Диагноз COVID-19 был поставлен на основании временных методических рекомендаций [26], при наличии клинических проявлений в сочетании с характерными изменениями в легких по данным компьютерной томографии (КТ) или обзорной рентгенографии органов грудной клетки и/или положительного результата лабораторного исследования на наличие РНК SARS-CoV-2 с применением методов амплификации нуклеиновых кислот, вне зависимости от клинических проявлений.
Оценка изменений в легких проводилась с помощью КТ, выполненной на аппарате TOSHIBA Aquilion Prime 160 в первые 2 сут после определения вируса SARS-CoV-2 ПЦР-тестом, а в случае повторного исследования учитывалось наиболее тяжелое поражение легочной ткани. Для определения объема поражения легких по степеням использовалась Эмпирическая визуальная шкала, согласно временным клиническим рекомендациям [26], где КТ-1 — это поражение менее 25% легочной ткани, КТ-2 — 25–50%, КТ-3 — 50–75%, КТ-4 — более 75% поражения легочной ткани.
Для обработки данных использованы программы Microsoft Excel и IBM SPSS 22 Statistics Base. Количественные показатели представлены в виде среднего и стандартного отклонения (M±SD). Достоверность разницы полученных результатов оценивалась с помощью критерия Стьюдента. Полученные различия расценивали как статистически значимые при t>1,96. Результаты исследования
Средняя длительность госпитализации пациентов составила 14,9±2,5 дня: у выписанных — 15,6±2,2 дня, у умерших — 14,2±2,8 дня (различия недостоверны).
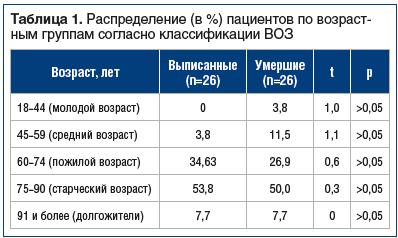
Из 52 находившихся на лечении пациентов летальный исход наступил у 26: 19 (73,1%) женщин и 7 (26,9%) мужчин. Минимальный возраст умерших пациентов составил 43 года, а максимальный — 95 лет, выписанных — 55 лет и 93 года соответственно. Достоверной разницы по возрасту между группами выявлено не было (табл. 1). Однако при распределении пациентов по возрастным группам отчетливо видно, что среди молодых пациентов и пациентов среднего возраста летальность значительно выше.
Среди всех пациентов с ОНМК в сочетании с новой коронавирусной инфекцией 43 (82,7%) пациента перенесли ишемический инсульт, 8 (15,4%) — геморрагический инсульт, 1 (1,9%) — транзиторную ишемическую атаку. В структуре причин смерти геморрагические инсульты в сочетании с COVID-19 составили 19,2%, ишемические — 80,8%. В подгруппе пациентов среднего возраста летальные исходы наступили от сочетания ишемического инсульта и новой коронавирусной инфекции, в подгруппе пациентов молодого возраста 1 пациент умер от сочетания геморрагического инсульта и СOVID-19.
По данным нейровизуализации у пациентов с ишемическими инсультами преобладали ОНМК в каротидном бассейне: 91,7% среди выписанных больных и 95,2% среди умерших. При анализе по патогенетическим подтипам атеротромботический подтип диагностирован у 29,2% выписанных пациентов и у 33,3% умерших, кардиоэмболический подтип встречался у 12,5% выписанных больных и у 19,0% умерших. Доля лакунарных инсультов составила 25% среди выписанных пациентов и 9,5% среди умерших. Остальные пациенты с неуточненными подтипами имели либо несколько причин развития инсульта, либо не было установлено его возможной причины.
Нами был проведен анализ клинических проявлений и данных лабораторно-инструментальной диагностики (табл. 2).
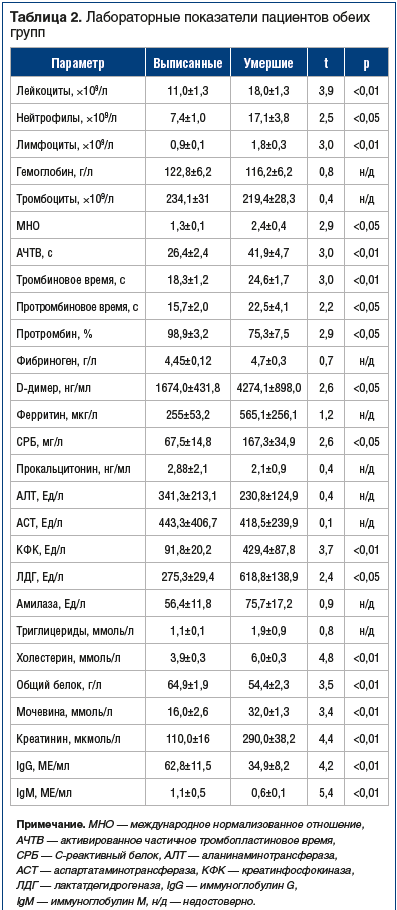
Сравнительный анализ показал достоверно более низкое количество лейкоцитов, нейтрофилов и лимфоцитов у выписанных пациентов по сравнению с умершими. Уровень С-реактивного белка (СРБ) был достоверно значительно выше нормы в обеих группах, однако в группе умерших пациентов данный показатель был превышен в 2,5 раза. Также у умерших пациентов в несколько раз был повышен уровень креатинфосфокиназы (КФК) в сравнении с выписанными пациентами, таким образом, данный фермент может являться биомаркером неблагоприятного исхода. У умерших пациентов были достоверно повышены показатели азотистого обмена, а также снижена концентрация общего белка. Все эти изменения можно объяснить развитием полиорганной недостаточности на фоне ОНМК в совокупности с новой коронавирусной инфекцией. В группе умерших пациентов было отмечено повышение уровня D-димера и ферритина, удлинение тромбинового и протромбинового времени, активированного частичного тромбопластинового времени, снижение уровня протромбина. Уровень печеночных ферментов был повышен в обеих группах.
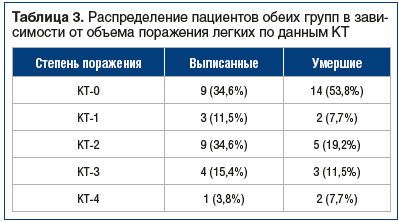
Среди умерших пациентов легкое течение пневмонии КТ 0–1 было выявлено в 61,5% случаев (табл. 3). Таким образом, поражение легочной ткани не явилось ведущим в танатогенезе у пациентов, умерших от инсульта на фоне новой коронавирусной инфекции.
Достоверной разницы в частоте сопутствующей патологии между группами выявлено не было. Наиболее распространенной сочетанной патологией являлась гипертоническая болезнь (в 92% случаев у выписанных пациентов и в 96,2% — у умерших). Сахарный диабет у выписанных пациентов был выявлен в 19,2% случаев, у умерших — в 96,2%. Нарушение ритма сердца (фибрилляция / трепетание предсердий) у выписанных пациентов диагностировано в 26% случаев, у умерших — в 34,6%. Атеросклероз брахиоцефальных артерий был выявлен у 61,5% выписанных пациентов и у 46,2% умерших. При анализе с учетом возрастных групп у пациентов молодого и среднего возраста из сопутствующих заболеваний встречалась только гипертоническая болезнь, отсутствовали сахарный диабет, нарушение ритма сердца и атеросклероз магистральных артерий.
Все пациенты получали терапию согласно протоколу, утвержденному временными рекомендациями по лечению новой коронавирусной инфекции [26].
Достоверных различий по частоте назначения антикоагулянтов и антиагрегантов в группе выписанных и умерших пациентов не выявлено (табл. 4). Не получали антитромботической терапии только пациенты с геморрагическими инсультами, которые составили 7,7% среди выписанных пациентов и 19,2% среди умерших, достоверность различий 1,2.
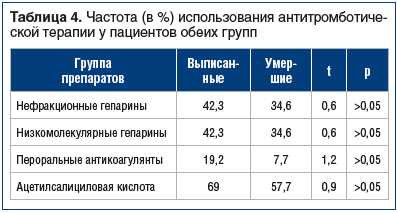
Данные о проведении тромболитической терапии и тромбоэкстракции будут представлены отдельно, эти пациенты не вошли в настоящее исследование.
Обсуждение
Как показали результаты проведенного нами исследования, новая коронавирусная инфекция осложняет течение ОНМК, приводя в части случаев к летальному исходу. Чаще всего новая коронавирусная инфекция сочеталась с ишемическим инсультом, преобладал большой полушарный инсульт.
Летальность была выше в подгруппах молодых пациентов и больных среднего возраста.
Среди изменений показателей крови следует отметить выраженное повышение уровня СРБ, особенно высокое в группе умерших пациентов. По данным исследования китайских ученых [27], уровень СРБ был повышен у 60,7% пациентов, что соответствует нашим данным. Повышенный уровень прокальцитонина (маркер вторичной бактериальной инфекции, осложняющей течение COVID-19) был обнаружен у 23,5% пациентов. В исследованииях F. Zhou et al. [28, 29] была показана значимая связь между повышенными уровнями КФК, ЛДГ, АСТ, АЛТ и внутрибольничной смертностью (р=0,043). Также было установлено, что уровень КФК был значительно выше у пациентов с COVID-19 тяжелого течения по сравнению с уровнем у пациентов с легким течением (р=0,0016). По нашим данным, также было выявлено повышение уровней вышеуказанных показателей в обеих группах. Нарушение функции печени может быть использовано в качестве индикатора оценки прогноза пациентов с COVID-19. Поэтому соответствующие показатели должны тщательно контролироваться во время госпитализации [29–31]. В исследовании W. Guan et al. [27], объединившем данные из различных провинций Китая, были получены схожие результаты: повышенный уровень ЛДГ был выявлен у 41% умерших пациентов, а среди пациентов с тяжелым течением заболевания по сравнению с больными с легким течением высокие значения данного фермента выявлены у 81,5% пациентов против 56,4%.
В группе умерших пациентов преобладало поражение легких КТ 0–1, таким образом, поражение легочной ткани не явилось ведущей причиной внутрибольничной летальности от инсульта на фоне новой коронавирусной инфекции.
У всех пациентов молодого и среднего возраста из сопутствующих хронических заболеваний, которые являются фоном для развития ОНМК, имелась только гипертоническая болезнь, отсутствовали сахарный диабет, нарушение ритма сердца, стенозирующий атеросклероз брахиоцефальных артерий.
Заключение
Известно, что COVID-19 ассоциирован с гиперкоагуляцией. Динамическое наблюдение за биомаркерами крови в период заболевания должно определять индивидуальный подход к лечению и необходимость в интенсивной терапии, а также прогнозировать исход.
Новая коронавирусная инфекция осложняет течение инсульта, увеличивает летальность в подгруппе молодых пациентов и пациентов среднего возраста, не отягощенных тяжелыми хроническими заболеваниями, такими как сахарный диабет и др. ОНМК может являться атипичным симптомом COVID-19 и приводить к летальному исходу при отсутствии массивного поражения легких.
Таким образом, высокая летальность при сочетании данных заболеваний повышает актуальность дальнейшего изучения причинно-следственной связи процессов, происходящих при ОНМК на фоне новой коронавирусной инфекции.
2. Panigada M., Bottino N., Tagliabue P. et al. Hypercoagulability of COVID-19 patients in intensive care unit: A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost. 2020;18(7):1738–1742. DOI: 10.1111/jth.14850.
3. Ranucci M., Ballotta A., Di Dedda U. et al. The procoagulant pattern of patients with COVID-19 acute respiratory distress syndrome. J Thromb Haemost. 2020;18(7):1747–1751. DOI: 10.1111/jth.14854.
4. Ackermann M., Verleden S.E., Kuehnel M. et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–128. DOI: 10.1056/NEJMoa2015432.
5. Teuwen L.A., Geldhof V., Pasut A., Carmeliet P. COVID-19: the vasculature unleashed. Nat Rev Immunol. 2020;20(7):389–391. DOI: 10.1038/s41577-020-0343-0.
6. Varga Z., Flammer A.J., Steiger P. et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418. DOI: 10.1016/S0140-6736(20)30937-5.
7. Hamming I., Timens W., Bulthuis M.L. et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203(2):631–637. DOI: 10.1002/path.1570.
8. Engelmann B., Massberg S. Thrombosis as an intravascular effector of innate immunity. Nat Rev Immunol. 2013;13(1):34–45. DOI: 10.1038/nri3345.
9. Levi M., van der Poll T. Coagulation and sepsis. Thromb Res. 2017;149:38–44. DOI: 10.1016/j.thromres.2016.11.007.
10. Jackson S.P., Darbousset R., Schoenwaelder S.M. Thromboinflammation: challenges of therapeutically targeting coagulation and other host defense mechanisms. Blood. 2019;133(9):906–918. DOI: 10.1182/blood-2018-11-882993.
11. Bikdeli B., Madhavan M.V., Gupta A. et al. Pharmacological Agents Targeting Thromboinflammation in COVID-19: Review and Implications for Future Research. Thromb Haemost. 2020;120(7):1004–1024. DOI: 10.1055/s-0040-1713152.
12. Koupenova M., Corkrey H.A., Vitseva O. et al. The role of platelets in mediating a response to human influenza infection. Nat Commun. 2019;10(1):1780. DOI: 10.1038/s41467-019-09607-x.
13. Yeaman M.R. Platelets in defense against bacterial pathogens. Cell Mol Life Sci. 2010;67(4):525–544. DOI: 10.1007/s00018-009-0210-4.
14. Semple J.W., Italiano J.E. Jr, Freedman J. Platelets and the immune continuum. Nat Rev Immunol. 2011;11(4):264–274. DOI: 10.1038/nri2956.
15. Merad M., Martin J.C. Pathological inflammation in patients with COVID-19: a key role for monocytes and macrophages. Nat Rev Immunol. 2020;20(7):448. DOI: 10.1038/s41577-020-0353-y.
16. Zuo Y., Yalavarthi S., Shi H. et al. Neutrophil extracellular traps in COVID-19. JCI Insight. 2020;5(11):e138999. DOI: 10.1172/jci.insight.138999.
17. Gupta N., Zhao Y.Y., Evans C.E. The stimulation of thrombosis by hypoxia. Thromb Res. 2019;181:77–83. DOI: 10.1016/j.thromres.2019.07.013.
18. Giannis D., Ziogas I.A., Gianni P. Coagulation disorders in coronavirus infected patients: COVID-19, SARS-CoV-1, MERS-CoV and lessons from the past. J Clin Virol. 2020;127:104362. DOI: 10.1016/j.jcv.2020.104362.
19. Deshpande C. Thromboembolic Findings in COVID-19 Autopsies: Pulmonary Thrombosis or Embolism? Ann Intern Med. 2020;173(5):394–395. DOI: 10.7326/M20-3255.
20. Zhang H., Zhou P., Wei Y. et al. Histopathologic Changes and SARS-CoV-2 Immunostaining in the Lung of a Patient With COVID-19. Ann Intern Med. 2020;172(9):629–632. DOI: 10.7326/M20-0533.
21. Dolhnikoff M., Duarte-Neto A.N., de Almeida Monteiro R.A. et al. Pathological evidence of pulmonary thrombotic phenomena in severe COVID-19. J Thromb Haemost. 2020;18(6):1517–1519. DOI: 10.1111/jth.14844.
22. Copin M.C., Parmentier E., Duburcq T. et al. Lille COVID-19 ICU and Anatomopathology Group. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med. 2020;46(6):1124–1126. DOI: 10.1007/s00134-020-06057-8.
23. Fuchs T.A., Brill A., Wagner D.D. Neutrophil extracellular trap (NET) impact on deep vein thrombosis. Arterioscler Thromb Vasc Biol. 2012;32(8):1777–1783. DOI: 10.1161/ATVBAHA.111.242859.
24. Geddings J.E., Mackman N. New players in haemostasis and thrombosis. Thromb Haemost. 2014;111(4):570–574. DOI: 10.1160/TH13-10-0812.
25. Голохвастов С.Ю., Литвиненко И.В., Янишевский С.Н. и др. Ишемический мозговой инсульт как первое клиническое проявление новой коронавирусной инфекции. Известия Российской военно-медицинской академии. 2020;39(S3–2):35–38. [Golokhvastov S.Yu., Litvinenko I.V., Yanishevsky S.N. Ischemic cerebral stroke as the first clinical manifestation of a new coronavirus infection. Proceedings of the Russian Military Medical Academy. 2020;39(S3–2):35–38 (in Russ.)].
26. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (CОVID-19). Версия 6 (28.04.2020). М.; 2020. [Temporary guidelines. Prevention, diagnosis and treatment of novel coronavirus infection (COVID-19). Version 6 (28.04.2020). M.; 2020 (in Russ.)].
27. Guan W., Zheng-yi N., Yu H. et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382(18):1708–1720. DOI: 10.1056/NEJMoa2002032.
28. Zhou F., Xia J., Yuan H.X. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet (London). 2020;395(10229):1054–1062. DOI: 10.1016/S0140-6736(20)30566-3.
29. Zhou F., Xia J., Yuan H.X. et al. Liver injury in COVID-19: Known and unknown. World J Clin Cases. 2021;9(19):4980–4989. DOI: 10.12998/wjcc.v9.i19.4980.
30. Wang H., Qiu P., Liu J. et al. The liver injury and gastrointestinal symptoms in patients with Coronavirus Disease 19: A systematic review and meta-analysis. Clin Res Hepatol Gastroenterol. 2020;44(5):653–661. DOI: 10.1016/j.clinre.2020.04.012.
31. Da B.L., Mitchell R.A., Lee B.T. et al. Kinetic patterns of liver enzyme elevation with COVID-19 in the USA. Europ J gastroenterology and hepatology. 2020;32(11):1466–1469. DOI: 10.1097/MEG.0000000000001792.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
