Вакцинотерапия вируса простого герпеса: от прошлого до настоящего — где мы? Обзор литературы
Рецидивирующее течение инфекции, вызванной вирусом простого герпеса 1 и 2 типов, является актуальной медико-социальной проблемой. К настоящему времени в арсенале врачей существует не так много препаратов прямого противовирусного действия, имеющих доказанную эффективность против вирусов герпеса. Лечение пациентов с рецидивирующими герпетическими инфекциями затруднено из-за особенностей патогенеза инфекции, способности вируса к уклонению от иммунного ответа. Применение этиотропной терапии может привести к развитию резистентности. В сложившейся ситуации важным вопросом в лечении и профилактике рецидивирующих герпетических инфекций является применение специфических вакцин. Обзор литературы посвящен вакцинотерапии простого герпеса, дана подробная характеристика различных видов вакцин. Информация об эффективности вакцинации при рецидивирующем течении герпетической инфекции противоречива. Так, эффективность некоторых вакцин, показанная в доклинических исследованиях, не была подтверждена в клинических испытаниях. Для других вакцин была продемонстрирована клиническая эффективность. Перспективными направлениями в лечении герпесвирусных инфекций является разработка усовершенствованных схем терапии с использованием вакцин, рекомбинантных интерферонов и пробиотиков, позволяющих быстро подготовить пациента к началу вакцинотерапии, а также удлинить период последующей ремиссии.
Ключевые слова: вирус простого герпеса, герпетическая инфекция, вакцинопрофилактика, вакцинотерапия, генитальный герпес, лабиальный герпес, офтальмогерпес.
Для цитирования: Мелехина Е.В., Солдатова Е.Ю., Музыка А.Д., Понежева Ж.Б. Вакцинотерапия вируса простого герпеса: от прошлого до настоящего — где мы? Обзор литературы. РМЖ. Медицинское обозрение. 2021;29(10):3-10.
Vaccination of herpes simplex virus: past to present — where are we? Literature review
E.V. Melekhina, E.Yu. Soldatova, A.D. Musica, Zh.B. Ponezheva
Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Moscow
The recurrent course of herpes simplex virus type 1 and 2 is an urgent medical and social problem. Nowadays, there are not many direct antiviral drugs in the arsenal of doctors that have proven efficacy against herpes viruses. Treatment of patients with recurrent herpes viruses is difficult due to the pathogenesis peculiarities and the ability of immune evasion. The use of etiotropic therapy can lead to resistance occurrence. In the current situation, the use of specific vaccines is an important issue in the treatment and prevention of recurrent herpes viruses. The literature review is devoted to herpes vaccine therapy with the given detailed description of various vaccine types. Information about the vaccination efficacy in the recurrent course of the herpes virus is contradictory. Thus, the efficacy of some vaccines shown in preclinical studies has not been confirmed in clinical trials. Also, clinical efficacy has been demonstrated for other vaccines. Promising directions in the treatment of herpesvirus infections are the development of improved therapy regimens using vaccines, recombinant interferons, and probiotics, which allow to quickly prepare the patient for the vaccine therapy onset, as well as to lengthen the period of subsequent remission.
Keywords: herpes simplex virus, herpesvirus infection, vaccination, vaccine therapy, genital herpes, labial herpes, ocular herpes.
For citation: Melekhina E.V., Soldatova E.Yu., Musica A.D., Ponezheva Zh.B. Vaccination of herpes simplex virus: past to present — where are we? Literature review. RMJ. 2021;10:3–10.
Введение
Вирусами простого герпеса (ВПГ) инфицировано 65–90% населения в мире [1]. Рецидивирующее течение герпетической инфекции 1 и 2 типов (возбудители — ВПГ-1 и ВПГ-2 соответственно) является актуальной медико-социальной проблемой. ВПГ может вызывать не только язвенные поражения полости рта, кожных покровов или половых органов, но и генерализованные формы инфекции с развитием энцефалита и тяжелыми исходами в различных возрастных группах. Следует отметить, что ВПГ является триггером развития хронической соматической патологии у пациентов различного возраста и приводит к широкому спектру рецидивирующих заболеваний на протяжении всей жизни [2]. Так, вирусы герпетической группы играют роль в развитии неопластических процессов и атеросклероза, влияют на течение беременности и родов [1, 3].
Способность вирусов герпеса к активации генома вируса иммунодефицита человека (ВИЧ) обеспечивает возможность влияния на прогрессирование заболевания [4, 5]. У лиц с вторичной иммунологической недостаточностью встречаются атипичные формы герпетической инфекции.
В структуре заболеваний, которые передаются половым путем, инфекция, вызванная ВПГ-2, занимает одно из ведущих мест. Рецидивы генитального герпеса при инфекции ВПГ-2 отмечаются у 90% пациентов, при ВПГ-1 — у 60% больных.
Вирусные заболевания глаз, вызванные ВПГ, могут протекать клинически тяжело — с поражением всех сред глаза и зрительного нерва, возможно также снижение остроты зрения вплоть до полной слепоты. При тяжелом течении офтальмогерпеса бывает трудно добиться выздоровления пациента в течение 2–3 мес. [6].
Вирус простого герпеса поражает не только нервную систему, но и слизистые оболочки, паренхиматозные органы. Персистенция вируса сопровождается снижением активности Т-клеточного звена иммунитета, что приводит к клинической манифестации заболевания. ВПГ персистирует и репродуцируется в иммунных клетках, нарушая их активность или приводя к гибели, таким образом, развивается вторичная иммунологическая недостаточность, формируется «порочный круг». ВПГ способен уклоняться от иммунного ответа, заболевание протекает с периодами обострения и ремиссии. У пациентов с рецидивирующей ВПГ-инфекцией снижена продукция эндогенного интерферона (ИФН), активность NК-клеток и антителозависимая клеточная цитотоксичность, снижено абсолютное число и активность Т-лимфоцитов (СD3+, СD4+, СD8+) и нейтрофилов [4]. ВПГ-1 и ВПГ-2 выработали множество стратегий иммунного уклонения, многие из которых уникальны. Способность вируса уклоняться от врожденного, гуморального и Т-клеточного, иммунитета может затруднять диагностику и разработку эффективной терапии, в том числе и вакцин.
С учетом вышесказанного лечение пациентов с рецидивирующей ВПГ-инфекцией затруднено из-за особенностей патогенеза инфекции, способности к уклонению от иммунного ответа. Кроме того, применение этиотропной терапии может привести к развитию резистентности [4]. Очевидна необходимость поиска новых лекарственных средств и терапевтических тактик, которые могли бы не только подавлять репликацию вирусов, но и восстанавливать противовирусную защиту организма.
К настоящему времени в арсенале врачей существует не так много препаратов прямого противовирусного действия, имеющих доказанную эффективность против вирусов герпеса [3, 7]. Рецидивирующее течение заболевания подразумевает применение препаратов прямого противовирусного действия длительными курсами с низкими дозами, что способствует образованию штаммов герпесвирусов, резистентных к препаратам группы аналогов нуклеозидов [8, 9]. Целый ряд препаратов, эффективных в отношении лечения герпесвирусных инфекций, имеет иммуномодулирующее действие, что ограничивает их применение у пациентов с аутоиммунными заболеваниями, протекающими на фоне активных герпесвирусных инфекций (например, с ревматоидным артритом) [10, 11]. Целесообразно отметить, что лекарственные средства, используемые для лечения и профилактики герпетических вирусных инфекций, должны отвечать ряду требований, таких как: хорошая переносимость, малая токсичность и низкая вероятность развития резистентности микроорганизмов, возможность применения во время беременности и лактации. Однако целый ряд противогерпетических препаратов обладает широким спектром побочных эффектов, что не позволяет применять их у беременных, кормящих и детей [3]. Среди более чем 200 видов герпесвирусных инфекций только 9 имеют доказанную роль в патологии человека: α-герпесвирусы (ВПГ-1, ВПГ-2, Varicella Zoster virus), β-герпесвирусы (цитомегаловирус (ЦМВ), ВГЧ-6А, ВГЧ-6В, ВГЧ-7), γ-герпесвирусы (вирус Эпштейна – Барр (ВЭБ), ВГЧ-8). В сложившейся ситуации важным вопросом в лечении и профилактике рецидивирующих герпетических вирусных инфекций является применение специфических вакцин [12–15].
История вакцинопрофилактики и вакцинотерапии герпесвирусных инфекций
Разработка средств специфической профилактики против инфекций, вызванных ВЭБ и ЦМВ, ведется в двух направлениях — разрабатываются препараты профилактического и лечебного действия. Первые предназначены для иммунизации неинфицированных ВЭБ и ЦМВ лиц, вторые — для лечения сопряженной с ВЭБ и ЦМВ онкологической патологии [12]. Однако до сих пор в рутинную клиническую практику они не внедрены. С успехом применяются вакцины против Varicella Zoster virus, а также лечебные вакцины против ВПГ-1 и ВПГ-2. Трудности вакцинопрофилактики герпесвирусных инфекций связаны с уклонением от иммунного ответа хозяина, длительной персистенцией вируса герпеса в организме человека, наличием периодов латенции, реактивации и бессимптомного носительства, а также отсутствием системной вирусемии на фоне местного воспаления [13, 14].
История разработки и испытания герпетических вакцин началась в прошлом веке. За эти годы были созданы и прошли клинические испытания герпетические вакцины, предназначенные для профилактического и лечебного применения (рис. 1).
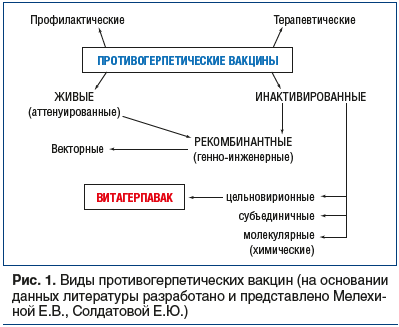
Несмотря на имеющийся мировой опыт использования вакцин как для профилактики инфицирования вирусами герпеса у серонегативных пациентов, так и для лечения рецидивирующих форм герпетической инфекции у серопозитивных индивидуумов, неизвестно, возможно ли безопасно устранить скрытый вирусный резервуар у серопозитивных людей [15]. Кроме того, с учетом высокого уровня серопозитивности к ВПГ-1 в молодом возрасте вакцина должна быть иммуногенной в условиях уже имеющегося иммунитета к ВПГ.
Вакцины против ВПГ для профилактического и терапевтического применения представлены в таблице 1 [16].
![Таблица 1. Результаты клинических исследований противогерпетических вакцин профилактического и терапевтического действия [16] Таблица 1. Результаты клинических исследований противогерпетических вакцин профилактического и терапевтического действия [16]](/upload/medialibrary/fa7/3-2.png)
Живые (аттенуированные) вакцины против ВПГ
Живые вакцины получают путем инактивации (мутации/аттенуации) гена, ответственного за синтез фактора вирулентности (штаммы с ослабленной вирулентностью), а также из дивергентных штаммов либо путем отбора естественных авирулентных штаммов. Вакцинные штаммы способны к размножению в месте введения вакцины и в лимфатических узлах. Как правило, живые вакцины являются цельновирионными (корпускулярными). Векторные вакцины, которые получены генно-инженерным путем, также можно отнести к живым вакцинам. Живые вакцины обладают высокой иммуногенностью — активируют все звенья иммунной системы, вызывая системный и локальный, иммуноглобулиновый и клеточный иммунный ответ, схожий с постинфекционным. Это имеет особое значение при тех инфекциях, когда клеточный иммунитет играет важную роль, а также при инфекциях слизистых оболочек (в том числе при ВПГ), где требуется как системный, так и локальный иммунитет. Локальное применение живых вакцин более эффективно у непраймированных хозяев, чем применение инактивированных вакцин. К сожалению, живые вакцины не могут быть использованы для лечения герпесвирусных инфекций у человека из-за возможной реверсии вирулентных форм и развития заболевания.
В вакцине gH-null отсутствует ген гликопротеина H (gH), который необходим для проникновения вируса и распространения от клетки к клетке. Таким образом, вакцинный штамм вируса ограничен одним инфекционным циклом. Вакцина была применена с терапевтической целью у добровольцев с 6 или более ежегодными рецидивами генитального герпеса. Применение ее было безопасным, но изменения количества рецидивов, времени до заживления или сроков выделения вируса в сравнении с плацебо получено не было [17]. Специфические иммунные реакции на вакцину в ходе клинического исследования зарегистрированы не были. Вакцина больше не применялась и никогда не тестировалась в профилактических целях.
Впоследствии в качестве кандидатов на профилактические вакцины было разработано несколько различных вирусов с дефектом репликации или одноцикловых вирусов. Первым из них, прошедшим клинические испытания, был вирус ВПГ-2, у которого отсутствовали гены UL5 (хеликаза и праймаза) и UL29 (ДНК-связывающий белок) и который был обозначен как dl5-29 или HSV529 [18, 19]. В ходе доклинических исследований было установлено, что вакцина безопасна, создает высокий титр нейтрализующих антител и CD4 и CD8 Т-клеточных ответов, защищает от острой или рецидивирующей генитальной инфекции, вызванной ВПГ-2, серонегативных самок мышей, а также неиммунных или ВПГ-1-инфицированных самок морских свинок при вагинальном заражении модели [20]. Это уменьшало частоту развития латентной инфекции [21, 22].
В исследовании I фазы штамма HSV529 вакцина показала себя безопасной и вызывала нейтрализующие и специфичные к gD антитела реакции у дважды серонегативных участников. Однако, в отличие от исследований на морских свинках, у серопозитивных участников вакцина не стимулировала реакцию нейтрализующих антител ВПГ-1 или ВПГ-2 [22, 23].
Вирус ВПГ-2, содержащий делецию в ICP0 (ΔNLS), обладает способностью к репликации, но чувствителен к ИФН, что способствует ослаблению его фенотипа в моделях животных [24]. ΔNLS обеспечивал большую защиту от высокодозной вакцины против ВПГ-2 по сравнению с вакциной субъединицы gD-2 у морских свинок, подвергнутых интравагинальному воздействию ВПГ-2 (штамм MS). Он вызывал полиантигенные иммунные реакции, включая образование специфических и нейтрализующих антител к gD-2, хотя специфические корреляты иммунной защиты не были определены [25].
Вакцина на основе ΔNLS была протестирована в исследовании безопасности I фазы у 20 серопозитивных добровольцев с ВПГ-1 и/или ВПГ-2, имевших в анамнезе генитальный герпес. Участники самостоятельно сообщили об уменьшении симптомов. Исследование II фазы было запланировано, но отменено, когда стало известно, что вакцина была протестирована при отсутствии необходимых доклинических исследований безопасности. Кроме того, несколько участников сообщили о неблагоприятных побочных эффектах.
Инактивированные (цельновирионные и субъединичные) вакцины
Инактивированные вакцины содержат убитые микроорганизмы или их субклеточные структуры, которые нарабатывают на культурах клеток или куриных эмбрионах, инактивируют химически или физически и высушивают для достижения стабильности при хранении. Основной механизм инактивации — образование «сшивок» между нуклеиновой кислотой и белком. Минусом инактивированных вакцин является высокая реактогенность (высокий процент балласта, используемого для инактивации) и низкая иммуногенность (создают только гуморальный и не очень стойкий иммунитет), что требует повторных введений (бустерные иммунизации) и/или применения адъювантов.
При разработке инактивированных вакцин была попытка использовать штаммы ВПГ-1, выращенного в культуре почек кролика, позже были разработаны инактивированные вакцины [26, 27].
В 1980-х годах в Болгарии разработали и применяли культуральную инактивированную вакцину, убитую формалином. Был продемонстрирован иммуномодулирующий эффект, стимуляция активности Т-клеточного звена иммунитета и активности макрофагов. Эффект наблюдался у 73–93% больных генитальным герпесом. Выявлен синергизм при использовании болгарской вакцины в сочетании с лазеротерапией [1].
Две субъединичные вакцины — gB/gD/MF59 и gD-2-alum/MPL прошли III фазу клинических испытаний эффективности в качестве профилактических вакцин с ограниченным успехом.
Вакцина gB/gD/MF59 была оценена в 2 плацебо-контролируемых исследованиях. В одном исследовании был зарегистрирован 531 серонегативный партнер ВПГ-2-серопозитивных людей, инфицированных ВПГ-2, а в другом – 1862 человека, которые обратились к врачу с проявлениями заболеваний, передающихся половым путем. Вакцина индуцировала высокий уровень нейтрализующих антител, но общая эффективность вакцины составила 9% (95% доверительный интервал (ДИ) от -29% до 36%) [28].
Вакцина gD-2/AS04, состоящая из gD-2 с монофосфорильным липидом А (MPL) и гидроксидом алюминия (квасцы), была оценена в 3 различных клинических испытаниях III фазы. Первые 2 исследования были проведены в серодискордантных парах. В одном из них было зарегистрировано 847 дважды серонегативных участников (268 женщин), а в другом — 1867 серопозитивных по ВПГ-1 (710 женщин). Объединение данных обоих исследований показало, что вакцина обеспечивала защиту у приблизительно 70% дважды серонегативных женщин, но не у серопозитивных женщин с ВПГ-1 или у мужчин независимо от их серостатуса [29].
Результаты, полученные в субпопуляциях, были подтверждены в третьем клиническом исследовании, в котором приняли участие 8323 дважды серонегативные женщины в возрасте от 18 до 30 лет с первичной конечной точкой заболевания генитальным герпесом, вызванного любым серотипом. Общая эффективность вакцины против заболевания генитальным герпесом составила всего 20% (95% ДИ от 29% до 50%), однако наблюдалась умеренная эффективность против генитального заболевания, вызванного ВПГ-1 (58%; 95% ДИ от 12% до 80%) [30].
Таким образом, субъединичная вакцина (gD2gB-2-MF59) имела кратковременный эффект [28], вакцина gD-2/AS04 снижала частоту заболевания у 73–74% пациенток с инфекцией ВПГ-2 и лишь на 38–42% обеспечивала снижение количества новых случаев инфицирования у серонегативных женщин [29].
Вакцина герпетическая культуральная сухая инактивированная
В Санкт-Петербурге в 1994 г. производилась герпетическая культуральная сухая инактивированная вакцина [31]. Ее терапевтический эффект был продемонстрирован в ходе комплексного лечения пациентов с рецидивирующими формами инфекции [32, 33].
Клиническая эффективность данной вакцины изучалась в исследовании с участием 2391 больного: 44% страдали генитальным герпесом, 35% — лабиальным герпесом, 21% — офтальмогерпесом, кожными проявлениями и другими формами герпетической инфекции. Эффективность была достигнута в 85% случаев при комплексном лечении с использованием вакцины [34].
Рекомбинантные вакцины (субъединичные, пептидные, ДНК-опосредованные)
Рекомбинантная технология совершила прорыв в создании принципиально новых вакцин. Принцип создания генно-инженерных вакцин заключается в том, что в геном живых аттенуированных вирусов, бактерий, дрожжей или клеток эукариотов встраивается ген, кодирующий образование протективного антигена того возбудителя, против которого будет направлена вакцина. В качестве вакцин используются сами модифицированные микроорганизмы или протективный антиген, образующийся при их культивировании в условиях in vitro. В первом случае иммунный ответ направлен не только на продукты встроенного гена, но и на носитель вектора. Во втором случае для создания векторных живых вирусных вакцин используют аттенуированный ДНК-содержащий вирус, в геном которого встраивается необходимый предварительно клонированный ген. Вирус, носитель вектора, активно размножается, а продукт встроенного гена обеспечивает формирование иммунитета. Вектор может содержать несколько встроенных генов, отвечающих за экспрессию соответствующих чужеродных антигенов. Экспериментальные векторные вакцины на основе вируса осповакцины получены к ветряной оспе, гриппу А, гепатитам А и В, малярии, простому герпесу. К сожалению, вакцины испытаны преимущественно на животных, которые устойчивы к большинству из этих инфекций. Важно отметить, что рекомбинантный продукт не всегда имеет ту же структуру, что и естественный антиген, поэтому иммуногенность такого продукта может быть сниженной.
Имеются данные о том, что с соответствующим адъювантом рекомбинантные вакцины против ВПГ вызывают хороший гуморальный и клеточно-опосредованный иммунитет у серонегативных лиц. Эффективность лечебной иммунизации серопозитивных больных с целью уменьшения частоты рецидивов герпетической инфекции имеет не столь однозначную оценку. Так, завершенные исследования по апробации рекомбинантной ВПГ-2 gpD вакцины у больных генитальным герпесом показали небольшой, но достоверный эффект в уменьшении частоты рецидивов герпетической инфекции [1].
Неизвестно, отличаются ли типы иммунных реакций, необходимых для терапевтических вакцин, которые предназначены для снижения частоты и тяжести клинических рецидивов и/или бессимптомного течения, от типов, необходимых для профилактики. Однако, несмотря на то, что несколько вакцин продемонстрировали эффективность на животных мышиных моделях, результаты клинических испытаний были разочаровывающими.
При применении вакцины HerpV в рандомизированном двойном слепом исследовании II фазы у большинства пациентов развился стойкий анти-ВПГ цитотоксический Т-клеточный иммунный ответ, но была только на 17% снижена частота вирусного выпадения, несмотря на 75% снижение вирусной нагрузки [35, 36].
Вакцина, содержащая ДНК ВПГ-2 и состоящая из gD и белка тегумента UL46, оценивалась в плацебо-контролируемом исследовании II фазы, в котором участвовал 261 здоровый серопозитивный взрослый доброволец с ВПГ-2 в анамнезе, переносивший от 4 до 9 рецидивов в год. Хотя годовая частота рецидивов в группе плацебо была ниже, чем в основной группе, но статистически достоверных различий для демонстрации эффективности выявлено не было [37].
Альтернативой белковым, ДНК- или живым аттенуированным вакцинам, или вакцинам с одним циклом является стратегия векторной вакцины. Векторные вакцины относятся к вставке антигенных целевых генов от одного патогена в неродственную векторную «основу». Они были оценены, например, как стратегия профилактики ВИЧ [38].
Было проведено несколько доклинических исследований стратегий векторной вакцины для профилактики или лечения ВПГ, которые могут дать представление о будущем развитии. Например, гликопротеин В ВПГ-1 (gB1) был введен в вектор вируса иммунодефицита кошек (FIV) и протестирован против вагинальных инфекций ВПГ-1 и ВПГ-2 у мышей. Вакцина вызвала перекрестно-нейтрализующие антитела и клеточно-опосредованные реакции, которые защитили 100% и 75% животных от тяжелого течения заболевания ВПГ-1 и ВПГ-2 соответственно, но не от инфицирования [39].
Витагерпавак
С 2003 г. в РФ запущено производство вакцины Витагерпавак (в мировой практике подобного рода вакцин нет), которая представляет собой лиофилизированный инактивированный антиген ВПГ типов 1 и 2, выращенного на перевиваемой линии клеток почек зеленой мартышки — VeroB, разрешенных Всемирной организацией здравоохранения в качестве субстрата для производства вирусных вакцин. Лиофилизированная вакцина выпускается во флаконах по 0,3 мл, предназначена для внутрикожного введения (1 прививочная доза — 0,2 мл). Вакцина стерильна, нетоксична, непирогенна и безопасна.
Клинические исследования по оценке эффективности и безопасности вакцины Витагерпавак, проведенные в разные годы, изучали три основных клинических варианта течения герпетической инфекции, вызванной ВПГ-1 и ВПГ-2: рецидивирующий генитальный герпес, рецидивирующий лабиальный герпес, офтальмогерпес и смешанные формы. Проведенные клинические исследования и их результаты представлены в таблице 2. При использовании вакцины показан иммунокорригирующий эффект: снижение степени иммунных расстройств со 2–3-й до 1-й после первой вакцинации, а также расстройства 1-й степени через 6 мес.
![Таблица 2. Резюме исследований, посвященных изучению клинической эффективности вакцины Витагерпавак [39–49] Таблица 2. Резюме исследований, посвященных изучению клинической эффективности вакцины Витагерпавак [39–49]](/upload/medialibrary/d94/3-3.png)
Вакцинация хронически инфицированных ВПГ кроликов сопровождалась усилением в 3–4 раза специфических реакций Т-клеточного иммунитета, реакции задержки миграции лимфоцитов, тогда как высокий уровень В-клеточных реакций (титр антител, выявляемый в реакциях нейтрализации и связывания комплемента) оставался неизменным. Усиление реакций Т-клеточного иммунитета на антигены ВПГ сохранялось в течение 45 дней после курса внутрикожной вакцинации (5 инъекций). Сравнительное изучение активности реакций Т-клеточного иммунитета у вакцинируемых показало усиление специфической Т-киллерной активности лимфоцитов. Таким образом, вакцинация способствовала увеличению активности NК-клеток и прекращению вирусемии [13].
Витагерпавак применяют не ранее 5 дней после исчезновения клинических симптомов инфекции.
Таким образом, российскими учеными (начиная с исследований 1990-х годов и заканчивая исследованиями последних лет) была продемонстрирована клиническая эффективность и безопасность противогерпетической вакцины Витагерпавак в предотвращении тяжести и частоты рецидивов у 63–85% пациентов с монотонным типом рецидивирования генитального герпеса, орофациального непрерывно рецидивирующего герпеса и офтальмогерпеса.
Заключение
В заключение следует отметить, что среди вирусных заболеваний герпетическая инфекция занимает одно из важных мест, однако на современном этапе развития вирусологии не существует эффективного метода полной элиминации ВПГ из организма. Несмотря на достигнутые успехи в лечении простого герпеса, существующие препараты и их комплексы не обеспечивают достижения полной ремиссии заболевания. До настоящего времени отсутствуют лекарственные средства системного действия, обладающие длительным периодом полувыведения, способные уменьшить вероятность «прорывов» инфекции в период супрессивной терапии. Поэтому поиск новых лекарственных средств и методов лечения и совершенствование существующих с применением вакцинотерапии и вакцинопрофилактики ВПГ по-прежнему актуальны.
Следовательно, основной целью противогерпетической терапии является формирование адекватного иммунного ответа и уменьшение частоты и тяжести рецидивов, а также блокирование реактивации вируса в очагах персистирования и снижение репликации в период обострения заболевания. В связи с этим перспективным терапевтическим направлением является разработка и использование противогерпетических вакцин. Важно отметить, что в случае инфекции, вызванной ВПГ, вакцина рассматривается не только как специфическая профилактика развития инфекции у серонегативных лиц, но и как терапевтическое воздействие с целью уменьшения тяжести и частоты рецидивов герпетической инфекции у серопозитивных индивидуумов.
Противоречива информация об эффективности вакцинации при рецидивирующем течении герпетической инфекции. Ряд авторов доказали, что применение инактивированной культуральной поливакцины против ВПГ способствует прекращению вирусемии и нормализации показателей Т-клеточного иммунитета и, как следствие, клиническому улучшению состояния пациентов.
Разработанные живые вакцины отличаются высокой иммуногенностью, однако могут привести к развитию заболевания у человека. Вакцины против живых вирусов со специфическими делециями в генах известной функции демонстрировали эффективность в моделях на животных, однако не показали клинической эффективности у человека.
Инактивированные вакцины недостаточно иммуногенны, требуют введения бустерных доз и применения адъювантов, обладают высокой реактогенностью. Субъединичные вакцины имеют невысокую эффективность или кратковременный эффект, а разработанная трехвалентная вакцина показала эффективность только на доклиническом этапе. Рекомбинантные вакцины вызывают иммунный ответ преимущественно у серонегативных лиц, несмотря на хорошие результаты испытаний на животных, их клинический эффект был недостаточным.
Разработанная в нашей стране герпетическая культуральная сухая инактивированная вакцина демонстрировала эффективность у пациентов с генитальным, лабиальным герпесом, офтальмогерпесом. Вакцина Витагерпавак (лиофилизированный инактивированный антиген ВПГ типов 1 и 2) выпускается в РФ и не имеет аналогов за рубежом. Более чем в 10 сравнительных клинических исследованиях показаны высокий профиль безопасности и эффективность у 60–85% пациентов с хроническим рецидивирующим лабиальным герпесом, рецидивирующим герпетическим стоматитом, генитальным герпесом с монотонным типом рецидивирования, а также с заболеваниями глаз герпетической этиологии. Перспективным направлением в лечении герпесвирусных инфекций является разработка усовершенствованных схем терапии с использованием вакцин, рекомбинантных интерферонов и пробиотиков, позволяющих быстро подготовить пациента к началу вакцинотерапии, а также удлинить период последующей ремиссии.
Благодарность
Редакция благодарит АО «ФИРМА «ВИТАФАРМА» за оказанную помощь в технической редактуре настоящей публикации.
2. Xu X., Zhang Y., Li Q. Characteristics of herpes simplex virus infection and pathogenesis suggest a strategy for vaccine development. Rev Med Virol. 2019;29(4):e2054. DOI: 10.1002/rmv.2054.
3. Исаков В.А., Рыбалкин С.Б., Романцов М.Г. Герпесвирусная инфекция. Рекомендации для врачей. СПб.; 2006. [Isakov V.A., Rybalkin S.B., Romantsov M.G. Herpesvirus infection. Recommendations for doctors. SPb.; 2006 (in Russ.)].
4. Исаков Д.В., Исаков В.А. Простой и опоясывающий герпес (клиника, лечение и профилактика). Руководство для врачей под ред. Исакова В.А. СПб.: СпецЛит; 2021. [Isakov D.V., Isakov V.A. Simple and herpes zoster (clinic, treatment and prevention). A guide for physicians, Isakov. V.A., ed. SPb.: SpetsLit; 2021 (in Russ.)].
5. McAllister S.C., Schleiss M.R. Prospects and perspectives for development of a vaccine against herpes simplex virus infections. Expert Rev Vaccines. 2014;13(11):1349–1360. DOI: 10.1586/14760584.2014.932694.
6. Каспаров А.А., Воробьева О.К., Каспарова Е.А. Современные аспекты лечения офтальмогерпеса. Вестник Российской академии медицинских наук. 2003;2:44–49. [Kasparov A.A., Vorob’yeva O.K., Kasparova Ye.A. Modern aspects of the treatment of ophthalmic herpes. Vestnik Rossiyskoy akademii meditsinskikh nauk. 2003;2:44–49 (in Russ.)].
7. Боковой А.Г., Таратина М.Э. Лечение герпесвирусных инфекций у детей. Учебное пособие для студентов медицинских вузов, ординаторов и врачей. М.: МАКС Пресс; 2008. [Bokovoy A.G., Taratina M.E. Treatment of herpesvirus infections in children. Textbook for medical students, residents and doctors. M.: MAKS Press; 2008 (in Russ.)].
8. Piret J., Boivin G. Antiviral resistance in herpes simplex virus and varicella-zoster virus infections: diagnosis and management. Curr Opin Infect Dis. 2016;29(6):654–662. DOI: 10.1097/QCO.0000000000000288.
9. Duan R., de Vries R.D., Osterhaus A.D. et al. Acyclovir-resistant corneal HSV-1 isolates from patients with herpetic keratitis. J Infect Dis. 2008;198(5):659–663. DOI: 10.1086/590668.
10. Солдатова Е.Ю., Мелехина Е.В., Горелов А.В. Герпесвирусная инфекция у больных ювенильным артритом. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2017;1:46–53. [Soldatova Ye.Yu., Melokhina Ye.V., Gorelov A.V. Herpesvirus infection in patients with juvenile arthritis. Epidemiologiya i infektsionnyye bolezni. Aktual’nyye voprosy. 2017;1:46–53 (in Russ.)].
11. Солдатова Е.Ю., Горелов А.В., Мелехина Е.В., Жолобова Е.С. Клинические особенности герпесвирусной инфекции у детей с ювенильным ревматоидным артритом. Инфекционные болезни. 2016;14(S1):264–265. [Soldatova Ye.Yu., Gorelov A.V., Melekhina Ye.V., Zholobova Ye.S. Clinical features of herpesvirus infection in children with juvenile rheumatoid arthritis. Infektsionnyye bolezni. 2016;14(S1):264–265 (in Russ.)].
12. Соломай Т.В., Семененко Т.А., Филатов Н.Н. и др. Вирус Эпштейна — Барр: разработка вакцин. Иммунология. 2020;41(4):381–390. [Solomay T.V., Semenenko T.A., Filatov N.N. et al. Epstein-Barr virus: vaccine development. Immunologiya. 2020;41(4):381–390 (in Russ.)]. 10.33029/0206-4952-2020-41-3-381-390.
13. Баринский И.Ф., Алимбарова Л.М., Лазаренко А.А. и др. Вакцины как средство специфической иммунокоррекции при герпетических инфекциях. Вопросы вирусологии. 2014;5(1):5–11. [Barinskiy I.F., Alimbarova L.M., Lazarenko A.A. et al. Vaccines as a means of specific immunocorrection for herpes infections. Voprosy virusologii. 2014;5(1):5–11 (in Russ.)].
14. Бархалева О.А., Воробьева М.С., Хорошева Т.В. и др. Сравнительные клинические испытания отечественных лечебных вакцин против вируса герпеса простого. Эпидемиология и вакцинопрофилактика. 2006;2(27):38–41. [Barkhaleva O.A., Vorob’yeva M.S., Khorosheva T.V. et al. Comparative clinical trials of domestic therapeutic vaccines against herpes simplex virus. Epidemiologiya i vaktsinoprofilaktika. 2006;2(27):38–41 (in Russ.)].
15. Roberts C.M., Pfister J.R., Spear S.J. Increasing proportion of herpes simplex virus type 1 as a cause of genital herpes infection in kollege students. Sex Transm Dis. 2003;30(10):797–800. DOI: 10.1097/01.OLQ.0000092387.58746.C7.
16. Aschner C.B., Herold B.C. Alphaherpesvirus Vaccines. Curr Issues Mol Biol. 2021;41:469–508. DOI: 10.21775/cimb.041.469.
17. De Bruyn G., Vargas-Cortez M., Warren T. et al. A randomized controlled trial of a replication defective (gH deletion) herpes simplex virus vaccine for the treatment of recurrent genital herpes among immunocompetent subjects. 2006;24(7):914–920. DOI: 10.1016/j.vaccine.2005.08.088.
18. Da Costa X., Kramer M.F., Zhu J. et al. Construction, phenotypic analysis, and immunogenicity of a UL5/UL29 double deletion mutant of herpes simplex virus 2. J Virol. 2000;74(17):7963–7971. DOI: 10.1128/jvi.74.17.7963-7971.2000.
19. Da Costa X., Morrison L.A., Knipe D.M. Comparison of different forms of herpes simplex replication-defective mutant viruses as vaccines in a mouse model of HSV-2 genital infection. Virology. 2001;288(2):256–263. DOI: 10.1006/viro.2001.1094.
20. Hoshino Y., Pesnicak L., Dowdell K.C. et al. Comparison of immunogenicity and protective efficacy of genital herpes vaccine candidates herpes simplex virus 2 dl5–29 and dl5–29–41L in mice and guinea pigs. Vaccine. 2008;26(32):4034–4040. DOI: 10.1016/j.vaccine.2008.05.022.
21. Hoshino Y., Dalai S.K., Wang K. et al. Comparative efficacy and immunogenicity of replication-defective, recombinant glycoprotein, and DNA vaccines for herpes simplex virus 2 infections in mice and guinea pigs. J Virol. 2005;79(1):410–418. DOI: 10.1128/JVI.79.1.410-418.2005.
22. Dropulic L.K., Oestreich M.С., Pietz H.L. et al. A Replication-Defective Herpes Simplex Virus (HSV)-2 Vaccine, HSV529, is Safe and Well-Tolerated in Adults with or without HSV Infection and Induces Significant HSV-2 Specific Antibody Responses in HSV Seronegative Individuals. Open Forum Infectious Diseases. 2017;4:S415–S416. DOI: 10.1093/ofid/ofx163.1041.
23. Dropulic L.K., Oestreich M.C., Pietz H.L. et al. A Randomized, Double-Blinded, Placebo-Controlled, Phase 1 Study of a Replication-Defective Herpes Simplex Virus (HSV) Type 2 Vaccine, HSV529, in Adults With or Without HSV Infection. J Infect Dis. 2019;220(6):990–1000. DOI: 10.1093/infdis/jiz225.
24. Halford W.P., Püschel R., Rakowski B. Herpes Simplex Virus 2 ICPo Mutant Viruses Are Avirulent and Immunogenic: Implications for a Genital Herpes Vaccine. PLoS ONE. 2010;5(8):e12251. DOI: 10.1371/journal.pone.0012251.
25. Halford W.P., Püschel R., Gershburg E. et al. A live-attenuated HSV-2 ICPo virus elicits 10 to 100 times greater protection against genital herpes than a glycoprotein D subunit vaccine. PLoS ONE. 2011;6(3):e17748. DOI: 10.1371/journal.pone.0017748.
26. Kitagawa K. Therapy of herpes simplex with heat inactivated Herpes virus hominis type 1 and type 2. Z Hautkr. 1973;48(13):533–535.
27. Dundarov S., Andonov P., Bakalov B. et al. Immunotherapy with inactivated polyvalent herpes vaccines. Dev Biol Stand. 1982;52:351–358.
28. Corey L., Langenberg A.G., Ashley R. et al. Recombinant glycoprotein vaccine for the prevention of genital HSV-2 infection: two randomized controlled trials. Chiron HSV Vaccine Study Group. JAMA. 1999;282(4):331–340. DOI: 10.1001/jama.282.4.331.
29. Stanberry L.R., Spruance S.L., Cunningham A.L. et al. Glycoprotein-D-adjuvant vaccine to prevent genital herpes. N Engl J Med. 2002;347(21):1652–1661. DOI: 10.1056/NEJMoa011915.
30. Belshe R.B., Leone P.A., Bernstein D.I. et al. Efficacy results of a trial of a herpes simplex vaccine. N Engl J Med. 2012;366(1):34–43. DOI: 10.1056/NEJMoa1103151.
31. Турова Е.П., Шитикова Г.С. Применение вакцины для лечения больных с рецидивирующим течением герпесвирусной инфекции. Инфекционные болезни. 2014;12(3):87–90. [Turova Ye.P., Shitikova G.S. The use of the vaccine for the treatment of patients with recurrent herpesvirus infection. Infektsionnyye bolezni. 2014;12(3):87–90 (in Russ.)].
32. Шитикова Г.С., Абросимова Ю.Ю., Жунко О.В., Потапчук М.В. Герповакс — десять лет производства и применения в практике здравоохранения. Материалы Всероссийской научной конференции с международным участием, посвященной 100-летию со дня основания филиала «Иммунопрепарат» ФГУП «НПО Микроген» МЗ и СРРФ. М.; 2005:213–215. [Shitikova G.S., Abrosimova Yu.Yu., Zhunko O.V., Potapchuk M.V. Gerpovax — ten years of production and use in healthcare practice. Materials of the All-Russian scientific conference with international participation, dedicated to the 100th anniversary of the founding of the «Immunopreparat» branch of the FSUE «NPO Microgen» MH and SRRF. M.; 2005:213–215 (in Russ.)].
33. Шитикова Г.С., Петровский С.В., Абросимова Ю.Ю. Применение герпетической вакцины для лечения и профилактики рецидивов герпетической инфекции. Лабораторная диагностика. 2012;3(7). [Shitikova G.S., Petrovskiy S.V., Abrosimova Yu.Yu. The use of herpes vaccine for the treatment and prevention of recurrence of herpes infection. Laboratornaya diagnostika. 2012;3(7) (in Russ.)].
34. Шитикова Г.С., Абросимова Ю.Ю., Андрианова Л.В. Применение вакцины для лечения больных с рецидивирующим течением герпесвирусной инфекции. Материалы III междисциплинарной научно-практической конференции «Урогенитальные инфекции и репродуктивное здоровье: клинико-лабораторная диагностика и терапия». М.; 2010:83–84. [Shitikova G.S., Abrosimova Yu.Yu, Andrianova L.V. The use of the vaccine for the treatment of patients with recurrent herpesvirus infection. Materials of the III interdisciplinary scientific-practical conference «Urogenital infections and reproductive health: clinical and laboratory diagnostics and therapy». M.; 2010:83–84 (in Russ.)].
35. Wald A., Koelle D.M., Fife K. et al. Safety and immunogenicity of long HSV-2 peptides complexed with rhHsc70 in HSV-2 seropositive persons. Vaccine. 2011;29(47):8520–8529. DOI: 10.1016/j.vaccine.2011.09.046.
36. Cohen J.I. Vaccination to reduce reactivation of herpes simplex virus type 2. J Infect Dis. 2017;215(6):844–846. DOI: 10.1093/infdis/jix006.
37. Vical Reports Phase 2 Trial of HSV-2 Therapeutic Vaccine Did Not Meet Primary Endpoint. (Electronic resourse.) URL: https://www.globenewswire.com/news-release/2018/06/11/1519433/0/en/Vical-Reports-Phase-2-Trial-of-HSV-2-Therapeutic-Vaccine-Did-Not-Meet-Primary-Endpoint.html (access date: 20.10.2021).
38. Draper S.J., Heeney J.L. Viruses as vaccine vectors for infectious diseases and cancer. Nat Rev Microbiol. 2009;8(1):62–73. DOI: 10.1038/nrmicro2240.
39. Chiuppesi F., Vannucci L., De Luca A. et al. A lentiviral vector-based, herpes simplex virus 1 (HSV-1) glycoprotein B vaccine affords cross-protection against HSV-1 and HSV-2 genital infections. J Virol. 2012;86(12):6563–6574. DOI: 10.1128/JVI.00302-12.
40. Акулич Н.Ф. Опыт и схемы клинического применения герпетической вакцины в профилактике рецидивирующей герпетической инфекции. Иммунопатология, аллергология, инфектология. 1999;1:131–135. [Akulich N.F. Experience and schemes of clinical use of herpes vaccine in the prevention of recurrent herpes infection. Immunopatologiya, allergologiya, infektologiya. 1999;1:131–135 (in Russ.)].
41. Нуржанова С.К. Метод лечения хронического рецидивирующего герпетического стоматита с использованием отечественной герпетической вакцины. Вестник АГИУВ. 2010;3–4(11–12):82–83. [Nurzhanova S.K. A method of treating chronic recurrent herpetic stomatitis using a domestic herpes vaccine. Vestnik AGIUV. 2010;3–4(11–12):82–83 (in Russ.)].
42. Спиридонов В.Е., Федорович Е.И., Саларев В.В. Использование препарата Панавир в лечении больных с ИППП. Достижения фундаментальной, клинической медицины и фармации. Материалы 67-й научной сессии сотрудников университета. Витебск: ВГМУ; 2012. [Spiridonov V.Ye., Fedorovich Ye.I., Salarev V.V. The use of Panavir in the treatment of patients with STIs. Advances in fundamental, clinical medicine and pharmacy. Materials of the 67th scientific session of the university staff. Vitebsk: VGMU; 2012 (in Russ.)].
43. Баринский И.Ф., Алимбарова Л.М., Лазаренко А.А. и др. Вакцина как средство иммунокоррекции при герпетических инфекциях. Медицина и образование в Сибири. 2013;5:4. [Barinskiy I.F., Alimbarova L.M., Lazarenko A.A. et al. Vaccine as a means of immunocorrection for herpes infections. Meditsina i obrazovaniye v Sibiri. 2013;5:4 (in Russ.)].
44. Баринский И.Ф., Алимбарова Л.М., Лазаренко А.А. и др. Эффективность применения поливакцины Витагерпавак и иммуномодулятора Гиаферон в противорецидивной терапии генитального герпеса. Terra Medica. 2013;3(73):12–18. [Barinskiy I.F., Alimbarova L.M., Lazarenko A.A. et al. The effectiveness of the use of the polyvaccine Vitagerpavac and the immunomodulator Giaferon in the anti-relapse therapy of genital herpes. Terra Medica. 2013;3(73):12–18 (in Russ.)].
45. Исаков В.А., Ермоленко Д.К., Исаков Д.В. Эффективность вакцины Витагерпавак для профилактики простого герпеса с монотонным типом рецидивирования. Эффективная фармакотерапия. Дерматовенерология и косметология. 2013;40:6–13. [Isakov V.A., Yermolenko D.K., Isakov D.V. The effectiveness of the Vitagerpavac vaccine for the prevention of herpes simplex with a monotonous type of recurrence. Effektivnaya farmakoterapiya. Dermatovenerologiya i kosmetologiya. 2013;40:6–13 (in Russ.)].
46. Исаков В.А., Исаков Д.В., Ермоленко Д.К. Эффективность вакцины Витагерпавак для профилактики рецидивов простого герпеса. Современная медицина. 2019;3(15):45–48. [Isakov V.A., Isakov D.V., Yermolenko D.K. The effectiveness of the vaccine Vitagerpavac for the prevention of recurrence of herpes simplex. Sovremennaya meditsina. 2019;3(15):45–48 (in Russ.)].
47. Баринский И.Ф., Алимбарова Л.М., Лазаренко А.А. и др. Иммуномодуляторы и специфические инактивированные вакцины как средство экстренной профилактики острых вирусных инфекций и профилактики рецидивов хронических вирусных заболеваний. Иммунология. 2015;36(2):95–98. [Barinskiy I.F., Alimbarova L.M., Lazarenko A.A. et al. Immunomodulators and specific inactivated vaccines as a means of emergency prevention of acute viral infections and prevention of recurrence of chronic viral diseases. Immunologiya. 2015;36(2):95–98 (in Russ.)].
48. Алимбарова Л.М., Львов Н.Д., Мезенцева М.В. Эффективность герпетической поливакцины в лечении часто рецидивирующей герпесвирусной инфекции. Современная медицина. 2018;3(11):26–32. [Alimbarova L.M., L’vov N.D., Mezentseva M.V. The effectiveness of the herpes polio vaccine in the treatment of frequently recurrent herpesvirus infection. Sovremennaya meditsina. 2018;3(11):26–32 (in Russ.)].
49. Каспаров А.А. Офтальмогерпес. М.: Медицина; 1994. [Kasparov A.A. Ophthalmic herpes. M.: Meditsina; 1994 (in Russ.)].
50. Каспарова Евг.А., Каспарова Е.А., Марченко Н.Р. и др. Диагностика, лечение и профилактика рецидивирующей герпетической эрозии роговицы. Современные технологии в офтальмологии. 2020;4(35):69–70. DOI: https://doi.org/10.25276/2312-4911-2020-4-69-70. [Kasparova Yevg.A., Kasparova Ye.A., Marchenko N.R. et al. Diagnosis, treatment and prevention of recurrent herpetic erosion of the cornea. Sovremennyye tekhnologii v oftal’mologii. 2020;4(35):69-70 (in Russ.)]. DOI: https://doi.org/10.25276/2312–4911-2020-4-69–70.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
