Рандомизированное открытое многоцентровое сравнительное исследование терапевтической эффективности, безопасности и переносимости комплексного растительного препарата BNO 1030 при лечении легких форм COVID-19
Введение: COVID-19 является серьезной медицинской и социальной проблемой, до сих пор для него нет специфических методов лечения. Большинство пациентов c COVID-19 можно вести при помощи средств симптоматической терапии, аналогичных таковым для обычных респираторных инфекций. Во многих случаях COVID-19 протекает в легких формах, не требующих госпитализации.
Цель исследования: анализ эффективности, безопасности и переносимости применения растительного лекарственного препарата BNO 1030 при легких формах COVID-19 с целью дополнительного облегчения симптомов.
Материал и методы: открытое рандомизированное проспективное многоцентровое клиническое исследование. Из 133 прошедших скрининг амбулаторных пациентов в возрасте от 18 до 70 лет с легкими симптомами COVID-19 120 пациентов были рандомизированы в 2 параллельные группы (1:1). Основная группа получала BNO 1030 (Тонзилгон® Н) в дополнение к симптоматической терапии (ацетаминофен или ибупрофен). Контрольная группа получала только симптоматическую терапию. В окончательный анализ были включены пациенты с лабораторно подтвержденной коронавирусной инфекцией: 47 — в основной группе, 46 — в контрольной группе. Критерием оценки была динамика симптомов: гипертермии, мышечной боли, заложенности носа, выделений из носа, кашля, аносмии, гнусавости голоса, боли в горле, длительности применения жаропонижающих препаратов, связанного с клинически значимым повышением температуры. Эти симптомы врачи оценивали у пациентов во время их визитов в клинку по 4-балльной шкале. Также пациенты ежедневно в дневниках проводили самооценку симптомов по 10-балльной визуально-аналоговой шкале. Первичной конечной точкой было снижение среднего балла оценки по сравнению с исходным значением, что определялось как терапевтическая польза применения BNO 1030.
Результаты исследования: при сравнении обеих групп на протяжении времени приема препаратов в основной группе (n=47) выявлено более значительное снижение тяжести указанных симптомов при их оценке врачом на визите 2 (4-й день) и визите 3 (14-й день) по сравнению с визитом 1, а также меньшая длительность приема жаропонижающих препаратов (p<0,05). Также достоверные отличия были обнаружены в основной группе по результатам самооценки симптомов пациентами. Терапевтическая польза применения BNO 1030 составила 3 дня. В основной группе по сравнению с контрольной зарегистрировали увеличение числа выздоровевших пациентов с 73,9% до 96,6% и уменьшение количества госпитализированных пациентов с 8,6% до 4,4% соответственно (p<0,05). Все пациенты хорошо переносили прием растительного препарата.
Выводы: BNO 1030 при сочетании с симптоматической терапией ацетаминофеном или другими нестероидными противовоспалительными средствами является безопасным и эффективным препаратом для лечения легкой формы подтвержденной коронавирусной инфекции у пациентов в возрасте 18–70 лет. У больных с COVID-19, получающих Тонзилгон® Н, отмечалось более раннее облегчение симптомов, имеющее достоверную связь с приемом препарата.
Ключевые слова: фитотерапия, BNO 1030, Тонзилгон, легкие формы COVID-19, коронавирусная инфекция.
Для цитирования: Попович В., Кошел И., Хаман Ю., Лещак В., Малофийчук О., Капустина Н., Шевага И., Шевага О., Куницка Т. Рандомизированное открытое многоцентровое сравнительное исследование терапевтической эффективности, безопасности и переносимости комплексного растительного препарата BNO 1030 при лечении легких форм COVID-19. РМЖ. Медицинское обозрение. 2021;29(10):11-20.
A randomized, open-label, multicentre, comparative study of therapeutic efficacy, safety, and tolerability of complex herbal drug BNO 1030 in the treatment of mild forms of COVID-19
V. Popovych1, I. Koshel2, Y. Haman3, V. Leschak3, O. Malofiichuk4, N. Kapustina4, I. Shevaga5, O. Shevaga5 , T. Kunytska1
1 Ivano-Frankivsk National Medical University, Ivano-Frankivsk, Ukraine
2Institute of Postgraduate Education, National Medical University, Ivano-Frankivsk, Ukraine
3Uzhgorod National University, Uzhhorod, Ukraine
4Regional Clinical Hospital of Gerbachevsky, Ivano-Frankivsk, Ukraine
5Kamianets-Podilsky City Hospital, Kamianets-Podilsky, Ukraine
Background: COVID-19 is a high burden for medicine and society as still no specific therapy exists. Most patients depend on symptomatic treatment, comparable to that in common respiratory infection e.g. Many cases of COVID-19 show mild forms without need of hospitalization.
Aim: analyze the efficacy, safety, and tolerability of the herbal medicinal product BNO 1030 in mild cases of COVID-19 to offer an additional symptomatic relive.
Patients and Methods: the study was designed as an open label randomized, prospective, multicentred clinical trial. Out of 133 screened outpatients aged 18 to 70 with mild COVID-19 symptoms 120 patients were randomised (1:1) in 2 parallel groups. The main group received BNO 1030 (Tonsilgon® N) in addition to symptomatic therapy (acetaminophen or ibuprofen). The control group got a symptomatic therapy only. The patients with laboratory proven COVID-19 were included for the final analyses: 47 — in the main group and 46 — in the control one. The evaluation criteria were dynamics of the symptoms: hyperthermia, myalgia, nasal congestion, nasal discharge, coughing, anosmia, rhinolalia, sore throat, duration of the use of antipyretics (clinically significant fever). These symptoms were assessed during the physician’s visit on a 4-point scale and self- assessed via ten-point visual analogue scale (VAS) daily in a patient’s diary. The primary endpoint was the decrease of the average score compared to the baseline defined as "therapeutic benefit" from the usage of BNO 1030.
Results: in the comparison of both groups over the treatment time, the main group (n=47) showed a greater decrease in the severity of symptoms, assessed by the doctor on a 4-point scale on V2 (4th day) and V3 (14th day) compared to those on V1, as well as a reduction of the antipyretics intake duration (p<0.05). Significant differences of the main group were obtained, too, based on the results of symptoms self-assessment by the patient. The "therapeutic benefit" from the use of BNO 1030 was 3 days. There is an increase in the number of recovered patients from 73.9–96.6 %, and a decrease in the number of hospitalized patients from 8.6–4.4 % in the main group, as compared to the data of the control group (p<0.05). All patients tolerated the herbal medicine well.
Conclusions: BNO 1030 offers a safe and effective treatment benefit in patients with mild forms of diagnosed COVID-19 aged 18–70 in addition to symptomatic treatment with acetaminophen or NSAIDs. COVID-19 positive patients treated with Tonsilgon® N showed an earlier relive of symptoms when being treated with BNO 1030.
Keywords: Phytotherapy, BNO 1030, Tonsilgon, mild COVID-19, coronavirus infection.
For citation: Popovych V., Koshel I., Haman Y. et al. A randomized, open-label, multicentre, comparative study of therapeutic efficacy, safety, and tolerability of complex herbal drug BNO 1030 in the treatment of mild forms of COVID-19. RMJ. 2021;10:11–20.
Введение
Пациентам с легкими формами COVID-19, не включенным в группы риска, Всемирная организация здравоохранения (ВОЗ) и национальные нормативные документы рекомендуют амбулаторное лечение с соблюдением режима самоизоляции. В рекомендации включены диета, применение жаропонижающих средств (парацетамола, ибупрофена) для устранения гипертермии и боли [1, 2], а также другие лекарственные средства симптоматической терапии
(в соответствии с показаниями).
Клинические исследования эффективности растительных препаратов, соответствующие стандартам надлежащей клинической практики (Good Clinical Practice, GCP), очень немногочисленны, однако эта ситуация изменилась после выпуска соответствующих рекомендаций [7]. Поскольку случаям легкого течения заболевания уделяется меньше внимания, несмотря на то, что такое течение отмечается у 40–80% пациентов с диагностированной коронавирусной инфекцией [8, 9], это исследование показывает возможности применения обладающих доказанной безопасностью лекарственных препаратов растительного происхождения с целью оптимизации симптоматической терапии легких случаев COVID-19. С учетом недавнего появления мутировавших штаммов вируса число случаев инфекции SARS-CoV-2 увеличивается. Темп вакцинации медленный. Доля бессимптомно протекающих случаев COVID-19 среди инфицированных пациентов высока, возможность ее распространения значительна [10, 11]. Кроме того, возможный рост частоты легких форм COVID-19 остается важным фактором, поскольку варианты тяжелого течения заболевания развиваются после относительно легких симптомов. Более короткий период от начала симптомов до их утяжеления и госпитализации пациентов связан с ухудшением исходов COVID-19, и у нас до сих пор нет достаточной информации о действительном течении и лечении легких форм этого заболевания [12, 13]. В то же время ВОЗ в обновленных рекомендациях по сдерживанию распространения COVID-19 заявила о необходимости диагностики и эффективного лечения пациентов с легкими и среднетяжелыми вариантами течения заболевания [1]. Легкое течение COVID-19 характеризуется некоторыми неспецифическими симптомами, похожими на симптомы простуды или гриппа: лихорадкой, кашлем, болью в горле, заложенностью носа, общим недомоганием, головной болью, мышечной болью и аносмией при отсутствии симптомов пневмонии и дыхательной недостаточности [1, 14]. Эти симптомы типичны для нетяжелых острых вирусных инфекций верхних дыхательных путей и острого назофарингита, вызываемых известными коронавирусами человека, например hCoV-229E, ОС43, NL63 и HKU1 [15, 16]. К сожалению, эффективное лечение COVID-19 отсутствует. Механизмы действия возможных лекарственных препаратов связаны с противовирусными эффектами (ремдесвир, лопинавир, ритонавир, интерферон β), блокадой слияния вируса с клеточной мембраной — рекомбинантный ангионтензинпревращающий фермент человека, гидроксихлорохин и некоторые другие, однако их рассматривают как средства лечения тяжелых форм заболевания [17–19]. Не обнаружено клинической пользы применения некоторых из этих испытанных препаратов [20–22].
В клинической практике используют фитониринговый экстракт растительного происхождения, состоящий из частей 7 лекарственных растений: корень алтея лекарственного (Radix Althaeae), цветы ромашки аптечной (Flores Chamomillae), трава хвоща обыкновенного (Herba Equiseti), листья грецкого ореха (Folia Jungladis), трава тысячелистника обыкновенного (Herba Millefolii), кора дуба (Cortex Quercus) и трава одуванчика лекарственного (Herba Taraxaci); этот препарат известен под названием Тонзилгон® Н. Компоненты этого лекарственного препарата обладают антисептическим и противовоспалительным действием, способствуют повышению неспецифической резистентности [23–29]. Показаниями к его применению являются острые и хронические заболевания верхних дыхательных путей (тонзиллит, фарингит, ларингит), а также профилактика осложнений респираторных заболеваний. Также он применяется в качестве дополнения к терапии антибиотиками при бактериальных инфекциях. К настоящему времени накоплен опыт применения препарата Тонзилгон® Н при лечении острых вирусных инфекций глоточного лимфоидного кольца: острого назофарингита и тонзиллита [30, 31].
Целью настоящего исследования была оценка эффективности растительного экстракта BNO 1030 (Тонзилгон® Н) в качестве дополнения к стандартному лечению по сравнению с только стандартным лечением легких форм COVID-19 (острого назофарингита) в соответствии с рекомендациями ВОЗ и национальных органов [1, 2].
Материал и методы
Открытое поисковое сравнительное многоцентровое рандомизированное проспективное исследование в параллельных группах было выполнено в 4 амбулаторных отделениях больниц Украины с июня по декабрь 2020 г. Это исследование было выполнено по стандартам GCP, в соответствии с Хельсинкской декларацией и было утверждено этическим комитетом в каждом исследовательском центре.
Каждый участник исследования до выполнения каких-либо связанных с исследованием процедур дал письменное согласие на участие в исследовании.
УчастникиДля участия в исследовании было скринировано 133 пациента с симптомами легкой формы COVID-19, из них было рандомизировано 120 амбулаторных пациентов в возрасте 18–70 лет. Диагноз устанавливался по следующим данным: клинические симптомы и предшествующий контакт с лицом, у которого была подтверждена коронавирусная инфекция. Все пациенты были рандомизированы в 2 группы: основная, принимающая BNO 1030 (Тонзилгон® Н) — стандартизованный экстракт из 7 лекарственных растений в дополнение к стандартной терапии, и контрольная группа, получающая только стандартную симптоматическую терапию.
Восемнадцать мужчин (30,0%) и 42 женщины (70,0%) (средний возраст — 32,98±13,12 года) были рандомизированы в основную группу (n=60); 19 мужчин (31,7%) и 41 женщина (68,3%) (средний возраст — 33,90±11,79 года) — в контрольную группу (n=60).
Критерии включения: мужчины и женщины в возрасте 18–70 лет с типичными симптомами коронавирусной инфекции. Обязательными признаками были внезапное развитие симптомов, нарушение обоняния (аносмия, гипосмия) и документированный контакт с подтвержденным случаем COVID-19. К другим типичным симптомам заболевания относились: гипертермия, мышечные боли, кашель, заложенность носа, выделения из носа (передняя или задняя ринорея). Дополнительными критериями включения в это исследование были: отсутствие признаков вирусной пневмонии или гипоксии, возможность самоизоляции в амбулаторных условиях, желание и способность пациента следовать протоколу исследования, подписание информированного согласия. Клинические симптомы, относящиеся к критериям включения, соответствовали диагностическим критериям легкой COVID-19 и симптомам, указанным в рекомендациях ВОЗ и представленным в национальных клинических руководствах [1, 20]. У рандомизированных пациентов инфекция COVID-19 была подтверждена лабораторным методом. Диагноз считали подтвержденным при наличии не менее одного положительного результата ПЦР, диагностически значимых уровней IgM и IgG.
Критерии невключения: показания к стационарному лечению, наличие иммунодефицитных состояний, онкологические заболевания, хронические заболевания сердечно-сосудистой или бронхолегочной системы, сахарный диабет, индивидуальная непереносимость компонентов лекарственного препарата.
Критерии исключения пациента из исследования: решение пациента прекратить участие в исследовании с отзывом письменного информированного согласия; потеря контакта с пациентом; индивидуальная непереносимость исследуемого лекарственного препарата и референтного режима терапии; возникновение у пациента серьезных и/или непредвиденных побочных эффектов (реакций) во время исследования; развитие осложнений сопутствующего заболевания, которое, по мнению врача, требует исключения пациента из исследования; отрицательный результат лабораторного исследования на коронавирусную инфекцию.
ПроцедурыНаходящимся в самоизоляции пациентам обеих групп были назначены щадящая диета, устранение раздражающих воздействий на носоглотку, носовые ирригации изотоническим солевым раствором 4 р/сут в течение 14 дней, жаропонижающие средства (ацетаминофен или ибупрофен в соответствии с национальными указаниями Министерства здравоохранения Украины) при наличии клинически значимого повышения температуры (выше 38 °C) и/или мышечной боли, превышающей 3 балла по 10-балльной визуальной аналоговой шкале (ВАШ).
Пациентам основной группы дополнительно назначали капли BNO 1030 (Тонзилгон® Н) внутрь из одной партии по 25 капель 6 р/сут. Капли для приема внутрь BNO 1030 являются стандартизованным водно-спиртовым экстрактом. Активные вещества: в 100 г капель содержится 29 г водно-спиртового экстракта (экстрагирующее вещество этанол 59% по объему) из следующих лекарственных растений: корни алтея (Radix Althaeae) 0,4 г; цветки ромашки (Flores Chamomillae) 0,3 г; трава хвоща (Herba Equiseti) 0,5 г; листья грецкого ореха (Folia Jungladis) 0,4 г; трава тысячелистника (Herba Millefolii) 0,4 г; кора дуба (Cortex Quercus) 0,2 г; трава одуванчика лекарственного (Herba Taraxaci) 0,4 г. Вспомогательные вещества: этанол 19% (по объему), вода очищенная.
Наименование и адрес изготовителя: «Бионорика СЕ», Кершенштайнерштрассе, 11–15, 92318 Ноймаркт, Германия.
Утвержденными показаниями к применению препарата являются лечение острых и хронических заболеваний верхних дыхательных путей (тонзиллита, фарингита, ларингита), профилактика осложнений при респираторных вирусных инфекциях, а также дополнение к терапии антибиотиками при бактериальных инфекциях.
Запрещенные препараты: другие растительные лекарственные препараты, иммуностимулирующие и иммуномодулирующие препараты, противовирусные препараты, кортикостероиды.
В этом исследовании участвовали практикующие специалисты-оториноларингологи с опытом работы не менее 5 лет.
Параметры исходовОценка всех данных была выполнена врачом во время 3 визитов на протяжении 14 дней. На Визите 1 (В1) в День 1 проводили скрининг, рандомизацию, назначение терапии. Визит 2 (В2) в День 4±1 представлял собой телефонный или виртуальный контакт, в ходе которого оценивали состояние пациента, определяли потребности внепланового визита. На Визите 3 (В3) в День 14±1 по окончании терапии проводилась оценка ее эффективности. Пациенты могли выполнить телефонный звонок в любой день. Незапланированный визит мог быть проведен при ухудшении состояния пациента, сохранении или утяжелении симптомов заболевания, включая, но не ограничиваясь, повышением температуры в подмышечной впадине выше 38,0 °C на 3-й день исследования и/или в последующие дни приема препаратов.
Наблюдение одного пациента продолжалось не более 14±1 день (период самоизоляции пациента). Были оценены симптомы, включенные в шкалу проявлений легкой формы COVID-19, например гипертермия, мышечная боль, заложенность носа, выделения из носа, кашель, аносмия, гнусавость голоса, боль в горле. Во время планового визита врача все симптомы оценивали по 4-балльной шкале (0 — отсутствует, 1 — незначительный, 2 — умеренный, 3 — сильный или значительный). Гипертермию оценивали следующим образом: 0 (отсутствие) <37 °C, 1 — от 37 °C до 37,5 °C, 2 — от 37,5 °C до 38 °C, 3 — >38 °C. Кроме того, пациент ежедневно оценивал симптомы в своем дневнике в соответствии с тяжестью лихорадки, мышечной боли, заложенности носа, выделений из носа, кашля, аносмии и боли в горле по 10-балльной ВАШ: <3 — легкие,
от 3 до 7 — умеренные, >7 — тяжелые.
Основным критерием эффективности был день начала ответа на лечение, снижение тяжести симптомов заболевания по оценочной шкале во время каждого визита по сравнению с оценкой при Визите 1, динамика выполненной врачом оценки и самооценки симптомов пациентом. Вторичные критерии: динамика применения нестероидных противовоспалительных препаратов (НПВП), оценка «терапевтической пользы» применения BNO 1030, исходы лечения, наличие или отсутствие показаний к госпитализации.
Размер выборкиИсследование было спланировано для получения надежного клинического описания эффективности активного (дополнительного) применения BNO 1030 по сравнению с только референтной стандартной терапией.
В соответствии с полученными данными были выполнены некоторые предварительные описательные и статистические оценки. На основании упрощенных допущений, например пригодности для оценки данных всех пациентов, α=0,05, применимости двустороннего t-критерия и равной дисперсии в обеих группах, использованный объем выборки (n=120) позволяет обнаружить даже слабые различия эффектов между группами, начиная от 0,37 и более. Распределение пациентов по группам было равным 1:1.
РандомизацияПациентов случайным образом распределяли в группу, получающую один из возможных вариантов лечения в соответствии с основным списком рандомизации. Рандомизацию выполняли с применением программного обеспечения StatSoft (генератор случайных чисел). Рандомизацию выполняли в отношении каждого пациента, подписавшего информированное согласие.
Статистические методыС целью определения однородности групп были использованы методы дескриптивной статистики для описания исходного состояния основной и контрольной групп (для количественных параметров: n, среднее арифметическое, медиана, стандартное отклонение, минимальное и максимальное значения; для качественных параметров: частота и доля в процентах). Проверка нормальности распределения данных в группах была выполнена в отношении количественных параметров тестом Шапиро — Уилка. При обнаружении нормального распределения данных по некоторым параметрам группы сравнивали с применением критерия Стьюдента для независимых выборок. В иных случаях (если распределение данных отличалось от нормального) сравнение групп выполняли по критерию Манна — Уитни. В отношении дискретных переменных группы сравнивали по критерию Пирсона хи-квадрат или точному критерию Фишера. Для анализа эффективности вычисляли для каждой группы дескриптивные статистические параметры (n, среднее арифметическое, медиану, стандартное отклонение, минимальное и максимальное значения) при всех визитах в соответствии со схемой обследования пациента.
Анализ динамики упомянутых параметров в каждой группе выполняли двухфакторным дисперсионным анализом (ANOVA) по указанной ниже схеме: фактор «Визит» был дискретным (уровни: Визит 1… Визит n); фактор «Пациенты» был случайным.
Результаты последующих визитов сравнивали с данными Визита 1 с помощью анализа контрастов с применением простых контрастов.
Сравнение динамики исследуемых параметров между группами выполняли по разностям dTi = (ТВизит n — ТВизит 1) исследуемых параметров с помощью теста Манна — Уитни. Уровень значимости теста Шапиро — Уилка принимали равным 0,01, а для остальных критериев его принимали равным 0,05.
Анализ был выполнен с помощью программ IBM SPSS 22.0.
Результаты
Исследованная выборка
Для участия в исследовании было скринировано 133 пациента. Тринадцать из них соответствовали критериям исключения. Остальные 120 пациентов в возрасте 18–65 лет с клинически диагностированной легкой коронавирусной инфекцией были рандомизированы в контрольную (n=60) или основную (n=60) группу (рис. 1).
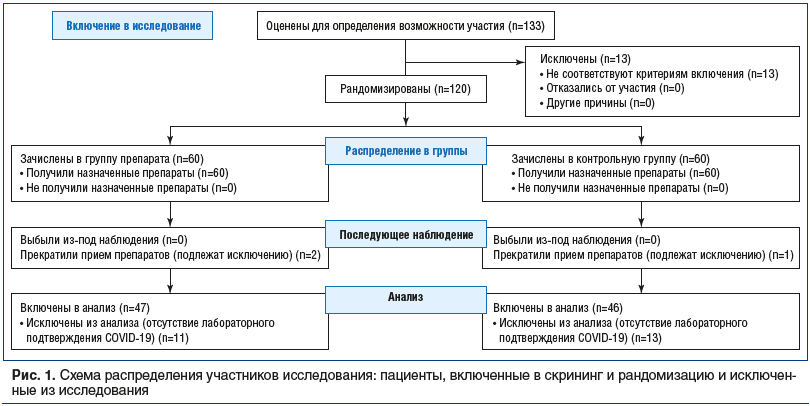
Три пациента (2,5%) были исключены из исследования: 1 — в контрольной группе и 2 — в основной группе (потеря контакта с пациентом). Двадцать четыре пациента (20%) были исключены из окончательной оценки результатов (11 — в основной группе и 13 — в контрольной группе). Причиной было отсутствие лабораторного подтверждения COVID-19. Поэтому в оценку результатов были включены 93 пациента (77,5%) (47 в основной группе и 46 в контрольной группе) с лабораторно подтвержденной коронавирусной инфекцией.
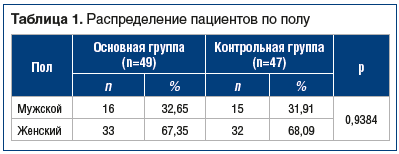
В таблице 1 показано распределение всех пациентов с лабораторно подтвержденной SARS-CoV-2-инфекцией по полу.
В таблице 2 показано распределение пациентов по возрасту.
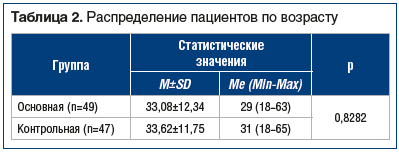
Группы были сопоставимыми по полу и возрасту.
Исходы и оценкаВ таблице 3 представлены сравнительные характеристики динамики симптомов легкой COVID-19 у пациентов основной и контрольной групп по оценкам врача по 4-балльной шкале. В исходном состоянии (В1) отсутствовали значительные различия (p>0,05) по таким основным клиническим проявлениям заболевания, как гипертермия, мышечная боль, заложенность носа, выделения из носа, кашель, аносмия, гнусавость голоса, боль в горле. У пациентов основной группы обнаружено значительно более быстрое снижение температуры во время В2 (p<0,05). Во время В3 это различие было недостоверным.
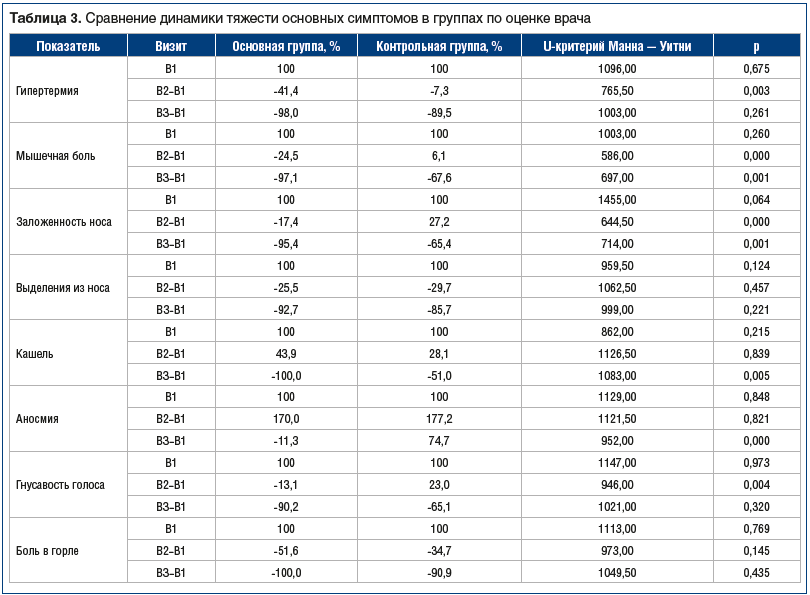
Показатель мышечной боли в основной группе во время В2 и В3 был более низким, чем в контрольной (p<0,05). Похожая динамика была обнаружена в отношении заложенности носа: во время В2 этот симптом был снижен на 17,4% в основной группе, а в контрольной группе повышен на 27,2% (p<0,05). Во время В3 заложенность носа была более выраженной у пациентов контрольной группы (p<0,05).
Кашель усиливался в обеих группах во время В2 (p>0,05). Во время В3 кашель полностью прекратился у пациентов основной группы, а у пациентов из контрольной группы интенсивность кашля уменьшилась вдвое (p<0,05).
Тяжесть аносмии была значительной во время В2 у пациентов обеих групп (p>0,05). В дальнейшем обоняние улучшалось, степень его нарушения достигла уровня статистической значимости между группами к В3.
Во время В2 показатель выраженности гнусавости голоса снизился в основной группе, но повысился в контрольной (p<0,05). Однако во время В3 динамика выравнивалась, и выраженность этого симптома у пациентов не имела значительных различий (p>0,05).
Ослабление боли в горле на протяжении всех визитов было более выраженным в основной группе, но это различие было статистически незначимым (p>0,05) во время всех визитов.
В таблице 4 представлена сравнительная характеристика динамики тяжести симптомов, включенных в шкалу выраженности легкой COVID-19, по самостоятельной оценке пациентов.
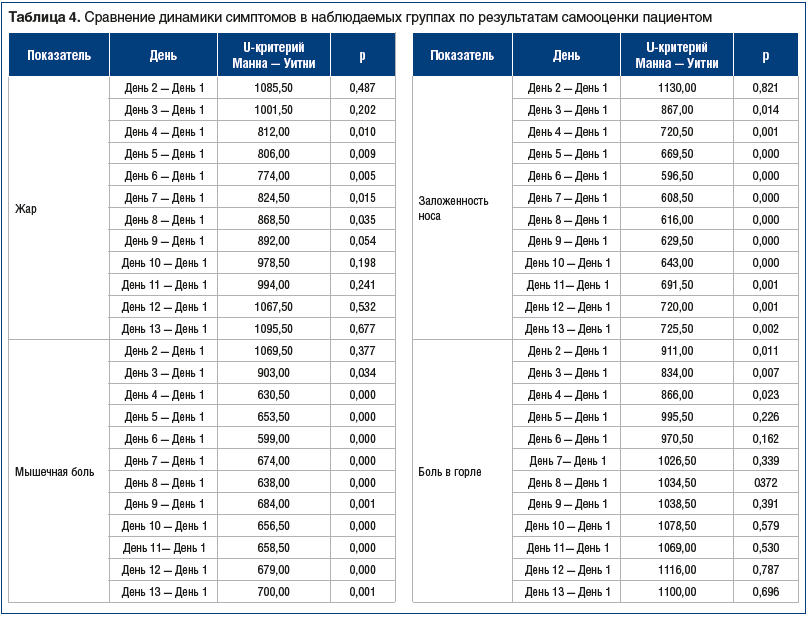
Основными клиническими симптомами, наиболее значимыми для удаленной оценки состояния амбулаторных пациентов во время самоизоляции, были лихорадка и мышечная боль, что отражало плохое общее самочувствие. После 3 дней приема препаратов у пациентов были обнаружены значительные различия в выраженности лихорадки, и эти различия оставались до 8-го дня приема препаратов. С 9-го дня эти показатели значительно не различались.
Показатели мышечной боли значительно различались в сравниваемых группах с 3-го дня и до конца периода наблюдения.
Характеристики динамики заложенности носа по данным оценок пациентом и врачом совпадали (табл. 3 и 4). Значительные различия между группами были отмечены с 3-го дня и на протяжении всего периода наблюдения.
Со 2-го по 4-й день приема препаратов различия между группами по выраженности боли в горле были значительными, с 5-го дня — незначительными. Не обнаружено значительных различий динамики ринореи, кашля и аносмии в исследуемых группах по самооценке пациентов.
Как известно, наличие таких симптомов, как лихорадка и мышечная боль является важным критерием оценки тяжести заболевания и одним из основных показаний к применению НПВП или жаропонижающих препаратов. Мы выполнили анализ динамики приема данных групп препаратов в зависимости от тяжести лихорадки и/или мышечной боли на основании результатов самооценки пациентов (рис. 2, 3). Как можно видеть на рисунке 3, умеренная лихорадка (более 3 баллов), требующая назначения жаропонижающих препаратов, была зарегистрирована у пациентов обеих групп на протяжении первых 3 дней заболевания. С 4-го дня пациенты основной группы отмечали снижение лихорадки до уровня меньше 3 баллов, что делало излишним применение НПВП. В контрольной группе похожие значения показателей отмечались на 2,5 дня позже — в среднем через 6,5 дня от начала лечения. Кроме того, в контрольной группе отмечена тенденция к более высокой гипертермии в первые 3 дня наблюдения.
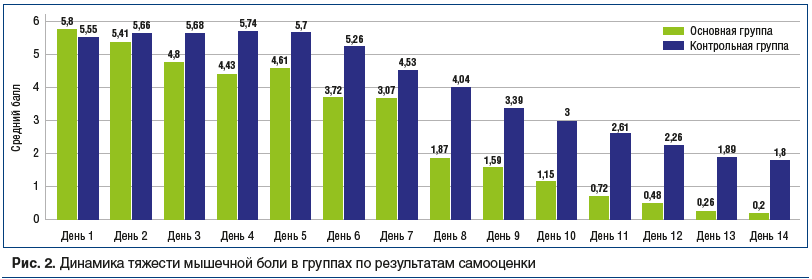
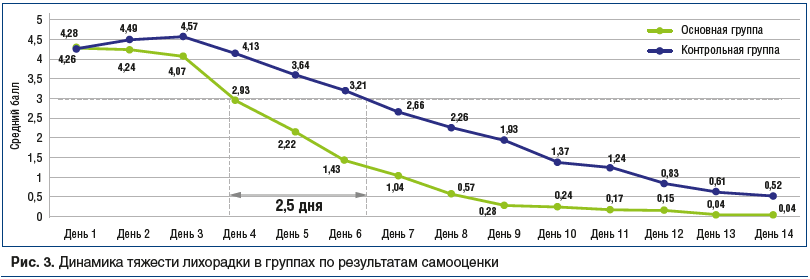
Мышечная боль с тяжестью свыше 3 баллов, приводящая к необходимости приема НПВП (ацетаминофен или ибупрофен), длилась до 7-го дня в основной группе и до 10-го дня в контрольной группе. Более того, в контрольной группе обнаружена тенденция к усилению мышечной боли с 5,55 балла в 1-й день до 5,74 балла в 4-й день.
Таким образом, «терапевтическая польза» лечения симптомов гипертермии и мышечной боли с применением BNO 1030 составляет 3 дня.
Режим самоизоляции пациентов предоставил возможность удаленного консультирования. Пациенты могли в любое время связаться с врачом по телефону, в связи с чем количество дополнительных телефонных контактов может служить критерием эффективности лечения. Число дополнительных консультативных контактов с врачом в контрольной группе было значительно выше, чем в основной группе, — 32 против 16. Наиболее частыми поводами для удаленного консультирования были гипертермия и мышечная боль.
Также мы сравнили исходы лечения (например, необходимость госпитализации, продолжение течения заболевания и пр.) в обеих группах на 14-й день, т. е. к концу периода самоизоляции (табл. 5). На 14-й день в основной группе 96,6% пациентов выздоровели, 4,4% были госпитализированы; в контрольной группе выздоровели73,9% пациентов, а 8,6% были госпитализированы. Кроме того, на 14-й день (окончание приема препаратов) 17,3% пациентов контрольной группы жаловались на сохраняющиеся или остаточные симптомы (от 1 до 3 баллов по ВАШ). Показатели критерия исхода лечения имели при этом статистически значимые различия (p<0,05).
Безопасность и переносимостьАнализ безопасности выявил хорошую переносимость лечения. Во время В3 (завершающего визита) 2 пациента основной группы и 1 пациент контрольной группы отметили, что у них были временные симптомы абдоминального дискомфорта: тошнота, изжога, умеренная боль. Один пациент основной группы отметил эпизод диареи. Все эти симптомы были легкими и не привели к изменению порядка приема препаратов.
Обсуждение результатов
Исследование показало, что среди пациентов с легкой COVID-19 было больше женщин, чем мужчин, средний возраст пациентов составил 33,35±12,04 года. Опубликованные данные свидетельствуют о том, что COVID-19 у мужчин протекает тяжелее и чаще завершается летальным исходом [8, 32]. В различных возрастных группах доля мужчин с тяжелым течением этого заболевания также выше, чем доля женщин [32–34]. Было также показано влияние возраста на исходы у пациентов, госпитализированных с COVID-19: в старших группах выше частота тяжелых форм. Это означает, что существуют значительные возрастные и половые различия между группами пациентов с различными степенями тяжести заболевания, и такие пациенты нуждаются в дифференцированном подходе к назначению амбулаторного лечения в режиме самоизоляции.
Рекомендации по лекарственной терапии легкой COVID-19 включают только симптоматические средства для облегчения симптомов, например жаропонижающие (ацетаминофен или ибупрофен) [1, 2]. Установлена эффективность некоторых лекарственных препаратов растительного происхождения при нетяжелых острых вирусных инфекциях верхних дыхательных путей [30, 31]. Поэтому необходимо проведение соответствующих требованиям GCP исследований эффективности применения лекарственных препаратов растительного происхождения, в частности BNO 1030, при лечении легкой формы коронавирусного заболевания.
Настоящее исследование показало возможность эффективного применения лекарственного препарата растительного происхождения BNO 1030 в дополнение к стандартной симптоматической терапии. У пациентов группы BNO 1030 обнаружена меньшая тяжесть таких симптомов, как гипертермия, мышечная боль, заложенность носа, кашель, аносмия и гнусавость голоса, по оценке врача, во время В2 и ВЗ по сравнению с В1 и контрольной группой. Обнаружены существенные различия в динамике ослабления симптомов и результатах самооценки симптомов пациентами.
Важным и интересным выводом этого исследования является усиление симптомов, в частности гипертермии и мышечной боли, в контрольной группе пациентов по сравнению с основной группой в первые 3–4 дня наблюдения. Это приводило к более частым удаленным консультациям пациентов. Многие исследователи полагают, что слабая динамика регрессии симптомов и, более того, утяжеление симптомов острой респираторной инфекции являются причиной неоправданного назначения антибиотиков врачами и желания пациентов получить антибиотикотерапию, что становится одной из основных причин глобальной проблемы антибиотикорезистентности [35]. По результатам некоторых исследований, более 90% пациентов с коронавирусной инфекцией получают антибиотики, включая сочетанную терапию и парентеральное введение препаратов в амбулаторных условиях. В таких ситуациях ВОЗ рекомендует при бактериальной инфекции проводить антибактериальную терапию только в условиях стационара [36].
Наши результаты лечения легкой COVID-19 с применением BNO 1030 соответствуют данным, опубликованным в литературе [30, 31]. Результаты этих исследований показали, что препарат BNO 1030 (Тонзилгон® Н) эффективен при лечении острых респираторных вирусных инфекций. Наши результаты подтверждаются данными проведенного в Германии наблюдательного исследования, которое показало эффективность и безопасность этого препарата у более чем 1100 пациентов с рецидивирующими острыми инфекциями верхних дыхательных путей [37].
Важным и интересным фактом, обнаруженным в этом исследовании, было снижение потребности пациентов, получавших BNO 1030, в системном применении НПВП (ибупрофена или ацетаминофена) в связи с более значительным ослаблением симптомов, например лихорадки и мышечной боли. Терапевтическая польза составила 3 дня. Некоторые исследователи высказали озабоченность тем, что ибупрофен может утяжелять течение коронавирусного заболевания [3, 4]. Уменьшение продолжительности приема НПВП в совокупности с другими эффектами этого лекарственного препарата является важным фактором в улучшении результатов лечения. В основной группе пациентов обнаружены значительно лучшие показатели исхода лечения. На 14-й день 96,6% пациентов основной группы выздоровели и 4,4% были госпитализированы.
В контрольной группе 73,9% пациентов выздоровели и 8,6% были госпитализированы. Кроме того, у 17,3% пациентов контрольной группы на 14-й день (окончание приема препаратов) симптомы все еще сохранялись, и эти пациенты нуждались в дальнейшей лекарственной терапии и наблюдении.
Таким образом, показанная в этом исследовании эффективность BNO 1030 в значительной степени соответствует результатам ранее выполненных исследований с участием пациентов с острыми вирусными инфекциями. Однако преимуществом этого исследования является установление диагноза легкой COVID-19 по общепринятым критериям. Рандомизированная и включенная в анализ группа пациентов была однородной по диагнозу и клиническим проявлениям, что позволило сделать обоснованные выводы по оценке общих результатов лечения. В основной группе выздоровело значительно больше пациентов, чем в контрольной. Терапевтическая польза по критерию симптоматического лечения гипертермии и мышечной боли в основной группе пациентов составила 3 дня, что свидетельствует о значительно большем числе выздоровевших пациентов. Это позволяет уменьшить число пациентов с продолжающимся заболеванием и потребностью в дальнейшей изоляции и фармакотерапии до полной регрессии симптомов, что является критическим фактором распространения инфекции, поскольку уменьшение средней продолжительности инфекционного периода может предотвратить в среднем от 442 852 до 44,4 млн случаев вызванной SARS-CoV-2 инфекции, в зависимости от доли пролеченных случаев, средней продолжительности инфекционного периода и способности вируса к репродукции. Предполагается, что лечение до 75% всех случаев инфекции, включая бессимптомные инфекции с R0 2,5, предотвратит 35,9 млн случаев и 4 млн госпитализаций, что сэкономит 48,8 млрд долларов США [38].
Был выбран дизайн сравнительного исследования без плацебо-контроля. Было выполнено сравнение с лечением, соответствующим клиническим указаниям, предусматривающим обязательное назначение только симптоматической терапии жаропонижающими препаратами [1, 2]. Поэтому все различия результатов лечения можно объяснить клиническими эффектами BNO 1030.
Ограничения
К ограничениям этого исследования относится открытый дизайн вследствие отсутствия плацебо. Диагноз был первоначально поставлен по клиническим данным, и лабораторные данные становились доступными только через несколько дней. Ограниченное число пациентов в этом исследовании не позволило оценить воздействие дополнительного приема растительного лекарственного препарата на риск развития тяжелых форм заболевания.
Заключение
Дополнительный прием некоторых лекарственных препаратов растительного происхождения, например BNO 1030 Тонзилгон® Н, может быть полезным при лечении легкой COVID-19, значительно ослабляя клинические симптомы, улучшая общее состояние пациентов, сокращая длительность лечения и потребность в жаропонижающих средствах, обладая при этом благоприятным профилем безопасности. Можно рекомендовать включение этого лекарственного препарата в схему лечения пациентов с легкой COVID-19. Однако для лучшей оценки такого лечения в отношении отдельных симптомов заболевания и проблем безопасности требуются дополнительные исследования с большей численностью пациентов и плацебо-контролем. Будущие исследования будут направлены на определение действия этого лекарственного препарата на период изоляции вируса.
Перевод выполнен по материалам статьи: Popovych V., Koshel I., Haman Y. et al. A randomized, open-label, multicentre, comparative study of therapeutic efficacy, safety, and tolerability of BNO 1030 extract, containing marshmallow root, chamomile flowers, horsetail herb, walnut leaves, yarrow herb, oak bark, dandelion herb, in the treatment of mild forms of COVID-19. Clin Phytosci 7, 72 (2021). DOI: 10.1186/s40816-021-00308-x. URL: https://clinphytoscience.springeropen.com/articles/10.1186/s40816-021-00308-x#citeas.
Благодарность
Редакция благодарит компанию «Бионорика» за оказанную помощь в переводе оригинальной статьи.
2. www.dec.gov.Ua (Electronic resource.) URL: https://www.dec.gov.Ua/wpcontent/uploads/2020/12/2020_722_standart_covid_19.pdf.
3. Day M. Covid-19: ibuprofen should not be used for managing symptoms, say doctors and scientists. BMJ. 2020;368:m1086. DOI: 10.1136/bmj.m1086.
4. Lund L.C., Kristensen K.B., Reilev M. et al. Adverse outcomes and mortality in users of non-steroidal anti-inflammatory drugs who tested positive for SARS-CoV-2: A Danish nationwide cohort study. PLoS Med. 2020;17(9):e1003308. DOI: 10.1371/journal.pmed.1003308.
5. Roshdy W.H., Rashed H.A., Kandeil A. et al. EGYVIR: An immunomodulatory herbal extract with potent antiviral activity against SARS-CoV-2. PLoS One. 2020;15(11):e0241739. DOI: 10.1371/journal.pone.0241739.
6. WHO Africa. Expert panel endorses protocol for COVID-19 herbal medicine clinical trials. (Electronic resource.) URL: https://www.afro.who.int/news/expert-panel-endorses-protocol-covid- 19-herbal-medicine-clinical-trials.
7. Gagnier J.J., Boon H., Rochon P. et al. Recommendations for reporting randomized controlled trials of herbal interventions: explanation and elaboration. J Clin Epidemiol. 2006;59(11):1134–49. DOI: 10.1016/j.jclinepi.2005.12.020.
8. Alshukry A., Ali H., Ali Y. et al. Clinical characteristics of coronavirus disease 2019 (COVID-19) patients in Kuwait. PLoS One. 2020;15(11):e0242768. DOI: 10.1371/journal.pone.0242768.
9. EpiCentro. Epidemia COVID-19 — Aggiornamento nazionale del 2 Aprile. 2020. (Electronic resource.) URL: https://www.epicentro.iss.it/coronavirus/bollettino/Bollettino- so rveg I ia nza-integ rata-COVI D-19_2-aprile-2020.pdf.
10. Yanes-Lane M., Winters N., Fregonese F. et al. Proportion of asymptomatic infection among COVID-19 positive persons and their transmission potential: A systematic review and meta-analysis. PLoS One. 2020;15(11):e0241536. DOI: 10.1371/journal.pone.0241536.
11. Buitrago-Garcia D., Egli-Gany D., Counotte M.J. et al. Occurrence and transmission potential of asymptomatic and presymptomatic SARS-CoV-2 infections: A living systematic review and meta-analysis. PLoS Med. 2020;17(9):e1003346. DOI: 10.1371/journal.pmed.1003346.
12. Alshami A., Alattas R., Anan H. et al. Silent disease and loss of taste and smell are common manifestations of SARS-COV-2 infection in a quarantine facility: Saudi Arabia. PLoS One. 2020;15(10):e0241258. DOI: 10.1371/journal.pone.0241258.
13. European society of clinical microbiology and infectious diseases. Meeting ESCMID Conference on Coronavirus Disease. (Electronic resource.) URL: https://eurekalert.org/pub_releases/2020–09/esoc-stf092520.php.
14. Tang D., Cornish P., Kang R. The hallmarks of COVID-19 disease. PLoS Pathog. 2020;16(5):e1008536. DOI: 10.1371/journal.ppat.1008536.
15. Huang C., Wang Y., Li X. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. DOI: 10.1016/S0140-6736(20)30183-5.
16. Richman D.D., Whitley R.J., Hayden F.G. Clinical virology. 4th edition. Washington: ASM Press; 2016.
17. Sheahan T.P., Sims A.C., Leist S.R. et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun. 2020;11(1):222. DOI: 10.1038/s41467-019-13940-6.
18. Monteil V., Kwon H., Prado P. et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 2020;181(4):905–913.e7. DOI: 10.1016/j.cell.2020.04.004.
19. Gautret P., Lagier J.C., Parola P. et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: Results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020;56(1):105949. DOI: 10.1016/j.ijantimicag.2020.105949.
20. Mahevas M., Tran V.-T., Roumier M. et al. No evidence of clinical efficacy of hydroxychloroquine in patients hospitalised for COVID-19 infection and requiring oxygen: results of a study using routinely collected data to emulate a target trial. MedRxiv. 2020; 04.10.20060699. https://d0i.0rg/l 0.1101 /2020.04.10.20060699.
21. Tang W., Cao Z., Han M. et al. Hydroxychloroquine in patients mainly with mild to moderate COVID-19: an open-label, randomized, controlled trial. MedRxiv. 2020; 04.10.20060558. https://doi.org/10.1101/2020.04.10.20060558.
22. Borba M., Val F., Sampaio V. et al. Chloroquine diphosphate in two different dosages as adjunctive therapy of hospitalized patients with severe respiratory syndrome in the context of coronavirus (SARS-CoV-2) infection: Preliminary safety results of a randomized, double-blinded, phase lib clinical trial (CloroCovid-19 Study). MedRxiv. 2020;04.07.20056424. https://d0i.0rg/l0.1101 /2020.04.07.20056424.
23. Kommission E. Monographie Matricariae flos (KamillenbICiten), inkl. Berichtigung. Bundesanzeiger Nr. 228 vom 05.12.1984, Bundesanzeiger Nr. 50 vom 13.03.1990. Bundesinstitut fQr Arzneimittel und Medizinprodukte.
24. Kommission E. Monographie Equiseti herba (Schachtelhalmkraut). In: Bundesanzeiger Nr. 173 vom 18.09.1986. Bundesinstitut fQr Arzneimittel und Medizinprodukte; 1986.
25. Kommission E. Monographie Althaeae radix (Eibischwurzel). In: Bundesanzeiger Nr. 43 vom 02.03.1989. Bundesinstitut fQr Arzneimittel und Medizinprodukte; 1989.
26. Kommission E. Monographie Achillea millefolium (Schafgarbe). Bundesanzeiger Nr. 22 a vom 01.02.1990. Bundesinstitut fQr Arzneimittel und Medizinprodukte; 1990.
27. Kommission E. Monographie Juglandis folium (WalnuBblatter). Bundesanzeiger Nr. 101 vom 01.06.1990. Bundesinstitut fQr Arzneimittel und Medizinprodukte; 1990.
28. Kommission E. Monographie Quercus cortex (Eichenrinde). In: Bundesanzeiger Nr. 22 a vom 01.02.1990. Bundesinstitut fQr Arzneimittel und Medizinprodukte; 1990.
29. Kommission E. MonographieTaraxi herba (Lowenzahnkraut). Bundesanzeiger Nr. 162 vom 29.08.1992. Bundesinstitut fQr Arzneimittel und Medizinprodukte; 1992.
30. Попович В.И. Острый назофарингит, ассоциированный с герпесвирусной инфекцией. Педиатрия. Восточная Европа. 2017;5(4):656–669. [Popovich V.I. Acute nasopharyngitis associated with herpesvirus infection. Pediatrics. Eastern Europe. 2017;5(4):656–669 (in Russ.)].
31. Popovych V., Koshel I., Malofiichuk A. et al. A randomized, open-label, multicenter, comparative study of therapeutic efficacy, safety and tolerability of BNO 1030 extract, containing Althea root, Cammomile flowers, horsetail herb, walnut leaves, yarrow herb, oak bark, dandelion herb in the treatment of acute non-bacterial tonsillitis in children aged 6 to 18 years. Am J Otolaryngol. 2019;40(2):265–273. DOI: 10.1016/j.amjoto.2018.10.012.
32. Goodacre S., Thomas B., Lee E. et al. Characterisation of 22445 patients attending UK emergency departments with suspected COVID-19 infection: Observational cohort study. PLoS One. 2020;15(11):e0240206. DOI: 10.1371/journal.pone.0240206.
33. Altonen B.L., Arreglado T.M., Leroux O. et al. Characteristics, comorbidities and survival analysis of young adults hospitalized with COVID-19 in New York City. PLoS One. 2020;15(12):e0243343. DOI: 10.1371/journal.pone.0243343.
34. Lakbar I., Luque-Paz D., Mege J-L. et al. COVID-19 gender susceptibility and outcomes: A systematic review. PLoS One. 2020;15(11):e0241827. DOI: 10.1371/journal.pone.0241827.
35. McCullough A., Pollack A.J., Plejdrup Hansen M.P. et al. Antibiotics for acute respiratory infections in general practice: comparison of prescribing rates with guideline recommendations. Med J Aust. 2017;207(2):65–69. DOI: 10.5694/mja16.01042.
36. WHO. Coronavirus disease (COVID-19) advice for the public: Mythbusters. (Electronic resource.) URL: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/advice-for-public/myth-busters?fbclid=lwAR094DVyzt9WrpWNKn1K5jZB5%20y8nGtMEmsG4hi0q2ECkUOIc6Y2gYA7X1oU.
37. Berger T. Tolerability and efficacy of a herbal combination preparation in children and adolescents with recurrent infections of the upper respiratory tract. MMW Fortschr Med. 2008;150:85–90.
38. Lee B.Y., Bartsch S.M., Ferguson M.C. et al. The value of decreasing the duration of the infectious period of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection. PLoS Comput Biol. 2021;17(1):e1008470. DOI: 10.1371/journal.pcbi.1008470.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
