Нарушения кишечного микробиоценоза: актуальные аспекты терминологии, клиники, профилактики
Бактериальная флора желудочно-кишечного тракта (ЖКТ) оказывает локальное и системное воздействие не только на органы пищеварения, но и на весь организм в целом. Многочисленные исследования доказали патогенетическую связь состояния кишечного биоценоза не только с заболеваниями ЖКТ, но и с патологией других органов и систем организма. В то же время в результате различных неблагоприятных воздействий на человека и развития разнообразных патологических состояний часто происходят количественные и качественные изменения нормальной микрофлоры кишечника. В представленном обзоре рассмотрены актуальные аспекты терминологии и клиники нарушений кишечного микробиоценоза. Важное место в комплексной терапии нарушений микробиоценоза кишечника и соответствующих им клинических проявлений занимают пробиотики, пребиотики и синбиотики. В рамках обзора рассмотрены основные механизмы взаимодействия пробиотик/хозяин, возможные эффекты пробиотиков и предъявляемые к ним требования. В профилактике нарушений кишечного микробиоценоза и связанных с ними возможных метаболических сдвигов пробиотики, пребиотики и синбиотики выходят на первый план.
Ключевые слова: микробиоценоз кишечника, дисбиоз, дисбактериоз, клиника, профилактика, пробиотик, пребиотик, синбиотик, Bifidobacterium lactis, инулин, холекальциферол.
Для цитирования: Голошубина В.В., Трухан Д.И., Багишева Н.В. Нарушения кишечного микробиоценоза: актуальные аспекты терминологии, клиники, профилактики. РМЖ. Медицинское обозрение. 2020;28(12):17-22.
Intestinal microbiocenosis disorder: current aspects of terminology, clinical picture and prevention
V.V. Goloshubina, D.I. Trukhan, N.V. Bagisheva
Omsk State Medical University, Omsk
Bacterial flora in the gastrointestinal tract (GI) has a topical and systemic effect not only on the digestive organs but also on the entire body. Numerous studies have proved the pathogenetic association of the intestinal biocenosis state not only with GI diseases but also with pathological processes of other body organs and systems. At the same time, quantitative and qualitative changes in the normal intestinal microflora commonly occur as a result of various adverse events in humans and the development of various pathological conditions. In this review, the current aspects of terminology and clinical picture of intestinal microbiocenosis disorders are considered. Probiotics, prebiotics and synbiotics occupy an important place in the combination therapy of intestinal microbiocenosis disorders and clinical manifestations, associated with them. The review examines the main mechanisms of probiotic-host interaction, probiotics possibl e effects, and the requirements for them. Probiotics, prebiotics and synbiotics are used as the first-line treatment in the prevention of intestinal microbiocenosis disorders and associated possible metabolic shifts.
Keywords: intestinal microbiocenosis, dysbiosis, dysbacteriosis, clinical picture, prevention, probiotic, prebiotic, synbiotic, Bifidobacterium lactis, inulin, cholecalciferol.
For citation: Goloshubina V.V., Trukhan D.I., Bagisheva N.V. Intestinal microbiocenosis disorder: current aspects of terminology, clinical picture and prevention. RMJ. 2020;12:17–22.
Роль кишечной микрофлоры
Изучение микрофлоры кишечника, его количественного и качественного состава и возможного влияния на здоровье человека началось в конце XVII в., когда изобретатель микроскопа нидерландский натуралист Антони ван Левенгук (Antoni van Leeuwenhoek) обнаружил бактерии в фекалиях человека. С той поры прошло более трех столетий, но аспекты взаимодействия человека и бактерий до сих пор окружены множеством загадок и тайн. Более 400 различных видов и подвидов микроорганизмов населяют кишечник, их общий вес достигает 2,5–3 кг (эквивалентно весу печени), а общее количество микробных клеток на порядок больше, чем число собственных клеток человека [1–3].
Кишечная микрофлора по своему участию в поддержании гомеостаза макроорганизма не уступает другим жизненно важным органам и системам. Все это позволяет рассматривать ее как самостоятельный орган [1–3].
Бактериальная флора желудочно-кишечного тракта (ЖКТ) оказывает локальное и системное воздействие не только на органы пищеварения, но и на весь организм в целом. В многочисленных исследованиях продемонстрирована патогенетическая связь состояния кишечного микробиоценоза не только с заболеваниями ЖКТ, но и с болезнями сердечно-сосудистой системы (атеросклероз, артериальная гипертензия), мочевыделительной системы (мочекаменная болезнь, пиелонефрит), патологией гепатобилиарной системы (гепатиты, гепатозы, желчнокаменная болезнь) [2, 3].
Нормальная микрофлора, являясь симбионтной, выполняет ряд значимых функций, имеющих важное значение для поддержания гомеостаза и жизнедеятельности макроорганизма [2, 3]:
Обеспечивает неспецифическую защиту, основанную на микробном антагонизме, от патогенных бактерий, вызывающих кишечные инфекции.
Участвует в выработке антител, особенно относящихся к иммуноглобулинам класса А (IgA).
Осуществляет витамин-синтезирующую функцию (в частности, витамины В1, В2, В6, В12, С, К, РР, пантотеновая и фолиевая кислоты).
Участвует в ферментативном расщеплении целлюлозы, высокомолекулярных углеводов, белков и жиров.
Способствует всасыванию витамина D, железа, кальция.
Принимает участие в обмене желчных кислот (их энтерогепатической циркуляции) и образовании в толстой кишке дезоксихолевой кислоты, стеркобилина и копростерина.
Вносит свой вклад в образование продуктов распада белка (фенола, индола, скатола), обеспечивающих нормальную перистальтику кишечника.
Оказывает влияние на структуру слизистой оболочки кишечника и ее всасывательную способность.
Содействует «созреванию» лимфоидно-макрофагальной системы.
В результате различных неблагоприятных воздействий на человека и развития разнообразных патологических состояний часто происходят количественные и качественные изменения нормальной микрофлоры кишечника.
Изменения количественного и качественного состава кишечной микрофлоры
Краткосрочные сдвиги в состоянии кишечного микробиоценоза, часто исчезающие без каких-либо воздействий извне, после прекращения действия неблагоприятного триггера, относят к категории «дисбактериальных реакций». Термин «дисбактерия» кишечника является более широким и предполагает более выраженные и стойкие качественные и количественные изменения нормальной микрофлоры кишечника. Часто дисбактерия рассматривается как проявление или следствие дисгармонии в экосистеме [3, 4].
Дисбиоз представляет собой состояние экосистемы, при котором происходит нарушение функционирования ее составных частей и механизмов взаимодействия, следствием чего может являться заболевание человека. Пациенты с различными заболеваниями, жители экологически неблагоприятных регионов, рабочие вредных производств страдают дисбиозами, возникающими у них в результате воздействия на организм физических, химических, радиационных и других неблагоприятных факторов [3, 5].
Микрофлора кишечника считается «дисбиотической», когда в результате выраженных и стабильных ее изменений (количественных и качественных) манифестирует ряд клинических симптомов болезни. Термин «дисбиоз» характеризует состояние всех групп микроорганизмов: бактерий, вирусов, грибов, простейших, а также гельминтов.
Дисбактериоз отражает состояние бактериальных форм представителей микрофлоры. Дисбактериоз наиболее часто представляет собой уменьшение общего количества бактерий, иногда вплоть до полного исчезновения некоторых видов нормальной микрофлоры с одновременным увеличением числа тех бактерий, которые в норме присутствуют в минимальных количествах. Это преобладание может отмечаться периодически или быть достаточно продолжительным [2, 3].
Различные проявления дисбактериоза в разнообразных сочетаниях обнаруживаются практически у всех пациентов с хроническими заболеваниями кишечника, при изменениях характера и режима питания, воздействии ряда факторов окружающей среды, приеме антибактериальных препаратов и ряда других лекарственных средств. Поэтому, в первую очередь, дисбактериоз кишечника является бактериологическим понятием.
Таким образом, дисбактериоз — состояние, при котором нарушается подвижное равновесие кишечной микрофлоры, заселяющей в норме нестерильные полости и кожные покровы, и возникают качественные и количественные изменения кишечного микробиоценоза. В соответствии с отраслевым стандартом ОСТ 91500.11. 0004–2003 дисбактериоз кишечника рассматривается как клинико-лабораторный синдром, возникающий при ряде заболеваний и клинических ситуаций, характеризующийся изменением качественного и/или количественного состава нормальной микрофлоры, метаболическими и иммунными нарушениями, сопровождающимися у части больных клиническими проявлениями [3].
Ряд авторов термин «дисбактериоз» относят лишь к процессам в толстом кишечнике, а к процессам в тонкой кишке применяют термин «микробная тонкокишечная контаминация» [2, 4]. Синдром тонкокишечной микробной контаминации (СТМК) характеризуется увеличением в проксимальных отделах тощей кишки содержания микроорганизмов с доминированием бактерий рода Escherichia, Klebsiella, лактобацилл, энтерококков. При этом синдроме содержание бактерий в тонкой кишке повышается до 1011/г и более (при норме 104–107/г) [4].
В зарубежной литературе [2, 6] широко используется объединяющий термин — «синдром избыточного размножения бактерий» (bacterial overgrowth syndrome), т. е. повышение в тонком и толстом кишечнике популяционного уровня условно-патогенных микробов (стафилококков, энтеробактерий, грибов рода Candida и др.).
Клиническая картина дисбактериоза кишечника
Клинические симптомы дисбактериоза кишечника могут быть разделены на кишечные и системные [1, 3, 5].
Специфические клинические проявления дисбиоза кишечника отсутствуют. При анализе клинической картины различных заболеваний ЖКТ можно выделить кишечные симптомы, появление которых обусловлено дисбалансом кишечной микрофлоры (синдромом избыточного бактериального роста):
а) синдром кишечной диспепсии:
метеоризм, урчание, вздутие живота;
чувство тяжести и переполнения/распирания в животе;
боль (спастическая или тупая, ноющая в нижней половине живота);
неустойчивый стул (диарея или запор, чередование диареи и запора);
б) синдром нарушения пищеварения:
стеаторея;
нарушение всасывания жирорастворимых витаминов (D, К);
нарушение водно-электролитного баланса;
диспепсические симптомы (отрыжка, горечь во рту, тошнота);
в) астеновегетативный синдром (обусловлен гипо- и авитаминозом, интоксикацией).
Возможно развитие анемии, остеомаляции/остеопороза, гипо- и диспротеинемии, нарушений свертывания крови, гиповитаминоза, снижение массы тела.
К системным проявлениям нарушения кишечного микробиоценоза относятся [2, 3, 5]:
бактериемия (септицемия, сепсис);
аллергия;
канцерогенез;
гиперхолестеринемия;
артериальная гипертензия;
деменция и болезнь Альцгеймера;
ожирение;
артриты/артрозы;
оксалатурия и мочекаменная болезнь;
развитие реакции «трансплантат против хозяина».
Связь нарушений микробиоценоза кишечника с этими проявлениями обусловлена продукцией микроорганизмами веществ, вызывающих соответствующие биологические эффекты, изменениями барьерной функции кишечника, развитием синдрома повышенной эпителиальной/кишечной проницаемости, аутоиммунными нарушениями и т. д.
Способы коррекции дисбиоза
Для стабилизации нормальной микрофлоры применяются различные средства, которые принято подразделять на пробиотики, пребиотики и синбиотики. В соответствии с определением WGO (World Gastroenterology Organisation — Всемирная организация гастроэнтерологов) (2008), пробиотики — это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина [6].
Механизм взаимодействия пробиотик/хозяин включает иммунологические и неиммунологические эффекты [7, 8].
Иммунологические эффекты пробиотиков:
активация локальных макрофагов для увеличения презентации различных антигенов B-лимфоцитам;
увеличение выработки секреторного IgA на местном и системном уровнях;
модулирование цитокиновых профилей;
формирование гиперергического ответа на различные пищевые аллергены.
Неиммунологические эффекты пробиотиков:
переваривание пищи;
изменение локальной pH, способствующей формированию неблагоприятного местного окружающего пространства для развития патогенов;
конкуренция за питательные вещества и адгезию с патогенными бактериями;
производство бактериоцинов для подавления патогенов;
антиоксидантный — посредством устранения супероксидных радикалов;
мукопротективный — за счет стимуляции продукции эпителиального муцина;
защитный — усиление барьерной функции кишечника и модификация патогенных токсинов.
Основные требования, которым должен соответствовать современный пробиотик [2–4, 7, 8]: 1) обладать высокой жизнеспособностью и биологической активностью, а также высокой адгезивной способностью; 2) содержать пробиотические штаммы в количестве 106–109; 3) обладать антагонизмом по отношению к условно-патогенной и патогенной флоре; 4) быть устойчивым к физико-химическим факторам (кислотность, осмотический шок, температура, действие желчных кислот и т. п.); 5) сохранять стабильность на протяжении всего срока хранения; 6) быть устойчивым к действию антибиотиков; 7) иметь доказанную клиническую эффективность и безопасность.
К пробиотикам отнесены лечебно-профилактические препараты, разработанные на основе живых бактерий родов Bifidobacterium, Lactobacillus, Escherichia, Enterococcus, Aerococcus или апатогенных спорообразующих микроорганизмов и сахаромицет, которые при естественном способе введения положительно влияют на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию функции его нормальной микрофлоры.
Важным является характер основного заболевания, при котором развивается нарушение микробиоценоза кишечника. Так, при вирусных заболеваниях более целесообразно использовать лактосодержащие препараты, при бактериальных — бифидо- и лактосодержащие [2, 7, 8].
Бифидосодержащие препараты применяются с целью нормализации микробиоценоза ЖКТ, повышения неспецифической резистентности организма, стимуляции функциональной деятельности пищеварительной системы, для профилактики госпитальных инфекций в родильных домах и больницах.
В настоящее время показания к назначению пробиотиков существенно расширились [9]:
воспалительные изменения слизистой оболочки ЖКТ, в т. ч. ассоциированные с инфекцией Helicobacter pylori;
аллергические заболевания;
профилактика и лечение антибиотико-ассоциированной диареи;
острые кишечные инфекции;
диарея путешественников;
синдром раздраженного кишечника.
Согласно определению WGO (2008) пребиотики — это невсасывающиеся вещества, которые оказывают положительное физиологическое воздействие на хозяина, селективно стимулируя необходимый рост или активность кишечной микрофлоры [6].
Пребиотики — это пищевые вещества (в основном состоящие из некрахмальных полисахаридов и олигосахаридов, плохо перевариваемых человеческими ферментами), которые питают определенную группу кишечных микроорганизмов. В отличие от пробиотиков, большинство пребиотиков используются в качестве пищевых добавок — в бисквитах, кашах, шоколаде, пастообразных и молочных продуктах. К наиболее известным пребиотикам относятся: лактулоза, инулин, олигофруктоза, галакто-олигосахариды, олигосахариды грудного молока [2, 3, 10].
Необходимо отметить, что нарушение кишечного микробиоценоза и витаминно-микроэлементная недостаточность практически не встречаются изолированно, поскольку только нормальная микрофлора кишечника обеспечивает полноценное всасывание этих нутрициентов. В этой связи ряд авторов относит к пребиотикам микроэлементы и витамины [4, 10].
Современная концепция коррекции нарушенного кишечного микробиоценоза заключается в комбинированном совместном применении про- и пребиотиков [2, 3].
Синбиотики — продукты, содержащие комбинацию пробиотиков и пребиотиков [6], совмещая эффекты тех и других.
Пробиотики, пребиотики и синбиотики занимают важное место в комплексной терапии нарушений микробиоценоза кишечника и соответствующих им клинических проявлений [10–14].
Первичная профилактика дисбактериоза с учетом разнообразных причин его развития является достаточно сложной задачей. К основным направлениям решения этой непростой задачи можно отнести: рациональное питание, улучшение благосостояния населения, экологическую безопасность, устранение других триггерных факторов внешней и внутренней среды. Вторичная профилактика предполагает рациональное применение антибиотиков, антисекреторных препаратов, нестероидных противовоспалительных препаратов и других лекарственных средств, нарушающих количественный и качественный баланс кишечной микрофлоры, своевременное и оптимальное лечение заболеваний ЖКТ, сопровождающихся нарушением микробиоценоза.
В профилактике нарушений кишечного микробиоценоза и связанных с ними возможных метаболических сдвигов пробиотики, пребиотики и синбиотики выходят на первый план.
Новым перспективным продуктом, недавно появившимся на российском фармацевтическом рынке, является нутрицевтик — биологически активная добавка к пище БиоТоффи Пробиотик (ООО «Бауш Хелс», Россия).
БиоТоффи Пробиотик — инновационный и единственный в РФ пробиотик в форме выпуска «шоколадные батончики», содержащий 1 млрд полезных пробиотических микроорганизмов.
Пробиотическим компонентом являются Bifidobacte-rium lactis, которые относятся к представителям естественной микрофлоры кишечника, обладают высокой способностью к адгезии, и их количество соответствует нормам ВОЗ и рекомендациям Российской гастроэнтерологической ассоциации (РГА): среднее содержание этих бифидобактерий в 1 батончике составляет ≥1×109 КОЕ [15].
B. lactis является представителем вида Bifidobacterium animalis, который входит в состав рода Bifidobacterium (семейство Bifidobacteriaceae). Полное название подвида B. lactis — Bifidobacterium animalis lactis. B. lactis широко представлена в составе различных БАД и пищевых продуктов с пробиотическими свойствами [6].
B. lactis содержится в естественной биопленке кишечника здоровых людей, обеспечивает устойчивость к колонизации кишечника патогенными микроорганизмами (колонизационная резистентность) [16, 17] и способна ингибировать активность различных патогенных бактерий [18, 19]. Отмечена устойчивость B. lactis к антибиотикам [20, 21].
Результаты многочисленных исследований B. lactis, являющихся одним из компонентов БиоТоффи Пробиотик, демонстрируют, что бифидобактерии способствуют не только поддержанию нормального состояния кишечного микробиоценоза [17, 22, 23], но и восстановлению нарушенной кишечной микрофлоры на фоне и после приема антибиотиков [22, 23], регуляции двигательной функции кишечника и устранению клинической симптоматики [22, 24, 25], нормализации метаболических процессов в организме [26], поддержанию и восстановлению защитной функции кишечника [27], активации иммунных процессов, повышению сопротивляемости к инфекционным заболеваниям [17, 23, 28, 29], в т. ч. к респираторным инфекциям верхних дыхательных путей [30–32], снижению выраженности аллергических реакций [33, 34].
Пребиотический компонент БиоТоффи Пробиотик — инулин (содержит Baneo® — природную клетчатку из корня цикория) — сложный углевод, не переваривается в организме человека, но расщепляется бактериями в кишечнике и поэтому позитивно влияет на состояние микробиоты. Включение пребиотика благоприятно влияет на состав, количество и активность лактобактерий и бифидобактерий, способствует нормализации стула [33–35]. Кроме того, в процессе метаболизма из инулина в кишечнике образуются короткоцепочечные жирные кислоты, улучшающие защитную функцию кишечника и иммунный ответ организма [34, 36].
Витамин D как важный пребиотический компонент
Дефицит витамина D — достаточно распространенное явление, затрагивающее, по некоторым оценкам, до 1 млрд жителей Земли [37]. В европейских странах распространенность дефицита витамина D составляет от 13% до 40,4% [38]. Россия расположена в зоне низкой инсоляции, поэтому практически все население входит в группу риска развития дефицита витамина D [39].
В этой связи актуальным является выявление дефицита витамина D на начальном этапе до появления клинических проявлений. На рисунке 1 представлен клинико-диагностический алгоритм выявления дефицита витамина D на амбулаторно-поликлиническом этапе.
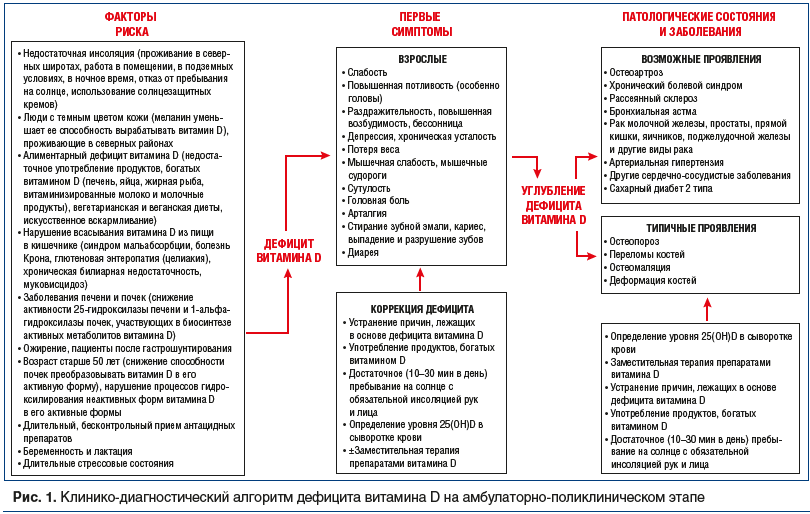
На синтез холекальциферола в коже влияют широта расположения региона проживания, продолжительность светового дня, время года, особенности профессиональной деятельности (работа в ночное время, под землей или в помещении), пигментация кожи человека и площадь кожного покрова, не прикрытого одеждой [40]. К дефициту витамина D в организме приводит и ряд других причин, которые на рисунке 1 представлены в качестве факторов риска.
К возможным симптомам дефицита витамина D относятся слабость, нервозность, раздражительность, повышенная возбудимость, бессонница, мышечная слабость, мышечные судороги, повышенная потливость [40] и ряд других симптомов, указанных в алгоритме. Эти симптомы неспецифичны и могут отмечаться при многих других заболеваниях. Однако появление этих симптомов в сочетании с наличием факторов риска также позволяет предположить возможность развития дефицита витамина D.
Необходимо отметить, что в эпидемиологических исследованиях последнего десятилетия дефицит витамина D постоянно ассоциируется с повышенным риском сердечно-сосудистых заболеваний и артериальной гипертензии [41–43].
БиоТоффи Пробиотик содержит холекальциферол (витамин D3) 2,5 мкг в 1 батончике, поэтому может рассматриваться в качестве биологически активной добавки для профилактики дефицита витамина D у лиц, проживающих в зонах низкой инсоляции.
Шоколад как средство доставки пробиотической микрофлоры
Какао и шоколад содержат большое количество мощных антиоксидантов и других питательных веществ, которые могут положительно влиять на здоровье человека [44]. В целом ряде обзоров отмечено повышение популярности функциональных продуктов, которые не только доставляют пищевое удовольствие, но и позитивно влияют на общее состояние здоровья, при этом большое внимание уделяется возможному сочетанию шоколада и пробиотиков [45].
Бельгийские ученые провели оценку шоколада как потенциального защитного носителя пробиотиков. Полученные ими данные показали, что покрытие пробиотиков шоколадом является отличным решением для защиты их от условий окружающей среды и их оптимальной доставки в толстый кишечник [46].
В ряде последующих исследований также получены результаты, позволяющие рассматривать шоколад в качестве перспективной системы доставки пробиотиков [47], появилось и понятие «пробиотический шоколад» [48–50]. Результаты исследования сербских ученых показали очень хорошую выживаемость пробиотических бактерий после производства и при хранении как в первые 60 дней, так и спустя 180 дней [44].
Еще в одном исследовании отмечается, что шоколад может служить средством доставки пробиотиков с дополнительным преимуществом, которое делает их безопасными для зубов. Все пробиотические конфеты были эффективны в снижении количества колоний Streptococcus mutans в полости рта [49]. В южнокорейском исследовании было продемонстрировано, что пробиотический шоколад, содержащий бифидо- и лактобактерии, потенциально может быть использован в качестве альтернативного средства для профилактики запоров [50].
На сегодняшний день существуют различные формы выпуска пробиотиков. К наиболее распространенным формам относятся жидкие и сухие пробиотики [1, 3]. Жидкие продукты обычно содержат действительно живые бактерии, которые, достигнув кишечника, могут сразу же образовывать жизнеспособные колонии микроорганизмов. Однако для них характерен достаточно короткий срок годности, необходимо строго соблюдать условия их хранения, при приеме внутрь они проходят через агрессивную среду желудка, вкусовые качества жидких пробиотиков достаточно сомнительны [6]. Сухие пробиотики (таблетки, капсулы) защищены от агрессивной среды желудка, имеют более продолжительный срок хранения. Однако бактерии, входящие в их состав, подвергаются сублимационной сушке — заморозке при предельно низкой температуре и давлении, что помещает их в состояние, сходное с анабиозом. Как только влажность становится доступной для бактерий, они повторно гидратируются, и часть их будет продолжать функционировать и делиться снова, как это было до замораживания. Вместе с тем процесс гидратирования может занять определенное время, при ускоренной моторике кишечника часть бактерий может покинуть организм, так и не выполнив свою задачу [6].
В этой связи к преимуществам шоколада как способа доставки кишечной микрофлоры — в виде шоколадных батончиков — можно отнести приятный вкус, удобство и приверженность их приему.
В составе БиоТоффи Пробиотик отсутствуют сахар, красители и ГМО. Рекомендации по применению в соответствии с инструкцией — взрослым по 1 батончику 1 раз в день во время или после еды. Продолжительность приема — 10 дней. При необходимости прием можно повторить.
В соответствии с наличием в составе БиоТоффи Пробиотик бифидобактерий, инулина, холекальциферола возможно рекомендовать его в качестве биологически активной добавки к пище — дополнительного источника пробиотических микроорганизмов (бифидобактерий) и источника витамина D с целью поддержания и восстановления кишечной микрофлоры, устранения дискомфорта в ЖКТ, активизации иммунных процессов.
Благодарность
Редакция благодарит компанию ООО «Бауш Хелс» за предоставленную информацию о продукте БиоТоффи Пробиотик.
2. Тарасова Л.В., Трухан Д.И. Болезни кишечника. Клиника, диагностика и лечение. СПб.: СпецЛит; 2013. [Tarasova L.V., Trukhan D.I. Bolezni kishechnika. Klinika, diagnostika i lechenie. SPb.: SpecLit; 2013 (in Russ.)].
3. Ардатская М.Д., Бельмер С.В., Добрица В.П. и др. Дисбиоз (дисбактериоз) кишечника: современное состояние проблемы, комплексная диагностика и лечебная коррекция. Экспериментальная и клиническая гастроэнтерология. 2015;5:13–50. [Ardatskaya M.D., Bel’mer S.V., Dobritsa V.P. et al. Colon dysbacteriosis (dysbiosis): modern state of the problem, comprehensive diagnosis and treatment correction. Eksperimental`naya i klinicheskaya gastroenterologiya. 2015;5:13–50 (in Russ.)].
4. Трухан Д.И., Филимонов С.Н. Заболевания кишечника: клиника, диагностика и лечение. Новокузнецк: ООО «Полиграфист»; 2017. [Trukhan D.I., Filimonov S.N. Intestinal diseases: clinic, diagnosis and treatment. Novokuznetsk: LLC «Poligrafist»; 2017 (in Russ.)].
5. Трухан Д.И., Филимонов С.Н. Дифференциальный диагноз основных гастроэнтерологических синдромов и симптомов. М.: Практическая медицина; 2016. [Trukhan D.I., Filimonov S.N. Differential diagnosis of the main gastroenterological syndromes and symptoms. M.: Practical medicine; 2016 (in Russ.)].
6. Пробиотики и пребиотики. Всемирная гастроэнтерологическая организация (WGO). Практические рекомендации. 2008. (Электронный ресурс). URL: https://www.gastroscan.ru/literature/authors/5634. Дата обращения: 05.04.2020. [Probiotics and prebiotics. World Gastroenterological Organization (WGO). Practical recommendations. 2008. (Electronic resource). URL: https://www.gastroscan.ru/literature/authors/5634. Access date: 05.04.2020 (in Russ.)].
7. Manzanares W., Lemieux M., Langlois P.L., Wischmeyer P.E. Probiotic and synbiotic therapy in critical illness: a systematic review and meta-analysis. Crit Care. 2016;19:262. DOI: 10.1186/s13054-016-1434-y.
8. Sebastian Domingo J.J. Review of the role of probiotics in gastrointestinal diseases in adults. Gastroenterol Hepatol. 2017;40(6):417–429. DOI: 10.1016/j.gastrohep.2016.12.003.
9. Reid G., Jass J., Sebulsky M.T., McCormick J.K. Potential uses of probiotics in clinical practice. Clin Microbiol Rev. 2003;16(4):658–672. DOI: 10.1128/cmr.16.4.658-672.2003.
10. Illiano P., Brambilla R., Parolini C. The mutual interplay of gut microbiota, diet and human disease. FEBS J. 2020;287(5):833–855. DOI: 10.1111/febs.15217.
11. Kim S.Y. Irritable bowel syndrome and synbiotics. Korean J Fam Med. 2019;40(1):1. DOI: 10.4082/kjfm.40.1E.
12. Salvucci E. The human-microbiome superorganism and its modulation to restore health. Int J Food Sci Nutr. 2019;70(7):781–95. DOI: 10.1080/09637486.2019.1580682.
13. Oka A., Sartor R.B. Microbial-based and microbial-targeted therapies for inflammatory bowel diseases. Dig Dis Sci. 2020;65(3):757–788. DOI: 10.1007/s10620-020-06090-z.
14. Cresci G.A.M., Lampe J.W., Gibson G. Targeted approaches for in situ gut microbiome manipulation. JPEN J Parenter Enteral Nutr. JPEN J Parenter Enteral Nutr. 2020;44(4):581–588. DOI: 10.1002/jpen.1779.
15. Ивашкин В.Т., Шелыгин Ю.А., Баранская Е.К. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению синдрома раздраженного кишечника. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2017;27(5):76–93. [Ivashkin V.T., Shelygin Yu.A., Baranskaya Ye.K. et al. Diagnosis and treatment of the irritable bowel syndrome: clinical guidelines of the Russian gastroenterological association and Russian association of coloproctology. Rossiyskiy zhurnal gastroenterologii gepatologii i koloproktologii. 2017;27(5):76–93 (in Russ.)].
16. Van der Waaij D. Colonization resistance of the digestive tract — mechanism and clinical consequences. Nahrung. 1987;31:507–517. DOI: 10.1002/food.19870310551.
17. Sanders M.E. Summary of probiotic activities of Bifidobacterium lactis HN019. J Clin Gastroenterol. 2006;40(9):776–783. DOI: 10.1097/01.mcg.0000225576.73385.f0.
18. Martins F.S., Silva A.A., Vieira A.T. et al. Comparative study of Bifidobacterium animalis, Escherichia coli, Lactobacillus casei and Saccharomyces boulardii probiotic properties. Arch Microbiol. 2009;191(8):623–630. DOI: 10.1007/s00203-009-0491-x.
19. Martinez F.A., Domínguez J.M., Converti A., Oliveira R.P. Production of bacteriocin-like inhibitory substance by Bifidobacterium lactis in skim milk supplemented with additives. J Dairy Res. 2015;82(3):350–355. DOI: 10.1017/S0022029915000163.
20. Morovic W., Roper J.M., Smith A.B. et al. Safety evaluation of HOWARU® Restore (Lactobacillus acidophilus NCFM, Lactobacillus paracasei Lpc-37, Bifidobacterium animalis subsp. lactis Bl-04 and B. lactis Bi-07) for antibiotic resistance, genomic risk factors, and acute toxicity. Food Chem Toxicol. 2017;110:316–324. DOI: 10.1016/j.fct.2017.10.037.
21. Morovic W., Roos P., Zabel B. et al. Transcriptional and Functional Analysis of Bifidobacterium animalis subsp. lactis Exposure to Tetracycline. Appl Environ Microbiol. 2018;84(23): pii: e01999–18. DOI: 10.1128/AEM.01999-18.
22. Ibarra A., Latreille-Barbier M., Donazzolo Y. et al. Effects of 28-day Bifidobacterium animalis subsp. lactis HN019 supplementation on colonic transit time and gastrointestinal symptoms in adults with functional constipation: A double-blind, randomized, placebo-controlled, and dose-ranging trial. Gut Microbes. 2018;9(3):236–251. DOI: 10.1080/19490976.2017.1412908.
23. Miller L.E., Lehtoranta L., Lehtinen M.J. Short-term probiotic supplementation enhances cellular immune function in healthy elderly: systematic review and meta-analysis of controlled studies. Nutr Res. 2019;64:1–8. DOI: 10.1016/j.nutres.2018.12.011.
24. Ahmed M., Prasad J., Gill H. et al. Impact of consumption of different levels of Bifidobacterium lactis HN019 on the intestinal microflora of elderly human subjects. J Nutr Health Aging. 2007;11(1):26–31.
25. Waller P.A., Gopal P.K., Leyer G.J. et al. Dose-response effect of Bifidobacterium lactis HN019 on whole gut transit time and functional gastrointestinal symptoms in adults. Scand J Gastroenterol. 2011;46(9):1057–1064. DOI: 10.3109/00365521.2011.584895.
26. Bernini L.J., Simão A.N., Alfieri D.F. et al. Beneficial effects of Bifidobacterium lactis on lipid profile and cytokines in patients with metabolic syndrome: a randomized trial. Effects of probiotics on metabolic syndrome. Nutrition. 2016;32(6):716–719. DOI: 10.1016/j.nut.2015.11.001.
27. Gill H.S. Probiotics to enhance anti-infective defences in the gastrointestinal tract. Best Pract Res Clin Gastroenterol. 2003;17(5):755–773. DOI: 10.1016/s1521-6918 (03) 00074-x.
28. Arunachalam K., Gill H.S., Chandra R.K. Enhancement of natural immune function by dietary consumption of Bifidobacterium lactis (HN019). Eur J Clin Nutr. 2000;54(3):263–267. DOI: 10.1038/sj.ejcn.1600938.
29. Paineau D., Carcano D., Leyer G. et al. Effects of seven potential probiotic strains on specific immune responses in healthy adults: a double-blind, randomized, controlled trial. FEMS Immunol Med Microbiol. 2008;53(1):107–113. DOI: 10.1111/j.1574-695X.2008.00413.x.
30. West N.P., Horn P.L., Pyne D.B. et al. Probiotic supplementation for respiratory and gastrointestinal illness symptoms in healthy physically active individuals. Clin Nutr. 2014;33(4):581–587. DOI: 10.1016/j.clnu.2013.10.002.
31. Turner R.B., Woodfolk J.A., Borish L. et al. Effect of probiotic on innate inflammatory response and viral shedding in experimental rhinovirus infection — a randomised controlled trial. Benef Microbes. 2017;8(2):207–215. DOI: 10.3920/BM2016.0160.
32. Трухан Д.И., Викторова И.А. Коррекция нарушений кишечного микробиоценоза в аспекте профилактики респираторных инфекций дыхательных путей: возможности Lactobacillus rhamnosus GG. Гастроэнтерология. Хирургия. Интенсивная терапия. Consilium Medicum. 2018;2:39–44. [Trukhan D.I., Viktorova I.A. Correction of infringements of intestinal microbiocenosis in the aspect of prevention of respiratory infections of respiratory tract: opportunities of Lactobacillus rhamnosus GG. Gastroenterologiya. Khirurgiya. Intensivnaya terapiya. Consilium Medicum. 2018;2:39–44 (in Russ.)]. DOI: 10.26442/26583739.2018.2.180103.
33. Kleessen B., Sykura B., Zunft H.J., Blaut M. Effects of inulin and lactose on fecal microflora, microbial activity, and bowel habit in elderly constipated persons. Am J Clin Nutr. 1997;65(5):1397–1402. DOI: 10.1093/ajcn/65.5.1397.
34. Shoaib M., Shehzad A., Omar M. et al. Inulin: Properties, health benefits and food applications. Carbohydr Polym. 2016;147:444–454. DOI: 10.1016/j.carbpol.2016.04.020.
35. Micka A., Siepelmeyer A., Holz A. et al. Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial. Int J Food Sci Nutr. 2017;68(1):82–89. DOI: 10.1080/09637486.2016.1212819.
36. Mensink M.A., Frijlink H.W., van der Voort Maarschalk K., Hinrichs W.L. Inulin, a flexible oligosaccharide. II: Review of its pharmaceutical applications. Carbohydr Polym. 2015;134:418–428. DOI: 10.1016/j.carbpol.2015.08.022.
37. Шварц Г.Я. Типы дефицита витамина D и их фармакологическая коррекция. Лекарственные средства. 2011;2(3):33–42. [Shvarts G. Ya. Types of Vitamin D Deficiency and Their Pharmacological Correction. Lekarstvennye sredstva. 2011;2(3):33–42 (in Russ.)].
38. Cashman K.D., Dowling K.G., Škrabáková Z. et al. Vitamin D deficiency in Europe: pandemic? Am J Clin Nutr. 2016;103(4):1033–1044. DOI: 10.3945/ajcn.115.120873.
39. Громова О.А. Витамин D и его синергисты. Лекция. Consilium Medicum. Педиатрия. 2015; 1:14–19. [Gromova O.A. Vitamin D and its synergists. Lecture. Consilium Medicum. Pediatrija. 2015; 1:14–19 (in Russ.)].
40. Трухан Д.И. Остеопороз. Клинико-диагностические подходы на амбулаторно-поликлиническом этапе. Справочник поликлинического врача. 2016;02:14–17. [Trukhan D.I. Osteoporosis. Clinical and diagnostic approaches at the outpatient stage. Spravochnik poliklinicheskogo vracha. 2016;02:14–17 (in Russ.)].
41. Wang T.J. Vitamin D and Cardiovascular Disease. Annu Rev Med. 2016;67:261–272. DOI: 10.1146/annurev-med-051214-025146.
42. Trehan N., Afonso L., Levine D.L., Levy P.D. Vitamin D deficiency, supplementation, and cardiovascular health. Crit Pathw Cardiol. 2017;16(3):109–118. DOI: 10.1097/HPC.0000000000000122.
43. Holick M.F. The vitamin D deficiency pandemic: approaches for diagnosis, treatment and prevention. Rev Endocr Metab Disord. 2017;18(2):153–165. DOI: 10.1007/s11154-017-9424-1.
44. Mirković M., Seratlić S., Kilcawley K. et al. The sensory quality and volatile profile of dark chocolate enriched with encapsulated probiotic Lactobacillus plantarum bacteria. Sensors (Basel). 2018;18(8): pii: E2570. DOI: 10.3390/s18082570.
45. Ozyurt V.H., Ötles S. Properties of probiotics and encapsulated probiotics in food. Acta Sci Pol Technol Aliment. 2014;13(4):413–424. DOI: 10.17306/J.AFS.2014.4.8.
46. Possemiers S., Marzorati M., Verstraete W., Van de Wiele T. Bacteria and chocolate: a successful combination for probiotic delivery. Int J Food Microbiol. 2010;141(1–2):97–103. DOI: 10.1016/j.ijfoodmicro.2010.03.008.
47. Marcial-Coba M.S., Saaby L., Knøchel S., Nielsen D.S. Dark chocolate as a stable carrier of microencapsulated Akkermansia muciniphila and Lactobacillus casei. FEMS Microbiol Lett. 2019;366(2). DOI: 10.1093/femsle/fny290.
48. Kobus-Cisowska J., Szymanowska D., Maciejewska P. et al. Enriching novel dark chocolate with Bacillus coagulans as a way to provide beneficial nutrients. Food Funct. 2019;10(2):997–1006. DOI: 10.1039/c8fo02099j.
49. Janani R.G., Asokan S., Geetha Priya P.R. Effect of Custom-made Probiotic Chocolates on Streptococcus mutans, Plaque pH, Salivary pH and Buffering Capacity in Children — A Randomised Controlled Trial. Oral Health Prev Dent. 2019;17(1):7–15. DOI: 10.3290/j.ohpd.a41809.
50. Lee C.S., Tan P.L., Eor J.Y. et al. Prophylactic use of probiotic chocolate modulates intestinal physiological functions in constipated rats. J Sci Food Agric. 2019;99(6):3045–3056. DOI: 10.1002/jsfa.9518.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

