Наследственный ангионевротический отек: случай из практики
DOI: 10.32364/2587-6821-2020-4-1-58-61
Несмотря на осведомленность врачей, наследственный ангионевротический отек (HAО) до настоящего времени остается серьезной проблемой как в педиатрии, так и во взрослой клинической практике, часто скрываясь под масками других заболеваний. Повторяющиеся эпизоды потенциально опасного для жизни отека кожи, слизистых и подслизистых оболочек могут стать фатальными. Клиническое наблюдение, приведенное в статье, показывает многообразие клинических проявлений НАО, которые, с одной стороны, демонстрируют разную локализацию, с другой — идентичны с симптомами других заболеваний (поллиноз, пиелонефрит, цистит и др.). Тщательный сбор анамнеза и анализ объективных данных помогают выделить ключевые признаки НАО, своевременно поставить диагноз, подтвердить его исследованиями концентрации и активности ингибитора С1-эстеразы, провести генетические исследования у пациента и его родственников. Своевременно поставленный диагноз и адекватная терапия такими препаратами, как икатибант (Фиразир) и ингибитор С1-эстеразы, позволяют избежать летальных исходов и значительно улучшить качество жизни пациентов с НАО.
Ключевые слова: наследственный ангиоотек (НАО), атопия, абдоминальная атака, дефект системы комплемента, брадикинин, икатибант, ингибитор С1-эстеразы.
Для цитирования: Андронова Е.В., Бельтюков Е.К., Лепешкова Т.С. Наследственный ангионевротический отек: случай из практики. РМЖ. Медицинское обозрение. 2020;4(1):58-61. DOI: 10.32364/2587-6821-2020-4-1-58-61.
E.V. Andronova1, E.K. Bel’tyukov2, T.S. Lepeshkova2,3
1LLC “Family doctor”, Magnitogorsk, Russian Federation
2Ural State Medical University, Yekaterinburg, Russian Federation
3Children’s City Polyclinic No. 13, Yekaterinburg, Russian Federation
Despite the awareness of doctors, hereditary angioedema is still an important issue both in children and adults being often masqueraded by other diseases. Recurrent episodes of potentially life-threatening skin, mucosal, and submucosal edema can be fatal. This paper describes case report which demonstrates the diversity of clinical signs of angioedema. These signs illustrate various localization of angioedema while being the symptoms of other diseases (i.e., hay fever, pyelonephritis, cystitis etc.). Careful history taking and analysis of objective data help define key signs of hereditary angioedema, early diagnose and verify the disease (by measuring concentration and activity of C1 esterase inhibitor), and perform genetic testing in patients and their relatives. Early diagnosis and adequate treatment with icatibant (Firazyr) and C1 esterase inhibitor prevent fatal outcome and significantly improve the quality of life of patients with hereditary angioedema.
Keywords: hereditary angioedema, atopy, abdominal attack, complement defect, bradykinin, icatibant, C1 esterase inhibitor.
For citation: Andronova E.V., Bel’tyukov E.K., Lepeshkova T.S. Hereditary angioedema: case report. Russian Medical Review. 2020;4(1):58–61. DOI: 10.32364/2587-6821-2020-4-1-58-61.
Введение
Наследственный ангионевротический отек (НАО) — редкое, потенциально жизнеугрожающее, генетически детерминированное заболевание с аутосомно-доминантным типом наследования, встречающееся примерно у 1 из 50 000 человек [1–4]. Мутация в гене SERPING1 приводит к дефициту количества ингибитора С1-эстеразы и/или снижению его функциональной активности. При раннем дебюте НАО у многих пациентов он тем не менее остается нераспознанным на протяжении десятков лет. Типичными ошибочными диагнозами являются аллергический или идиопатический ангионевротический отек, а в некоторых случаях — анафилаксия.
Основными симптомами НАО выступают отеки кожи и слизистых/подслизистых оболочек, вызываемые брадикинином, который высвобождается под действием самых разнообразных триггеров [1]. Характерной особенностью НАО является отсутствие зуда, гиперемии кожи, сопутствующей крапивницы, а также клинического эффекта от лечения системными глюкокортикостероидами (ГКС) и антигистаминными препаратами (АГП) [1, 4].
Для профилактики развития отеков больным НАО назначаются андрогены (даназол) или антифибринолитические препараты [1, 5]. Для лечения приступов НАО применяют икатибант (Фиразир) — блокатор В2-рецепторов брадикинина. Для краткосрочной профилактики и лечения атак применяется также ингибитор С1-эстеразы человека [1, 6, 7].
По данным литературных источников, больные НАО крайне редко имеют сопутствующие аллергические заболевания. Однако бывают единичные случаи совместных проявлений НАО и атопии [8].
Приводим описание такого случая.
Клиническое наблюдение
Больная Г., 30 лет, была осмотрена врачом аллергологом-иммунологом частного медицинского центра после многочисленных консультаций врачей других специальностей.
Из анамнеза: до года росла и развивалась соответственно возрасту. Вакцинирована в детстве согласно календарю прививок без реакций и осложнений. С 7-летнего возраста стали беспокоить периодические приступы кашля при контакте с домашней пылью. Симптомы были достаточно легкими и проходили самостоятельно без приема АГП. С 10 лет присоединились симптомы атопического конъюнктивита. С 25 лет стали проявляться легкие симптомы сезонного аллергического риноконъюнктивита (апрель — май, июль — сентябрь).
Наследственный анамнез отягощен по сахарному диабету 2 типа (бабушка со стороны матери). У сестры в детстве периодически отмечалась отечность губы (проходила самостоятельно, к врачу не обращалась); с возрастом добавились симптомы холодовой крапивницы. У сына наблюдаются проявления аллергического риноконъюнктивита (на домашнюю пыль и пыльцу деревьев).
Из акушерско-гинекологического анамнеза: в 2008 г. у пациентки был выкидыш; в 2009 г. — оперативные роды (ребенок — живой мальчик). Повторное кесарево сечение в 2016 г. (ребенок — живая девочка), после чего спустя 3 мес. появились тянущие боли в низу живота с позывами на мочеиспускание. На осмотре врачом-гинекологом при болях в животе пальпаторно отмечалась выраженная болезненность (цитологическое исследование: норма; при ультразвуковом исследовании: отечность органов малого таза). Далее наблюдалась у гинеколога с диагнозом «аденомиоз» и с 2018 по 2019 г. получала оральные контрацептивы. Периодичность абдоминальных болей была 1 раз в 3–4 мес. В 2018 г. было несколько эпизодов «цистита», сопровождавшихся внезапной болью в области половых органов. В комплексную терапию пациентки всегда включались курсы антибактериальных препаратов; при этом, со слов женщины, врачи всякий раз сомневались в целесообразности таких назначений, т. к. результаты анализов всегда были в пределах нормы.
В октябре 2017 г. больной были установлены 4 зубных титановых имплантата и удален зуб, после чего у пациентки сразу же увеличились шейные и подчелюстные лимфатические узлы. Была осмотрена стоматологом и челюстно-лицевым хирургом, проведена антибактериальная терапия и местное лечение димексидом. Осмотрена гематологом, который не нашел данных за болезнь крови. В феврале 2018 г. после механического воздействия в области бедра возник отек, плотный на ощупь, зудящий, без изменения цвета кожи, сохранявшийся на протяжении 7–10 дней. Затем (с апреля 2018 г.) практически ежемесячно стали беспокоить отеки разной локализации (подмышечная область, спина, ноги), сопровождавшиеся периодически незначительным зудом. Отеки всегда были плотные на ощупь, с четкими границами, с небольшой гиперемией на 2-й день (когда отек начинал увеличиваться), болезненные, негорячие на ощупь и самостоятельно проходили за 3–4 дня. На фоне месячной терапии ГКС и АГП (без существенной динамики) отеки рецидивировали. Пациентка была осмотрена дерматологом, хирургом, неврологом, гематологом, сосудистым хирургом — диагноз не был установлен. В течение 2018 г. больная получила 15 курсов антибиотиков.
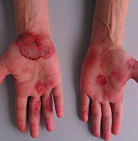
В ноябре 2018 г. на фоне «полного здоровья» появился выраженный отек правой кисти, сопровождавшийся зудом, нараставший в течение нескольких часов. Бригадой скорой медицинской помощи были введены ГКС и АГП, эффект отсутствовал. На следующие сутки отек распространился на предплечье и сохранялся в течение недели. В декабре 2018 г. во время имплантации зуба появилась отечность лица, в т. ч. губ, нараставшая в течение суток, затем прошла самостоятельно в течение недели.
В январе 2019 г. обратилась на консультацию к аллергологу-иммунологу, было проведено обследование и выявлены следующие отклонения: анемия легкой степени тяжести (гемоглобин 101 г/л), анизоцитоз (микро), незначительная гипохромия, эозинофилия (13,9%, абс. количество: 870 кл/мкл); С4-компонент комплемента 0,06 г/л (норма: 0,15–0,57 г/л); антитела к С1q комплемента 14,03 отн. ед/мл (норма: до 10 отн. ед/мл), ингибитор С1-эстеразы 0,52 Ед/мл (норма: 0,7–1,3 Ед/мл). Анализ крови на специфические IgE к аллергенам (RIDA, Санкт-Петербург, апрель 2019 г.) выявил сенсибилизацию к пыльце березы — 1,11 МЕ/мл, ольхи — 1,66 МЕ/мл, смеси трав — 2,12 МЕ/мл, ржи — 2,91 МЕ/мл, к моркови — 0,93 МЕ/мл, пшенице (мука) — 1,23 МЕ/мл, клещу домашней пыли (Dermatophagoides farinae) — 0,83 МЕ/мл (норма: до 0,34 МЕ/мл). Уровень общего IgE — менее 25 МЕ/мл (норма: до 100 МЕ/мл). Сенсибилизация к пыльце деревьев и клещам домашней пыли совпадала с данными аллергологического анамнеза.
При дообследовании в ФБУН НИИ эпидемиологии и микробиологии имени Пастера (центральная клинико-диагностическая лаборатория) методом иммунотурбидиметрии: ингибитор С1-эстеразы количественный 33,4 мг/дл (норма: 23–41 мг/дл), функциональная активность 9,38% (норма: 70–130%), С4 0,36 г/л (норма: 0,09–0,36 г/л). В ФГБНУ «МГНЦ» (лаборатория молекулярно-генетической диагностики) было проведено исследование ДНК на наличие мутаций в гене SERPING1 (C1NH) и обнаружены 2 неописанных варианта неопределенного клинического значения в гетерозиготном состоянии: с.874G>C (Ala292Pro) и c.889+81(IVS5+81G>C). Такие же мутации в вышеуказанном гене были выявлены у сестры, матери и сына пациентки (при дальнейшем исследовании в той же лаборатории). При проведении исследования ДНК на наличие протяженных делеций/дупликаций экзонов гена SERPING1 (C1NH) методом количественной MLPA экзонов (1–8) гена SERPING1 изменения числа копий последовательности не обнаружены.
В марте 2019 г. у пациентки развился острый пиелонефрит, сопровождавшийся отеком передней брюшной стенки.
В результате проведенного обследования был установлен основной диагноз: Первичный иммунодефицит: дефект в системе комплемента (D84.1). Наследственный ангиоотек 1 типа (мутация в гене SERPING1 с.874G>C (Ala292Pro), c.889+81(IVS5+81G>C)).
Сопутствующие заболевания: аллергический риноконъюнктивит легкого персистирующего течения; сенсибилизация к аллергенам пыльцы деревьев, злаковых трав, клещам домашней пыли; анемия легкой степени тяжести.
В мае 2019 г. пациентка была поставлена на диспансерный учет у аллерголога-иммунолога и терапевта по месту жительства. В соответствии с Федеральными клиническими рекомендациями по НАО (2019 г.) для купирования атак был рекомендован икатибант (шприц-ручка); для краткосрочной профилактики и купирования атак — концентрат ингибитора С1-эстеразы [1]. Заявка на препараты осуществлялась ежемесячно по мере потребности, в зависимости от частоты атак. За полгода было использовано 2 шприц-ручки икатибанта и 4 флакона ингибитора С1-эстеразы. Для базисной терапии был рекомендован даназол 200 мг 1 р./сут.
При назначении транексамовой кислоты в дозе 1 г/сут отмечались побочные реакции в виде головокружения, ухудшения самочувствия, выраженной болезненности в брюшной полости во время очередной атаки. В августе 2019 г. через 5 дней после установки зубных имплантатов (по решению пациентки без предварительной консультации аллерголога-иммунолога и без краткосрочной профилактики) появилась резкая боль в шее, голове, повысилось артериальное давление до 160/90 мм рт. ст., наблюдалась потеря сознания с судорогами Через 4 ч от начала атаки внутривенно был введен концентрат ингибитора С1-эстеразы (соответственно массе тела пациентки). Состояние стабилизировалось постепенно, в течение 3 сут сохранялась выраженная головная боль. В сентябре на фоне пиелонефрита с затрудненным мочеиспусканием вновь появился отек передней брюшной стенки. В результате внутривенного введения концентрата ингибитора С1-эстеразы ожидаемого эффекта не последовало. Через 33 дня (отмечена четкая связь с менструальным циклом) на фоне повышения температуры тела до фебрильных цифр и боли в горле на 2-й день
отмечены затрудненное глотание, уплотнение в области шеи. На фоне введения икатибанта болезненность в шее уменьшилась через 30 мин, отечность спала в течение суток. В ноябре 2019 г. была потеря сознания с судорогами; сразу был введен икатибант, и в течение одного часа состояние нормализовалось. В январе 2020 г. при обследовании в отделении иммунопатологии ФГБУ «ГНЦ Институт иммунологии» ФМБА России: С4 компонент комплемента 0,02 мг/мл (норма: 0,2–0,55 мг/мл), количественный уровень ингибитора С1-эстеразы составил 2,3 мг/дл (норма: 15–35 мг/дл), функциональная активность менее 5% (норма: 70–130%). В результате дообследования пациентке был установлен диагноз: НАО 1 типа.
Заключение
Данный клинический случай демонстрирует редкое сочетание дефекта в системе комплемента (дефицит ингибитора С1-эстеразы человека) и атопии (с детства у пациентки и ее сына отмечался аллергический риноконъюнктивит; увеличивалась концентрация в крови пациентки специфических IgE к пыльце растений и клещам домашней пыли; отмечена связь симптомов риноконъюнктивита с реакцией на домашнюю пыль и пыльцу растений). Кроме того, особенностью данного случая явились разнообразие локализаций ангиоотеков (голова, шея, глотка, мочеполовая система, конечности) и большое число курсов антибиотиков (15 за 2018 г.). Необходимо отметить, что пациентка осматривалась терапевтом, гинекологом, стоматологом, дерматологом, хирургом, неврологом, гематологом, сосудистым хирургом, но никто из специалистов не заподозрил НАО. В диагностике НАО большое значение имеют тщательный сбор анамнеза и анализ объективных данных, выявление семейной предрасположенности и оценка ответа на терапию системными ГКС и АГП.
В связи с указанными трудностями следует подчеркнуть актуальность просвещения врачей разных специальностей, особенно стоматологов, оториноларингологов, хирургов, гастроэнтерологов, гинекологов, анестезиологов-реаниматологов, терапевтов, педиатров относительно комплемент-зависимых ангиоотеков, НАО, что поможет существенно улучшить выявляемость таких состояний. От ранней диагностики НАО зависят своевременное назначение эффективных для комплемент-зависимых ангиоотеков лекарственных средств и отмена ненужных препаратов.
В настоящее время проведение своевременной и адекватной терапии НАО способно значительно улучшить качество жизни больных. Наличие таких препаратов, как икатибант (Фиразир), в бесплатном для пациентов доступе (при своевременной постановке таких больных на учет по программе орфанных заболеваний) позволяет избежать летальных исходов [9, 10].
Благодарность
Компания ООО «Такеда Фармасьютикалз» поддерживала техническую редакцию статьи и обеспечивала взаимодействие между авторами настоящей публикации.
Acknowledgement
Technical edition and cooperation between the authors is supported by LLC “Takeda Pharmaceuticals”.
Сведения об авторах:
1Андронова Елена Владимировна — врач аллерголог-иммунолог, ORCID iD 0000-0002-9506-6365;
2Бельтюков Евгений Кронидович — д.м.н., профессор кафедры факультетской терапии, эндокринологии, аллергологии и иммунологии, ORCID iD 0000-0003-2485-2243;
2,3Лепешкова Татьяна Сергеевна — к.м.н., ассистент кафедры поликлинической педиатрии и педиатрии ФПК и ПП, врач
аллерголог-иммунолог, ORCID iD 0000-0002-0716-3529.
1ООО «Семейный доктор». 455034, Россия, г. Магнитогорск, ул. Жукова, д. 11.
2ФГБОУ ВО УГМУ Минздрава России. 620028, Россия,
г. Екатеринбург, ул. Репина, д. 3.
3МАУ «ДГП № 13». 620100, Россия, г. Екатеринбург,
ул. Ткачей, д. 16а.
Контактная информация: Андронова Елена Владимировна, e-mail: andronova.elena_@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.02.2020.
About the authors:
1Elena V. Andronova — MD, allergist and immunologist,
ORCID iD 0000-0002-9506-6365;
2Evgeniy K. Bel’tyukov — MD, PhD, Professor of the Department of Faculty Therapy, Endocrinology, Allergy, and Immunology, ORCID iD 0000-0003-2485-2243;
2,3Tat’yana S. Lepeshkova — MD, PhD, Assistant of the Department of Polyclinic Pediatrics and Pediatrics, allergist and immunologist, ORCID iD 0000-0002-0716-3529.
1LLC “Family doctor”. 11, Zhukova str., Magnitogorsk, 455034, Russian Federation.
2Ural State Medical University. 3, Repin str., Yekaterinburg, 620028, Russian Federation.
3Children’s City Polyclinic No. 13. 16a, Tkachey str., Yekaterinburg, 620100, Russian Federation.
Contact information: Elena V. Andronova, e-mail:
andronova.elena_@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.02.2020.
2. Zuraw B.L. Current and future therapy for hereditary angioedema. Clin Immunol. 2005;114:10–16. DOI: 10.1016/j.clim.2004.08.001.
3. Kerrigan M.J., Naik P. C1 Esterase Inhibitor Deficiency. Stat Pearls Publishing, 2019.
4. Аллергология: фармакотерапия без ошибок. Руководство для врачей. Под ред. акад. РАН и РАМН Р.М. Хаитова. М.: E-noto; 2013.
5. Longhurst H., Zinser E. Prophylactic Therapy for Hereditary Angioedema. Immunol Allergy Clin North Am. 2017;37(3):557–570. DOI: 10.1016/j.iac.2017.04.003.
6. Agostoni A., Bergamaschini L., Martignoni G.C. et al. Treatment of acute attacks of hereditary angioedema with C1-inhibitor concentrate. Ann Allergy. 1980;44(5):299–301. PMID: 6155097.
7. Longhurst H., Zinser E. Prophylactic Therapy for Hereditary Angioedema. Immunol Allergy Clin North Am. 2017;37(3):557–570. DOI: 10.1016/j.iac.2017.04.003.
8. Дробик С., Фомина Д.С., Горячкина Л.А. Наследственный ангиоотек — вопросы клиники и диагностики. Consilium Medicum. 2012;3:40–42.
9. Инструкция по медицинскому применению лекарственного препарата Фиразир ЛСР-008206/09 от 16.10.2009. (Электронный ресурс). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=c5d3ef50–9bd8–45f6–8241–8a626920837bandt=. Дата обращения: 15.02.2020.
10. Malbran A., Riedl M., Ritchie B. et al. Repeat treatment of acute hereditary angioedema attacks with open‐label icatibant in the FAST‐1 trial. Clin Exp Immunol. 2014;177(2):544–553. DOI: 10.1111/cei.12358.
References
1. Federal clinical guidelines for the diagnosis and treatment of urticaria, 2015. Ed. acad. RAS R.M. Khaitov, prof. N.I. Ilyina. M.: Pharmarus Pint Media; 2015 (in Russ.).
2. Zuraw B.L. Current and future therapy for hereditary angioedema. Clin Immunol. 2005;114:10–16. DOI: 10.1016/j.clim.2004.08.001.
3. Kerrigan M.J., Naik P. C1 Esterase Inhibitor Deficiency. StatPearls Publishing, 2019.
4. Allergology: pharmacotherapy without errors. A guide for doctors. Ed. acad. RAS and RAMS R.M. Khaitov. M.: E-noto; 2013 (in Russ.).
5. Longhurst H., Zinser E. Prophylactic Therapy for Hereditary Angioedema. Immunol Allergy Clin North Am. 2017;37(3):557–570. DOI: 10.1016/j.iac.2017.04.003.
6. Agostoni A., Bergamaschini L., Martignoni G.C. et al. Treatment of acute attacks of hereditary angioedema with C1-inhibitor concentrate. Ann Allergy. 1980;44(5):299–301. PMID: 6155097.
7. Longhurst H., Zinser E. Prophylactic Therapy for Hereditary Angioedema. Immunol Allergy Clin North Am. 2017;37(3):557–570. DOI: 10.1016/j.iac.2017.04.003.
8. Drobik S., Fomina D.S., Goryachkina L.A. Hereditary angioedema — clinical and diagnostic issues. Consilium Medicum. 2012;3:40–42 (in Russ.).
9. Instructions for the medical use of the drug Firazir LSR-008206/09 of 16.10.2009. (Electronic resource). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=c5d3ef50–9bd8–45f6–8241–8a626920837bandt=. Access date: 15.02.2020 (in Russ.).
10. Malbran A., Riedl M., Ritchie B. et al. Repeat treatment of acute hereditary angioedema attacks with open‐label icatibant in the FAST‐1 trial. Clin Exp Immunol. 2014;177(2):544–553. DOI: 10.1111/cei.12358.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.