Роль герпесвирусов при мужском бесплодии
DOI: 10.32364/2587-6821-2021-5-3-123-129
Поиск этиопатогенетических факторов бесплодия является актуальной медико-социальной задачей. Наблюдали 23 мужчин с абактериальным хроническим простатитом, состоящих в бесплодном браке. Герпесвирусы 4–6 типов были выявлены в урогенитальных образцах (мазки из уретры, эякулят, секрет предстательной железы) у 8 из 23 мужчин, которым проводили лечение валацикловиром 500 мг 2 р/сут 3 мес. и препаратом интерферона α-2b в комплексе с антиоксидантами (витаминами Е и С) в форме ректальных суппозиториев. Исходя из личного опыта авторов, пациентам была назначена следующая схема использования препарата: 3 млн МЕ 2 раза в день — 10 дней, затем 3 раза в неделю (также 2 раза в день) в течение последующих 3 нед. Остальным 15 пациентам, у которых вирусы не были обнаружены, проводили лечение: левофлоксацин 500 мг — 30 дней, тамсулозин 0,4 мг — 90 дней, диклофенак свечи 50 мг — 10 дней. К концу терапии электронно-микроскопическое и вирусологическое исследования показали снижение концентрации и числа вирус-положительных урогенитальных проб, а также снижение числа сперматозоидов с вирусными капсидами. В течение 6 мес. от начала терапии наблюдали наступление беременности у супруг 6 из 8 мужчин с герпесвирусами и у 4 из 11 мужчин без вирусов (р=0,026). Таким образом, получены данные о роли герпесвирусов 4–6 типов при мужском бесплодии. Достигнут хороший репродуктивный эффект терапии валацикловиром и препаратом интерферона α-2b в комплексе с антиоксидантами у большинства пациентов.
Ключевые слова: герпесвирусы, вирус Эпштейна — Барр, цитомегаловирус, вирус герпеса человека 6 типа, мужское бесплодие.
Для цитирования: Ковалык В.П., Гомберг М.А., Брагина Е.Е., Юрлов К.И., Кущ А.А. Роль герпесвирусов при мужском бесплодии. РМЖ. Медицинское обозрение. 2021;5(3):123-129. DOI: 10.32364/2587-6821-2021-5-3-123-129.
V.P. Kovalyk1, M.A. Gomberg2, E.E. Bragina3, K.I. Yurlov4, A.A. Kushch4
1Federal Research and Clinical Center of the Federal Medical Biological Agency,
Moscow, Russian Federation
2Moscow Scientific and Practical Center of Dermatovenereology and Cosmetology,
Moscow, Russian Federation
3A.N. Belozersky Research Instituteof Physico-Chemical Biology MSU, Moscow,
Russian Federation
4National Research Center for Epidemiology and Microbiology named after Honorary
Academician N.F. Gamaleya, Moscow, Russian Federation
Nowadays, the search for etiopathogenetic factors of infertility is an urgent medical and social task. 23 men with chronic abacterial prostatitis in a barren marriage underwent the follow-up. Herpesviruses of types IV–VI were detected in urogenital samples (urethra, ejaculate, prostate secretions) in 8 of 23 men who were treated with valacyclovir (500 mg 2 times a day for 3 months) and interferon α-2b in combination with antioxidants — vitamins E and C (rectal suppositories). Based on the personal experience of the authors, the patients were prescribed the following drug use regimen: 3 million IU twice a day — 10 days, then 3 million IU twice a day — 3 times per week for the next 3 weeks. The remaining 15 patients without any detected viruses were prescribed the following: levofloxacin 500 mg — 30 days, tamsulosin 0.4 mg — 90 days, diclofenac 50 mg — 10 days. By the end of therapy, electron microscopy and virology showed a decrease in the concentration and number of virus-positive urogenital samples, as well as a decrease in the number of spermatozoa with viral capsids. Within 6 months from the therapy initiation, the onset of pregnancy was observed in the married couples of 6 out of 8 men with herpesviruses vs. in 4 out of 11 without viruses (p=0.026). Thus, we obtained the data on the role of herpesviruses of types IV–VI in male infertility. A good reproductive effect was achieved with valacyclovir and interferon α-2b in combination with antioxidants in most patients.
Keywords: herpesviruses, Epstein-Barr virus, cytomegalovirus, human herpes virus type VI, male infertility.
For citation: Kovalyk V.P., Gomberg M.A., Bragina E.E. et al. Herpesvirus role in male infertility. Russian Medical Inquiry. 2021;5(3):123–129. DOI: 10.32364/2587-6821-2021-5-3-123-129.
Введение
Бесплодие является актуальной медицинской и социальной проблемой. В России каждая пятая семейная пара бесплодна [1]. При этом мужской фактор отвечает за половину из этих случаев. Это связано с прогрессивным снижением репродуктивной функции. Существуют многочисленные данные о негативном влиянии вирусов на состояние репродуктивной системы мужчин. В человеческой популяции широко распространены вирусы герпеса человека (ВГЧ) [2].
Герпесвирусы вызывают пожизненное инфицирование и являются причиной множества заболеваний, половина из которых имеет рецидивирующее течение. ВГЧ инфицированы от 95% до 100% населения, а в разные периоды жизни человек инфицируется хотя бы одним, а чаще — несколькими типами вирусов, относящимися к семейству герпесвирусов. Во второй половине жизни практически все люди имеют антитела к большинству ВГЧ [3]. 8 типов герпесвирусов патогенны для человека.
Типы вирусов герпеса человека
Вирус простого герпеса (ВПГ) впервые выделил W. Goiter в 1912 г., ВПГ представлен в двух типах: 1 и 2. Вирусоносительство ВПГ-1, -2 встречается более чем у 90% населения. Это ДНК-содержащие вирусы, поражающие кожу, слизистые оболочки, эндотелий сосудов, клетки крови, центральную и периферическую нервную систему.
ВГЧ 3 типа — Varicella-zoster virus, вирус варицелла зостер (ВВЗ) — открыт в 1911 г. Н. Aragao и представляет собой ДНК-содержащий вирус. Является возбудителем ветряной оспы и опоясывающего лишая, может поражать кожу, слизистые оболочки, эндотелий сосудов, клетки крови, печень, центральную и периферическую нервную систему.
ВГЧ 4 типа — вирус Эпштейна — Барр (ВЭБ) был выделен в 1964 г. Эпштейном и Барр. ВЭБ обладает тропизмом в основном к В-лимфоцитам, эпителию верхних дыхательных путей и эпителию ЖКТ. Может выступать этиологическим агентом при инфекционном мононуклеозе и лимфоме Беркитта.
ВГЧ 5 типа — цитомегаловирус (ЦМВ) был выделен в 1956 г. М.G. Smith, содержит двухспиральную ДНК, окруженную гликопротеиновой оболочкой. Может поражать практически любые клетки организма человека, вызывая широкий спектр заболеваний.
ВГЧ 6 типа (розеоловирус) был идентифицирован в 1986 г., ассоциирован с внезапной экзантемой и фебрильными судорогами у детей.
ВГЧ 7 типа (розеоловирус) был выделен в 1990 г. из CD4+ Т-лимфоцитов периферической крови. Вирус связывают с различными заболеваниями ЦНС и кожи аутоиммунной природы.
ВГЧ 8 типа ассоциирован с саркомой Капоши и был открыт в 1994 г., является новым трансформирующим вирусом человека, который способствует злокачественному перерождению клеток.
ВГЧ являются распространенными вирусами, передаваемыми половым путем [4], с возможным влиянием на мужской фактор бесплодия. Патогенный потенциал может быть реализован либо непосредственно вирусным токсическим воздействием на клетки половых путей, либо косвенно — местными или системными инфекционными или иммунологическими реакциями. Семейство герпесвирусов (ВПГ-1, -2, ВВЗ, ВЭБ, ЦМВ и ВГЧ-6) обычно обнаруживается в сперме, но влияние этих вирусных агентов на мужскую фертильность широко не изучалось.
Вирусы простого герпеса 1 и 2 типа и вирус варицелла зостер
ВПГ поражают кожу и слизистые, являясь основной причиной генитальных язв. ВПГ 1 и 2 типов часто выявляют в спермоплазме, на поверхности и внутри сперматозоидов [5].
Зафиксирована передача ВПГ-1, -2 при инсеминации спермой донора. Несмотря на то, что частота выявления ВПГ-1 и -2 в сперме относительно низкая (менее 5%) [6], ВПГ является патогеном, который имеет наиболее сильное влияние на параметры спермы: значительно снижается концентрация сперматозоидов, их общее количество, подвижность, концентрация цитрата и нейтральной α-глюкозидазы. Данные патогенные свойства также выявляли в более поздних исследованиях. Известно, что противовирусное лечение бесплодных мужчин с ВПГ в эякуляте приводило к успешным беременностям [7].
В 2000 г. Е.Е. Брагиной и соавт. впервые были представлены доказательства инфицированности сперматозоидов ВПГ-1, -2. Данные вирусы в мазках из уретры были обнаружены только у лиц с манифестным генитальным герпесом, в эякуляте выявлены у 33–54% обследованных. Электронная микроскопия эякулята позволила обнаружить сперматозоиды, содержащие нуклеокапсиды ВПГ-1, -2 различной степени зрелости. ВПГ может инфицировать сперматозоиды, нарушать сперматогенез путем резкого уменьшения концентрации сперматозоидов и их подвижности, увеличения количества патологических форм, в т. ч. патологии головки. Среди супружеских пар, имеющих генитальный герпес, наблюдается бльшая частота невынашивания беременности по сравнению со здоровыми супругами [8].
Также было проведено исследование по изучению антител в крови к ЦМВ, ВЭБ и ВПГ-1, -2 у мужчин с лейкоспермией и без лейкоспермии. Оказалось, что анти-ВПГ-1, -2 IgM были ассоциированы с лейкоспермией, хотя с помощью полимеразной цепной реакции (ПЦР) обнаружить ВПГ-1, -2 в эякуляте не удалось [9].
В проспективное рандомизированное исследование Е. Neоfytou et al. (2009) были включены 172 мужчины, из которых у 143 (83,1%) в эякуляте выявлены ВГЧ. В группе мужчин с нормальными параметрами спермы против группы с патоспермией содержание вирусов составило: ВПГ-1, -2 – 2,5% / 2,1%, ВВЗ — 1,2% / 3,2%, ВЭБ — 45% / 39,1%, ЦМВ — 62,5% / 56,5%, ВГЧ-6 – 70% / 66,3%, ВГЧ-7–0% / 0% соответственно. Таким образом, не было выявлено ассоциации между вирусными агентами и патоспермией, однако ВВЗ при этом выявляли почти втрое чаще [10].
Снижение концентрации нейтральной α-глюкозидазы и цитрата свидетельствует, что бесплодие возникает вследствие нарушения функции придатка яичка и простаты под воздействием ВПГ.
Цитомегаловирус
В ряде исследований оценивалась распространенность ЦМВ. Так, во многих странах в образцах спермы человека этот показатель составил от 0% до 62,5% [11].
ЦМВ входит в семейство ВГЧ, может быть причиной разнообразных тератогенных повреждений у новорожденных и клинических случаев болезни у взрослых по типу инфекционного мононуклеоза. Его наличие и персистенцию в сперме описывали в различных исследованиях [9, 12–14]. ЦМВ вызывает асимптомную инфекцию у здоровых лиц, в т. ч. инфекцию урогенитального тракта. Подобно всем вирусам герпеса, ЦМВ имеет свойство реактивироваться и вызывать хроническое воспаление [15, 16].
Содержание ЦМВ в эякуляте здоровых доноров обычно колеблется в пределах 3–5%, в эякуляте пациентов с бесплодием — от 1,4% до 56,5% [11].
В проведенном М. Habibi et al. скрининге эякулятов пациентов с инфекционным воспалением предстательной железы методом ПЦР установлено, что ЦМВ чаще встречается у инфертильных мужчин с хроническими воспалительными заболеваниями мочеполовой системы, причем ДНК ЦМВ ассоциирована с клеточной фракцией эякулята. Распространенность вирусной ДНК составила 3,4% для ВЭБ, 5,2% — для ЦМВ, 6,5% — для ВГЧ-6, 0,43% — для ВЭБ + ЦМВ, 0,87% — для ВЭБ + ВГЧ-6, 1,3% — для ЦМВ + ВГЧ-6. Выявление ЦМВ было значительно чаще в группе пациентов с бесплодием и ассоциировалось со снижением количества сперматозоидов. Полученные результаты свидетельствуют о том, что как ЦМВ, так и ВГЧ-6 могут способствовать развитию инфекционного воспаления предстательной железы и мужскому бесплодию [9].
Концентрация ЦМВ в сперме может варьировать от 110 до 12 млн. При этом возможна тенденция к снижению подвижности сперматозоидов и концентрации нейтральной α-глюкозидазы — маркера повреждения придатка яичка. Таким образом, ЦМВ может иметь влияние на качество спермы вследствие поражения придатка яичка [17, 18].
Более убедительные результаты получены в работе М. Mohseni et al. В этом исследовании определяли частоту обнаружения ЦМВ с помощью real-time ПЦР у 100 бесплодных мужчин, которые обратились в клинику экстракорпорального оплодотворения с низкими показателями подвижности (менее 40%) или концентрации сперматозоидов (менее 15 млн/мл), анамнезом бесплодия более 5 лет, при этом их жены были здоровы и без видимых причин бесплодия. В контрольную группу вошли 100 здоровых доноров спермы. Частота выявления ЦМВ в исследуемой группе оказалась 23%, в группе контроля — 7%, разница достоверно значима (р<0,01). Таким образом, была продемонстрирована значимая роль ЦМВ в бесплодии у мужчин. Авторы предлагают включить определение ЦМВ в диагностический поиск при бесплодии, а доноров спермы с выявленным ЦМВ исключать из списка доноров [19].
Изучение путей проникновения вирусов в мужские гаметы до сих пор вызывает интерес исследователей, а зара-зить зрелые сперматозоиды ЦМВ и ВПГ до недавнего времени не удавалось. Однако Е.А. Малолиной и соавт. (2016) разработана модель заражения сперматозоидов in vitro и впервые доказана принципиальная возможность инфицирования зрелых гамет ЦМВ [16].
Исследование Muhsin et al. (2019) было проведено на 90 мужчинах, среди которых фертильных мужчин с нормальным качеством спермы было 35 (38,9%), бесплодных мужчин — 55 (61,1%). Выявленные антитела IgG в спермоплазме к ВЭБ (38%), ЦМВ (43%) и ВГЧ-6 (53%) были достоверно ассоциированы с идиопатическим бесплодием. Выявление иммунологических маркеров вирусной инфекции сопровождалось подъемом уровней провоспалительных цитокинов: интерлейкина 10, γ-интерферона, что сказывалось на состоянии антиоксидантной защиты: наблюдали повышение содержания 8-ОН-дезоксигуанозина спермоплазмы и значительное снижение общей антиоксидантной емкости спермы. Результаты исследования продемонстрировали, что у 45 (50,0%) бесплодных мужчин было обнаружено сниженное количество сперматозоидов, у 52 (57,8%) — снижение количества подвижных сперматозоидов, у 33 (24,4%) — аномалии морфологии сперматозоидов. Данные подтверждают негативную корреляцию между уровнем воспалительных биомаркеров и стандартными показателями спермограммы: концентрацией, подвижностью сперматозоидов, долей клеток с нормальной морфологией. Авторы исследования предположили, что хроническая вирусная инфекция протекает на фоне повышенной концентрации цитокинов, нарушает окислительный статус спермы, систему антиоксидантной защиты, что приводит к повреждению ДНК сперматозоидов [20].
Взаимосвязь между заражением герпесвирусом и мужским бесплодием была доказана с помощью ПЦР и секвенирования ДНК у бесплодных мужчин 21–49 лет в Китае (n=151). Герпесвирусы были идентифицированы у 59 пациентов (39%). Количество носителей составило 39 (25%) для ВПГ-1, 6 (4%) — для ВЭБ, 33 (22%) — для ЦМВ и 3 (2%) — для ВГЧ-6. Двойная инфекция была обнаружена у 22 человек (59 образцов, 37%), большинство из которых (n=15) были инфицированы ВПГ-1 и ЦМВ [21].
Вирус Эпшейна — Барр
ВЭБ вызывает инфекционный мононуклеоз и лимфому Беркитта. ВЭБ был обнаружен в сперме, имеются веские данные, что он передается половым путем. Частота его обнаружения в эякуляте на 1–2 порядка выше, чем ВПГ-1, -2 [11]. В исследовании Е. Moretti et al. (2017) обнаружение анти-BЭБ антител в крови у 47% лиц было ассоциировано со снижением концентрации и подвижности сперматозоидов, а также с увеличением частоты некрозооспермии, что приводило к уменьшению индекса фертильности [14]. Известно, что ВЭБ персистирует в В-лимфоцитах, которые находятся лишь в небольшом количестве среди всех лейкоцитов в сперме. Медианная концентрация ВЭБ в сперме составляла 500 копий/мл [17]. Однако имеются также прямо противоположные данные о том, что при наличии ВЭБ в эякуляте наблюдали парадоксальное двукратное увеличение показателя подвижности типа А в исследовании V. Naumenko et al. (2016) [17]. По-видимому, феномен увеличения подвижности сперматозоидов дает эволюционные преимущества некоторым вирусным агентам, которые используют его для большего распространения в популяции.
ВЭБ является этиологическим агентом В-клеточной лимфомы, а первично-тестикулярный вариант этого заболевания ведет к бесплодию [22]. Исследования показали, что наличие в сперме ВЭБ ассоциировано с повышением вероятности тестикулярного рака в 4,8 раза [23]. Систематический обзор и метаанализ А. Garolla et al. подтвердили достоверную связь ВЭБ-инфекции спермы и опухолей герминативных клеток яичка, в то время как ЦМВ не обладали онкогенным потенциалом [24].
Герпесвирусы человека 6 типа
Важным свойством ВГЧ-6 является хромосомная интеграция его генетического материала, что может наблюдаться у 0,8–1,5% носителей. Заподозрить хромосомную интеграцию возможно при концентрации ВГЧ-6 в крови более 105 копий/мл. Прямой метод диагностики хромосомной интеграции — флуоресцентная гибридизация in situ — малодоступен и трудоемок. Косвенное подтверждение такого состояния возможно с помощью детекции ВГЧ-6 в луковицах волос и ногтях, т. е. в пробах, в которых ВГЧ-6 обычно не обнаруживается [25]. Генетическая интеграция вируса происходит в концевых участках хромосом — теломерах, что крайне настораживает в отношении влияния на клеточное деление и апоптоз. Интегрированный вирус передается потомкам по законам Менделя, т. е. половина детей наследует хромосомную интеграцию ВГЧ-6 [26].
Влияние ВГЧ-6 на репродуктивную функцию изучали в нескольких исследованиях. Так, в работе V. Evdokimov et al. (2016) ВГЧ-6 был достоверно более часто ассоциирован с инфекциями вспомогательных половых желез у мужчин (19% против 6,3% в контрольной группе) [27]. В данном исследовании медианная концентрация ВГЧ-6 составляла всего 250 копий/мл, таким образом, при хромосомной интеграции ВГЧ-6, когда вирусная нагрузка измеряется миллионами копий на миллилитр, можно ожидать значительных нарушений параметров спермы [28].
Как мы видим, в литературе нет однозначного мнения о влиянии ВГЧ на сперматозоиды, и некоторые исследователи не могут установить связь между наличием вирусов в эякуляте и ухудшением показателей спермограммы, другие отмечают снижение концентрации и подвижности сперматозоидов в эякулятах, положительных на ВГЧ [11, 29].
Возможно, имеют место разные варианты инфицирования сперматозоидов вирусом. В первом варианте развития событий уже зрелые гаметы инфицируются ВГЧ при их прохождении по половым путям. Во втором возможно инфицирование на стадии созревания сперматозоидов, при котором повреждающее воздействие вирусов будет более значимым [11].
Таким образом, имеются важные свидетельства влияния различных ВГЧ на качество спермы и достоверные ассоциации этих вирусов как этиологического фактора в развитии инфекций добавочных половых желез, приводящих к бесплодию у мужчин. Тем не менее требуются дальнейшие исследования в этом направлении для определения точных механизмов патогенеза вирусных инфекций в качестве этиологических агентов инфекций вспомогательных половых желез и бесплодия у мужчин.
Собственные результаты
Нами было проведено исследование, в которое были включены 287 мужчин с хроническим простатитом / синдромом хронической тазовой боли IIIA, у 23 из которых имелось бесплодие. Диагнозы верифицировали согласно критериям Европейской урологической ассоциации [30].
Помимо стандартных диагностических процедур проводили детекцию ВГЧ 4–6 типов в пробах из уретры, секрета предстательной железы и эякулята.
При выявлении ВГЧ пациентам с бесплодием (группа 1) назначали валацикловир 1000 мг/сут в течение 3 мес. и препарат ВИФЕРОН® (интерферон α-2b в комплексе с антиоксидантами (витаминами Е и С)) в форме ректальных суппозиториев. Исходя из личного опыта авторов, пациентам была назначена следующая схема использования препарата: 3 млн МЕ 2 раза в день — 10 дней, затем 3 раза в неделю (также 2 раза в день) в течение последующих 3 нед. Контроль вирусной нагрузки проводили к концу 3-месячного лечения. Остальным пациентам, у которых не было обнаружено ВГЧ 4–6 типов (группа II), назначали левофлоксацин 500 мг на 30 дней, тамсулозин 0,4 мг — на 3 мес., суппозитории диклофенак 50 мг — на 10 дней.
Помимо ациклического нуклеозида, обладающего прямым антигерпетическим действием и назначаемого при терапии абактериального простатита, ассоциированного с герпесвирусами, был выбран ВИФЕРОН® как препарат, способный обеспечить долгосрочный антивирусный эффект. Препарат содержит интерферон α-2b, это человеческий рекомбинантный аналог вещества, вырабатываемого в любых клетках организма. Он обладает противовирусными, иммуномодулирующими, антипролиферативными свойствами, подавляет репликацию РНК- и ДНК-содержащих вирусов. Интерферон α-2b в клетках запускает последовательность реакций, приводящих к супрессии синтеза вирусных белков, сборки и выхода вирионов в межклеточный матрикс. Помимо влияния на протеиновый синтез, интерфероны обладают эпигенетической активностью, активируя сотни генов, играющих важную роль в антивирусной защите клетки [31]. Кроме того, интерферон α-2b лимитирует распространение вирусных частиц путем активации так называемого «стража генома» — белка p53, что ведет к апоптотической смерти инфицированной клетки [32]. Аскорбиновая кислота и α-токоферола ацетат, входящие в состав препарата, являются высокоактивными антиоксидантами, обладают противовоспалительным, мембраностабилизирующим, а также регенерирующим свойствами.
У 11 пациентов с выявленными герпесвирусами проводили электронно-микроскопическое исследование сперматозоидов (JEM 1400, JEOL, Япония).
Нами было отмечено, что из 103 пациентов с обнаруженными ВГЧ 4–6 типов у 8 имелось бесплодие (группа I), в то время как среди 184 пациентов без герпесвирусов инфертильность была верифицирована у 15 (группа II).
Из 24 урогенитальных проб от 8 пациентов группы I было получено 12 вирус-положительных проб: 7 — эякулят, 1 — мазки из уретры, 4 — секрет предстательной железы. ЦМВ и ВЭБ обнаружены в 4 и 3 образцах соответственно, включая образцы с сочетаниями 2 ВГЧ. Значительно чаще встречался ВГЧ-6 — суммарно в 7 образцах из всех 12. Медианная вирусная нагрузка герпесвирусов 4–6 типов составила 1770 копий на 100 000 клеток.
В результате противовирусного лечения к концу 3-го месяца контрольные исследования обнаружили вирус только у 5 из 8 пациентов группы I, у которых выявляли герпесвирусы в 5 биопробах. При этом медианная вирусная нагрузка в них снизилась до 48 копий на 100 000 клеток.
В результате терапии в течение 6 мес. после окончания лечения наблюдали наступление беременности у супруг 10 из 23 мужчин, которые распределились по группам следующим образом: 6 из 8 из группы I и 4 из 10 из группы II. Статистический анализ показал, что различия в частоте наступления беременности достигают достоверной значимости между группами I и II (значение критерия χ2 составляет 4,960, критическое значение χ2 при уровне значимости p=0,05 составляет 3,841, уровень значимости р=0,026).
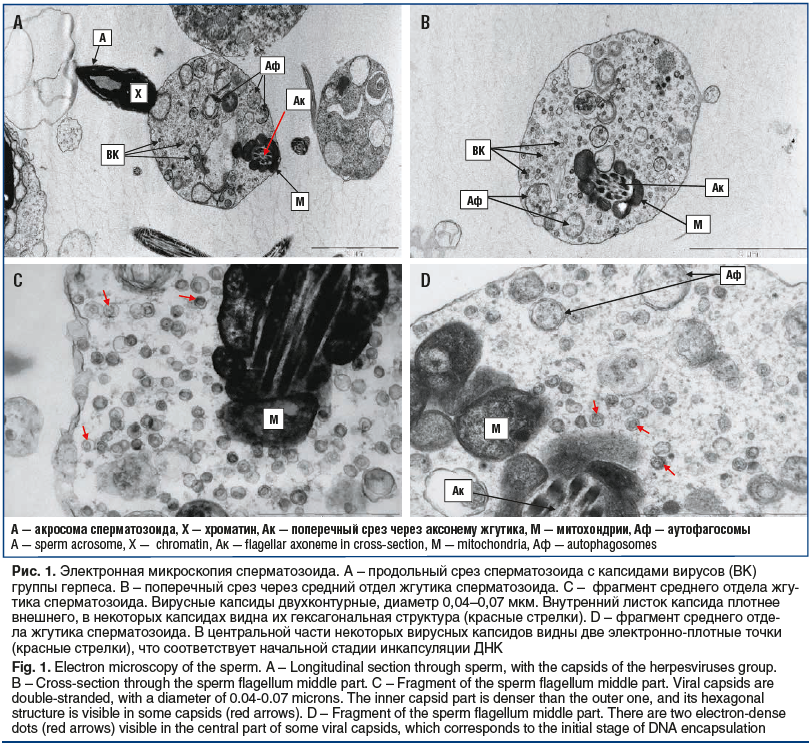
Влияние курса противовирусной терапии оценивали также методом электронной микроскопии. Изучение сперматозоидов 11 пациентов с бесплодием показало, что если до лечения капсиды ВГЧ 4–6 типов обнаруживали у 8 пациентов, то после лечения у 4 из этих пациентов вирусные капсиды в сперматозоидах более не выявляли, а у 3 других пациентов количество сперматозоидов с капсидами в среднем уменьшилось более чем в 2 раза: с 12% до 5% инфицированных гамет в эякуляте (рис. 1).
Обсуждение
Лечение бесплодия не являлось главной целью для 23 мужчин этого исследования. Они обратились по поводу хронического простатита / синдрома хронической тазовой боли и получили хороший терапевтический ответ в виде снижения баллов по шкале NIH-CPSI, что было нами ранее описано [33]. Тем не менее на примере этих 23 пациентов удалось проследить улучшение их репродуктивного потенциала в результате терапии. Достоверно чаще беременность наступала у женщин, чьи мужчины были инфицированы ВГЧ 4–6 типов и получили противовирусную терапию.
Впервые концентрация вируса нами была представлена в количестве копий на единицу клеток, что позволяет сравнить вирусные концентрации у пациентов с различным содержанием сперматозоидов. При этом показано, что применение противовирусных препаратов привело к прекращению активности вирусов у всех пациентов: ВЭБ, ЦМВ и ВГЧ-6 либо не обнаруживали, либо их титры были незначительными (<1000 копий на 100 000 клеток). Эти данные также косвенно указывают на значимую роль ВЭБ, ЦМВ и ВГЧ-6 в этиопатогенезе мужского бесплодия.
В ранее проведенных исследованиях было показано, что ЦМВ и ВГЧ-6 в эякуляте в основном локализованы в клеточной фракции сперматозоидов. Это позволило предположить, что эти вирусы либо прикрепляются к поверхности половых клеток, либо находятся внутриклеточно. Причем последний вариант наиболее неблагоприятный, поскольку может клинически проявляться не только мужским бесплодием, но и передачей потомкам хромосомно-интегрированного вируса. Последствия рождения ребенка с хромосомной интеграцией ВЭБ и ВГЧ-6 до конца неизвестны, имеются данные о развитии демиелинизирующих заболеваний ЦНС, миокардита, лимфом, лейкоза [33].
Выводы
Герпесвирусы являются важными этиопатогенетическими факторами, приводящими к мужскому бесплодию.
Противовирусная терапия приводит к снижению активности вируса, элиминации его из сперматозоидов или снижению содержания вирусных фагосом в цитоплазме половых клеток.
Результатом противовирусной терапии, включавшей валацикловир и интерферон α-2b, явилось наступление беременности у супруг большинства пролеченных пациентов.
Благодарность
Редакция благодарит компанию ООО «Ферон» за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgements
Editorial Board are grateful to LLC “Feron” for technical edition.
Сведения об авторах:
Ковалык Владимир Павлович — к.м.н., доцент, профессор кафедры дерматовенерологии и косметологии ФГБУ ФНКЦ ФМБА России; 125371, Россия, г. Москва, Волоколамское шоссе, д. 91; ORCID iD 0000-0002-0453-2771.
Гомберг Михаил Александрович — д.м.н., профессор, главный научный сотрудник ГБУЗ «Московский центр дерматовенерологии и косметологии»; 127473, Россия, г. Москва, ул. Селезневская, д. 20; ORCID iD 0000-0002-1070-5229.
Брагина Елизавета Ефимовна — д.м.н., профессор, НИИ ФХБ им. А.Н. Белозерского МГУ; 119992, Россия, г. Москва, Ленинские горы, д. 1, стр. 40; ORCID iD 0000-0002-8422-4962.
Юрлов Кирилл Иванович — научный сотрудник отдела молекулярной вирусологии ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России; 123098, Россия, г. Москва, ул. Гамалеи, д. 18; ORCID iD 0000-0002-4694-2445.
Кущ Алла Александровна — д.б.н., профессор, заведующая отделом молекулярной вирусологии ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России; 123098, Россия, г. Москва, ул. Гамалеи, д. 18; ORCID iD 0000-0002-3396-5533.
Контактная информация: Ковалык Владимир Павлович, e-mail: kovalyk@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 14.03.2021, поступила после рецензирования 02.04.2021, принята в печать 19.04.2021.
About the authors:
Vladimir P. Kovalyk — Cand. of Sci. (Med.), Associate Professor, Professor of the Department of Dermatovenerology and Cosmetology, Federal Research and Clinical Center of the Federal Medical Biological Agency; 91, Volokolamsk highway, Moscow, 125371, Russian Federaton; ORCID iD 0000-0002-0453-2771.
Mikhail A. Gomberg — Dr. of Sci. (Med.), Professor, Chief Researcher of the Moscow Scientific and Practical Center of Dermatovenereology and Cosmetology; 20, Seleznevskaya str., Moscow, 127473, Russian Federaton; ORCID iD 0000-0002-1070-5229.
Elizaveta E. Bragina — Dr. of Sci. (Med.), Professor, A.N. Belozersky Research Instituteof Physico-Chemical Biology MSU; 1, bld. 40, Leninskie gory, Moscow, 119992, Russian Federaton; ORCID iD 0000-0002-8422-4962.
Kirill I. Yurlov — Researcher of the Department of Molecular Virology, National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; 18, Gamalei str., Moscow, 123098, Russian Federaton; ORCID iD 0000-0002-4694-2445.
Alla A. Kushch — Dr. of Sci. (Biology), Professor, Head of the Department of Molecular Virology, National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; 18, Gamalei str., Moscow, 123098, Russian Federaton; ORCID iD 0000-0002-3396-5533.
Contact information: Vladimir P. Kovalyk, e-mail: kovalyk@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 14.03.2021, revised 02.04.2021, accepted 19.04.2021.
2. Владимирова Е.В., Ковалык В.П., Мураков С.В. и др. Анализ распространенности инфекций, передаваемых половым путем, в России, по данным федеральной лабораторной сети. Клиническая практика. 2019;10(3):35–41. DOI: 10.17816/clinpract10335-41.
3. Филатова Т.Г. Герпесвирусная инфекция: учеб. пособие для студентов 5–6-го курсов. Петрозаводск: Изд-во ПетрГУ, 2014.
4. Murakov S., Vladimirova E., Markova Yu. et al. Epidemiology of STIs in Russia in 2019 According to the Federal Laboratory Network. Presented at the 29th European Academy of Dermatology and Venereology (EADV) congress, 29–31 October 2020, Virtual. DOI: 10.13140/RG.2.2.17109.24804/1.
5. Spornraft-Ragaller P., Varwig-Janßen D. Sexually transmitted infections and male fertility. Hautarzt. 2018;69(12):1006–1013 (in German). DOI: 10.1007/s00105-018-4300-9.
6. Владимирова Е.В., Ковалык В.П., Мураков С.В. и др. Генитальный герпес и другие инфекции, передающиеся половым путем: анализ распространенности среди 40 тысяч пациентов федеральной диагностической лаборатории. Материалы конференции «Герпетические инфекции: проблемы и перспективы терапии, профилактика рецидивов». Ярославль; 2019.
7. Brookings C., Goldmeier D., Sadeghi-Nejad H. Sexually transmitted infections and sexual function in relation to male fertility. Korean J Urol. 2013;54(3):149–156. DOI: 10.4111/kju.2013.54.3.149.
8. Брагина Е.Е., Арифулин Е.А., Сенченков Е.П. Генетически обусловленные нарушения подвижности сперматозоидов человека. Онтогенез. 2016;47(5):271–286. DOI: 10.7868/S0475145016050025.
9. Habibi M., Bahrami A., Morteza A. et al. Study of cytomegalovirus infection in idiopathic infertility men referred to Shariati hospital, Tehran, Iran. Iran J Reprod Med. 2014;12(2):151–154. PMID: 24799874.
10. Neofytou E., Sourvinos G., Asmarianaki M. et al. Prevalence of human herpes virus types 1–7 in the semen of men attending an infertility clinic and correlation with semen parameters. Fertil Steril. 2009;91:2487–2494. DOI: 10.1016/j.fertnstert.2008.03.074.
11. Kaspersen M.D., Höllsberg P. Seminal shedding of human herpesviruses. Virol J. 2013;10:226. DOI: 10.1186/1743-422X-10-226.
12. Jahromi B.N., Yaghobi R., Matlub N. et al. Prevalence of cytomegalovirus in semen of male partners of infertile couples and the virus impact on sperm parameters. J Reprod Infertil. 2020;21(2):124–129. PMID: 32500015.
13. Cito G., Coccia M.E., Picone R. et al. Can cytomegalovirus infection affect male reproductive function? Results of a retrospective single-centre analysis. Andrologia. 2020;52(9):e13699. DOI: 10.1111/and.13699.
14. Moretti E., Figura N., Campagna M.S. et al. Infectious Burden and Semen Parameters. Urology. 2017;100:90–96. DOI: 10.1016/j.urology.2016.10.032.
15. Griffiths P., Baraniak I., Reeves M. The pathogenesis of human cytomegalovirus. J Pathol. 2015;235(2):288–297. DOI: 10.1002/path.4437.
16. Малолина Е.А., Лебедева А.Л., Кулибин А.Ю. и др. Взаимодействие герпесвирусов со зрелыми сперматозоидами человека в модельной системе in vitro. Вопросы вирусологии. 2016;61(3):119–125. DOI: 10.18821/0507-4088-2016-61-3-119-125.
17. Naumenko V.A., Tyulenev Yu.A., Kurilo L. et al. Detection and quantification of human herpes viruses types 4–6 in sperm samples of patients with fertility disorders and chronic inflammatory urogenital tract diseases. Andrology. 2014;2(5):687–694. DOI: 10.1111/j.2047-2927.2014.00232.x.
18. Amirjannati N., Yaghmaei F., Akhondi M.M. et al. Molecular and serologic diagnostic approaches; the prevalence of herpes simplex in idiopathic men infertile. Iran J Reprod Med. 2014;12(5):327–334. PMID: 25031577.
19. Mohseni M., Mollaei H.R., Arabzadeh S.A. et al. Frequency of cytomegalovirus in fertile and infertile men, referring to Afzalipour Hospital IVF Research Center, Kerman, IRAN: A case-control study. Int J Reprod Biomed. 2018;16(7):443–446. DOI: 10.29252/ijrm.16.7.443.
20. Muhsin J.M., Yousif S.O., Hadi А.M., Hamad M.H. Male Infertility and Viral Infection: Interference Role of the Human Herpesvirus types (3–6) with Disturbances Effects of Some Cytokines Hypersecretion and Seminal Oxidative Defense System in the Infertility Etiopathogenesis of Some Idiopathic Infertile Iraqi Patients. Biomed Pharmacol J. 2019;12(3):1181–1192. DOI: 10.13005/bpj/1747.
21. Chen М., Cai L., Kanno N. et al. Detection of Human Herpesviruses (HHVs) in Semen of Human Male Infertile Patients. J Reprod Dev. 2013;59(5):457–462. DOI: 10.1262/jrd.2013-023.
22. Sukswai N., Lyapichev K., Khoury J.D., Medeiros L.J. Diffuse large B-cell lymphoma variants: an update. Pathology. 2020;52(1):53–67. DOI: 10.1016/j.pathol.2019.08.013.
23. Yousif L., Hammer G.P., Blettner M., Zeeb H. Testicular cancer and viral infections: a systematic literature review and meta-analysis. J Med Virol. 2013;85(12):2165–2175. DOI: 10.1002/jmv.23704.
24. Garolla A., Vitagliano A., Muscianisi F. et al. Role of Viral Infections in Testicular Cancer Etiology: Evidence From a Systematic Review and Meta-Analysis. Front Endocrinol (Lausanne). 2019;10:355. DOI: 10.3389/fendo.2019.00355.
25. Campioni D., Gentili V., Cavazzini F. et al. Detection of inherited chromosomally integrated HHV-6 (ciHHV-6) in a marker chromosome. Eur J Haematol. 2017;98(6):635–637. DOI: 10.1111/ejh.12872.
26. Никольский М.А., Голубцова В.С. Хромосомно-интегрированный вирус герпеса человека 6 типа. Инфекция и иммунитет. 2015;5(1):7–14.
27. Евдокимов В.В., Науменко В.А., Тюленев Ю.А. и др. Количественная оценка ДНК вирусов папилломы человека высокого канцерогенного риска и герпесвирусов человека у мужчин при нарушении фертильности. Вопросы вирусологии. 2016;61(2):63–68. DOI: 10.18821/0507-4088-2016-61-2-63-68.
28. Godet A.N., Soignon G., Koubi H. et al. Presence of HHV-6 genome in spermatozoa in a context of couples with low fertility: what type of infection? Andrologia. 2015;47(5):531–535. DOI: 10.1111/and.12299.
29. Климова Р.Р., Чичев Е.В., Науменко В.А. и др. Вирус простого герпеса и цитомегаловирус в эякуляте мужчин: вирус простого герпеса чаще встречается при идиопатическом бесплодии и коррелирует со снижением показателей спермы. Вопросы вирусологии. 2010;1:27–30.
30. EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam 2021. ISBN 978-94-92671-13-4.
31. Fensterl V., Chattopadhyay S., Sen G.C. No Love Lost Between Viruses and Interferons. Annu Rev Virol. 2015;2(1):549–572. DOI: 10.1146/annurev-virology-100114-055249.
32. Yu Q., Katlinskaya Y.V., Carbone C.J. et al. DNA-damage-induced type I interferon promotes senescence and inhibits stem cell function. Cell Rep. 2015;11(5):785–797. DOI: 10.1016/j.celrep.2015.03.069.
33. Евдокимов В.В., Ковалык В.П., Малиновская В.В. и др. Диагностика и лечение абактериального ХП/СХТБ III, ассоциированного с герпес-вирусами. Урология. 2019;3:23–30. DOI: 10.18565/urology.2019.3.23-30.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.