Последствия избыточного формирования фиброза у больных хроническим простатитом
РМЖ. №2 от 30.05.2019 стр. 39-41
Рубрика:
Урология
Одной из причин хронического рецидивирующего течения простатита является гиперпродукция фиброзной ткани. Склерозирование тканей усугубляет клиническую картину простатита и снижает эффективность лечения.
Цель исследования: определить влияние степени воспалительных процессов и фиброза предстательной железы на уродинамику и локальную микроциркуляцию.
Материал и методы: в открытое ретроспективное сравнительное исследование «случай-контроль» включены 18 пациентов, которым выполняли биопсию простаты. Показатели урофлоуметрии и степень нарушения микроциркуляции сравнили между группой больных с выраженным фиброзом (1-я группа, 9 пациентов) и группой с незначительными фиброзными изменениями предстательной железы (2-я группа, также 9 пациентов). Степень фиброзирования и воспаления оценивали в баллах: от 0 (нет изменений) до 3 баллов (выраженные изменения).
Результаты исследования: у всех обследованных были выявлены структурные изменения в предстательной железе согласно данным ультразвукового исследования, показавшего преимущественно эхогенную неоднородность, очаги повышенной и пониженной эхогенности. В 1-й группе степень фиброза в среднем составила 2,7 балла, а степень воспаления — 2,5 балла. Во 2-й группе фиброз и воспаление были незначительными: 0,2 и 0,3 балла соответственно. Показатели мочеиспускания в 1-й группе были в 1,5 раза, а микроциркуляции в 1,7 раза хуже, чем во 2-й группе.
Заключение: хронический простатит, осложненный избыточным развитием фиброзной ткани, приводит к статистически значимому ухудшению параметров мочеиспускания и локальной микроциркуляции. Степень нарушения микроциркуляции и уродинамики опосредованно свидетельствует об уровне фиброзирования простаты.
Ключевые слова: хронический простатит, фиброз, склерозирование, нарушение микроциркуляции, нарушение уродинамики.
Для цитирования: Филимонов П.Н., Кульчавеня Е.В. Последствия избыточного формирования фиброза у больных хроническим простатитом. РМЖ. Медицинское обозрение. 2019;27(2):39-41.
Цель исследования: определить влияние степени воспалительных процессов и фиброза предстательной железы на уродинамику и локальную микроциркуляцию.
Материал и методы: в открытое ретроспективное сравнительное исследование «случай-контроль» включены 18 пациентов, которым выполняли биопсию простаты. Показатели урофлоуметрии и степень нарушения микроциркуляции сравнили между группой больных с выраженным фиброзом (1-я группа, 9 пациентов) и группой с незначительными фиброзными изменениями предстательной железы (2-я группа, также 9 пациентов). Степень фиброзирования и воспаления оценивали в баллах: от 0 (нет изменений) до 3 баллов (выраженные изменения).
Результаты исследования: у всех обследованных были выявлены структурные изменения в предстательной железе согласно данным ультразвукового исследования, показавшего преимущественно эхогенную неоднородность, очаги повышенной и пониженной эхогенности. В 1-й группе степень фиброза в среднем составила 2,7 балла, а степень воспаления — 2,5 балла. Во 2-й группе фиброз и воспаление были незначительными: 0,2 и 0,3 балла соответственно. Показатели мочеиспускания в 1-й группе были в 1,5 раза, а микроциркуляции в 1,7 раза хуже, чем во 2-й группе.
Заключение: хронический простатит, осложненный избыточным развитием фиброзной ткани, приводит к статистически значимому ухудшению параметров мочеиспускания и локальной микроциркуляции. Степень нарушения микроциркуляции и уродинамики опосредованно свидетельствует об уровне фиброзирования простаты.
Ключевые слова: хронический простатит, фиброз, склерозирование, нарушение микроциркуляции, нарушение уродинамики.
Для цитирования: Филимонов П.Н., Кульчавеня Е.В. Последствия избыточного формирования фиброза у больных хроническим простатитом. РМЖ. Медицинское обозрение. 2019;27(2):39-41.
Consequences of excessive fibrosis formation in patients with chronic prostatitis
P.N. Filimonov1, E.V. Kulchavenya1,2
1Novosibirsk Scientific Research Institute of Tuberculosis
2Novosibirsk State Medical University
One of the reasons for chronic recurrent prostatitis is the hyperproduction of fibrous tissue. Tissue sclerosis aggravates the clinical picture of prostatitis and reduces the effectiveness of treatment.
Aim: to determine the influence of the degree of severity of inflammatory phenomena and prostate fibrosis on urodynamics and local microcirculation.
Patients and Methods: an open, retrospective case-control comparative study included 18 patients who had been biopsied by a prostate biopsy. Indicators of urofluometry and the degree of microcirculation disorder were compared between the group of patients with severe fibrosis (the 1st group, 9 people) and the 2nd group (also 9 patients) — with insignificant fibrosis changes of the prostate gland. The degree of fibrosis and inflammation was indicated: from 0 (no change) to 3 points (expressed changes).
Results: structural changes in the prostate gland were revealed in all of them according to the ultrasound examination data, mainly — echogenic heterogeneity, regions of increased and decreased echodensity. In the 1st group, the degree of fibrosis averaged 2.7 points, and the degree of inflammation — 2.5 points. In the 2nd group fibrosis and inflammation were insignificant: 0.2 and 0.3 points, respectively. Urination indexes in the 1st group were 1.5 times worse than in the 2nd group, and microcirculation indexes were 1.7 times worse than in the 2nd group.
Conclusion: chronic prostatitis complicated by excessive development of fibrous tissue leads to statistically significant deterioration of urinary parameters and local microcirculation. The degree of microcirculation disorder and urodynamics indirectly indicates the level of prostate fibrosis.
Keywords: chronic prostatitis, fibrosis, hardening, impaired microcirculation, impaired urodynamics.
For citation: Filimonov P.N., Kulchavenya E.V. Consequences of excessive fibrosis formation in patients with chronic prostatitis. RMJ. 2019;2:39–41.
P.N. Filimonov1, E.V. Kulchavenya1,2
1Novosibirsk Scientific Research Institute of Tuberculosis
2Novosibirsk State Medical University
One of the reasons for chronic recurrent prostatitis is the hyperproduction of fibrous tissue. Tissue sclerosis aggravates the clinical picture of prostatitis and reduces the effectiveness of treatment.
Aim: to determine the influence of the degree of severity of inflammatory phenomena and prostate fibrosis on urodynamics and local microcirculation.
Patients and Methods: an open, retrospective case-control comparative study included 18 patients who had been biopsied by a prostate biopsy. Indicators of urofluometry and the degree of microcirculation disorder were compared between the group of patients with severe fibrosis (the 1st group, 9 people) and the 2nd group (also 9 patients) — with insignificant fibrosis changes of the prostate gland. The degree of fibrosis and inflammation was indicated: from 0 (no change) to 3 points (expressed changes).
Results: structural changes in the prostate gland were revealed in all of them according to the ultrasound examination data, mainly — echogenic heterogeneity, regions of increased and decreased echodensity. In the 1st group, the degree of fibrosis averaged 2.7 points, and the degree of inflammation — 2.5 points. In the 2nd group fibrosis and inflammation were insignificant: 0.2 and 0.3 points, respectively. Urination indexes in the 1st group were 1.5 times worse than in the 2nd group, and microcirculation indexes were 1.7 times worse than in the 2nd group.
Conclusion: chronic prostatitis complicated by excessive development of fibrous tissue leads to statistically significant deterioration of urinary parameters and local microcirculation. The degree of microcirculation disorder and urodynamics indirectly indicates the level of prostate fibrosis.
Keywords: chronic prostatitis, fibrosis, hardening, impaired microcirculation, impaired urodynamics.
For citation: Filimonov P.N., Kulchavenya E.V. Consequences of excessive fibrosis formation in patients with chronic prostatitis. RMJ. 2019;2:39–41.
В статье представлены результаты исследования, посвященного определению влияния степени воспалительных процессов и фиброза предстательной железы на уродинамику и локальную микроциркуляцию.
Введение
Истинная заболеваемость хроническим простатитом (ХП) неизвестна, однако воспаление простаты — частая находка при патоморфологическом исследовании операционного материала или биоптатов, выполненных по поводу доброкачественной гиперплазии или рака простаты. Показана корреляция между интенсивностью воспаления и степенью выраженности симптомов нижних мочевыводящих путей [1–3]. Полагают, что основной причиной этого является потеря эластичности тканей вследствие избыточного склерозирования как конечного этапа хронического воспалительного процесса [4–6]. Патофизиология воспаления предполагает закономерное включение механизмов патологического заживления через избыточную продукцию фиброза, если воспаление не разрешилось в острую фазу [7].Коллаген является основным представителем большой группы внеклеточных протеинов. Большинство субтипов коллагена формируют фибриллы [8]. Они играют ведущую роль в формировании «тканевого скелета», обеспечивающего прочность и растяжимость тканей, клеточную миграцию и адгезию, восстановление тканей после повреждения [9–11]. Существуют два сбалансированных разнонаправленных процесса: синтез коллагена и его деградация. При нарушении баланса происходит избыточное формирование фиброзной ткани, нарушающее функцию пострадавшего органа [12–15]. Так, формирование посттуберкулезной стриктуры мочеточника может привести к гибели ипсилатеральной почки даже в случае ее излечения от туберкулеза; избыточное рубцевание туберкулезного воспаления в мочевом пузыре завершается его сморщиванием вплоть до полной облитерации [16].
Именно хроническое воспаление предстательной железы, приводящее к фиброзу периуретральных тканей, является одной из основных причин нарушения мочеиспускания при ХП [17–18]. Хроническое воспаление способствует также фиброзированию corpus cavernosum, что было экспериментально доказано [19]. Подобный феномен отчасти объясняет эректильную дисфункцию у больных ХП.
При ретроспективном анализе историй болезни 2316 мужчин, прооперированных по поводу доброкачественной гиперплазии предстательной железы и рака предстательной железы, установлена положительная корреляция между степенью фиброза и злокачественным перерождением простаты, в то время как вероятность обнаружения простатической интраэпителиальной неоплазии II степени была выше при преобладании воспалительных изменений [20]. Обнаружили, что накопление коллагена при хроническом бактериальном простатите происходило как путем усиления синтеза de novo, так и за счет экспрессии генов, связанных с ремоделированием коллагена, созданного в хронической фазе воспаления [17].
При патоморфологическом исследовании биоптатов простаты пациентов — рабочих химического производства, страдающих ХП, обнаружили прогрессирующий фиброз стромы с явлениями перигландулярного и периваскулярного склероза, а также редукцию сосудов микроциркуляторного русла [21]. Фиброз предстательной железы влияет не только на мочеиспускание, но и ухудшает результаты оперативных вмешательств. Вместе с тем экспериментально показана потенциальная возможность регресса за счет ферментативного воздействия препаратов, способствующих биодеградации коллагена [22].
В эксперименте на мышах было показано, что у животных с острым бактериальным простатитом, пролеченных фторхинолоном, наступал регресс воспалительных изменений и синтез коллагена был незначительным [17]. А в группе животных с моделью бактериального простатита, получавших чистую воду без антибиотика, присутствовалo как выраженное воспаление, так и существенные фиброзные изменения паренхимы предстательной железы (рис. 1).
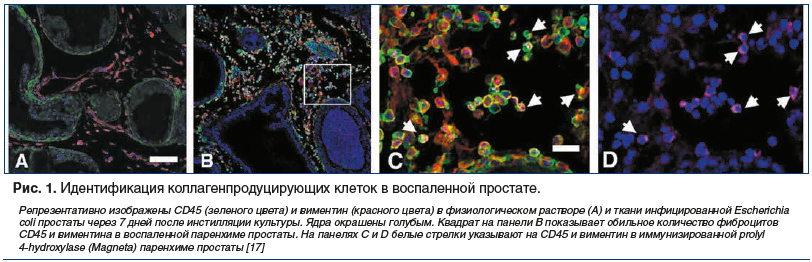
Таким образом, доказано (преимущественно экспериментальными работами), что если при остром воспалении предстательной железы фиброз может быть минимальным, то хроническое воспаление сопровождается развитием склеротических реакций вплоть до полного рубцевания паренхимы предстательной железы.
Цель исследования: определить влияние степени воспалительных явлений и фиброза предстательной железы на уродинамику и локальную микроциркуляцию.
Материал и методы
Для подтверждения корреляции между хроническим воспалением и фиброзом простаты и нарушением уродинамики и микроциркуляции в предстательной железе было проведено открытое ретроспективное сравнительное исследование «случай-контроль». В исследование вошли 18 пациентов, которым выполняли трансректальное ультразвуковое исследование с целью определения структуры железы. Затем определяли уровень локальной микроциркуляции методом лазерной допплеровской флоуметрии (ЛДФ) с помощью аппарата ЛАКК-01; измерение проводили на промежности в точке проекции простаты. ЛДФ является современным методом неинвазивной оценки состояния микроциркуляции, основанным на изменении частотных характеристик лазерного луча, зондирующего ткани, при его отражении от движущихся компонентов крови, в первую очередь эритроцитов. Компьютерная обработка полученной допплерограммы позволяет вычислить интегральный показатель микроциркуляции (ИМ), характеризующий перфузию тканей. ИМ прямо пропорционален скорости движения эритроцитов, количеству функционирующих капилляров и величине гематокрита в микрососудах; выражается в перфузионных единицах (п. е.). При расчете учитывали α — среднеквадратическое отклонение, которое отражает временную изменчивость кровотока, Кv — коэффициент вариации, характеризующий соотношение величины перфузии тканей и ее изменчивости.
Всем пациентам также выполняли урофлоуметрию, во время которой оценивали максимальную скорость (Qmax) и среднюю скорость (Qave) мочеиспускания.
Затем проводили трансректальную биопсию простаты под ультразвуковым наведением из 6 стандартных точек с предварительной анестезией путем ректальной инстилляции геля для местного применения с лидокаином и хлоргексидином с последующим патоморфологическим исследованием биоптатов при стандартной окраске.
При патоморфологическом исследовании биоптатов сформировали две группы: 1-я группа — 9 человек с выраженными воспалением и фиброзом ткани и 2-я группа — 9 человек с минимальными воспалением и фиброзом. Степень фиброзирования и воспаления оценивали в баллах: от 0 (нет изменений) до 3 баллов (выраженные изменения). После чего сопоставили данные урофлоуметрии и ЛДФ со степенью фиброзирования простаты, и таким образом определили корреляцию между нарушением уродинамики и микроциркуляции и степенью воспаления и фиброза.
Статистическая обработка результатов проведена на персональном компьютере с помощью пакетов статистических программ Мicrosoft Eхсе1 2007 и Statistiсa for Windows 6.0. Определяли среднюю арифметическую, отклонение от средней арифметической, далее рассчитывали среднеквадратическое отклонение (σ) и среднюю ошибку относительной величины (m). Для решения вопроса о случайности расхождений наблюдаемых средних (относительных) величин рассчитывали среднюю ошибку разности двух средних. Полученные результаты представляли как среднее ± ошибка средней (M±m). Далее посредством сравнения средних значений двух выборочных совокупностей (М1 и М2) вычисляли t-критерий Стьюдента и определяли уровень значимости р. При оценке достоверности результатов первого этапа исследования применяли непараметрический аналог критерия Стьюдента — критерий Манна — Уитни. Статистически значимыми считали различия при р<0,05.
Результаты исследования
По данным ультразвукового исследования у всех 18 пациентов были выявлены те или иные структурные изменения в предстательной железе: эхогенная неоднородность, очаги повышенной и пониженной эхоплотности. В 1-й группе степень фиброза в среднем составила 2,7 балла, степень воспаления — 2,5 балла. Во 2-й группе фиброз и воспаление были незначительными: 0,2 и 0,3 балла соответственно. В 1-й группе больных с грубым фиброзированием Qmax в среднем составила 11,7 мл/с (от 9,9 до 14,0 мл/с), Qave варьировала в пределах 3,8–7,1 мл/с, в среднем составив 5,7 мл/с. Во 2-й группе (с минимальным фиброзированием простаты) урофлоуметрические показатели были достоверно лучше: 17,9 и 9,6 мл/с соответственно. Нарушение микроциркуляции по результатам ЛДФ также было более выражено в 1-й группе; у пациентов 2-й группы, с небольшими фиброзными изменениями, показатели микроциркуляции оказались в 1,7 раза выше. Сравнительные данные представлены в таблице 1.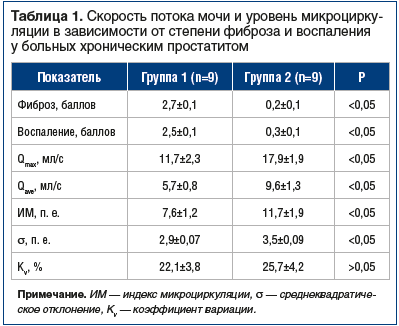
Таким образом, за исключением коэффициента вариации различия между группами по всем показателям оказались достоверными.
Примеры патоморфологической картины представлены на рисунке 2.
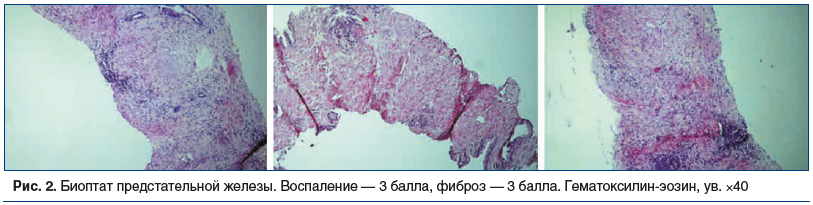
Таким образом, нами установлено, что хроническое воспаление ассоциировано с фиброзом, что фиброз простаты в 1,5 раза ухудшает локальную микроциркуляцию и в 1,7 раза — уродинамику. ХП, осложненный избыточным развитием фиброзной ткани, приводит к статистически значимому ухудшению параметров мочеиспускания и локальной микроциркуляции. Следовательно, профилактика образования и регресс сформировавшегося фиброза являются патогенетически обоснованными.
Заключение
По результатам нашего исследования можно сделать вывод, что степень нарушения микроциркуляции и уродинамики опосредованно свидетельствует об уровне фиброзирования простаты. Однако этот процесс обратим за счет применения антисклеротических препаратов в комплексе лечения больных ХП, например пролонгированного фермента гиалуронидазы [23].
Литература
1. Wong L., Hutson P.R., Bushman W. Resolution of chronic bacterial-induced prostatic inflammation reverses established fibrosis. Prostate. 2015;75(1):23–32. DOI: 10.1002/pros.22886.
2. Nickel J.C., Roehrborn C.G., O’Leary M.P. et al. The relationship between prostate inflammation and lower urinary tract symptoms: examination of baseline data from the REDUCE trial. Eur Urol. 2008;54:1379–1384.
3. Roehrborn C.G. Definition of at-risk patients: baseline variables. BJU Int.2006;97(Suppl. 2):7–11; discussion 21–12.
4. Zhou J., Lei Y., Chen J., Zhou X. Potential ameliorative effects of epigallocatechin-3-gallate against testosterone-induced benign prostatic hyperplasia and fibrosis in rats. Int Immunopharmacol. 2018;64:162–169. DOI: 10.1016/j.intimp.2018.08.038.
5. Ma J., Gharaee-Kermani M., Kunju L. et al. Prostatic fibrosis is associated with lower urinary tract symptoms. J Urol. 2012;188:1375–1381.
6. Rodriguez-Nieves J.A., Macoska J.A. Prostatic fibrosis, lower urinary tract symptoms, and BPH. Nat Rev Urol. 2013;10(9):546–550. DOI: 10.1038/nrurol.2013.149.
7. Wight T.N., Potter-Perigo S. The extracellular matrix: an active or passive player in fibrosis? Am J Physiol Gastrointest Liver Physiol. 2011;301: G950–955.
8. Gordon M.K., Hahn R.A. Collagens. Cell Tissue Res. 2010;339:247–257.
9. Frantz C., Stewart K.M., Weaver V.M. The extracellular matrix at a glance. J Cell Sci. 2010;123:4195–4200.
10. Kadler K.E., Baldock C., Bella J., Boot-Handford R.P. Collagens at a glance. J Cell Sci. 2007;120:1955–1958.
11. Rode´s J. Textbook of hepatology from basic science to clinical practice. 3rd ed. Malden. Mass.: Blackwell, 2007.
12. Eid B.G., Mosli H., Hasan A., El-Bassossy H.M. Ginger Ingredients Alleviate Diabetic Prostatic Complications: Effect on Oxidative Stress and Fibrosis. Evid Based Complement Alternat Med. 2017;2017:6090269. DOI: 10.1155/2017/6090269.
13. He Y., Zeng H.Z., Yu Y., Zhang J.S. et al. Resveratrol improves prostate fibrosis during progression of urinary dysfunction in chronic prostatitis. Environ Toxicol Pharmacol. 2017;54:120–124. DOI: 10.1016/j.etap.2017.06.025.
14. Garcia-Bolao I., Lopez B., Macias A. et al. Impact of collagen type I turnover on the long-term response to cardiac resynchronization therapy. Eur Heart J. 2008;29:898–906.
15. Bushman W.A., Jerde T.J. The role of prostate inflammation and fibrosis in lower urinary tract symptoms. Am J Physiol Renal Physiol. 2016;311(4): F817–F821. DOI: 10.1152/ajprenal.00602.2015.
16. Kulchavenya E., Naber K., Bjerklund Johansen T.E. Urogenital tuberculosis: classification, diagnosis, and treatment. European Urology Supplement, 2016;15(4):112–121.
17. Wong L., Hutson P.R., Bushman W. Prostatic inflammation induces fibrosis in a mouse model of chronic bacterial infection. PLoS One. 2014;9(6): e100770. DOI: 10.1371/journal.pone.0100770. eCollection 2014.
18. Cantiello F., Cicione A., Salonia A. et al. Periurethral fibrosis secondary to prostatic inflammation causing lower urinary tract symptoms: a prospective cohort study. Urology. 2013;81(5):1018–1023. DOI: 10.1016/j.urology.2013.01.053.
19. Hu Y., Niu X., Wang G. et al. Chronic prostatitis/chronic pelvic pain syndrome impairs erectile function through increased endothelial dysfunction, oxidative stress, apoptosis, and corporal fibrosis in a rat model. Andrology. 2016;4(6):1209–1216. DOI: 10.1111/andr.12273.
20. Горбунова Е.Н., Давыдова Д.А., Крупин В.Н. Хроническое воспаление и фиброз как факторы риска простатических интраэпителиальных неоплазий и рака предстательной железы. Современные технологии в медицине. 2011;1:79–83. [Gorbunova E.N., Davydova D.A., Krupin V.N. Chronic inflammation and fibrosis as risk factors for prostatic intraepithelial neoplasias and prostate cancer. Modern technology in medicine. 2011;1:79–83. (in Russ.)].
21. Неймарк А.И., Киптилов А.В., Лапий Г.А. Клинические и патоморфологические особенности хронического простатита у рабочих химического производства. Урология. 2015;3:68–73. [Neimark A.I., Kiptilov A.V., Lapiy G.A. Clinical and pathological features of chronic prostatitis in chemical production workers. Urology. 2015;3:68–73 (in Russ.)].
22. Зайцев А.В., Пушкарь Д.Ю., Ходырева Л.А., Дударева А.А. Хронический бактериальный простатит, расстройства мочеиспускания у мужчин и фиброз предстательной железы. Урология. 2016;4:114–120. [Zaitsev A.V., Pushkar D. Yu., Khodyreva L.A., Dudareva A.A. Chronic bacterial prostatitis, urinary disorders in men and prostate fibrosis. Urology. 2016;4:114–120 (in Russ.)].
23. Кульчавеня Е.В., Швецова О.П., Бреусов А.А. Обоснование назначения и эффективность препарата Лонгидаза у больных хроническим простатитом. Урология. 2018;4:64–72. [Kulchavenya E.V., Shvetsova O.P., Breusov A.A. Justification of the purpose and effectiveness of the drug Longidas in patients with chronic prostatitis. Urology. 2018;4:64–72 (in Russ.)]. DOI: https://dx.doi.org/10.18565/urology.2018.4:64–71.
2. Nickel J.C., Roehrborn C.G., O’Leary M.P. et al. The relationship between prostate inflammation and lower urinary tract symptoms: examination of baseline data from the REDUCE trial. Eur Urol. 2008;54:1379–1384.
3. Roehrborn C.G. Definition of at-risk patients: baseline variables. BJU Int.2006;97(Suppl. 2):7–11; discussion 21–12.
4. Zhou J., Lei Y., Chen J., Zhou X. Potential ameliorative effects of epigallocatechin-3-gallate against testosterone-induced benign prostatic hyperplasia and fibrosis in rats. Int Immunopharmacol. 2018;64:162–169. DOI: 10.1016/j.intimp.2018.08.038.
5. Ma J., Gharaee-Kermani M., Kunju L. et al. Prostatic fibrosis is associated with lower urinary tract symptoms. J Urol. 2012;188:1375–1381.
6. Rodriguez-Nieves J.A., Macoska J.A. Prostatic fibrosis, lower urinary tract symptoms, and BPH. Nat Rev Urol. 2013;10(9):546–550. DOI: 10.1038/nrurol.2013.149.
7. Wight T.N., Potter-Perigo S. The extracellular matrix: an active or passive player in fibrosis? Am J Physiol Gastrointest Liver Physiol. 2011;301: G950–955.
8. Gordon M.K., Hahn R.A. Collagens. Cell Tissue Res. 2010;339:247–257.
9. Frantz C., Stewart K.M., Weaver V.M. The extracellular matrix at a glance. J Cell Sci. 2010;123:4195–4200.
10. Kadler K.E., Baldock C., Bella J., Boot-Handford R.P. Collagens at a glance. J Cell Sci. 2007;120:1955–1958.
11. Rode´s J. Textbook of hepatology from basic science to clinical practice. 3rd ed. Malden. Mass.: Blackwell, 2007.
12. Eid B.G., Mosli H., Hasan A., El-Bassossy H.M. Ginger Ingredients Alleviate Diabetic Prostatic Complications: Effect on Oxidative Stress and Fibrosis. Evid Based Complement Alternat Med. 2017;2017:6090269. DOI: 10.1155/2017/6090269.
13. He Y., Zeng H.Z., Yu Y., Zhang J.S. et al. Resveratrol improves prostate fibrosis during progression of urinary dysfunction in chronic prostatitis. Environ Toxicol Pharmacol. 2017;54:120–124. DOI: 10.1016/j.etap.2017.06.025.
14. Garcia-Bolao I., Lopez B., Macias A. et al. Impact of collagen type I turnover on the long-term response to cardiac resynchronization therapy. Eur Heart J. 2008;29:898–906.
15. Bushman W.A., Jerde T.J. The role of prostate inflammation and fibrosis in lower urinary tract symptoms. Am J Physiol Renal Physiol. 2016;311(4): F817–F821. DOI: 10.1152/ajprenal.00602.2015.
16. Kulchavenya E., Naber K., Bjerklund Johansen T.E. Urogenital tuberculosis: classification, diagnosis, and treatment. European Urology Supplement, 2016;15(4):112–121.
17. Wong L., Hutson P.R., Bushman W. Prostatic inflammation induces fibrosis in a mouse model of chronic bacterial infection. PLoS One. 2014;9(6): e100770. DOI: 10.1371/journal.pone.0100770. eCollection 2014.
18. Cantiello F., Cicione A., Salonia A. et al. Periurethral fibrosis secondary to prostatic inflammation causing lower urinary tract symptoms: a prospective cohort study. Urology. 2013;81(5):1018–1023. DOI: 10.1016/j.urology.2013.01.053.
19. Hu Y., Niu X., Wang G. et al. Chronic prostatitis/chronic pelvic pain syndrome impairs erectile function through increased endothelial dysfunction, oxidative stress, apoptosis, and corporal fibrosis in a rat model. Andrology. 2016;4(6):1209–1216. DOI: 10.1111/andr.12273.
20. Горбунова Е.Н., Давыдова Д.А., Крупин В.Н. Хроническое воспаление и фиброз как факторы риска простатических интраэпителиальных неоплазий и рака предстательной железы. Современные технологии в медицине. 2011;1:79–83. [Gorbunova E.N., Davydova D.A., Krupin V.N. Chronic inflammation and fibrosis as risk factors for prostatic intraepithelial neoplasias and prostate cancer. Modern technology in medicine. 2011;1:79–83. (in Russ.)].
21. Неймарк А.И., Киптилов А.В., Лапий Г.А. Клинические и патоморфологические особенности хронического простатита у рабочих химического производства. Урология. 2015;3:68–73. [Neimark A.I., Kiptilov A.V., Lapiy G.A. Clinical and pathological features of chronic prostatitis in chemical production workers. Urology. 2015;3:68–73 (in Russ.)].
22. Зайцев А.В., Пушкарь Д.Ю., Ходырева Л.А., Дударева А.А. Хронический бактериальный простатит, расстройства мочеиспускания у мужчин и фиброз предстательной железы. Урология. 2016;4:114–120. [Zaitsev A.V., Pushkar D. Yu., Khodyreva L.A., Dudareva A.A. Chronic bacterial prostatitis, urinary disorders in men and prostate fibrosis. Urology. 2016;4:114–120 (in Russ.)].
23. Кульчавеня Е.В., Швецова О.П., Бреусов А.А. Обоснование назначения и эффективность препарата Лонгидаза у больных хроническим простатитом. Урология. 2018;4:64–72. [Kulchavenya E.V., Shvetsova O.P., Breusov A.A. Justification of the purpose and effectiveness of the drug Longidas in patients with chronic prostatitis. Urology. 2018;4:64–72 (in Russ.)]. DOI: https://dx.doi.org/10.18565/urology.2018.4:64–71.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
