Полиморфизм генов цитокинов, ассоциированных с инфекционным эндокардитом
Инфекционный эндокардит является заболеванием с первичной локализацией возбудителя на клапанах сердца и пристеночном эндокарде, протекающим с возможной генерализацией септического процесса и развитием иммунопатологических изменений, весьма значимых в формировании и течении заболевания. Исходя из того, что 30–50% случаев инфекционного эндокардита развиваются без очевидного участия классических факторов риска (инвазивные процедуры или эндоваскулярные нарушения), можно предположить вовлечение в патогенез заболевания и его осложнений молекулярно-генетических факторов. Есть основания полагать, что активация неадекватного воспаления в ответ на вторжение микроорганизмов может быть обусловлена полиморфизмом в генах, контролирующих активность цитокинов. Однако имеющиеся сегодня сведения об уровне содержания различных цитокинов и полиморфизме их генов при различных клинических вариантах инфекционного эндокардита весьма ограничены и нередко противоречивы, что требует более глубокого изучения патогенетической связи инфекционного эндокардита с генетическими дефектами цитокинов. В этой связи расширение представлений о полиморфизмах генов цитокинов в виде точечных мутаций (SNP), способных регулировать интенсивность экспрессии цитокинов и их биологические эффекты, позволит прогнозировать риск развития инфекционного эндокардита, тяжесть его течения, риск возможных осложнений, а также индивидуальный подбор специфической терапии для пациентов.
Ключевые слова: инфекционный эндокардит, клинические варианты, осложнения, цитокины, гены цитокинов, генетический полиморфизм, патогенез, диагностика.
Для цитирования: Самойленко Е.С., Колесникова Н.В. Полиморфизм генов цитокинов, ассоциированных с инфекционным эндокардитом. РМЖ. Медицинское обозрение. 2023;7(7). DOI: 10.32364/2587-6821-2023-7-7-2.
Для цитирования: Самойленко Е.С., Колесникова Н.В. Полиморфизм генов цитокинов, ассоциированных с инфекционным эндокардитом. РМЖ. Медицинское обозрение. 2023;7(7):411-417. DOI: 10.32364/2587-6821-2023-7-7-2.
E.S. Samoylenko, N.V. Kolesnikova
Kuban State Medical University, Krasnodar, Russian Federation
Infectious endocarditis is a disease with the primary pathogen localization on the heart valves and the mural endocardium, occurring with the possible generalization of the septic process and the immunopathological changes that are very significant in the disease manifestation and course. Based on the fact that 30–50% of cases concerning infectious endocarditis develop without the obvious involvement of standard risk factors (invasive procedures or endovascular disorders), it can be assumed that molecular genetic factors are involved in the disease pathogenesis and its complications. There is reason to believe that the activation of inadequate inflammation in response to the microbial invasion may be due to polymorphism in the genes controlling the cytokine activity. However, the information available today on the various cytokines level and the gene polymorphism in various clinical variants of infectious endocarditis is very limited and commonly contradictory, which requires a deeper study of the pathogenetic association of infectious endocarditis with cytokine genetic defects. In this regard, the expansion of ideas concerning the of cytokine gene polymorphisms in the form of point mutations (SNP), capable of regulating the intensity of cytokine expression and their biological effects, will allow to predict the risk of infectious endocarditis, the severity of its course, the risk of possible complications, as well as the individual treatment tactics for patients.
Keywords: infectious endocarditis, clinical variants, complications, cytokines, cytokine genes, genetic polymorphism, pathogenesis, diagnosis.
For citation: Samoylenko E.S., Kolesnikova N.V. Cytokine gene single nucleotide polymorphisms associated with infectious endocarditis. Russian Medical Inquiry. 2023;7(7):411–417 (in Russ.). DOI: 10.32364/2587-6821-2023-7-7-2.
Введение
Инфекционный эндокардит (ИЭ) является заболеванием бактериальной природы с преимущественной локализацией возбудителя на клапанах сердца и эндокарда и сопровождается иммунопатологическими проявлениями с возможной генерализацией септического процесса. Группу высокого риска возникновения ИЭ составляют пациенты с пороками сердца, дегенеративными изменениями клапанного аппарата, иммунодефицитами, искусственными клапанами, кардиологическими операциями, употребляющие наркотики внутривенно, но все чаще (в 30–50% случаев) заболевание возникает в отсутствие явных факторов риска, что свидетельствует о возможном вовлечении в патогенез генетических факторов [1, 2].
В настоящее время причинами смерти пациентов с ИЭ зачастую становятся тромбоэмболические осложнения (инфаркт миокарда, ишемический инсульт, тромбоэмболия легочной артерии и др.), выраженность которых зависит от варианта течения ИЭ [3]. При этом если для острого варианта течения чаще характерен септический процесс с выраженной интоксикацией организма и неблагоприятным прогнозом, то подострый вариант ИЭ характеризуется преобладающим поражением клапанного аппарата сердца, преходящей септицемией и развитием выраженной иммунокомплексной патологии в виде васкулита, серозита, гломерулонефрита, миокардита [1].
Основу диагностики ИЭ составляют критерии Duke (2015), включающие клинические особенности, результаты эхокардиографии и посева крови [4]. Между тем диагностика ИЭ затруднена в связи с выраженным полиморфизмом клиники, широким спектром возбудителей и ростом доли полимикробной инфекции в генезе заболевания, а отсутствие специфических диагностических признаков на ранних этапах ИЭ не позволяет дифференцировать его с другими инфекционными и опухолевыми заболеваниями, которым также свойственны анемия, лейкоцитоз, ускорение СОЭ, повышение уровня С-реактивного белка (СРБ), микрогематурия и протеинурия в общем анализе мочи, т. е. у пациентов имеют место лабораторные признаки, свойственные ряду других заболеваний [1, 5, 6].
Актуальность уточнения вопросов иммунопатогенеза ИЭ обусловлена непрерывной активацией гуморального и клеточного иммунитета в условиях постоянной бактериемии, сопровождающейся существенными изменениями спектра про- и противовоспалительных цитокинов. При этом изучение структуры и особенностей экспрессии генов, кодирующих белковые молекулы человека, а также внедрение в рутинную лабораторную практику новых диагностических технологий тестирования различных генных полиморфизмов сегодня считаются перспективными направлениями в отношении прогноза риска развития определенных заболеваний у конкретного индивидуума [1]. В целом если исследование патогенетической роли цитокинов может позволить прогнозировать риск развития и тяжесть течения заболевания и подобрать специфическую персонифицированную терапию, то исследование генов цитокинов помогает обнаружить предрасположенность к ИЭ [7].
Таким образом, с точки зрения актуальности изучения и внедрения в практику дополнительных иммуногенетических критериев лабораторной оценки прогноза и риска неблагоприятных исходов у больных ИЭ представляют интерес анализ и систематизация современных научных сведений о полиморфизме генов цитокинов, ассоциированных с данным заболеванием.
Генетический полиморфизм цитокинов при инфекционном процессе
Важное место в индукции иммунного дисбаланса при инфекционном процессе отводят нарушениям межклеточного взаимодействия, опосредованного цитокин-рецепторной сетью [8]. При этом синтез и секреция цитокинов, обладающих широким спектром биологических эффектов, регулируются генетическими механизмами экспрессии их генов, исследование которых активно продолжается в настоящее время [9]. В норме многие гены цитокинов экспрессируются с высокой степенью индивидуальной вариабельности, тогда как при патологиях могут наблюдаться характерные изменения экспрессии как в виде активации конкретных генов, так и в виде репрессии исходно активных, наряду с чем часто можно наблюдать каскадную экспрессию генов, когда активация одного гена вызывает экспрессию другого или даже группы генов [10]. Известно, что экспрессия генов биомолекул зависит от их полиморфизма: если при однонуклеотидном полиморфизме (SNPs) в результате точечных мутаций имеет место изменение последовательности ДНК (в один нуклеотид) в гомологичных участках гомологичных хромосом, то полиморфные генетические сайты могут рассматриваться как маркеры предрасположенности или резистентности к различным заболеваниям, в патогенезе которых важную роль играют цитокины [11]. Генетически детерминированное нарушение регуляции образования цитокинов обусловливает не только хронизацию, но и генерализацию воспалительного процесса, а также может определять возникновение ранних рецидивов заболеваний. В частности, нарушения продукции цитокинов семейства интерлейкина (IL) 1 (IL-1β, IL-1RA, IL-1RI) определяют характер течения воспаления и являются одним из пусковых механизмов патологических процессов [12], а маркерами прогностически неблагоприятного ответа на проводимую терапию могут являться аллели -308G TNF-α, -31T IL-1β, -592A IL-10.
Известен ряд полиморфных вариантов в промоторных и интронных областях генов провоспалительных цитокинов TNF, IL-1β и их рецепторов, ассоциированных с уровнем их продукции, необходимой для регуляции пролиферации, дифференцировки и апоптоза клеток, коагуляции и метаболизма липидов (cм. таблицу) [13–15].
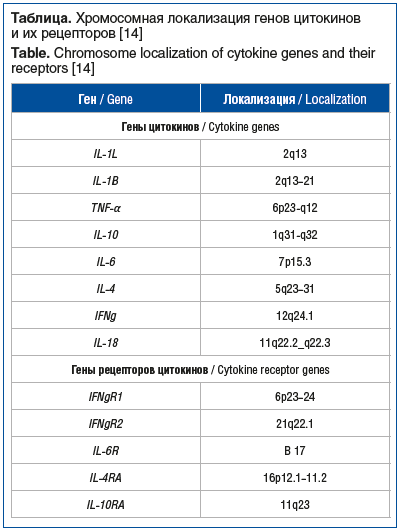
Промоторная область гена TNF-α включает 8 полиморфных участков с единичными нуклеотидными заменами: -1031T>C, -863C>A, -857C>T, -575G>A, -376G>A, -308G>A, -244G>A, -238G>A, но наиболее значимыми считаются однонуклеотидные замены гуанина на аденин в позициях -308 и -238, которые вызывают изменения уровня продукции TNF-α. Так, выявление полиморфного аллеля TNF-α -308*А при малярии является фактором высокого риска формирования церебральной формы инфекции [16], а наличие хотя бы одной копии аллеля -308*А в геноме ребенка с менингококковой инфекцией увеличивает вероятность ее неблагоприятного исхода в 2,5 раза [17, 18]. При этом клетки доноров, гомозиготных по генотипу А/А, синтезируют в 3 раза больше TNF-α, чем клетки лиц с генотипом G/G, а при замене гуанина на аденин, напротив, имеет место снижение продукции данного цитокина.
Функциональный полиморфизм генов, кодирующих белки семейства провоспалительного IL-1 (IL-1β), обусловлен точечными заменами нуклеотидов и тандемными повторами отрезка гена [19], что обусловливает дефекты фагоцитоза и инициации воспаления, ведущие к хронизации инфекционно-воспалительного процесса [20]. Наряду с этим выявленная связь между генетическим полиморфизмом IL-1 и IL-4 в процессе формирования сенсибилизации к антигенам Streptococcus pyogenes существенно увеличивает риск развития осложнений в присутствии данного патогена [21]. Несмотря на недостаточность данных об экспрессии гена IL-4, имеются убедительные сведения о том, что полиморфизм гена IL-4RA (1902А>G) приводит к замене аминокислоты глутамина на аргинин в 551-м положении (551G>A), что может влиять на передачу сигнала IL-4 [22], и присутствие полиморфных вариантов генов IL-4 и IL-17A чаще можно обнаружить у лиц с инфекционно-зависимой бронхиальной астмой (70,2 и 67,5%) [23].
Наиболее изученными членами семейства IL-17 являются IL-17A и IL-17F, в реализации эффектов которых принимают участие олигонуклеотидные полиморфизмы генов IL-17A (rs2275913) и IL-17F (rs763780), ассоциации которых с уровнями IL-17 в сыворотке крови выявлены у женщин с невынашиванием беременности инфекционного генеза [24–26].
Вариабельность концентрации противовоспалительного IL-10 на 50–70% обусловлена генетическими факторами [27]. Cреди полиморфизмов промоторного региона гена IL-10, влияющих на уровни транскрипции мРНК IL-10, наиболее изученными являются SNPs IL-10 А-1082G (rs1800896) и А-592C (rs1800872), ассоциируемые с уровнем продукции данного цитокина, а также с характером течения и исходом различных заболеваний [28, 29].
Hа важную регуляторную роль IFN-γ и полиморфизма его генов в инфекционно-воспалительном процессе указывает дефицит продукции IFN-γ у детей с рецидивирующей инфекцией, сопровождающийся нарушением миграционной функции нейтрофилов и активности естественных киллеров [30]. Существует также предположение, что полиморфизм IFN-γ, способствующий формированию ослабленного противоинфекционного иммунитета, может предотвращать связанные с воспалением заболевания (сердечно-сосудистые, остеоартрит, остеопороз и диабет) [31].
Таким образом, появляется все больше сведений, подтверждающих концепцию о влиянии генетического полиморфизма на восприимчивость к инфекционным заболеваниям и на их исходы. В частности, установлена связь SNPs TNF-α и IL-6 с развитием и исходами сепсиса [32]; между восприимчивостью к тяжелому сепсису и вариантом rs1800629 гена TNF [33]; между генетическими вариантами TNF-рецептор-ассоциированного фактора 6 (TRAF6) и повышенной восприимчивостью к острому повреждению легких, вызванному сепсисом [34]; между генетическими вариантами β2-адренорецептора и повышенной восприимчивостью к бактериальному менингиту [35]; между вариантами генов Toll-подобных рецепторов (TLR) и инфекционными и аутоиммунными заболеваниями [36]; а также между вариабельностью генов IL-17A и чувствительностью к грамположительной инфекции и тяжелым сепсисом [37]. При этом значительная часть генетического компонента инфекционного заболевания может быть связана с кумулятивным эффектом многих редких мутаций с ограниченной пенетрантностью [38], в то время как вероятность того, что какой-либо один ген будет связан с инфекционным заболеванием, весьма низкая [39].
Особый интерес представляет оценка генетических предикторов эндотелиальной дисфункции, среди которых хорошо изученными генами-кандидатами являются гены эндотелина 1, ангиотензин-конвертирующего фермента, ангиотензин-II-рецептора 1-го типа, предрасполагающие к развитию сердечно-сосудистых заболеваний и оказывающие неблагоприятное влияние на их течение [40]. В этой связи важно отметить факт обнаружения ассоциации между экспрессией провоспалительного IL-6, TNF-α и активностью ангиотензина II, что подтверждает положение о вовлеченности провоспалительных цитокинов в процессы развития атеросклероза и формирования эндотелиальной дисфункции [41]. Между тем весьма немногочисленными и требующими более детального анализа являются сведения о влиянии полиморфизмов генов медиаторов воспаления «первой волны» — IL-17A (G197A, rs2275913), IL-1β (T511C, rs16944), TNF-α (G308A, rs1800629) и IL-4 (C589T, rs2243250) на риск развития сердечно-сосудистых заболеваний в мировых популяциях [42, 43].
Роль однонуклеотидного полиморфизма генов цитокинов в развитии ИЭ
До 30–50% случаев ИЭ развиваются без какого-либо очевидного участия классических факторов риска (инвазивные процедуры или эндоваскулярные расстройства), что свидетельствует о возможном вовлечении в патогенез заболевания, а также его осложнений молекулярно-генетических факторов [44]. Как и при других заболеваниях инфекционной природы, инициация и прогресс ИЭ являются следствием сложнейшей связи огромного количества генов с различными факторами окружающей среды, а различия в восприимчивости к ИЭ могут быть связаны с генетической изменчивостью не только организма хозяина, но и микроорганизма, так как изменчивость генов, кодирующих вирулентность S. aureus, его устойчивость к антибиотикам, а также адаптационные возможности организма хозяина, могут способствовать возникновению ИЭ в ходе бактериемии [45].
Весьма немногочисленные молекулярно-генетические исследования ИЭ, проводимые в последнее десятилетие, в основном посвящены изучению ассоциаций ИЭ с полиморфизмом генов системы врожденного иммунитета, среди которых особый интерес представляют экспрессируемые кардиомиоцитами и эндотелиоцитами TLR [46], гены которых обусловливают восприимчивость к бактериальным агентам и могут являться генами-кандидатами ИЭ. В частности, выявлена диагностическая значимость полиморфизма гена TLR-6 (rs3775073), при котором синонимичная мутация в первом экзоне TLR6 приводит к уменьшению риска развития ИЭ в среднем в 2 раза, тогда как несинонимичный полиморфизм в том же экзоне TLR-6 (C745T, rs5743810) связан с увеличением риска развития ИЭ [47].
Известная ключевая роль экспрессии генов про- и противовоспалительных цитокинов в развитии и течении многих патологических процессов в организме человека позволяет предположить, что однонуклеотидные полиморфизмы генов диагностически значимых цитокинов могут также влиять на развитие и течение ИЭ. Так, полиморфизм гена rs1817537 триггерного рецептора миелоидных клеток (TREM-1), контролирующего секрецию ряда провоспалительных цитокинов (IL-1β,IL-6, TNF-α) и хемокинов (IL-8, MCP-1), связан со сниженным риском развития ИЭ [47], тогда как об увеличении риска развития ИЭ у гетерозиготных носителей минорного аллеля Т свидетельствуют маркеры эндотелиальной дисфункции, в частности rs5370 Е-селектина (EDN1) [48].
В настоящее время факт влияния единичных SNPs на инфекционный процесс убедительно доказан в отношении сепсиса и других инфекций кровотока, между тем информация о связи SNPs с индукцией и характером течения ИЭ весьма ограничена [49]. В связи с этим интерес представляют данные M. Weinstock et al. [50] о трех вариантах SNPs цитокинов, которые могут обусловливать восприимчивость к ИЭ: IL-1β c.315C>T; IL-6 c.471+870G>A и IL-6 c. -237C>G). Несмотря на то, что полученные авторами данные о высокой частоте аллеля T варианта «IL-1β c.315C>T» у пациентов с ИЭ не были подтверждены другими исследователями [51], особого внимания заслуживает убедительно доказанное увеличение частоты полиморфизмов гена IL-6 (вариант «c.471+870G>A»), определяющих чувствительность индивидуумов к ИЭ [50].
Для генов таких провоспалительных цитокинов, как TNF и IL-1β, необходимых для регуляции дифференцировки, пролиферации, и апоптоза клеток, существует много SNPs в промоторных и в интронных зонах генов, связанных с уровнем их продукции [13]. При этом снижение риска развития ИЭ ассоциировано не только с генотипом A/G полиморфизма rs1130864 гена СРБ и G-аллелем полиморфизма rs1801197 гена рецептора кальцитонина (CALCR), но и с генотипом G/A полиморфизма rs1143634 гена IL-1β, генотипом G/T полиморфизма rs3212227 гена IL-12B, в то время как выявление гетерозиготных генотипов полиморфизмов (rs1143634 и rs3212227) сопровождалось повышением содержания IL-1β и IL-12 в плазме крови, что указывает на их патогенетическую роль при ИЭ [51, 52]. Кроме того, известно, что TNF посредством связывания со специфическими мембранными рецепторами может вызывать активацию факторов транскрипции, регулирующих гены других провоспалительных цитокинов (IL-1, IL-6), простагландинов, фактора активации тромбоцитов, трансформирующего фактора роста β (TGF-β), некоторых гормонов (адреналина) [53], а носительство аллелей минорной частоты А в -238 промоторной области гена TNF, а также присутствие любого из трех гаплотипов GGA/GAA/AGA было более частым у пациентов с ИЭ [54].
Однако существуют исследования, в которых не удалось подтвердить результаты связи генов IL-6 и TNF с ИЭ, что может быть связано с небольшой выборкой и внутригрупповыми различиями (пол, возраст, этническое происхождение, этиология и клиника заболевания) [55]. Вот почему определение патогенетической связи ИЭ и формирования его осложнений с генетическими факторами остается открытым вопросом, нуждающимся в более глубоком изучении с определением истинного влияния полиморфизма генов расширенного спектра цитокинов в патогенезе ИЭ.
Заключение
Эпоха персонализированной геномной медицины на данном этапе ее развития характеризуется широкими возможностями. Новейшие достижения молекулярной генетики позволяют выделить и исследовать иммуногенетические маркеры у пациентов с различными заболеваниями. Уникальность современной молекулярной медицины заключается в ее нацеленности на разрешение заболевания у конкретного пациента с учетом особенностей его генома, а также профилактику, когда информация о генах получена еще до болезни, что может предотвратить развитие патологического состояния.
Поскольку функционирование цитокиновой сети базируется на механизмах, лежащих в основе регуляции экспрессии генов цитокинов, то изучение таких генетических факторов, как аллельные варианты полиморфных локусов и экспрессия генов цитокинов, как и содержание самих цитокинов в крови, позволит оценить их ключевую роль в патогенезе разных вариантов течения ИЭ, а также определить их прогностическую значимость в отношении развития его тромбоэмболических осложнений. Идентификация генетических вариантов, связанных с инфекционным заболеванием, позволяет на ранней стадии выявить пациентов с более высоким риском неблагоприятного исхода от конкретных заболеваний — пневмонии, ИЭ, сепсиса, острого респираторного дистресс-синдрома и др., что способствует разработке новых, возможно, индивидуально подобранных методов лечения этих пациентов.
Между тем часто встречающаяся противоречивость данных мировой литературы относительно патогенетической роли генетического полиморфизма может быть обусловлена общим недостатком всех генетико-эпидемиологических работ по ИЭ, в частности недостаточной по объему выборкой вследствие сравнительно низкой частоты ИЭ, низкой воспроизводимостью результатов из-за смещения выбора генов-кандидатов, а также влиянием множества других генов и факторов окружающей среды на фенотип, эпигенетику, как и недостаточным представлением о паттернах вариации в геноме человека.
Тем не менее есть надежда, что возможности современных молекулярно-генетических исследований и новые технологии, более доступные с экономической точки зрения, позволят минимизировать влияние перечисленных факторов на результаты исследований и успешно решить проблему диагностики ИЭ и прогноза его возможных осложнений на основе полиморфизма генов патогенетически значимых цитокинов.
Сведения об авторах:
Самойленко Екатерина Сергеевна — аспирант кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0003-3147-0286.
Колесникова Наталья Владиславовна — д.б.н., профессор, профессор кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0002-9773-3408.
Контактная информация: Колесникова Наталья Владиславовна, e-mail: nvk24071954@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в пред- ставленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 13.01.2023.
Поступила после рецензирования 07.02.2023.
Принята в печать 03.03.2023.
About the authors:
Ekaterina S. Samoylenko — post-graduate student of the Department of Clinical Immunology, Allergology and Laboratory Diagnostics of the Faculty of Retraining and Advanced Training, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD0000-0003-3147-0286.
Natalia V. Kolesnikova — Dr. Sc. (Bio.), Professor of the Department of Clinical Immunology, Allergology and Laboratory Diagnostics of the of the Faculty of Retraining and Advanced Training, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0002-9773-3408.
Contact information: Natalia V. Kolesnikova, e-mail: nvk24071954@mail.ru.
Financial Disclosure: no authors have a financial or property
interest in any material or method mentioned. There is no conflict of interests.
2. Moing V.L., Alla F., Doco-Lecompte T. et al. Staphylococcus aureus bloodstream infection and endocarditis — a prospective cohort study. PLoS One. 2015;10(5):e0127385. DOI: 10.1371/journal.pone.0127385.
3. Свистунов А.А., Осадчук М.А. Заболевания миокарда, эндокарда и перикарда. М.: Лаборатория знаний; 2016. [Svistunov A.A., Osadchuk M.A. Diseases of the myocardium, endocardium and pericardium. M.: Laboratoriya znaniy; 2016 (in Russ.)].
4. Habib G., Lancellotti P., Antunes M.J. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015;36(44):3075–3128. DOI: 10.1093/eurheartj/ehv319.
5. Schwarz C., Hoerr V., Tore Y. et al. Isolating Crucial Steps in Induction of Infective Endocarditis With Preclinical Modeling of Host Pathogen Interaction. Front Microbiol. 2020;11(1325):1–14. DOI: 10.3389/fmicb.2020.01325.
6. Hoen B., Duval X. Infective endocarditis. N Engl J Med. 2013;368(15):1425–1433. DOI: 10.1056/nejmcp1206782.
7. Ризванова Ф.Ф., Пикуза О.И., Файзуллина Р.А. и др. Генетическая диагностика: полиморфизм генов цитокинов. Практическая медицина. 2010;6(45):41–43. [Rizvanova F.F., Pikuza O.I., Fayzullina R.A. et al. Genetic diagnosis: polymorphism of cytokine genes. Practical medicine. 2010;6(45):41–43 (in Russ.)].
8. Орадова А.Ш., Канжигалина З.К., Касенова Р.К. Лабораторная диагностика цитокинов. Вестник КазНМУ. 2015;1:357–360. [Oradova A.Sh., Kanzhigalina Z.K., Kasenova R.K. Laboratory diagnostics of cytokines. Vestnik KazNMU. 2015;1:357–360 (in Russ.)].
9. Бодиенкова Г.М., Титова Ж.В. Роль полиморфизма и экспрессии отдельных генов цитокинов в формировании патологии. Успехи современного естествознания. 2015;1-4:616–620. [Bodienkova G.M., Titova Zh.V. The role of polymorphism and expression of individual cytokine genes in the formation of pathology. Uspekhi sovremennogo yestestvoznaniya. 2015;1-4:616–620 (in Russ.)].
10. Сысоев К.А. Экспрессия мРНК хемокинов и хемокиновых рецепторов и содержание цитокинов в крови здоровых добровольцев. Цитокины и воспаление. 2011;10(3):91–97. [Sysoev K.A. Expression of mRNA of chemokines and chemokine receptors and the content of cytokines in the blood of healthy volunteers. Tsitokiny i vospaleniye. 2011;10(3):91–97 (in Russ.)].
11. Коненков В.И. Цитокиновые полигенные комплексы — маркеры индивидуальной настройки состояния цитокиновой сети здорового человека и пациентов с заболеваниями различной природы. Аллергология и иммунология. 2011;12(2):191–194. [Konenkov V.I. Cytokine polygenic complexes are markers of individual adjustment of the state of the cytokine network of a healthy person and patients with diseases of various nature. Allergology and immunology. 2011;12(2):191–194 (in Russ.)].
12. Пузырева Л.В., Сафонов А.Д. Генетический полиморфизм цитокинов: прошлое и будущее. Инфекция и иммунитет. 2016;6(2):103–108. DOI: 10.15789/2220-7619-2016-2-103-108. [Puzyreva L.V., Safonov A.D. Genetic polymorphism of cytokines: past and future. Russian Journal of Infection and Immunity. 2016;6(2):103–108 (in Russ.)]. DOI: 10.15789/2220-7619-2016-2-103-108.
13. Qidwai T., Khan F. Tumor necrosis factor gene polymorphism and disease prevalence. Scand J Immunol. 2011;74(6):522–547. DOI: 10.1111/j.1365-3083.2011.02602.x.
14. Wang X.M., Lehky T.J., Brell J.M., Dorsey S.G. Discovering cytokines as targets for chemotherapy-induced painful peripheral neuropathy. Cytokine. 2012;59(1):3–9. DOI: 10.1016/j.cyto.2012.03.027.
15. Воронина Е.В., Лобанова Н.В., Яхин И.Р. и др. Роль фактора некроза опухолей-альфа в иммунопатогенезе заболеваний различной этиологии и его значимость в развитии антицитокиновой терапии моноклональными антителами. Медицинская иммунология. 2018;20(6):797–806. DOI: 10.15789/1563-0625-2018-6-797-806. [Voronina E.V., Lobanova N.V., Yakhin I.R. et al. The role of tumor necrosis factor-alpha in the immunopathogenesis of diseases of various etiologies and its significance in the development of anti-cytokine therapy with monoclonal antibodies. Medical immunology. 2018;20(6):797–806 (in Russ.)]. DOI: 10.15789/1563-0625-2018-6-797-806.
16. Leao L., Puty B., Dolabela M.F. et al. Association of cerebral malaria and TNF-α levels: a systematic review. BMC Infect Dis. 2020;20(1):442. DOI: 10.1186/s12879-020-05107-2.
17. Georgescu A.M., Grigorescu B.L., Chirteș I.R. et al. The Relevance of Coding Gene Polymorphysms of Cytokines and Cellular Receptors in Sepsis. J Crit Care Med (Targu Mures). 2017;3(1):5–11. DOI: 10.1515/jccm-2017-0001.
18. Dale A.P., Read R.C. Genetic susceptibility to meningococcal infection. Expert Rev Anti Infect Ther. 2013;11(2):187–199. DOI: 10.1586/eri.12.161.
19. Азнабаева Л.Ф., Шарипова Э.Р., Арефьева Н.А. и др. Патогенетические особенности течения гнойного воспаления верхних дыхательных путей (риносинусита) в зависимости от генетического контроля продукции интерлейкина-1β. Цитокины и воспаление. 2011;10(2):50–55. [Aznabayeva L.F., Sharipova E.R., Arefieva N.A. et al. Pathogenetic features of the course of purulent inflammation of the upper respiratory tract (rhinosinusitis) depending on the genetic control of interleukin-1β production. Cytokines and inflammation. 2011;10(2):50–55 (in Russ.)].
20. Семенюк Д.Ю., Артюшкин С.А., Тимчук Л.Э., Симбирцев А.С. Иммуногенетические и иммунологические маркеры в иммунопатогенезе хронического риносинусита. Российская оториноларингология. 2013;6(67):155–164. [Semenyuk D.Yu., Artyushkin S.A., Timchuk L.E., Simbirtsev A.S. Immunogenetic and immunological markers in the immunopathogenesis of chronic rhinosinusitis. Russian otorhinolaryngology. 2013;6(67):155–164 (in Russ.)].
21. Шабалдин А.В., Шабалдина Е.В., Рязанцев С.В., Симбирцев А.С. Полиморфизм генов семейства интерлейкина-1 и интерлейкина-4 при сенсибилизации детей раннего и дошкольного возраста к Streptococcus pyogenes. Инфекция и иммунитет. 2016;6(1):45–54. DOI: 10.15789/2220-7619-2016-1-45-54. [Shabaldin A.V., Shabaldina E.V., Ryazantsev S.V., Simbirtsev A.S. Polymorphism of genes of the interleukin-1 family of interleukin-4 and during sensitization of children of early and preschool age to pyogenic streptococcus. Russian Journal of Infection and Immunity. 2016;6(1):45–54 (in Russ.)]. DOI: 10.15789/2220-7619-2016-1-45-54.
22. Козловская М.А., Швед Н.Ю., Ярмолинская М. И. и др. Поиск ассоциации и анализ межгенных взаимодействий генов цитокиновой системы (IL-4, IL-4Rα, TNF-α, RANTES) при эндометриозе. Медицинская генетика. 2012;11(9):10–18. [Kozlovskaya M.A., Shved N.Yu., Yarmolinskaya M. I. et al. Association search and analysis of intergenic interactions of cytokine system genes (IL-4, IL-4Ra, TNF-α, RANTES) in endometriosis. Medical Genetics. 2012;11(9):10–18 (in Russ.)].
23. Костина Е.М., Молотилов Б.А., Левашова О.А. и др. Изучение полиморфизма генов цитокинов IL-4, IL-10, IL-17A и TNFA у больных с инфекционно-зависимой бронхиальной астмой. Иммунопатология, аллергология, инфектология. 2013;1:53–58. [Kostina E.M., Molotilov B.A., Levashova O.A. et al. The study of polymorphism of cytokine genes IL-4, IL-10, IL-17A and TNFA in patients with infectious dependent bronchial asthma. Immunopathology, allergology, infectology. 2013;1:53–58 (in Russ.)].
24. Логинова Ю.В., Абрамовских О.С., Никонова Т.И. Определение частот полиморфизмов генов IL-17A И IL-17F у женщин с невынашиванием беременности. Российский иммунологический журнал. 2019;13(22):377–379. DOI: 10.31857/S102872210006633-1. [Loginova Yu.V., Abramovskikh O.S., Nikonova T.I. Determination of the frequencies of IL17A and IL17F gene polymorphisms in women with miscarriage. Russian Journal of Immunology. 2019;13(22):377–379 (in Russ.)]. DOI: 10.31857/S102872210006633-1.
25. Najafi S., Hadinedoushan H., Eslami G., Aflatoonian A. Association of IL-17A and IL-17 F gene polymorphisms with recurrent pregnancy loss in Iranian women. J Assist Reprod Genet. 2014;31:1491–1496. DOI: 10.1007/s10815-014-0294-0.
26. Питиримова Л.Н., Загороднева Е.А., Гумилевский Б.Ю. Особенности аллельного полиморфизма генов интерлейкинов и цитокиновый баланс женщин с невынашиванием беременности. Акушерство и гинекология. 2014;3:33–38. [Pitirimova L.N., Zagorodneva E.A., Gumilevsky B.Yu. Specific features of allelic polymorphism of the interleukin genes and the cytokine balance in women with miscarriage. Obstetrics and gynecology. 2014;3:33–38 (in Russ.)].
27. Rose-John S., Schooltink H. Cytokines are a therapeutic target for the prevention of inflammation-induced cancers. Recent Results Cancer Res. 2007;174:57–66. DOI: 10.1007/978-3-540-37696-5_5.
28. Милеева П.Л., Воронин Д.Н., Бойко Е.Л., Фетисова И.Н. Продукция IL-10 плацентарными макрофагами в зависимости от полиморфизма IL-10. Российский иммунологический журнал. 2019;13(2):409–410. DOI: 10.31857/S102872210006913-9. [Mileyeva P.L., Voronin D.N., Boyko Y.L., Fetisova I.N. IL-10 production by placental macrophages in dependence to IL-10 polymorphism. Russian Journal of Immunology. 2019;13(2):409–410 (in Russ.)]. DOI: 10.31857/S102872210006913-9.
29. Song L., Zhong M. Association between Interleukin-10 gene polymorphisms and risk of early-onset preeclampsia. Int J Clin Exp Pathol. 2015;8(9):11659–11664. PMID: 2661790.
30. Волынец Г.В., Беляев Д.Л., Филатов Ф.П. и др. Воспалительные заболевания кишечника и хронические активные герпесвирусные инфекции у детей. Детские инфекции. 2015;14(2):16–22. DOI: 10.22627/2072-8107-2015-14-2-16-22. [Volynets G.V., Belyaev D.L., Filatov F.P. et al. Inflammatory bowel disease and chronic active herpesvirus infections in children. Children infections. 2015;14(2):16–22 (in Russ.)]. DOI: 10.22627/2072-8107-2015-14-2-16-22.
31. Szkup M., Owczarek A.J., Lubkowska A. et al. Searching for the Role of the IFNγ rs2430561 Polymorphism in Inducible Inflammation: Contribution to Metabolic Syndrome in 45 to 60-Year-Old Women. Int J Environ Res Public Health. 2019;16(5):884. DOI: 10.3390/ijerph16050884.
32. Hu P., Chen Y., Pang J., Chen X. Association between IL-6 polymorphisms and sepsis. Innate Immun. 2019;25(8):465–472. DOI: 10.1177/1753425919872818.
33. Song Z., Song Y., Yin J. et al. Genetic variation in the TNF gene is associated with susceptibility to severe sepsis, but not with mortality. PLoS One. 2012;7(9):e46113. DOI: 10.1371/journal.pone.0046113.
34. Song Z., Yao C., Yin J. et al. Genetic variation in the TNF receptorassociated factor 6 gene is associated with susceptibility to sepsis-induced acute lung injury. J Transl Med. 2012;10:166. DOI: 10.1186/1479-5876-10-166.
35. Adriani K.S., Brouwer M.C., Baas F. et al. Genetic variation in the beta2-adrenocepter gene is associated with susceptibility to bacterial meningitis in adults. PLoS ONE. 2012;7(5):e37618. DOI: 10.1371/journal.pone.0037618.
36. Netea M.G., Wijmenga C., O'Neill L.A. Genetic variation in Toll-like receptors and disease susceptibility. Nat Immunol. 2012;13(6):535–542. DOI: 10.1038/ni.2284.
37. Nakada T.A., Russell J.A., Boyd J.H. et al. IL17A genetic variation is associated with altered susceptibility to Gram-positive infection and mortality of severe sepsis. Crit Care. 2011;15(5):R254. DOI: 10.1186/cc10515.
38. Gorlov I.P., Gorlova O.Y., Frazier M.L. et al. Evolutionary evidence of the effect of rare variants on disease etiology. Clin Genet. 2011;79(3):199–206. DOI: 10.1111/j.1399-0004.2010.01535.x.
39. Pan Y.R., Wu C.E., Wang Y.C. et al. Establishment of a novel gene panel as a biomarker of immune checkpoint inhibitor response. Clin Transl Immunology. 2020;9(7):e1145. DOI: 10.1002/cti2.1145.
40. Ашканова Т.М., Муженя Д.В., Пшидаток А.Р. и др. Прогностическая роль A1166C полиморфизмов гена рецептора 1 типа ангиотензина II (AGT2R1) при коронарном атеросклерозе у жителей Республики Адыгея. Российский кардиологический журнал. 2015;10(126):19–23. DOI: 10.15829/1560-4071-2015-10-19-23. [Ashkanova T.M., Muzhenya D.V., Pshidatok A.R. et al. Prognostic role of A1166C polymorphisms of the angiotensine II receptor gene (AGT2R1) in coronary atherosclerosis among Adyghea Republic inhabitants. Russ J Cardiol. 2015;10(126):19–23 (in Russ.)]. DOI: 10.15829/1560-4071-2015-10-19-23.
41. Минушкина Л.О., Асейчева О.Ю., Кочкина М.С. и др. Генетический полиморфизм генов цитокинов системы воспаления и состояние сосудистой стенки у больных артериальной гипертензией. Артериальная гипертензия. 2017;23(2):103–111. DOI: 10.18705/1607-419X-2017-23-2-103-111. [Minushkina L.O., Aseycheva O.Yu., Kochkina M.S. et al. Genetic polymorphism of the inflammatory cytokine genes and arterial wall properties in hypertensive patients. Arterial'naya Gipertenziya (Arterial Hypertension). 2017;23(2):103–111 (in Russ.)]. DOI: 10.18705/1607-419X-2017-23-2-103-111.
42. Тугуз А.Р., Шумилов Д.С., Муженя Д.В. и др. Дисбаланс субпопуляций NK-клеток и полиморфизмы генов провоспалительных цитокинов в патогенезе атеросклероза. Медицинская иммунология. 2022;24(1):135–146. DOI: 10.15789/1563-0625-ION-2361. [Tuguz A.R., Shumilov D.S., Muzhenya D.V. et al. Imbalance of NK cell subpopulations and polymorphisms of proinflammatory cytokine genes in the pathogenesis of atherosclerosis. Medical Immunology (Russia). 2022;24(1):135–146 (in Russ.)]. DOI: 10.15789/1563-0625-ION-2361.
43. Ramji D.P., Davies T.S. Cytokines in atherosclerosis: Key players in all stages of disease and promising therapeutic targets. Cytokine Growth Factor Rev. 2015;26(6):673–685. DOI: 10.1016/j.cytogfr.2015.04.003.
44. Данилов А.И., Алексеева И.В., Аснер Т.В. и др. Представления российских врачей об этиологии, диагностике и терапии инфекционного эндокардита. Клиническая микробиология и антимикробная химиотерапия. 2014;16(1):26–32. [Danilov A.I., Alekseeva I.V., Asner T.V. et al. Level of Knowledge of Medical Specialists on the Etiology, Diagnosis and Treatment of Infectious Endocarditis in Russia. Clinical Microbiology and Antimicrobial Chemotherapy. 2014;16(1):26–32 (in Russ.)].
45. Moing V.L., Alla F., Doco-Lecompte T. et al. Staphylococcus aureus bloodstream infection and endocarditis — a prospective cohort study. PLoS One. 2015;10(5):e0127385. DOI: 10.1371/journal.pone.0127385.
46. Bustamante J., Tamayo E., Florez S. et al. Toll-Like Receptor 2 R753Q Polymorphisms Are Associated With an Increased Risk of Infective Endocarditis. Rev Esp Cardiol. 2011;64(11):1056–1059. DOI: 10.1016/j.recesp.2011.02.024.
47. Понасенко А.В., Кутехин А.Г., Хуторная М.В. и др. Связь полиморфизмов генов системы TLR с риском развития инфекционного эндокардита. Медицина в Кузбасе. 2015;4(14):4–9. [Ponasenko A.V., Kutikhin A.G., Khutornaya M.V. et al. Polymorphisms within the genes encoding toll-like receptors and risk of infective endocarditis. Medicine in Kuzbass. 2015;4(14):4–9 (in Russ.)].
48. Понасенко А.В., Цепокина А.В., Кутихин А.Г. и др. Полиморфизм генов белков, связанных с функцией эндотелия, у пациентов с инфекционным эндокардитом. Российский кардиологический журнал. 2018;23(10):88–96. DOI: 10.15829/1560-4071-2018-10-88-96. [Ponasenko A.V., Tsepokina A.V., Kutixin A.G., Kudryavtseva Yu.A. Polymorphism of protein genes associated with endothelial function in patients with infective endocarditis. Russian Journal of Cardiology. 2018;23(10):88–96 (in Russ.)]. DOI: 10.15829/1560-4071-2018-10-88-96.
49. Чадаева И.В., Рассказов Д.А., Шарыпова Е.Б. и др. Кандидатные SNP-маркеры социального доминирования, способные влиять на сродство ТАТА-связывающего белка к промоторам генов человека. Вавиловский журнал генетики и селекции. 2016;20(6):787–796. DOI: 10.18699/VJ16.196. [Chadaeva I.V., Rasskazov D.A., Sharypova E.B. et al. Candidate SNP markers of social dominance, which may affect the affinity of the TATA-binding protein for human gene promoters. Vavilovskii Zhurnal Genetiki i Selektsii=Vavilov Journal of Genetics and Breeding. 2016;20(6):787–796 (in Russ.)]. DOI: 10.18699/VJ16.196.
50. Weinstock M., Grimm I., Dreier J. et al. Genetic variants in genes of the inflammatory response in association with infective endocarditis. PLoS One. 2014;9(10):e110151. DOI: 10.1371/journal.pone.0110151.
51. Ponasenko A.V., Kutikhin A.G., Khutornaya M.V. et al. Inherited variation in cytokine, acute phase response, and calcium metabolism genes affects susceptibility to infective endocarditis. Mediators Inflamm. 2017;2017:7962546. DOI: 10.1155/2017/7962546.
52. Golovkin A.S., Ponasenko A.V., Yuzhalin A.E. et al. An association between single nucleotide polymorphisms within TLR and TREM-1 genes and infective endocarditis. Cytokine. 2015;71(1):16–21. DOI: 10.1016/j.cyto.2014.08.001.
53. Салина Т.Ю., Морозова Т.И. Продукция фактора некроза опухоли-α мононуклеарными клетками крови при разных клинических вариантах саркоидоза. Пульмонология. 2013;3:89–92. DOI: 10.18093/0869-0189-2013-0-3-89-92. [Salina T.Yu., Morozova T.I. Tumor necrosis factor-α production by blood mononuclear cells in different manifestations of sarcoidosis. Pulmonologiya. 2013;(3):89–92 (in Russ.)]. DOI: 10.18093/0869-0189-2013-0-3-89-92.
54. Giannitsioti E., Damoraki G., Rokkas C. et al. Impact of haplotypes of TNF in the natural course of infective endocarditis. Clin Microbiol Infect. 2014;20(5):459–464. DOI: 10.1111/1469-0691.12370.
55. Gupta K., Jagadeesan N., Agrawal N. et al. Clinical, echocardiographic and microbiological study, and analysis of outcomes of infective endocarditis in tropical countries: a prospective analysis from India. J Heart Valve Dis. 2014;23(5):624–632. PMID: 25799713.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
