Волчаночноподобные дерматологические «маски» анапластической крупноклеточной лимфомы кожи
Системная красная волчанка (СКВ) характеризуется широким спектром клинических проявлений, что диктует необходимость проведения тщательной дифференциальной диагностики СКВ с другими заболеваниями. Особое место при этом занимают свойственные СКВ поражения кожи. Иногда волчаночноподобные изменения кожи могут маскировать дебют других заболеваний, в т. ч. онкогематологических. Пример такого случая приведен в статье.
К ревматологу направлена женщина 40 лет, у которой дерматологом заподозрена СКВ. Из анамнеза известно, что 6 мес. назад во время отдыха в палаточном лагере простудилась. Через 1 мес. появились слизисто-гнойные выделения из носовых ходов, а чуть позже в носовой и ротовой полости — безболезненные язвочки. В последующем у пациентки развился отек правой молочной железы с диффузным уплотнением тканей и покраснением кожи, подобным рожистому воспалению. Наблюдалось умеренное увеличение переднешейных и подмышечных лимфоузлов. Больная была направлена на консультацию к онкологу-маммологу, который на основании ультразвукового и маммографического исследований диагноз «рак молочной железы» отверг и направил пациентку на консультацию к дерматологу. После проведенных исследований дерматолог на основании двустороннего поражения ткани молочной железы, наличия участков эритемы кожи в области туловища, незначительной гиперемии кожи в области щек, увеличения периферических регионарных лимфоузлов, язв слизистых оболочек полости рта и носа, выпадения волос, похудания за время болезни на 7 кг заподозрил у пациентки дебют СКВ. Рекомендованные ревматологом иммунологические исследования диагноз СКВ у пациентки не подтвердили, что явилось основанием для проведения биопсии молочной железы. Совокупность гистологических и иммуногистохимических данных, полученных при исследовании биопсийного материала, позволила диагностировать у пациентки первичную анапластическую крупноклеточную лимфому с поражением ткани молочной железы. В целом с момента первого обращения к врачу до постановки точного диагноза
прошло 6 мес.
Ключевые слова: системная красная волчанка, поражение кожи и слизистых, рак молочной железы, анапластическая крупноклеточная лимфома, диагностические ошибки.
Для цитирования: Башкова И.Б., Мадянов И.В. Волчаночноподобные дерматологические «маски» анапластической крупноклеточной лимфомы кожи. РМЖ. Медицинское обозрение. 2020;28(7):24-27.
Lupus-like dermatological “masks” of cutaneous anaplastic large-cell lymphoma
I.B. Bashkova1,2, I.V. Madyanov1,3
1I.N. Ulianov Chuvash State University, Cheboksary
2Federal Center for Traumatology, Orthopedics and Arthroplasty, Cheboksary
3“The Postgraduate Doctors’ Training Institute”, Cheboksary
The systemic lupus erythematosus (SLE) is characterized by a wide range of clinical manifestations, which dictates the need for thorough differential diagnosis of SLE with other diseases. A special place in this case is occupied by skin lesions peculiar to SLE. Sometimes cutaneous lupus-like changes can mask the onset of other diseases, including oncohematological ones. The article gives an example of such a case.
A 40-year-old female patient whose dermatologist suspected SLE was referred to a rheumatologist. From medical history, it was known that 6 months ago during rest in camping site she caught a cold. A month later, mucopurulent discharge from the nasal passages occurred. Later, painless ulcers appeared in the nasal and oral cavity. Subsequently, right mammary gland swelling with diffuse induration and skin redness, similar to erysipelas, occurred. There was a moderate increase in the antero-cervical and axillary lymph nodes. The patient was referred for consultation to an oncologist-mammologist, who rejected the diagnosis of breast cancer based on ultrasound and mammography results and referred the patient to a dermatologist for consultation. After the research, the dermatologist suspected the onset of SLE on the basis of bilateral lesions in breast tissue, cutaneous erythema on the trunk, mild cutaneous hyperemia on the cheeks, increase in peripheral regional lym ph nodes, ulcers of the mucous membranes in the oral and nasal cavity, hair loss, weight loss during the disease by 7 kg. The immunological tests recommended by the rheumatologist did not confirm SLE in the female patient, which was the reason for conducting a breast biopsy. The combination of histological and immunohistochemical data obtained during the study of the biopsy material made it possible to diagnose primary anaplastic large-cell lymphoma with breast tissue lesions in the patient. In general, it took 6 months from the first visit to the doctors to establish a precise diagnosis.
Keywords: systemic lupus erythematosus, cutaneous and mucosal lesions, breast cancer, anaplastic large-cell lymphoma, diagnostic errors.
For citation: Bashkova I.B., Madyanov I.V. Lupus-like dermatological “masks” of cutaneous anaplastic large-cell lymphoma. RMJ. 2020;7:24–27.
Введение
Системная красная волчанка (СКВ) — аутоиммунное ревматическое заболевание, характеризующееся широким спектром клинических проявлений и непредсказуемым течением, поражающее любые органы и системы [1]. Дебютировать СКВ может с необъяснимой лихорадки, быстрого похудания, поражения кожи, артралгий/артрита, синдрома Рейно, серозитов, почечной патологии, гематологических (анемия, лейкопения, тромбоцитопения) или психоневрологических (судороги или психоз) нарушений, рецидивирующих тромбозов [2].
Многообразие дебютов, клинических проявлений и вариантов течения нередко вызывает трудности дифференциальной диагностики СКВ с другими заболеваниями. По мнению Н.Г. Клюквиной, существует около 50 заболеваний, течение которых похоже на течение СКВ, особенно на начальных стадиях. Нужно проводить дифференциальную диагностику СКВ с другими ревматическими заболеваниями (ранний ревматоидный артрит, ювенильный хронический артрит, системные васкулиты, системная склеродермия, идиопатические воспалительные миопатии, первичный антифосфолипидный синдром, лекарственная волчанка, фибромиалгия), с инфекционными заболеваниями (болезнь Лайма, туберкулез, бактериальный эндокардит, менингиты, инфекционный мононуклеоз, ВИЧ-инфекция, сифилис, вирусные гепатиты, вирусные артриты), а также с воспалительными заболеваниями кишечника, идиопатической тромбоцитопенической пурпурой, гемолитической анемией, лимфопролиферативными опухолями, саркоидозом и паранеопластическим синдромом [3]. Таким образом, СКВ справедливо называют болезнью-«хамелеоном» или «великим имитатором».
Подтвердить или опровергнуть диагноз СКВ позволяет знание характерных особенностей клинической картины, а также гематологических и иммунологических нарушений при СКВ. И тем не менее даже этих знаний бывает недостаточно для своевременной диагностики СКВ. В отдельных случаях, наоборот, чрезвычайное «увлечение» диагнозом СКВ в силу многообразия ее клинических проявлений способно заметно затруднить своевременную диагностику других серьезных заболеваний, которые могут дебютировать волчаночоподобными проявлениями, в т. ч. со стороны кожи.
В качестве примера, демонстрирующего трудности постановки основного диагноза при наличии у пациента в дебюте волчаночноподобных поражений кожи, приводим клиническое наблюдение.
Клиническое наблюдение
Больная К., 40 лет, обратилась на консультацию к ревматологу с жалобами на заложенность носа, гнойные выделения из носовых ходов, появление безболезненных язвочек в полости рта, чувство «жжения» в правой половине лица, отечность и покраснение в сосково-ареолярной области молочных желез с обеих сторон, больше справа, покашливание по утрам, выпадение волос, похудание на 7 кг за 6 мес.
Из анамнеза известно, что полгода назад, в августе 2017 г., в течение нескольких дней отдыхала с семьей в палаточном лагере на берегу озера, где постоянно подвергалась укусам насекомых, от которых зудела кожа. Особого значения этому не придавала, использовала кремы для защиты кожи от укусов. К концу отдыха на природе пациентка отмечала катаральные явления в носоглотке («простудилась») с гастроинтестинальными проявлениями (вздутие живота, диарея), что предположительно можно было расценить как ротавирусную инфекцию. Через 1 мес. гастроинтестинальные явления возобновились в более легкой форме, но уже сопровождались заложенностью носа, слизисто-гнойными выделениями из носовых ходов, а чуть позже в полости носа появились язвочки, покрытые гнойными корочками. Через несколько дней безболезненные язвочки стали формироваться в ротовой полости. Обратилась к отоларингологу, который направил пациентку на компьютерную томографию (КТ) придаточных пазух носа. На основании клинических данных, в т. ч. результатов КТ (тотальное затемнение обеих верхнечелюстных пазух), отоларингологом был диагностирован двусторонний гнойный гайморит, по поводу которого пациентка получала цефтриаксон в дозе 1,0 г/сут на протяжении 10 дней. Эффект от антибактериальной терапии был незначительным.
В октябре 2017 г. впервые заметила небольшой участок эритемы в области соска правой молочной железы с последующим быстрым распространением эритемы на ареолярную область и появлением новых эритематозных очагов. При осмотре отмечался отек правой молочной железы с неоднородным бугристым уплотнением тканей в месте поражения и покраснением кожи груди с синюшным оттенком, подобным рожистому воспалению. На коже туловища, конечностей, левой молочной железы — рассеянные эритематозные элементы в диаметре до 2 см, вокруг ареолы левой железы — застойная гиперемия, местами с уплотнением (рис. 1). Также наблюдалось умеренное увеличение переднешейных, надключичных и подмышечных лимфоузлов. С подозрением на отечно-инфильтративную форму злокачественного новообразования молочной железы пациентка была отправлена на консультацию к онкологу-маммологу, который по результатам ультразвукового и маммографического исследований (отсутствие очаговых образований) отверг диагноз «рак молочной железы». Биопсия молочной железы не проводилась. Были рекомендованы неспецифическая антибактериальная терапия (комбинированный препарат амоксициллина и клавулановой кислоты) и консультация дерматолога.
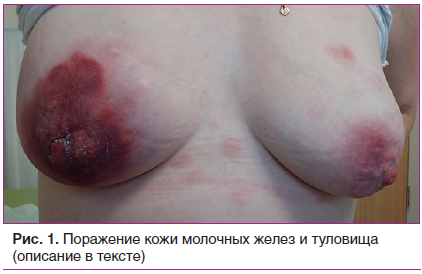
В общем анализе крови на тот момент имели место нормохромная анемия (гемоглобин 105 г/л), лейкопения (3,4×109/л), относительная лимфопения, СОЭ (по методу Панченкова) равнялось 26 мм/ч. Уровень С-реактивного белка (СРБ) составил 6 мг/л. Учитывая двустороннее поражение ткани молочной железы, наличие участков эритемы кожи в области туловища, незначительную гиперемию кожи в области щек, увеличение периферических регионарных лимфоузлов, язвы слизистых оболочек полости рта и носа, не купирующиеся антибиотиками, выпадение волос, похудание за время болезни на 7 кг, гематологические нарушения, у пациентки заподозрили дебют СКВ. При этом поражение кожи молочной железы расценивалось как соответствующее васкулиту кожи в рамках диффузного заболевания соединительной ткани. Поэтому дерматологом был выставлен диагноз «СКВ с поражением кожи», пациентке было рекомендовано обратиться к ревматологу.
В этой связи заметим, что в классификационных критериях СКВ (Systemic Lupus International Collaborating Clinics, SLICC) 2012 г. учитываются следующие варианты поражения кожи:
острое, активное поражение кожи:сыпь на скулах;
буллезные высыпания;
токсический эпидермальный некроз;
макулопапулезная сыпь;
фотосенсибилизация;
подострая кожная волчанка (неиндурированные псориазоформные и/или круговые полициклические повреждения, которые проходят без образования рубцов, но с возможной поствоспалительной депигментацией или телеангиэктазиями);
хроническая кожная волчанка:классическая дискоидная сыпь (локализованная и генерализованная);
гипертрофические (бородавчатые) поражения кожи;
панникулит;
поражение слизистых оболочек;
отечные эритематозные бляшки на туловище;
капилляриты;
дискоидная красная волчанка по типу красного плоского лишая [1].
При консультации пациентки и ознакомлении со всеми имеющимися данными обследования, включая дерматологические поражения, нам для подтверждения диагноза СКВ необходимо было провести дополнительные исследования. Дело в том, что, согласно современным требованиям (классификационные критерии SLICC, 2012), для установления диагноза СКВ необходимо наличие четырех критериев, из которых должно быть не менее одного клинического проявления и одного иммунологического показателя. Таким образом, без иммунологического критерия, отсутствующего у больной на момент нашей консультации, диагноз СКВ был неправомочен. Поэтому пациентка в рамках диагностики системного ревматического исследования прошла соответствующие иммунологические исследования [1], результаты которых не подтвердили диагноз СКВ. В частности, оказались отрицательными антинуклеарные антитела, антитела к двуспиральной ДНК класса IgG (3,9 Ед/мл), Smith-антигену (0,1 Ед/мл), антинейтрофильные цитоплазматические антитела (0,1 Ед/мл), антифосфолипидные антитела. Не был повышен ревматоидный фактор (1 Ед/мл). С3-, С4-фракции комплемента оказались в пределах референсных значений, была отрицательной реакция Вассермана. Поэтому дальнейшие исследования были направлены на поиск других причин (патологий), объясняющих столь своеобразное клиническое течение заболевания у женщины.
Антитела к ВИЧ, тестируемые онкомаркеры (раково-эмбриональный антиген, СА 125, СА 15.3, СА 19.9, СА 72.4), маркеры парентеральных вирусных гепатитов не обнаружены. Диаскинтест® — отрицательный. При проведении рентгенографии органов грудной клетки очагово-инфильтративных изменений в легочных полях не выявлено. Зафиксированы ультразвуковые признаки умеренного увеличения и диффузных изменений печени и селезенки без реакции внутрибрюшных лимфоузлов.
Для уточнения причины поражения кожи была проведена биопсия молочной железы. При гистологическом исследовании биопсийного материала определялась диффузная инфильтрация атипическими клетками с крупными гиперхромными эксцентрично расположенными ядрами и скудной цитоплазмой; поверхность кожи была очагово изъязвлена, в эпидермисе выявлялись признаки акантоза и гиперкератоза. Атипичные (крупные анапластические) клетки инфильтрировали эпидермис. При иммуногистохимическом исследовании в большинстве опухолевых клеток выявлена выраженная экспрессия антигенов CD30, CD4, CD3, а экспрессия антигенов CD5, CD8, CD20, ALK (киназа анапластической лимфомы) отсутствовала. Индекс пролиферативной активности Ki-67 составил 65% позитивных клеток опухолевого субстрата.
Совокупность полученных гистологических и иммуногистохимических данных соответствовала первичной кожной анапластической крупноклеточной лимфоме — одной из разновидностей злокачественных (неходжкинских) лимфом при раке молочной железы. Пациентка для дальнейшей курации была передана врачам-онкогематологам. Первым этапом лечения явилось проведение адъювантной химиотерапии — режим CHOP (циклофосфамид, доксорубицин, винкристин, преднизолон), не менее 6 курсов.
Обсуждение
В связи с установленным диагнозом уместным будет заметить, что первичная анапластическая крупноклеточная лимфома с поражением ткани молочной железы встречается достаточно редко и составляет около 0,5% от всех новообразований молочной железы и 1,7–2,2% от всех экстранодальных неходжкинских лимфом [4]. Под «первичной» лимфомой подразумевается Т-клеточная лимфома кожи без вовлечения в патологический процесс внутренних органов.
Наиболее частой локализацией анапластической крупноклеточной лимфомы является кожа конечностей, далее в порядке убывания следует кожа головы и шеи, в редких случаях развивается поражение кожи над ареолярной областью [5]. Большинство задокументированных случаев развития анапластической крупноклеточной лимфомы связано с наличием имплантатов молочных желез [6–13]. Считается, что имплантат молочной железы является первичным фактором, инициирующим иммунный ответ. В результате длительной антигенной стимуляции происходит накопление множественных онкогенных мутаций в иммунокомпетентных клетках, что в свою очередь приводит к злокачественной трансформации реактивного процесса [6]. В вышеприведенном случае пациентка косметической/реконструктивной операции с установкой имплантатов в молочные железы не подвергалась.
Весьма интригующими применительно к описанному нами случаю выглядят наблюдения отдельных исследований, предполагающих провоцирующую роль в развитии первичной кожной анапластической крупноклеточной лимфомы такого фактора, как укус насекомых [14, 15]. В частности, L. Lamant et al. приводят пять клинических случаев развития этого грозного заболевания после укуса насекомых [15]. В нашем примере, как было отмечено в анамнезе, больная на отдыхе, после которого начались признаки манифестации заболевания, постоянно подвергалась укусам насекомых, от которых зудела кожа. Предполагается, что укусы насекомых через ряд «передаточных» звеньев, включающих увеличение притока в место укуса CD4+ Т-лимфоцитов, последовательно обусловливают экспрессию онкогенного белка слияния NPM-ALK, что создает предпосылки для неконтролируемой клеточной пролиферации [15].
Вероятно, трудностями верификации первичной кожной лимфомы в нашем случае явилось панникулитоподобное поражение кожи, реакция со стороны периферических лимфоузлов, сопутствующие конституциональные и гематологические нарушения, а также отсутствие своевременного проведения биопсии ткани молочной железы. Касаясь несколько запоздалой диагностики лимфомы кожи в описанном нами случае, следует отметить, что в доступной нам литературе мы нашли лишь единичные описания клинических наблюдений первичных кожных Т-клеточных лимфом, которые протекали под маской СКВ [16, 17].
Таким образом, волчаночноподобные дерматологические «маски» анапластической крупноклеточной лимфомы кожи встречаются нечасто. В то же время практикующему врачу о них следует знать, в т. ч. для того, чтобы своевременно проводить биопсию пораженных тканей сразу после исключения диагноза СКВ.
2. Сигидин Я.А., Гусева Н.Г., Иванова М.М. Диффузные болезни соединительной ткани (Системные ревматические заболевания). М.: Медицина; 2004. [Sigidin Y.A., Guseva N.G., Ivanova M.M. Diffuse diseases connective tissue (Systemic rheumatic diseases). M.: Medicine; 2004 (in Russ.)].
3. Клюквина Н.Г. Системная красная волчанка: многообразие форм и вариантов течения. Современная ревматология. 2011;4:25–30. [Klyukvina N.G. Systemic lupus erythematosus: variety of forms and variants of the course. Modern Rheumatology Journal. 2011;4:25–30 (in Russ.)].
4. Swerdlow S.H., Campo E., Pileri S.A. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127:2375–2390.
5. Keith L., Herlihy W., Holmes H., Pin P. Breast implantassociated anaplastic large cell lymphoma. Proc. (Bayl. Univ. Med. Cent.). 2017;30:441–442.
6. Чернова Н.Г., Звонков Е.Е., Ковригина А.М. и др. Ассоциированная с имплантатом анапластическая крупноклеточная лимфома молочной железы: описание клинического случая и обзор литературы. Терапевтический архив. 2017;(89)7:93–98. DOI: 10.17116/terarkh201789793-98. [Chernova N.G., Zvonkov E.E., Kovrigina A.M. et al. Breast implant-associated anaplastic large-cell lymphoma: a case report and a review of literature. Therapeutic Archive. 2017;(89)7:93-98 (in Russ.)].
7. Spear S., Largent J., Kaplowitz H. et al. Occurrence of anaplastic large cell lymphoma (ALCL) among large multi-center prospective clinical studies of breast implant patients. Plast. Reconstr. Surg. 2010;126:68.
8. Kim B., Roth C., Chung K.C. et al. Anaplastic large-cell lymphoma and breast implants: a systematic review. Plast. Reconstr. Surg. 2011;127(6):2141–2150. DOI: 10.1097/PRS.0b013e3182172418.
9. Kim B., Roth C., Young V.L. et al. Anaplastic large cell lymphoma and breast implants: results from a structured expert consultation process. Plast. Reconstr. Surg. 2011;128(3):629–639. DOI:10.1097/PRS.0b013e31821f9f23.
10. Lazzeri D., Agostini T., Bocci G. et al. ALK-1-negative anaplastic large cell lymphoma associated with breast implants: a new clinical entity. Clin Breast Cancer. 2011;11(5):283–296. DOI: 10.1016/j.clbc.2011.03.020.
11. Story S.K., Schowalter M.K., Geskin L.J. Breast implant-associated ALCL: a unique entity in the spectrum of CD30+ lymphoproliferative disorders. Oncologist. 2013;18(3):301–307. DOI: 10.1634/theoncologist.2012-0238.
12. Xu J., Wei S. Breast implant-associated anaplastic large cell lymphoma: review of a distinct clinicopathologic entity. Arch. Pathol. Lab. Med. 2014;138(6):842–846. DOI: 10.5858/arpa.2013-0068-RS.
13. Ramos-Gallardo G., Cuenca-Pardo J., Rodriguez-Olivares E. et al. Breast implant and anaplastic large cell lymphoma: meta-analysis. J. Invest. Surg. 2017;30:56–65.
14. Bergsten T.M., Principe D.R., Raicu A. et al. Non-implant associated primary cutaneous anaplastic large cell lymphoma of the breast. J. Surg. Case Rep. 2019;5:rjz139. DOI: 10.1093/jscr/rjz139.
15. Lamant L., Pileri S., Sabattini E. et al. Cutaneous presentation of ALK-positive anaplastic large cell lymphoma following insect bites: Evidence for an association in five cases. Haematologica. 2010;95:449–455. DOI: 10.3324/haematol.2009.015024.
16. Dücker L.F., Stutz M., Thieme N. et al. Primary cutaneous gamma-delta T-cell lymphoma with long-term indolent clinical course initially mimicking lupus erythematosus profundus. Frontiers in Oncology. 10.10.3389/fonc.2020.00133. Published: 19 February 2020. DOI: 10.3389/fonc.2020.00133.
17. Yang S., Khera P., Wahlgren C. Cutaneous anaplastic large-cell lymphoma should be evaluated for systemic involvement regardless of ALK-1 status: case reports and review of literature. Am. J. Clin. Dermatol. 2011;12(3):203–209. DOI: 10.2165/11537520-000000000-00000.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

