Влияние пневмококковой вакцинации на риск развития инфекционных осложнений у пациентов с ревматоидным артритом, получающих лечение таргетными противовоспалительными препаратами (данные Московского Единого Регистра Артритов (МЕРА))
Введение: пневмококковые вакцины — 23-валентные полисахаридные вакцины (ППВ23) и 13-валентную конъюгированную вакцину (ПКВ13) рекомендуется применять у большинства пациентов с ревматическими заболеваниями. Однако данные, подтверждающие клиническую эффективность такой вакцинации, ограничены..
Цель исследования: оценить влияние вакцинации пневмококковыми вакцинами (ППВ23 и ПКВ13) пациентов с ревматоидным артритом (РА), получающих генно-инженерные биологические препараты (ГИБП) и таргетные синтетические базисные противовоспалительные препараты (тсБПВП), на риск развития инфекционных нежелательных явлений различных категорий в условиях реальной клинической практики..
Материал и методы: проведен анализ данных Московского Единого Регистра Артритов за 2018–2020 гг. Включали пациентов с РА старше 18 лет, получающих ГИБП или тсБПВП. Изучались все инфекционные, респираторные инфекционные и серьезные инфекционные события за один и тот же временной период у вакцинированных и невакцинированных пациентов.
Результаты исследования: в анализ включено 832 пациента, из которых 40 было вакцинировано ПКВ13, 35 — ППВ23. Длительность наблюдения составила 319±198 дней. Всего было зарегистрировано 237 инфекционных событий, из которых 201 было респираторным и 21 — серьезным.. Среди событий преобладали острые респираторные инфекции (70,0% всех инфекционных и 82,6% респираторных инфекционных событий). Сравнение кривых выживания (log-rank test), а также сравнение пропорционального риска методом Кокса, в том числе с поправкой на важнейшие факторы риска инфекционных событий (возраст и курение), выявило достоверное снижение риска любых инфекционных событий (p=0,012 и p=0,015 соответственно) у пациентов, иммунизированных ПКВ13, в сравнении с невакцинированными.. У этих пациентов отмечено также статистически значимое снижение риска респираторных инфекций (p=0,009 и p=0,014 соответственно). Значимого влияния вакцинации ППВ23 на риск этих событий не установлено. Не было выявлено значимого влияния ни одной из вакцин на вероятность серьезных инфекционных событий.
Заключение: в настоящем исследовании впервые продемонстрирована клиническая эффективность ПКВ13 у пациентов с РА, получающих таргетную противовоспалительную терапию. Эффект был достигнут преимущественно за счет снижения частоты острых респираторных инфекций.
Ключевые слова: ревматоидный артрит, пневмококковая вакцина, пневмония, таргетные противовоспалительные препараты, конфаундеры, курение, возраст.
Для цитирования: Жиляев Е.В., Лукина Г.В., Муртазалиева Д.А., Кольцова Е.Н., Шмидт Е.И., Лыткина К.А., Шмитько А.В., Благовидов Д.А., Костинов М.П. Влияние пневмококковой вакцинации на риск развития инфекционных осложнений у пациентов с ревматоидным артритом, получающих лечение таргетными противовоспалительными препаратами (данные Московского Единого Регистра Артритов (МЕРА)). РМЖ. Медицинское обозрение. 2021;29(7):7-12.
The effect of pneumococcal vaccination on the risk of infectious complications in patients with rheumatoid arthritis treated with targeted anti-inflammatory drugs (data from the Moscow Unified Arthritis Registry (MUAR))
E.V. Zhilyaev1,2,3, G.V. Lukina4,5, D.A. Murtazalieva4, E.N. Koltsova4, E.I. Shmidt6, K.A. Lytkina7, A.V. Shmit’ko8, D.A. Blagovidov8, M.P. Kostinov8,9
1CJSC European Medical Center, Moscow
2Russian Medical Academy of Continuous Professional Education, Moscow
3Pirogov Russian National Research Medical University, Moscow
4Moscow Clinical Scientific Center n.a. A.S. Loginov, Moscow
5Research Institute of Rheumatology named after V.A. Nasonova, Moscow
6City Clinical Hospital No. 1 named after N.I. Pirogov, Moscow
7City Clinical Hospital No. 4, Moscow
8І.І. Mechnikov Research Institute of Vaccines and Sera, Moscow
9I.M. Sechenov First Moscow State Medical University (Sechenov University), Moscow
Background: pneumococcal vaccines — 23-valent pneumococcal polysaccharide vaccine (PPV23) and 13-valent pneumococcal conjugate vaccine (PCV13) are recommended for use in most patients with rheumatic diseases. However, data confirming the clinical efficacy of such vaccination is limited.
Aim: to evaluate the effect of vaccination with pneumococcal vaccines (PPV23 and PCV13) in patients with rheumatoid arthritis (RA) receiving genetically engineered biological drugs (GEBDs) and targeted synthetic disease-modifying anti-rheumatic drugs (tsDMARDs) on the risk of developing infectious adverse events of various categories in real clinical practice.
Patients and methods: data analysis of the Moscow Unified Arthritis Registry (MUAR) for 2018–2020 was conducted. The patients with RA over 18 y.o. receiving GEBD or tsDMARDs were included. All infectious, respiratory infectious and serious infectious events were studied for the same period in vaccinated and unvaccinated patients.
Results: 832 patients were included in the analysis, of which 40 were vaccinated with PCV13, 35 — with PPV23. The follow-up was 319±198 days. A total of 237 infectious events were recorded, of which 201 were respiratory and 21 — serious. Acute respiratory infections prevailed among the events (70.0% of all infectious and 82.6% of respiratory infectious events). Survival curve comparison (log-rank test), as well as a comparison of the Cox proportional hazard regression, including adjusted for the most important risk factors for infectious events (age and smoking), revealed a significant reduction in the risk of any infectious events (p=0.012 and p=0.015, respectively) in patients immunized with PCV13, compared with unvaccinated. These patients also showed a statistically significant reduction in the risk of respiratory infections (p=0.009 and p=0.014, respectively). No significant effect of PPV23 vaccine on the risk of these events has been established. There w as no significant effect of any of the vaccines on the serious infectious event probability.
Conclusion: in this study, the clinical efficacy of PCV13 was demonstrated for the first time in patients with RA receiving therapy with tsDMARDs. The effect was achieved mainly by reducing the incidence of acute respiratory infections.
Keywords: rheumatoid arthritis, pneumococcal vaccine, pneumonia, targeted synthetic disease-modifying anti-rheumatic drugs, confounders, smoking, age.
For citation: Zhilyaev E.V., Lukina G.V., Murtazalieva D.A. et al. The effect of pneumococcal vaccination on the risk of infectious complications in patients with rheumatoid arthritis treated with targeted anti-inflammatory drugs (data from the Moscow Unified Arthritis Registry (MUAR)). RMJ. 2021;7:7–12.
Введение
Инфекции у больных ревматоидным артритом (РА) развиваются в 1,5–2 раза чаще, чем в общей популяции, и занимают 2–3-е место в структуре причин смерти таких пациентов [1, 2]. Риск инфекционных событий еще выше у пациентов, получающих генно-инженерные биологические препараты (ГИБП) или таргетные синтетические базисные противовоспалительные препараты (тсБПВП). В исследованиях, проведенных в условиях реальной клинической практики, риск серьезных инфекций при применении ГИБП возрастал в 1,5–3 раза [3, 4]. Пневмонии — наиболее частые серьезные инфекционные проявления у пациентов с РА. По результатам исследования, проведенного с использованием баз данных Администрации здравоохранения ветеранов США, пневмонии обусловливали 37% всех госпитализаций из-за инфекционных событий [5].
С учетом высоких рисков развития инфекции, в том числе пневмоний, Европейская противоревматическая лига (EULAR) настоятельно рекомендует пневмококковую вакцинацию большинства пациентов с аутоиммунными воспалительными ревматическими заболеваниями, включая лиц с РА. Для этой цели предлагается использовать 23-валентные пневмококковые полисахаридные вакцины (ППВ23) и 13-валентную пневмококковую конъюгированную вакцину (ПКВ13) [6]. Однако, несмотря на уверенность экспертов о необходимости пневмококковой вакцинации, для подтверждения ее эффективности у пациентов с ревматическими заболеваниями в настоящее время имеющихся данных недостаточно.
Цель исследования: оценить влияние вакцинации пневмококковыми вакцинами (ППВ23 и ПКВ13) пациентов с РА, получающих ГИБП и тсБПВП, на риск развития инфекционных нежелательных явлений различных категорий в условиях реальной клинической практики.
Материал и методы
Проанализированы данные Московского Единого Регистра Артритов за 2018–2020 гг. В регистр включаются пациенты старше 18 лет, получающие таргетные противовоспалительные препараты. В настоящий анализ включались пациенты с РА, соответствующие критериям ACR/EULAR (2010) и получающие ГИБП или синтетический таргетный иммуносупрессор тофацитиниб. Обязательным условием включения в регистр являлось подписание информированного согласия на участие.. Все пациенты наблюдаются в регистре амбулаторно.
Сбор информации о нежелательных явлениях осуществляли методом открытых вопросов. Регистрировали информацию обо всех принимаемых препаратах в любой момент времени в период наблюдения. Анализировали риски следующих событий: любая инфекция, респираторная инфекция, в том числе пневмония, серьезная инфекция. К серьезным относили события, имеющие хотя бы один из следующих признаков: повлекшие смерть или представлявшие угрозу жизни, вызвавшие уродства плода, потребовавшие госпитализации или продления госпитализации, приведшие к стойким функциональным нарушениям [7]. В анализ включали эпизоды наблюдения с момента вакцинации пневмококковой вакциной до момента развития анализируемого события (любая инфекция, респираторная инфекция или серьезная инфекция) или до окончания наблюдения. Для невакцинированных пациентов эпизоды наблюдения начинались со средней даты вакцинации пациентов групп сравнения (20 октября 2018 г.). Сравнивали группы пациентов, получивших ППВ23, ПКВ13, и невакцинированных.
Сравнение рисков развития инфекционных событий осуществлялось с помощью метода Каплана — Майера (log-rank test) и регрессии пропорционального риска по Коксу. При сравнении пропорционального риска вносили поправки на конфаундеры риска инфекционных событий, выявленные в ранее проведенном исследовании: возраст и курение [8].
Результаты исследования
В анализ включено 832 пациента, из которых 40 было вакцинировано ПКВ13, 35 — двумя видами ППВ23. Лица, получившие ППВ23, при анализе были объединены в одну группу. Мужчин было 144 (17,3%). Средний возраст — 55,4±12,1 года. Длительность наблюдения составила 319±198 дней. Подробная характеристика пациентов приведена в таблице 1.
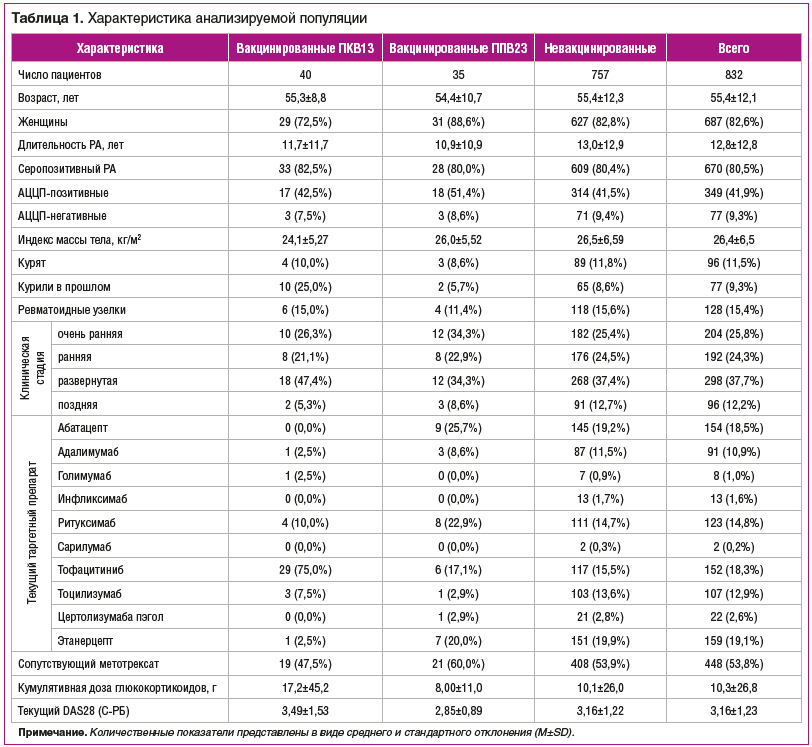
Всего было зарегистрировано 237 инфекционных событий, из которых 201 было респираторным и 21 — серьезным (табл.. 2).
Сравнение срока, прошедшего от вакцинации до возникновения первого инфекционного события, продемонстрировало, что как инфекции в целом, так и респираторные инфекции достоверно позже возникали в группе пациентов, вакцинированных ПКВ13, в сравнении с невакцинированными (p=0,012 и p=0,009 соответственно, log-rank test). Отличие между группами пациентов, вакцинированных ППВ23, и невакцинированных было статистически незначимым. При сравнении сроков наступления первого серьезного события значимых различий между группами выявлено не было.
При сравнении рисков развития инфекционных событий методом Кокса также отмечен достоверно меньший риск развития любой инфекции (относительный риск (ОР) 0,39, 95% доверительный интервал (95% ДИ) 0,18–0,84, p=0,015) и риск респираторной инфекции (ОР 0,32, 95% ДИ от 0,13 до -0,79, p=0,014) в группе пациентов, вакцинированных ПКВ13, в сравнении с невакцинированными.. Различия оставались статистически значимыми и после внесения поправок на наиболее значимые конфаундеры, выявленные в данной популяции в ходе предыдущих исследований (возраст и курение). Кривые выживания, рассчитанные с поправкой на указанные факторы в рамках множественной линейной регрессии пропорционального риска по Коксу, приведены на рисунке 1.
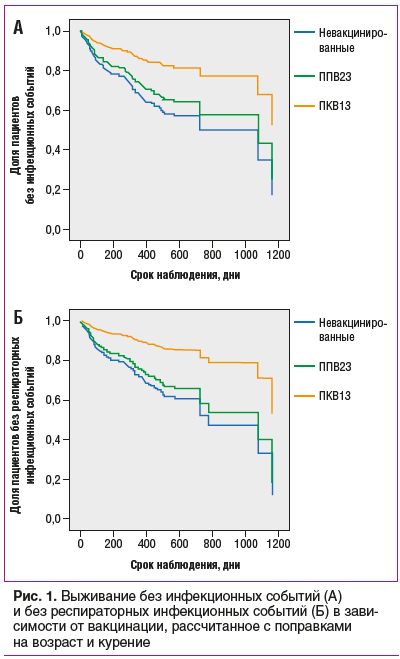
Значимых различий в риске развития серьезных инфекций между тремя группами выявлено не было ввиду небольшого числа событий такого рода. Однако следует отметить, что среди пациентов, вакцинированных ПКВ13, серьезных инфекций зарегистрировано не было.
Обсуждение
Целесообразность вакцинации пациентов с иммуновоспалительными заболеваниями в целом и с РА в частности пневмококковыми вакцинами в настоящее время обусловлена высокой частотой и клинической значимостью пневмоний у таких пациентов, особенно в условиях иммуносупрессивной терапии и с учетом данных об эффективности вакцинации различных контингентов условно здоровых лиц.. Так, клиническая эффективность ПКВ13 в отношении предупреждения пневмококковой пневмонии у лиц в возрасте 65 лет и старше была продемонстрирована в обширном рандомизированном клиническом исследовании CAPITA [9]. Наиболее крупные исследования, проведенные в условиях реальной клинической практики, также продемонстрировали эффективность ПКВ13 в предупреждении как всех пневмоний, так и пневмоний, вызываемых представленными в вакцине серотипами пневмококка [10].
Несомненно, пациенты с РА могут существенно отличаться от общей популяции как по риску развития респираторных инфекций, так и по эффективности вакцинации. Было показано, что иммунизация против пневмококковой инфекции у пациентов как с ревматоидным артритом, так и с ювенильным идиопатическим артритом высокоэффективна, хорошо переносится и не отражается негативно на течении ревматического заболевания [11, 12]. Единственное рандомизированное исследование [13] не смогло подтвердить способность ППВ23 снижать риск развития пневмонии у пациентов с РА. В одном ретроспективном исследовании отмечено достоверное повышение риска развития пневмонии у невакцинированных пациентов с РА, находящихся на лечении метотрексатом, по сравнению с иммунизированными ППВ23 (ОР 9,7, 95% ДИ 3,1–38,7) [14].
Таким образом, настоящее исследование является первым подтверждением клинической эффективности ПКВ13 у пациентов с РА, получающих таргетные противовоспалительные препараты. Исследование проведено в условиях реальной клинической практики на репрезентативной выборке в одно время.. Анализ выполнен с поправками на наиболее значимые конфаундеры, актуальные именно для данной популяции больных. Эти особенности исследования дают основание считать полученные данные вполне достоверными..
Вместе с тем настоящее исследование имеет и ряд существенных ограничений. Проведенный анализ продемонстрировал значительное снижение риска всех инфекционных событий и респираторных инфекционных событий.. С учетом структуры наблюдавшихся инфекций можно утверждать, что снижение их риска происходило преимущественно за счет снижения риска острых инфекций верхних дыхательных путей.. Оценить влияние вакцинации на риск пневмоний и серьезных инфекций не представляется возможным ввиду их небольшого числа.
Тем не менее и снижение риска острых респираторных инфекций ввиду их существенной экономической значимости представляется важным клиническим результатом вакцинации. Кроме того, частые респираторные инфекции нередко становятся поводом к отмене как обычных синтетических, так и таргетных базисных противовоспалительных препаратов.
Заключение
Применение ПКВ13 у пациентов с РА, получающих таргетную противовоспалительную терапию, способно существенно снизить риск инфекционных осложнений, преимущественно за счет острых респираторных инфекций. Полученные данные обосновывают широкое применение указанной вакцины у пациентов с РА. Значимого влияния ППВ23 на риск инфекционных и респираторных событий выявить не удалось. Требуются более масштабные исследования для оценки влияния пневмококковых вакцин на риск серьезных инфекций, включая пневмонии.
2. Sokka T., Abelson B., Pincus T. Mortality in rheumatoid arthritis: 2008 update. Clin Exp Rheumatol. 2008;26(5 Suppl 51):35–61.
3. Askling J., Fored C.M., Brandt L. et al. Time-dependent increase in risk of hospitalisation with infection among Swedish RA patients treated with TNF antagonists [published correction appears in Ann Rheum Dis. 2007;66(11):1548]. Ann Rheum Dis. 2007;66(10):1339–1344. DOI: 10.1136/ard.2006.062760.
4. Cecconi M., Ranza R., Titton D.C. et al. Incidence of Infectious Adverse Events in Patients With Rheumatoid Arthritis and Spondyloarthritis on Biologic Drugs-Data From the Brazilian Registry for Biologics Monitoring. J Clin Rheumatol. 2020;26(2):73–78. DOI: 10.1097/RHU.0000000000000935.
5. Curtis J.R., Yang S., Patkar N.M. et al. Risk of hospitalized bacterial infections associated with biologic treatment among US veterans with rheumatoid arthritis. Arthritis Care Res. 2014;66:990–997. DOI: 10.1002/acr.22281.
6. Furer V., Rondaan C., Heijstek M.W. et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis. 2020;79(1):39–52. DOI: 10.1136/annrheumdis-2019-215882.
7. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use, document E2A. (Electronic resource.) URL: https://database.ich.org/sites/default/files/E2A_Guideline.pdf. (access date: 07.25.2021).
8. Кольцова Е.Н., Лукина Г.В., Шмидт Е.И. и др. Поиск предикторов развития инфекционных нежелательных явлений у пациентов с ревматоидным артритом, получающих генно-инженерные биологические и таргетные синтетические базисные препараты по данным Московского единого регистра артритов (МЕРА). В кн.: Сборник тезисов Всероссийского конгресса с международным участием «Дни ревматологии в Санкт-Петербурге — 2020». СПб.; 2020:92–93. [Koltsova E.N., Lukina G.V., Schmidt E.I. and others. Search for predictors of the development of infectious adverse events in patients with rheumatoid arthritis receiving genetically engineered biological and targeted synthetic basic drugs according to the Moscow Unified Register of Arthritis (MERA). In: Collection of theses of the All-Russian Congress with international participation «Days of rheumatology in St. Petersburg — 2020». SPb.; 2020:92–93 (in Russ.)].
9. Bonten M.J., Huijts S.M., Bolkenbaas M. et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med. 2015;372(12):1114–1125. DOI: 10.1056/NEJMoa1408544.
10. Berild J.D., Winje B.A., Vestrheim D.F. et al. A systematic review of studies published between 2016 and 2019 on the effectiveness and efficacy of pneumococcal vaccination on pneumonia and invasive pneumococcal disease in an elderly population. Pathogens. 2020;9(4):259. DOI: 10.3390/pathogens9040259.
11. Буханова Д.В., Сергеева М.С., Белов Б.С. и др. Иммуногенность и эффективность 23-валентной пневмококковой вакцины у больных ревматоидным артритом: результаты 5-летнего наблюдения. Современная ревматология. 2018;12(4):85–88. [Bukhanova D.V., Sergeeva M.S., Belov B.S. et al. Immunogenicity and efficacy of 23-valent pneumococcal vaccine in patients with rheumatoid arthritis: results of a 5-year follow-up. Sovremennaya revmatologiya. 2018;12(4):85–88 (in Russ.)]. DOI: 10.14412/1996-7012-2018-4-85-88.
12. Алексеева Е.И., Дворяковская Т.М., Денисова Р.В. и др. Иммунизация пневмококковой полисахаридной вакциной детей с ювенильным идиопатическим артритом без системных проявлений: результаты проспективного исследования. Вопросы современной педиатрии. 2017;16(6):493–501. [Alekseeva E.I., Dvoryakovskaya T.M., Denisova R.V. et al. Pneumococcal polysaccharide vaccine immunization of children with juvenile idiopathic arthritis without systemic manifestations: results of a prospective study. Voprosy sovremennoy pediatrii. 2017;16(6):493-501 (in Russ.)]. DOI: 10.15690/vsp.v16i6.1822.
13. Izumi Y., Akazawa M., Akeda Y. et al. The 23-valent pneumococcal polysaccharide vaccine in patients with rheumatoid arthritis: a double-blinded, randomized, placebo-controlled trial. Arthritis Res Ther. 2017;19(1):15. DOI: 10.1186/s13075-016-1207-7.
14. Coulson E., Saravanan V., Hamilton J. et al. Pneumococcal antibody levels after pneumovax in patients with rheumatoid arthritis on methotrexate. Ann Rheum Dis. 2011;70(7):1289–1291. DOI: 10.1136/ard.2010.144451.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
