Современные подходы к лечению острых и хронических болей у пациентов с заболеваниями опорно-двигательного аппарата: фокус на безопасность фармакотерапии
Все заболевания опорно-двигательного аппарата характеризуются развитием хронического болевого синдрома, наиболее частой причиной которого является наличие хронического воспаления синовиальной оболочки. Нестероидные противовоспалительные препараты (НПВП) являются наиболее часто назначаемыми средствами в лечении хронической патологии суставов, а также применяются для купирования острого болевого синдрома. Нимесулид является единственным НПВП, относящимся к классу арилсульфонамидов. В данном обзоре обсуждаются возможности применения нимесулида для лечения хронических и острых болей у пациентов с заболеваниями опорно-двигательного аппарата. Авторы анализируют результаты зарубежных и отечественных рандомизированных и открытых сравнительных исследований, посвященных изучению эффективности и безопасности применения нимесулида при острых и хронических болях у больных с заболеваниями опорно-двигательного аппарата. На основании представленных данных исследователи пришли к выводу, что нимесулид обладает выраженным противовоспалительным и анальгетическим эффектом, высокой скоростью развития обезболивающего эффекта и хорошей переносимостью, в т. ч. у больных с НПВП-гастропатией, метаболическим синдромом, артериальной гипертензией. Применение нимесулида в лекарственной форме «гель для наружного применения» позволяет при комбинации с таблетированной формой достичь большего эффекта, однако не ухудшает переносимость терапии, что особенно актуально для коморбидных пациентов.
Ключевые слова: болезни опорно-двигательного аппарата, нимесулид, Найз, фармакодинамика, эффективность, переносимость, коморбидность.
Для цитирования: Чичасова Н.В., Лила А.М. Современные подходы к лечению острых и хронических болей у пациентов с заболеваниями опорно-двигательного аппарата: фокус на безопасность фармакотерапии. РМЖ. Медицинское обозрение. 2020;28(9):65-70.
Modern methods to the treatment of acute and chronic pain in patients with musculoskeletal disorders: the focus on the pharmacotherapy safety
N.V. Chichasova1,2, A.M. Lila1,2
1Research Institute of Rheumatology named after V.A. Nasonova, Moscow
2Russian Medical Academy of Continuous Professional Education, Moscow
All disorders of the musculoskeletal system are characterized by the development of chronic pain syndrome. The most common cause is the presence of chronic inflammation of the synovial membrane. The first-line means for the treatment of chronic joint pathology are commonly non-steroidal anti-inflammatory drugs (NSAIDs). They are also used to relieve acute pain. Nimesulide is the only NSAID belonging to the class of arylsulfonamides. This review discusses the possibility of using nimesulide in the treatment of chronic and acute pain in patients with musculoskeletal disorders. The authors analyze the results of foreign and national randomized and open comparative studies on the efficacy and safety of nimesulide in acute and chronic pain in patients with musculoskeletal disorders. Based on the presented data, the researchers conclude that nimesulide has a pronounced anti-inflam matory and analgesic effect with the high rate of its action, and good tolerability, including in patients with NSAID gastropathy, metabolic syndrome and hypertension. The use of nimesulide in the dosage form of gel for external use allows to reach a greater effect when combined with the tablet form. It does not worsen the therapy tolerability, which is especially important for comorbid patients.
Keywords: musculoskeletal disorders, nimesulide, Nise, pharmacodynamics, efficacy, tolerance, comorbidity.
For citation: Chichasova N.V., Lila A.M. Modern methods to the treatment of acute and chronic pain in patients with musculoskeletal disorders: the focus on the pharmacotherapy safety. RMJ. 2020;9:65–70.
Введение
Скелетно-мышечные боли — одна из самых частых причин обращения к врачам различных специальностей. В различные периоды жизни боль в связи с поражением компонентов опорно-двигательного аппарата встречается у 20–45% населения, чаще у женщин, чем у мужчин, и в старших возрастных группах [1].
Все заболевания опорно-двигательного аппарата характеризуются развитием хронической боли, наиболее частая причина которой — наличие хронического воспаления синовиальной оболочки. Поэтому нестероидные противовоспалительные препараты (НПВП) являются наиболее часто назначаемыми средствами для лечения хронической патологии суставов. Для лечения острой боли НПВП используются реже, хотя их анальгетический потенциал хорошо известен клиницистам. Применение НПВП, которые мы теперь относим к классу неселективных ингибиторов циклооксигеназы (ЦОГ), сопровождалось развитием нежелательных явлений (НЯ). Изотипы ЦОГ (ЦОГ-1 и ЦОГ-2) были открыты в конце XX в. [1].
В настоящее время имеется большой выбор НПВП, как неселективно ингибирующих ЦОГ-1 и ЦОГ-2, так и преимущественно влияющих на ЦОГ-2, определяющую действие провоспалительных простагландинов (ПГ). Появление селективных в отношении ЦОГ-2 НПВП позволило в значительной мере уменьшить частоту НЯ, в первую очередь со стороны желудочно-кишечного тракта (ЖКТ). Тем не менее в каждом конкретном случае необходимо оценивать факторы риска развития НЯ при приеме НПВП [2]. Назначая НПВП, необходимо выбирать препараты с более благоприятным профилем желудочно-кишечной и сердечно-сосудистой безопасности [2]. Таким образом, ценность того или иного НПВП определяется выраженностью его противовоспалительного и анальгетического действия, скоростью развития эффекта и хорошей переносимостью, особенно при необходимости длительного лечения. В данной статье обсуждаются возможности применения нимесулида при заболеваниях опорно-двигательного аппарата.
Фармакокинетические особенности нимесулида
Особенности структуры нимесулида определяют его возможности в лечении как хронической, так и острой боли, а также его хорошую переносимость. Нимесулид является единственным НПВП, относящимся к классу арилсульфонамидов, и обладает практически нейтральным уровнем кислотности (6,5), что препятствует его удерживанию в слизистой оболочке и захвату митохондриями ее клеток, способствуя меньшей частоте развития повреждения слизистой [3, 4]. Преимущественное ингибирование ЦОГ-2 нимесулидом давно доказано [5]. В терапевтических концентрациях нимесулид оказывает сбалансированное воздействие и на ЦОГ-2, ингибируя в терапевтических дозах 88% ее активности, и на ЦОГ-1, ингибируя 45% ее активности [6]. Однако нимесулид по механизму действия отличается не только от неселективных НПВП, но и от других селективных ингибиторов ЦОГ-2. Отличает его многофакторный механизм действия: помимо подавления синтеза провоспалительных ПГ путем ингибирования ЦОГ-2, нимесулид способен редуцировать освобождение ряда цитокинов, таких как фактор некроза опухоли α, интерлейкин 6 (ИЛ-6), а также уменьшать продукцию оксигенных радикалов и других компонентов активации нейтрофилов, высвобождение гистамина и энзимов, участвующих в деградации хряща (матриксных металлопротеаз) [5–8]. За счет разнообразия механизмов действия нимесулид не только, как и другие селективные НПВП, реже вызывает НЯ со стороны ЖКТ, но и обладает гастропротективным эффектом, предупреждая развитие НПВП-гастропатии, а сбалансированное ингибирование обеих изоформ ЦОГ определяет низкую частоту НЯ и со стороны сердечно-сосудистой системы (ССС) [9]. В экспериментальном исследовании было показано, что нимесулид, в отличие от напроксена, в терапевтической концентрации индуцирует внутриклеточное фосфорилирование и активацию глюкокортикоидных рецепторов, активирует их связывание с таргетными генами [10], что усиливает противовоспалительный потенциал препарата.
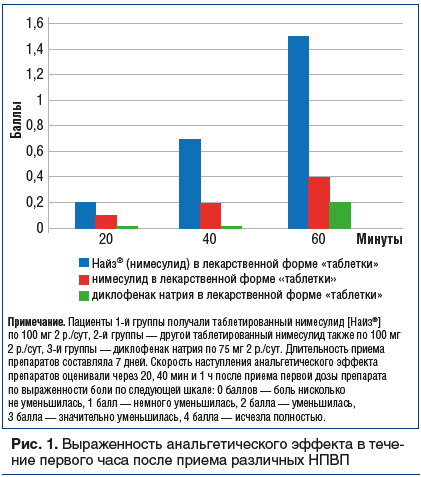
Отличает нимесулид скорость развития и выраженность анальгетического эффекта, что связывают с наличием у этого препарата, помимо периферического, центрального механизма действия [11, 12]. Скорость развития анальгетического эффекта зависит от скорости высвобождения лекарственного вещества из таблетки, т. е. распада (дезинтеграции) таблетки. Добиться быстрого высвобождения действующего вещества возможно при помощи специального вещества — дезинтегранта, поэтому постоянно ведется поиск веществ с улучшенными дезинтеграционными свойствами [13]. Дезинтеграция таблетки может осуществляться при помощи 2 основных механизмов: капиллярного эффекта и набухания [14]. Комбинирование различных дезинтегрантов позволяет достичь еще более выраженного эффекта дезинтеграции, что реализовано в препарате Найз® (нимесулид) в лекарственной форме «таблетка». При ее создании использовались различные дезинтегранты: крахмал, который обеспечивает хороший капиллярный эффект и быстрое проникновение жидкости внутрь таблетки, и натрия крахмал гликолят, который усиливает набухание и ведет к стремительному увеличению объема (в эксперименте его объем увеличивается в 100 раз) [14]. Таким образом, быстро абсорбируется большой объем жидкости, таблетка буквально «взрывается» изнутри и расширяется во всех направлениях, что названо 3D-эффектом [13, 15]. Анальгетический эффект препарата реализуется через 15 мин, что практически в 2 раза быстрее, чем у ибупрофена [16] и у эторикоксиба [17]. Более быстрое анальгетическое действие данного препарата по сравнению с другим воспроизведенным препаратом нимесулида или с диклофенаком натрия доказано в клиническом исследовании с участием пациентов, страдавших подагрическим артритом (рис. 1) [18]. Особенности фармакокинетики нимесулида и описанной выше структуры препарата объясняют преимущества, полученные за многие годы применения его у больных с различными заболеваниями структур опорно-двигательного аппарата.
Сравнительная оценка переносимости нимесулида и других НПВП
в отношении ЖКТ
По данным контролируемых рандомизированных исследований [19, 20], отмечена хорошая переносимость нимесулида в отношении ЖКТ. Это подтверждено данными когортного исследования по оценке риска развития поражения ЖКТ на фоне применения нимесулида и других НПВП, включившего 588 827 больных [21]. Авторы отметили, что риск повреждения верхних отделов ЖКТ в пересчете на 1000 пациенто-лет с 2001 по 2008 г. снизился с 4,45 до 2,21. Относительный риск повреждения слизистых ЖКТ для таких НПВП, как рофекоксиб, целекоксиб и нимесулид, был <2 (1,03, 1,57 и 1,41 соответственно), для напроксена, ибупрофена, диклофенака, эторикоксиба и мелоксикама — <5 (2,97, 3,11, 3,26 и 2,98 соответственно), а для кетопрофена, пироксикама и кеторолака — ≥5. Стоит отметить, что смена НПВП (что происходит в реальной клинической практике) увеличивала относительный риск осложнений до 4,92 [21]. Безопасность нимесулида в отношении ЖКТ была сопоставима с безопасностью других коксибов, не не эторикоксиба.
Хорошая переносимость нимесулида отмечена в многочисленных отечественных исследованиях. При анализе его переносимости в различных центрах РФ было отмечено, что отмена препарата из-за НЯ со стороны ЖКТ происходила в 0,2% случаев [22]. Проводилось детальное обследование 30 больных с патологией периферических суставов и позвоночника и сопутствующей патологией ЖКТ (в одном случае у больного имелось обострение язвенной болезни двенадцатиперстной кишки), включавшее, помимо клинического и лабораторного обследования, проведение ЭГДС в динамике 30-дневного применения нимесулида в суточной дозе 200 мг. Автором не было отмечено ухудшения эндоскопической картины в динамике. У больного с язвой двенадцатиперстной кишки отмечали рубцевание язвенного дефекта [20].
В настоящее время обсуждается вопрос о гепатотоксичности нимесулида. Известно, что многие НПВП, особенно диклофенак, вызывают НЯ со стороны печени. По статистическим данным, при кратковременном использовании нимесулида повышение уровня АСТ и АЛТ отмечается у 0,4% больных, при использовании его более 6 мес. — у 1,5% больных [23], напомним, что прием диклофенака вызывает повышение уровня АСТ и АЛТ примерно у каждого 5-го больного. С 1985 по 2002 г. во всем мире было зарегистрировано лишь 195 случаев непереносимости нимесулида со стороны печени. В Индии при регистрации нимесулида для использования в педиатрической практике 600 педиатров провели исследование его безопасности, при этом не было ни одного сообщения о тяжелых гепатотоксических реакциях [24]. В крупном популяционном исследовании гепатотоксичности нимесулида [25] представлен анализ частоты лекарственного поражения печени у 400 тыс. больных, получавших различные НПВП за период 1997–2001 гг. Было показано, что нимесулид вызывал гепатопатии в 35,3 случая на 100 тыс. пациенто-лет. Это значительно реже, чем диклофенак (39,2 случая на 100 тыс. пациенто-лет) и ибупрофен (44,6 случая на 100 тыс. пациенто-лет). Тяжелое поражение печени (цитолиз, холестатический синдром) при использовании НПВП — редкое осложнение (1 случай на 10 тыс. больных). По данным ВОЗ, из 185 253 сообщений о НЯ при приеме НПВП в 2,7% случаев были отмечены осложнения со стороны печени: при приеме диклофенака — 990 случаев, ибупрофена — 590, нимесулида — 152; при этом потенциально жизнеугрожающая печеночная недостаточность была зафиксирована у 21 больного, получавшего диклофенак, у 32 больных, получавших ибупрофен, и только у 4 пациентов, получавших нимесулид [26].
Нимесулид используется в Российской Федерации более 20 лет, при этом отечественные авторы свидетельствуют о благоприятной переносимости данного препарата в отношении функции печени [27], в т. ч. и при лечении больных подагрой, заболеванием с частым коморбидным поражением печени [28]. А.Е. Каратеевым и М.В. Журавлевой [27] был проведен анализ спонтанных сообщений о гепатотоксичности нимесулида (препаратов линейки Найз®), по данным Росздравнадзора, полученных с января 2009 г. по октябрь 2014 г. [29, 30]. За оцениваемый период Росздравнадзор получил 138 спонтанных сообщений о НЯ при использовании препаратов линейки Найз®. Средний возраст больных составил 50,3±16,5 года, 69,3% были женщины. В 128 случаях (92,8%) НЯ возникли во время приема таблеток, в остальных случаях — при использовании геля для наружного применения. Часто отмечались кожно-аллергические реакции (50,7% от общего числа НЯ), в 43 из 70 случаев — по типу крапивницы. На втором месте по частоте были реакции со стороны ЖКТ — 42 случая (30,4%), 6 случаев кровотечения из верхних отделов ЖКТ, 2 случая мелены при неустановленном источнике кровотечения и 1 ректальное кровотечение. Эрозивно-язвенное повреждение слизистой ЖКТ зарегистрировано в 13 случаях (9,4%), в 7% случаев регистрировались гастралгии, еще в 7,1% случаев — тошнота, рвота, диарея и НЯ, о котором сообщили как о гастрите. НЯ со стороны других органов и систем регистрировались реже: бронхоспазм — в 8 случаях (5,8%), со стороны ССС
по 1 случаю стенокардии, сердечной недостаточности и АГ. В 9 случаях отмечены НЯ со стороны почек (острая почечная недостаточность — 2 случая, интерстициальный нефрит — 2 случая и периферические отеки — 5 случаев). В 5 случаях (3,6%) сообщения касались НЯ со стороны печени: острая печеночная недостаточность в 1 случае у 41-летнего мужчины, причем в графе «Лекарственная терапия НЯ» было проставлено «самолечение», в 2 случаях сообщалось о лекарственном гепатите без уточнения, определялись ли изменения лабораторных показателей или была и клиническая картина повреждения печени, в 4 случаях сообщалось о повышении уровня трансаминаз.
В большинстве случаев связь с приемом нимесулида врачи оценили как вероятную (51,4%), в 3 раза реже — как определенную (14,5%), в 2 раза реже — как возможную (26,1%). Условную и сомнительную связь регистрировали редко — в 5,8% и 2,2% случаев соответственно. В каждом 5-м случае (21,7%) указывался прием и других препаратов, способных вызвать НЯ. Так, в 4 из 5 сообщений о гепатотоксичности указывался одновременный прием других гепатотоксичных препаратов (аторвастатина, парацетамола, диклофенака, азитромицина и цефтриаксона). Несмотря на серьезность этих НЯ, подавляющее большинство из них разрешились благополучно: в 59,1% случаев отмечали выздоровление без последствий, улучшение регистрировали в 17,4% случаев; выздоровление с последствиями — в 0,7% случаев; изменения отсутствовали в 6,5% случаев (исходы НЯ были оценены как «неизвестно» или «неприменимо» в 7,9 и 7,2% случаев соответственно). Исключение составляет только смерть одной пациентки (0,7%), в возрасте 60 лет, умершей от желудочно-кишечного кровотечения вследствие одновременного приема нимесулида, ибупрофена и метилпреднизолона.
Авторы этого сообщения [29] экстраполировали данные спонтанных сообщений о НЯ на число больных, получающих нимесулид, что косвенно можно сделать с учетом продаж препарата. С 2011 г. осуществляется продажа около 250 млн упаковок препарата Найз® (таблетки) в год. При условии приема данного препарата по 100 мг 2 р./сут и нередкого назначения его больным остеоартритом (а их большинство) короткими курсами ориентировочное число больных, использующих его, составляет 3–4 млн, следовательно, примерно на 150 тыс. пациентов, получивших нимесулид, приходится одно спонтанное сообщение о НЯ и на несколько миллионов больных в год — одно спонтанное сообщение в отношении НЯ со стороны печени.
Примечательно, что применение нимесулида у 81 больного подагрой [28], т. е. у пациентов, имеющих немало факторов риска лекарственного повреждения печени (употребление алкоголя, жировой гепатоз печени, частое развитие желчнокаменной болезни и др.), не зарегистрировали изменения биохимических параметров, отражающих функциональную способность печени: уровень АСТ до лечения — 25,4 МЕ/л, после лечения — 22,0 МЕ/л соответственно, уровень АЛТ — 37,3 и 33,6 МЕ/л соответственно, уровень щелочной фосфатазы — 169,6 и 177,4 МЕ/л соответственно.
Следует напомнить, что НПВП-индуцированная гепатопатия носит характер метаболической или иммунологической идиосинкразии. Факторами риска ее развития являются: пожилой возраст, женский пол, патология гепатобилиарной системы, тяжелые сопутствующие заболевания, сочетанный прием препаратов, влияющих на метаболизм НПВП, генетические аномалии, гипоальбуминемия, гепатотоксические реакции в анамнезе. Таким образом, тщательно собранный анамнез, исключение сочетанного приема потенциально гепатотоксических препаратов и лабораторный контроль переносимости нимесулида позволят еще уменьшить риск развития гепатотоксической реакции. Анализ исходов гепатотоксических реакций, развившихся при использовании нимесулида, по данным спонтанных сообщений врачей [29], не подтвердил мнение о том, что хотя повреждение печени на фоне приема нимесулида встречается нечасто, но всегда представляет собой тяжелые реакции, потенциально жизнеопасные. Хотя в сообщениях врачей указана острая печеночная недостаточность, однако лечебно-диагностические мероприятия не проводились, пациент занимался «самолечением», что ставит под сомнение тяжесть такой нежелательной реакции. Как уже упоминалось выше, большинство НЯ в данном сообщении разрешились благополучно.
Сравнительная оценка переносимости нимесулида и других НПВП в отношении сердечно-сосудистой системы и почек
В настоящее время, в соответствии с отечественными и зарубежными рекомендациями, считается, что все НПВП, независимо от механизма их действия, могут негативно влиять на ССС. По данным метаанализа 51 рандомизированного клинического исследования (n=130 451) [30], прием селективных НПВП приводит к существенному увеличению риска развития артериальной гипертензии (АГ) по сравнению с таковым при использовании плацебо (отношение шансов [ОШ] 1,49; 95% доверительный интервал [ДИ] 1,18–1,88; р=0,04). При этом не выявлено существенных различий между неселективными и селективными НПВП (р=0,23). Тромбоэмболические осложнения также характерны и для селективных, и для неселективных НПВП [31]. По данным масштабного исследования [32], включившего анализ риска возникновения инфаркта миокарда (ИМ) у пациентов, получавших 29 различных НПВП (данные 100 баз данных европейских стран, 79 553 пациента, получавшие НПВП, и 7 448 603 пациента, не получавшие НПВП), наиболее высокий риск развития ИМ был отмечен при использовании кеторолака, но не коксибов и нимесулида. Особенно возрастает риск осложнений со стороны ССС у больных, перенесших ИМ и операции на сердце и сосудах: он составляет для целекоксиба, диклофенака и ибупрофена 2,57, 2,40 и 1,50 соответственно [33].
Наиболее частым коморбидным состоянием у больных с патологией суставов является АГ. Оценка течения АГ при использовании нимесулида проводилась в нескольких отечественных исследованиях [27, 34]. В открытое исследование [27] было включено 40 больных ОА и РА, имеющих АГ не менее 5 лет и получающих стабильную дозу антигипертензивных препаратов в течение не менее 6 мес., без явных проявлений застойной сердечной недостаточности. Всем больным после 3-дневного периода перерыва в приеме НПВП (ибупрофен, мелоксикам, кетопрофен, диклофенак) назначали рандомизированно либо диклофенак в дозе 100–150 мг/сут, либо нимесулид в дозе 200–400 мг/сут на 20 дней. Артериальное давление (АД) в первую и последнюю недели приема НПВП регистрировали 6 р./сут; в остальное время исследования АД регистрировалось 4 р./сут — каждые 3 ч с момента пробуждения. Пациенты в течение периода исследования вели дневник с указанием АД, приема антигипертензивных препаратов и нежелательных реакций. После отмывочного периода, когда АД несколько повышалось у пациентов из обеих групп, в течение 1-й нед. лечения различия в среднем систолическом и диастолическом АД были статистически значимо выше в группе диклофенака (p<0,001), а в группе нимесулида практически не отличались от исходного. У 16 из 20 больных, получавших диклофенак, отмечалось негативное влияние препарата на течение АГ: повышение систолического и/или диастолического АД, сопровождавшееся неприятными субъективными ощущениями, головная боль, кардиалгии (n=16), развитие гипертонического криза (n=2), которое привело к отмене диклофенака через 6–14 дней приема, увеличение потребности в приеме антигипертензивных препаратов (n=6). Среди больных, получавших нимесулид, не отмечено случаев увеличения потребности в антигипертензивной терапии и значимого изменения уровня АД, так что все 20 больных закончили 3-недельный период лечения. Диклофенак был отменен 8 больным в связи с изменением течения АГ, гастралгией, диареей и головной болью. Увеличение среднесуточного САД у больных, закончивших лечение диклофенаком, было статистически значимым и составило 15,74±11,0 мм рт. ст. (p<0,05), тогда как к концу лечения нимесулидом данный показатель равнялся 1,71±5,22 мм рт. ст. (р>0,05).
В другом исследовании [34] сравнили влияние нимесулида и диклофенака на гемодинамические показатели у больных ОА с или без АГ, для чего пациентов разделили на 2 группы: в первую группу (А) включили пациентов с ОА и АГ, получавших диклофенак в дозе 100 мг/сут (подгруппа 1А) или нимесулид в дозе 200 мг/сут (подгруппа 1Б). Всем больным группы А был назначен эналаприл по 5–10 мг 2 р./сут утром и вечером. В группе Б пациентов с ОА и без АГ разделили на 2 подгруппы (в подгруппе 2А пациенты получали диклофенак 100 мг/сут, в подгруппе 2Б — нимесулид 200 мг/сут). В подгруппе 1Б пациентов с ОА с АГ, получавших нимесулид и гипотензивную терапию, существенного увеличения САД не выявили, напротив, при лечении диклофенаком в подгруппе 1А отмечалось статистически значимое повышение уровня САД (p<0,05). У лиц с исходно нормальным уровнем АД на фоне применения диклофенака, но не нимесулида, также отмечали статистически значимое повышение САД (p<0,05). Таким образом, установили, что нимесулид в сравнении с диклофенаком обладает менее выраженной способностью повышать АД у больных ОА с исходно нормальным его уровнем и с АГ. Кроме того, прием диклофенака у больных с ОА и эссенциальной АГ приводил к существенному ухудшению показателей функции сосудистого эндотелия, снижению эффективности проводимой антигипертензивной терапии [34].
Эффективность нимесулида при подборе индивидуальной дозы показана для всех заболеваний суставов. Как уже упоминалось выше, сНПВП в отличие от нсНПВП не оказывают отрицательного влияния на суставной хрящ. Показано, что спектр механизма действия нимесулида включает ингибирование IL-1b [35], ингибирование апоптоза хондроцитов [36] и подавление активности металлопротеаз [8], что свидетельствует об отсутствии у него отрицательного влияния на суставной хрящ.
При анализе сообщений о побочных реакциях со стороны почек за 10 лет применения нимесулида у 100 000 больных (с 1988 по 1997 гг.) было выявлено 11 сообщений, из которых только в 4 случаях проводилась монотерапия нимесулидом [37].
Нимесулид с успехом применяется и для купирования острой послеоперационной боли, превышая по эффективности неселективный НПВП ибупрофен [16, 38]. При острой боли в плече нимесулид (200 мг/сут) был так же эффективен, как диклофенак (150 мг/сут), при лучшей переносимости [39]. Следует еще раз подчеркнуть чрезвычайно быстрое купирование боли при остром приступе подагрического артрита [18, 40].
Нимесулид выпускается также в лекарственной форме для топического применения, что создает дополнительные возможности для максимально безопасного лечения больных с патологией суставов и периартикулярных тканей, в первую очередь страдающих ОА (пожилой контингент, имеющий высокую мультиморбидность). Последние рекомендации 2019 г. Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (The European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, ESCEO) [41], Международного общества по изучению ОА (Osteoarthritis Research Society International, OARSI) [42] строго рекомендуют использовать топические НПВП до назначения пероральных форм при лечении ОА коленного сустава, а Американский колледж ревматологов (American College of Rheumatology, ACR) в рекомендациях 2019 г. предлагает использовать топические формы до назначения пероральных форм при ОА коленных суставов и суставов кистей [43]. Для достижения терапевтического эффекта гель рекомендуется наносить не менее чем 3 р./сут в достаточном количестве: на крупный сустав — 5–10 см полоски, на мелкий сустав — 1–2 см полоски.
Заключение
Таким образом, по данным зарубежных и отечественных рандомизированных и открытых сравнительных исследований можно заключить, что нимесулид обладает выраженным противовоспалительным и анальгетическим эффектом, высокой скоростью развития обезболивания и хорошей переносимостью, в т. ч. у больных с НПВП-гастропатией, метаболическим синдромом (больные подагрой), артериальной гипертензией. Применение нимесулида в лекарственной форме «гель для наружного применения» позволяет при комбинации с таблетированной формой достичь большего эффекта без ущерба для переносимости.
Благодарность
Авторы и редакция благодарят ООО «Др. Редди’с Лабораторис» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
2. Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018;56:1–29. [Karateev A.E., Nasonov E.L., Ivashkin V.T. et al. Rational use of nonsteroidal anti-inflammatory drugs. Clinical guidelines. Rheumatology Science and Practice. 2018;56:1–29 (in Russ.)].DOI: 10.14412/1995-4484-2018-1-29.
3. Reinsford K.D. Members of the Consensus Report Group on Nimesulide. Nimesulide — a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin. 2006;22(6):1161–1170. DOI:10.1185/030079906X104849.
4. Кнорринг Г.Ю., Верткин А.Л. «Правильный» нимесулид: взгляд фармаколога. Доктор РУ. 2019;10(165):38–42. [Knorring G.Y., Vertkin A.L. «Correct» nimesulide: a pharmacologist’s view. Doctor RU. 2019;10(165):38–42 (in Russ.)]. DOI: 10.31550/1727-2378-2019-165-10-38-42.
5. Caiazzo E., Ialenti A., Cicala C. The relatively selective cyclooxigenase-2 inhibitor nimesulide: What’s going on? Eur J Pharmacol. 2019;848:105–111. DOI:10.1016/j.ejphar.2019.01.044.
6. Dallegri F., Ottonello L. Are there differences among non-steroidal anti-inflammatory drugs? Focus on Nimesulide. Clin Drug Investig. 2007;27(Suppl 1):15–22. DOI:10.2165/00044011–200727001–00004.
7. Reinsford K.D. Relationship of nimesulide safety to its pharmacocnetics: assessment of adverse reactions. Rheumatol (Oxford). 1999;38(Suppl 1):4–10. DOI: 10.1093/rheumatology/38.suppl_1.4.
8. Bennett A., Villa G. Nimesulide: an NSAID that preferentially inhibits COX-2, and has various unique pharmacological activities. Expert Opin Pharmacother. 2000;1(2):277–286. DOI: 10.1517/14656566.1.2.277.
9. Suleyman H., Cadrici E., Albayrak A., Halici Z. Nimesulide is a selective COX-2 inhibitory, atypical non-steroidal anti-inflammmatory drug. Curr Med Chem. 2008;15(3):278–283. DOI: 10.2174/092986708783497247.
10. Pelletier J.P., Di Battista J.A., Zhang M. et al. Effect of nimesulide on glucocortocoid receptor activity in human synovial fibroblasts. Rheumatology (Oxford). 1999;38(Suppl. 1):11–13. DOI: 10.1093/rheumatology/38.suppl_1.11.
11. Bianchi M., Broggini M. Anti-hyperalgesic effects of nimesulide: studies in rats and humans. Int J Clin Pract Suppl. 2002;128:11–19.
12. Tassorelli C., Greco R., Sandrini G., Nappi G. Central components of the analgesic/antihyperalgesic effect of nimesulide: studies in animal models of pain and hyperalgesia. Drugs. 2003;63(Suppl 1):9–22. DOI: 10.2165/00003495-200363001-00003.
13. Хесс Т., Морозов А. Быстрая дезинтеграция — задача при разработке рецептур. Фармацевтическая отрасль. 2014;1:92–99. [Khess T., Morozov A. Rapid disintegration is a challenge when developing recipes. Pharmaceutical industry. 2014;1:92–99 (in Russ.)].
14. Воллмер Р. Быстрая дезинтеграция — одна из основных задач при разработке рецептур. Фармацевт, технологии и упаковка. 2012;6:70–71. [Vollmer R. Rapid disintegration is one of the main tasks when developing recipes. Pharmacist, technology and packaging. 2012;6:70–71 (in Russ.)].
15. Хомяк Н., Мамчур В., Хомяк Е. 3D-эффект препарата Найз: как особенности фармакокинетики помогают справляться с болью. Фармацевт-практик. 2017;3:32–34. [Khomyak N., Momchur V., Khomyak E. 3D-effect of the drug Nize: how pharmacokinetics help to cope with pain. Pharmacist practitioner. 2017;3:32–34 (in Russ.)].
16. Bocanegra M., Seijas A., Gonzales-Yibrin M. Effectiveness and tolerability of once-daily nimesulide versus ibuprofen in pain management after surgical extraction of an impacted third molar: a 24-hour, double-blind, randomized, double-dummy, parallel-group study. Curr Therap Res. 2005;66(3):172–180. DOI: 10.1016/j.curtheres.2005.06.007.
17. Escudero-Contreras A., Varsquez-Mellado Cervantes J., Collantes-Estevez E. Update on the clinical pharmacology of etoricoxib, a potent cyclooxigenase-2 inhibitor. Future Rheumatol. 2007;2(6):545–565. DOI: 10.2217/17460816.2.6.545.
18. Кудаева Ф.М., Барскова В.Г., Насонова В.А. Сравнение скорости наступления противовоспалительного и анальгетичсекого эффекта таблетированных нимесулидов и диклофенака натрия при подагрческом артрите: рандомизированное исследование. Научно-практическая ревматология. 2008;1:55–59. [Kudaeva F.M., Barskova V.G., Nasonova V.A. Comparison of the rate of onset of anti-inflammatory and analgesic effects of tablet nimesulides and diclofenac sodium in gout arthritis: a randomized study. Rheumatology Science and Practice. 2008;1:55–59 (in Russ.)]. DOI: 10.14412/1995-4484-2008-854.
19. Husskisson E.C. Nimesulide, a balanced drug for the treatment of osteoarthritis. Clin Exp Rheumatol. 2001;19(Suppl 22): S21-S25.
20. Porto A., Almedia H., Cunha M.J., Macciocchi A. Double-blind evaluation by endoscopy the tolerability of nimesulide and diclofenac on gastric mucosa in osteoarhritic patients. Eur J Rheum Inflamm. 1994;14:33–38.
21. Castelsague J., Pisa F., Rosolen V. et al. Pharmacoepidemiol Drug Saf. 2013;22(4):365–375. DOI: 10.1002/pds.3385 DOI:10.1002/pds.3385.
22. Минушкин О.Н. Тактика ведения больных с сочетанной патологией суставов и верхних отделов желудочно-кишечного тракта. Научно-практическая ревматология. 2003;41(4):64–67. [Minushkin O.N. Treatment tactics in patient with articular pathology and concomiotant disorders of upper gasrrointestinal tract. Rheumatology Science and Practice. 2003;41(4):64–67 (in Russ.)]. DOI: 10.14412/1995-4484-2003-1336.
23. Boelestri U. Mechanism of NSAID hepatotoxicity: focus on nimesulide. Drug Saf. 2002;25(9):633–648. DOI: 10.2165/00002018-200225090-00003.
24. Kulkarni S. On the safety nimesulide, a preferential Cox-2 inhibitor. Curr. Sci. 2002;83:1442–1443.
25. Traversa G., Bianchi C., Da Cas R. et al. Cohort study of hepatotoxicity associated with nimesulide and other non-steroidal anti-inflammatory drugs. BMJ. 2003;327: 18–22. DOI: 10.1136/bmj.327.7405.18.
26. Sanchez-Matienzo D., Arana A., Castellsague J., Perez-Gutthann S. Hepatic disorders in patients treated with COX-2 selective inhibitors or nonselective NSAIDs: a case/noncase analysis of spontaneous reports. Clin Ther. 2006;28(8):1123–1132. DOI: 10.1016/j.clinthera.2006.08.014.
27. Чичасова Н.В., Имаметдинова Г.Р., Насонов Е.Л. Нимесулид в лечении хронических заболеваний суставов. Лечащий врач. 2008;4:75–78. [Chichasova N.V., Imametdinova G.R., Nasonov E.L. Nimesulide in the treatment chronic articular diseases. Attending doctor. 2008;4:75–78 (in Russ.)].
28. Каратеев А.Е., Барскова В.Г. Безопасность нимесулида: эмоции или взвешенная оценка? Consilium Med. 2007;9(2):60–64. [Karateev A.E., Barskova V.G. Nimesulide safety: emotions or a balanced assessment? Consilium Med. 2007;9(2):60–64 (in Russ.)].
29. Каратеев А.Е., Журавлева М.В. Анализ спонтанных сообщений российских врачей о неблагоприятных реакциях, возникших на фоне приема нимесулида: гепатотоксические осложнения очень редки. Эффективная фармакотерапия. 2015;8:4–12. [Karateev A.E., Ghuravleva M.V. Analysis of spontaneous reports of Russian doctors about adverse reactions that occurred while taking nimesulide: hepatotoxic complications are very rare. Effective pharmacotherapy. 2015;8:4–12 (in Russ.)].
30. Sharrar R.G., Dieck G.S. Monitoring product safety in the postmarketing environment. Ther Adv Drug Saf. 2013;4(5):211–229. DOI:10.1177/2042098613490780.
31. Avery A.J., Anderson C., Bond C.M. et al. Evaluation of patient reporting of adverse drug reactions in the UK «Yellow Card Scheme: literature review, descriptive and qualitative analyses, and questionnaire surveys». Health Technol Assess. 2011;15(20):1–234. DOI: 10.3310/hta15200.
32. Masclee G.M.C., Straatman H., Arfe A. et al. Risk of acute myocardial infarction during use of individual NSAIDs: a nested case-control study from the SOS project. PLoS ONE. 2018;13(11): e204746. DOI: 10.1371/journal.pone.0204746.
33. Gislason G.H., Jacobsen S., Rasmussen J.N. et al. Risk of death or reinfarction associated with the use of selective cyclooxygenase-2 inhibitors and nonselective nonsteroidal anti-inflammatory drugs after acute myocardial infarction. Circulation. 2006;113:2906–2913. DOI: 10.1161/CIRCULATIONAHA.106.616219.
34. Мазуров В.И., Побегай О.В., Мартынов И.В. Сравнительная оценка влияния нимесулида (найза) и диклофенака на гемодинамические показатели у больных остеоартрозом в сочетании с эссенциальной артериальной гипертензией. Артериальная гипертензия. 2009;15(4):485–491. [Mazurov V.I., Pobegai O.V., Martynov I.V. Comparative evaluation of the effect of nimesulide (Nise) and diclofenac on hemodynamic parameters in patients with osteoarthrosis and hypertension. Arterial Hypertension. 2009;15(4):485–491 (in Russ.)].
35. Di Batista J.A, Fahmi H., He Y. et al. Differential regulation of interleukin-1b-induced cyclooxigenase-2 gene expression by nimesulide in human synovial fibroblasts. Clin Exp Rheumatol. 2001;19(1 Suppl 22): S3–5.
36. Mikherjee P., Rachita C., Aisen P.S., Pasineti G.M. Non-steroidal anti-inflammatory drugs protect against chondrocyte apoptotic death. Clin Exp Rheum. 2001;19(Suppl. 22): S7–11.
37. Leone R., Conforti A., Chiotto E. et al. Nimesulide and renal impairment. Eur J Clin. Pharmacol. 1999;55:151–154. DOI: 10.1007/s002280050610.
38. Aho M., Kokki H., Nikanne E. Nimesulide versus ibuprofen for poctoperative tonsillectomy pain: a double-blind, randomized, active comparator-controlled clinical trial. Clin Drug Investig. 2003;23(10):651–660. DOI: 10.2165/00044011-200323100-00004.
39. Wober W. Comparative efficacy and safety of nimesulide and diclofenac in patients with acute shoulder, and a meta-analysis of controlled studies with nimesulide. Rheumatol (Oxford). 1999;38(Suppl 1):33–38. DOI: 10.1093/rheumatology/38.suppl_1.33.
40. Барскова В.Г., Насонова В.А. Нимесил в лечении подагрического артрита. Тер архив. 2003;75(5):60–64. [Barskova V.G., Nasonova V.A. Nimesil treatment of gouty arthritis. Ther archive. 2003;75(5):60–64 (in Russ.)].
41. Bruyère O., Honvo G., Veronese N. et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Seminars in Arthritis and Rheumatism. 2019;49(3):337–350. DOI:10.1016/j.semarthrit.2019.04.008.
42. Bannuru R.R., Osani M.C., Vaysbrot E.E. et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular oateoarthritis. Osteoarthr Cartilage. 2019;37(11):1578–1589. DOI: 10.1016/j.joca.2019.06.011.
43. Kolasinski S.L., Neogi T., Hochberg M.C. et al. 2019 American College of Rheumatology/Arthritis Foundation guideline for the management of osteoarthritis of the hand? Hip and knee. Arthr Rheumatol. 2020;72(2):220–233. DOI:10.1002/art.41142.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
