Синдром Гудпасчера (клиническое наблюдение)
Синдром Гудпасчера (СГ) — заболевание, ассоциированное с образованием антител к базальной мембране клубочков (БМК). Оно относится к редким иммунокомплексным органоспецифическим системным васкулитам. Представлено собственное клиническое наблюдение СГ у пациентки 23 лет. Болезнь манифестировала с картины фульминантного гломерулонефрита и быстронарастающей азотемии, с последующим вовлечением в патологический процесс легких в виде геморрагического альвеолита и легочного кровотечения. Лабораторным подтверждением болезни послужили высокие титры специфических антител к БМК (анти-БМК антитела). Особенностью описанного клинического наблюдения является молниеносное течение СГ, несмотря на проведение иммуносупрессивной терапии в комбинации с плазмаферезом, развитие у пациентки геморрагического инсульта, комы и наступление летального исхода. Морфологический анализ секционного материала показал пролиферативный нефрит с очень высоким процентом клубочков с полулуниями и васкулит сосудов легких. Авторы акцентируют внимание на острой потребности в пересмотре и адаптации к рутинной клинической практике междисциплинарных алгоритмов ведения больных с СГ, с устранением терминологических разногласий и определением порога вмешательства врача первичного звена и врача-специалиста (нефролога, пульмонолога, ревматолога).
Ключевые слова: синдром Гудпасчера, заболевание, ассоциированное с антителами к базальной мембране клубочков, анти-БМК болезнь, анти-БМК антитела, гломерулонефрит с полулуниями, геморрагический альвеолит, плазмаферез.
Для цитирования: Патрикеева И.М., Лушпаева Ю.А., Евенко А.Ю., Малышева Т.Ю., Биченова А.Г. Синдром Гудпасчера (клиническое наблюдение). РМЖ. Медицинское обозрение. 2022;30(6):75-79.
Goodpasture syndrome. Clinical case
I.M. Patrikeeva1, Yu.A. Lushpaeva2, A.Yu. Evenko1, T.Yu. Malysheva1, A.G. Bichenova3 1Regional Clinical Hospital No. 1, Tyumen
2Tumen State Medical University, Tyumen
3Multiprofile Clinical Medical Center "Meditsinskii Gorod", Tyumen
Goodpasture syndrome is a disease associated with the formation of anti-glomerular basement membrane antibodies. It belongs to the rare immune complex organ-specific systemic vasculitis. The article presents the clinical case of Goodpasture syndrome in a 23-year-old female patient. The disease manifested with a clinical picture of fulminant course of glomerulonephritis and rapidly progressive azotemia, followed by the pathological process in the lungs in the form of hemorrhagic alveolitis and pulmonary hemorrhage. Laboratory confirmation of the disease was high titers of specific anti-glomerular basement membrane antibodies (anti-GBM antibodies). The point of the described clinical case is the fulminant course of Goodpasture syndrome, despite the conducted immunosuppressive therapy in combination with plasmapheresis, the development of hemorrhagic stroke, coma and the fatal outc ome of the patient. Morphological analysis of the autopsy material showed proliferative nephritis with a very high percentage of crescentic glomeruli and pulmonary vasculitis. The authors focus on the urgent need for revision and adaptation to routine clinical practice of interdisciplinary algorithms for the patient management with Goodpasture syndrome, for the elimination of terminological differences and the determination of the intervention threshold of a primary care physician and a specialist (nephrologist, pulmonologist, rheumatologist).
Keywords: Goodpasture syndrome, anti-glomerular basement membrane antibodies disease, anti-GMB disease, anti-GBM antibodies, crescentic glomerulonephritis, hemorrhagic alveolitis, plasmapheresis.
For citation: Patrikeeva I.M., Lushpaeva Yu.A., Evenko A.Yu. et al. Goodpasture syndrome. Clinical case. RMJ. 2022;6:75–79.
Введение
Синдром Гудпасчера (СГ), или заболевание, ассоциированное с антителами к базальной мембране клубочков (анти-БМК антитела), согласно современной классификации, относится к редким иммунокомплексным органоспецифическим системным васкулитам [1]. Заболеваемость СГ максимальна в возрасте от 18 до 30 и от 50 до 65 лет. Мужчины заболевают приблизительно в 6–8 раз чаще [2].
Считается, что патогенез СГ связан с циркулирующими антителами преимущественно классов IgG1 и IgG3 к терминальному фрагменту α3-цепи, реже к α4- и α5-цепям, молекулы коллагена IV типа (α3(IV)NC1) базальной мембраны почечных клубочков (анти-БМК антитела) и альвеол [1, 3, 4]. Наличие этих антител вызывает быстропрогрессирующий гломерулонефрит и геморрагический альвеолит, при этом механизм выработки анти-БМК антител до конца не изучен.
У 80–90% пациентов проявлением СГ является развитие быстропрогрессирующей почечной недостаточности. К моменту установления диагноза до 50% пациентов нуждаются в проведении заместительной почечной терапии, а уровень смертности составляет примерно 25% через 1 год после постановки диагноза [5, 6]. У 40–60% пациентов поражение почек сочетается с патологией легких в виде диффузного альвеолярного кровотечения, которое может развиться внезапно и привести к смерти пациента в течение нескольких часов [7].
Синдром Гудпасчера в медицинской литературе описывают в виде отдельных клинических наблюдений [8, 9], а лечение данного заболевания, включающее плазмаферез и иммунодепрессанты, эффективно только на ранней стадии болезни, что определяет необходимость повышения осведомленности различных специалистов об этой редкой патологии.
Представлено собственное клиническое наблюдение СГ у молодой женщины — с развитием фульминантного гломерулонефрита и острой почечной недостаточности в дебюте болезни в сочетании с геморрагическим альвеолитом, быстропрогрессирующим течением и летальным исходом от наступивших осложнений.
Клиническое наблюдение
Пациентка, 23 года, 20.08.2021 поступила в ревматологическое отделение ГБУЗ ТО «ОКБ № 1» с жалобами на общую слабость, отеки лица и нижних конечностей, отсутствие мочи. Из анамнеза известно, что 04.08.2021 появились симптомы ОРВИ. Обратилась в поликлинику. При обследовании выявлен положительный результат ПЦР-теста на новую коронавирусную инфекцию COVID-19, однако клинические и инструментальные данные за пневмонию отсутствовали (рис. 1). До обращения в медучреждение хроническими заболеваниями не страдала.
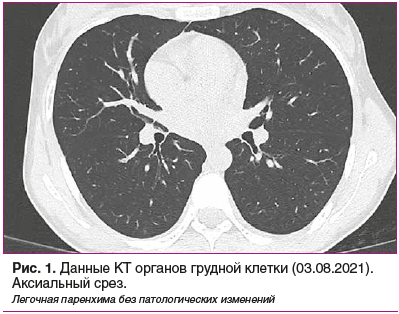
Лечилась амбулаторно: проводилась противовирусная и антибактериальная терапия, назначенная участковым терапевтом. Состояние было удовлетворительным. 11.08.2021 возникли выраженные боли в животе, тошнота, многократная рвота, субфебрилитет. Бригадой скорой помощи с подозрением на «острый живот» пациентка доставлена в многопрофильный стационар г. Тюмени. При поступлении исключена острая хирургическая патология, но выявлена выраженная азотемия (креатинин 2258 мкмоль/л, мочевина 51,3 ммоль/л, калий 6,05 ммоль/л). С предварительным диагнозом «Острая почечная недостаточность неуточненная (N17.9)» госпитализирована в реанимационное отделение, назначена заместительная терапия в виде гемодиафильтрации. При дополнительном обследовании выявлено: тромбоциты 720×109/л, лейкоциты 29×109/л, анемия тяжелой степени (эритроциты 2,8×1012/л, Hb 61 г/л), потребовавшая переливания эритроцитарной массы, С-реактивный белок (СРБ) 154 мг/л.
15.08.2021 на КТ органов грудной клетки выявлены двухсторонние инфильтративные изменения, сливные периваскулярные очаги, двухсторонний гидроторакс. Повторный ПЦР-тест отрицательный, в динамике антитела к SARS-CoV-2 отрицательные. Из областного ревматологического центра был приглашен врач-ревматолог, который по результатам обследования заподозрил системный васкулит и назначил дообследование на иммунологические маркеры, в результате которого обнаружены высокие титры специфических антител к БМК и отрицательные антитела к цитоплазме нейтрофилов.
17.08.2021 (через 2 нед. от дебюта болезни) на основании клинических, лабораторных и инструментальных критериев установлен клинический диагноз: «Синдром Гудпасчера. Быстропрогрессирующий гломерулонефрит с исходом в острую почечную недостаточность. Геморрагический альвеолит. Антитела к базальной мембране клубочков. Анемия тяжелой степени».
Пациентке была назначена интенсивная терапия с применением пульс-терапии метилпреднизолоном (1 г в/в 3 дня подряд). На фоне лечения отмечалось улучшение общего самочувствия и положительная динамика лабораторных показателей: эритроциты 3,26×1012/л, Нb 94 г/л, тромбоциты 170×109/л, лейкоциты 29,8×109/л, СРБ 24 г/л, мочевина 51,3 ммоль/л, креатинин 711 мкмоль/л, калий 4,4 ммоль/л.
Пациентку 20.08.2021 перевели в ревматологическое отделение ГБУЗ ТО «ОКБ № 1». 21.08.2021 был проведен очередной сеанс гемодиафильтрации. В ночь с 21 на 22 августа 2021 г. регистрировалось появление и нарастание одышки, сухого кашля, слабости, появление крепитирующих хрипов в нижних отделах легких, SpO2 до 89%, тахикардия 100 уд/мин, АД 90–85/60 мм рт. ст., повышение температуры до субфебрильных цифр и признаки легочного кровоизлияния по данным КТ легких (рис. 2).
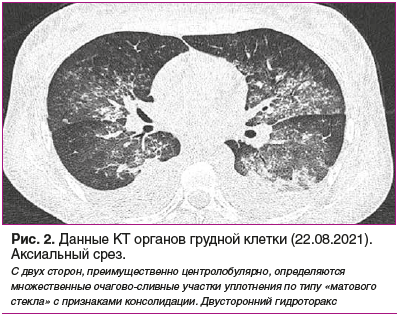
Данная ситуация была расценена как прогрессирование болезни, в связи с чем назначены повторные курсы интенсивной терапии: плазмаферез аппаратом MultiFiltrate (3 сеанса с интервалом в 2 дня) с восполнением объема свежезамороженной плазмой. После каждого сеанса плазмафереза вводился 1 г метилпреднизолона, иммуноглобулин человеческий 0,5 г/кг массы тела, а также 800 мг циклофосфамида после 2-й процедуры плазмафереза. На фоне лечения состояние стабилизировалось: SpO2 100%, АД 140/90 мм рт. ст., ЧСС 80 в минуту. Лечебная доза преднизолона — 60 мг/сут, запланировано повторное введение циклофосфамида.
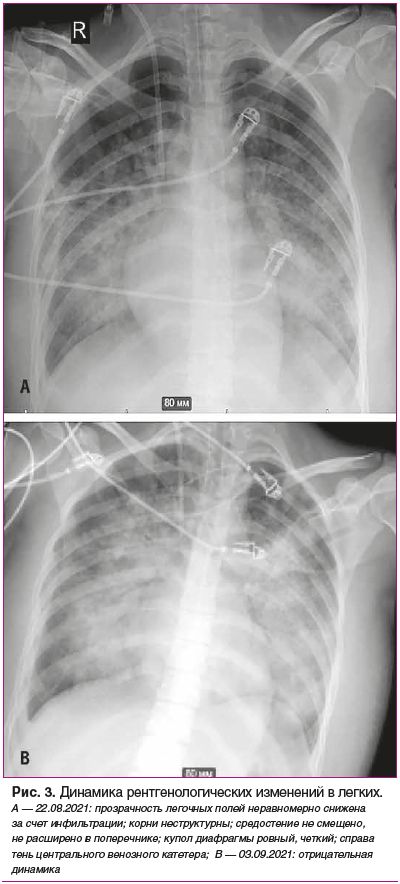
На фоне проводимой терапии 03.09.2021 отмечено резкое ухудшение состояния с острой, нарастающей по интенсивности головной болью, рвотой, повышением АД до 185/120 мм рт. ст., психомоторным возбуждением и последующим развитием комы. Отмечена отрицательная динамика рентгенологических изменений в легких (рис. 3). По экстренным показаниям проведена КТ головного мозга, выявлен обширный геморрагический инсульт, множественные паренхиматозные кровоизлияния в обоих полушариях, отек и аксиальная дислокация головного мозга (рис. 4). Пациентка переведена в отделение анестезиологии и реанимации, где до 07.09.2021 продолжалось динамическое наблюдение профильными специалистами (ревматологом и неврологом), в/в введение метилпреднизолона и симптоматическое лечение.
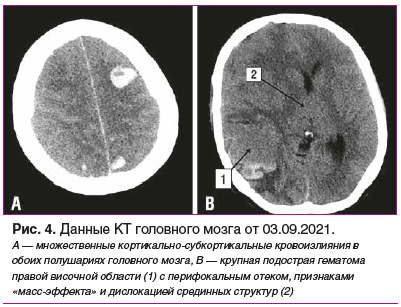
На 28-й день от первых проявлений болезни (07.09.2021) в 12:20 диагностированы клинические признаки смерти мозга, в 22:45 на фоне нарастающих явлений полиорганной недостаточности произошла остановка кровообращения, в 23:15 констатирована биологическая смерть.
Патологоанатомический диагноз: «Основное заболевание: синдром Гудпасчера — геморрагический пневморенальный синдром с некротическим васкулитом. Диффузные альвеолярные кровоизлияния, легочной капиллярит, геморрагический альвеолит; гломерулонефрит с формированием полулуний, субтотальный склероз почек.
Осложнения основного заболевания: состоявшееся легочное кровотечение. Почечная артериальная гипертензия. Внутримозговое кровоизлияние в правую височно-теменно-затылочную область (7×6×4 см), левую лобно-теменную область (3×1,5×1,5 см), ствол мозга (0,5×1×1 см) с перифокальным ишемическим размягчением вещества головного мозга. Мозговая кома (клинически). Двусторонний гидроторакс (по 1000 мл). Острое венозное полнокровие внутренних органов. Тяжелая белковая дистрофия эпителия проксимальных канальцев нефрона с переходом в нефронекроз».
Данные патогистологического исследования секционного материала представлены на рисунках 5, 6.
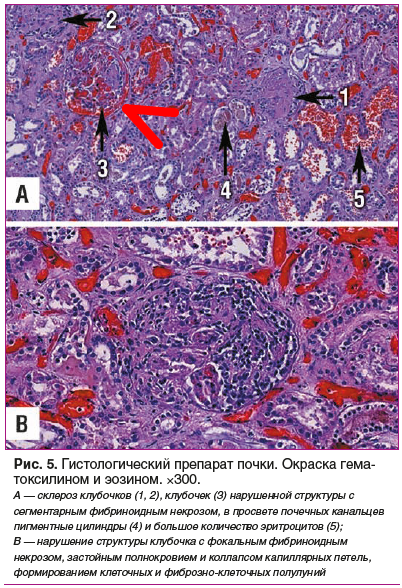
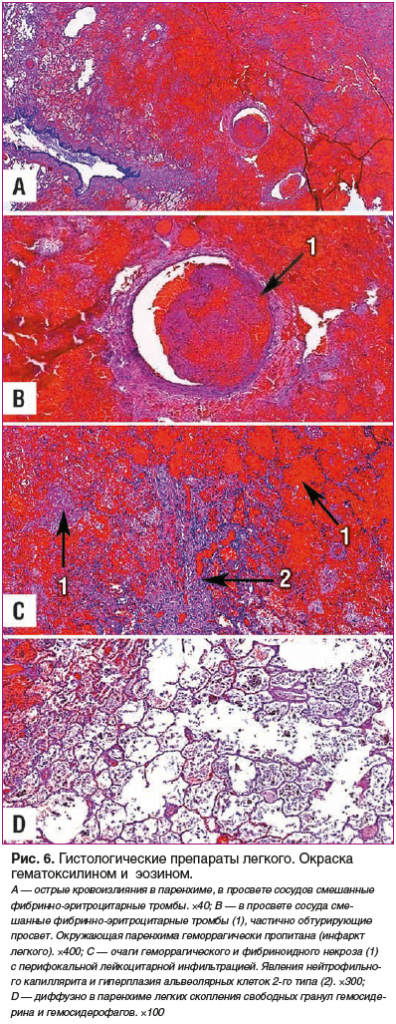
Обсуждение
Синдром Гудпасчера является редким аутоиммунным заболеванием, и, несмотря на яркую симптоматику, верификация диагноза представляет значительные трудности. В ревматологическом отделении ГБУЗ ТО «ОКБ № 1» настоящее наблюдение СГ является первым, подтвержденным иммунологическими и морфологическими методами обследования.
В настоящее время вместо СГ предлагается употреблять термин «болезнь, обусловленная антителами к базальной мембране клубочка (анти-БМК болезнь)», который зарегистрирован в онлайн-версии регистра наследственных болезней человека (Online Mendelian Inheritance in Man, OMIM) под номером 233450 [10] и в Международном регистре орфанных заболеваний под номером ORPHA375 [11]. Однако действующая Международная классификация болезней 10-го пересмотра (МКБ-10), являющаяся в настоящее время основополагающим документом для постановки клинического диагноза, кодом М31.0 определяет «синдром Гудпасчера», а термин «анти-БМК болезнь» в МКБ-10 отсутствует [12].
Причины развития СГ не установлены. Большинство авторов отмечают связь заболевания с перенесенной респираторной вирусной или бактериальной инфекцией, а также с контактом с углеводородами, такими как трихлорэтан, тетрахлорметан, пары клея, газообразный хлор, перхлорэтилен, толуол [13].
В дебюте заболевания у описываемой пациентки регистрировались явления ОРВИ, но утверждать, что дебют СГ был ассоциирован с определенной вирусной инфекцией, не представляется возможным.
Хотя классическая клиническая картина СГ включает сочетание поражения легких с быстропрогрессирующим гломерулонефритом (у 60–80% больных), до 40% пациентов имеют только признаки анти-БМК гломерулонефрита, у части из них почечная дисфункция прогрессирует исключительно медленно [14]. У 10% пациентов поражение легких носит изолированный характер [15].
Особенностями течения СГ в представленном клиническом наблюдении явились:
молниеносная (в течение суток) утрата функции почек, потребовавшая незамедлительного назначения заместительной терапии;
стертые клинические проявления патологии легких и подтверждение геморрагического альвеолита только с помощью инструментального обследования (КТ).
Основные этапы терапии СГ включают использование плазмафереза и применение глюкокортикостероидов (ГКС) и цитостатиков. В литературе встречаются единичные работы по успешному применению для лечения СГ ритуксимаба [16], однако это лекарственное средство назначается при данном заболевании off-label, отсутствует четкое понимание, на каком этапе развития болезни следует его назначать.
Стоит отметить, что национальные рекомендации по диагностике и лечению гломерулонефрита при СГ разработаны и утверждены Ассоциацией нефрологов России в 2014 г. [17], а представленный проект клинических рекомендаций от 2021 г. по диагностике и лечению гломерулонефрита, обусловленного анти-БМК антителами [18], в настоящее время пока не одобрен научно-практическим советом Минздрава РФ, следовательно, не может быть принят к исполнению в учреждениях здравоохранения. Информация о СГ для ревматологов очень ограничена и приводится в клинических рекомендациях от 2017 г. только в разделе «Классификация системных васкулитов» [19]. Междисциплинарные клинические рекомендации при этом отсутствуют. Таким образом, существующие коллизии нормативных документов затрудняют определение того, какой специалист должен вести пациента с СГ.
В качестве стартовой терапии были назначены пульсовые дозы ГКС в комбинации с циклофосфамидом. Плазмаферез был проведен только после перевода пациентки в специализированное ревматологическое отделение, так как при госпитализации в многопрофильное лечебное учреждение данная процедура отсутствовала.
Несмотря на применение синхронной комбинированной пульс-терапии, у пациентки не удалось достичь стабилизации состояния, течение СГ осложнилось легочным кровотечением, а в последующем возникло внутримозговое кровоизлияние на фоне гипертонического криза, с развитием мозговой комы и летального исхода.
Особенностями ведения пациентки с СГ в представленном клиническом наблюдении явились:
госпитализация в лечебное учреждение с отсутствием в штате врача-ревматолога, в связи с чем иммуносупрессивная терапия начата на 6-й день после поступления в стационар;
отсутствие технической возможности проведения плазмафереза в лечебном учреждении, куда была госпитализирована пациентка, на начальном этапе курации;
резистентность к синхронной интенсивной иммуносупрессивной терапии на этапе оказания специализированной медицинской помощи в ревматологическом отделении.
Заключение
Синдром Гудпасчера, или анти-БМК болезнь, относится к разряду редких нозологий, протекает с различными вариантами дебюта, развития и исходов, что может вызвать затруднение ее диагностики врачами различных специальностей, особенно при отсутствии достаточных знаний и опыта. Демонстрация как типичных, классических вариантов СГ, так и атипичных форм способствует более четким представлениям о данной нозологии. Представленное клиническое наблюдение свидетельствует о необходимости сохранения настороженности в отношении СГ во всех случаях быстропрогрессирующего гломерулонефрита. Кроме того, анализ ведения представленной пациентки выявил острую потребность в пересмотре и адаптации к рутинной клинической практике междисциплинарных алгоритмов ведения больных СГ, с устранением терминологических разногласий, определением порога вмешательства врача первичного звена и врача-специалиста (нефролога, пульмонолога, ревматолога).
2. Bergs L. Goodpasture syndrome. Crit Care Nurse. 2005;25(5):50–54, 56, 57–8. PMID: 16183752.
3. Pedchenko V., Bondar O., Fogo A.B. et al. Molecular architecture of the Goodpasture autoantigen in anti-GBM nephritis. N Engl J Med. 2010;363(4):343–354. DOI: 10.1056/NEJMoa0910500.
4. McAdoo S.P., Pusey C.D. Anti-Glomerular Basement Membrane Disease. Clin J Am Soc Nephrol. 2017;12(7):1162–1172. DOI: 10.2215/CJN.01380217.
5. Cui Z., Zhao J., Jia X.Y. et al. Anti-glomerular basement membrane disease: outcomes of different therapeutic regimens in a large single-center Chinese cohort study. Medicine (Baltimore). 2011;90(5):303–311. DOI: 10.1097/MD.0b013e31822f6f68.
6. Segelmark M., Hellmark T. Anti-glomerular basement membrane disease: an update on subgroups, pathogenesis, and therapies. Nephrol Dial Transplant. 2019;34(11):1826–1832. DOI: 10.1093/ndt/gfy327.
7. Wilson C.B., Dixon F.J. Anti-glomerular basement membrane antibody-induced glomerulonephritis. Kidney Int. 1973;3(2):74–89. DOI: 10.1038/ki.1973.14.
8. Dammacco F., Battaglia S., Gesualdo L., Racanelli V. Goodpasture’s disease: a report of ten cases and a review of the literature. Autoimmun Rev. 2013;12(11):1101–1108. DOI: 10.1016/j.autrev.2013.06.014.
9. Jurcić V., Vizjak A., Rigler A.A. et al. Goodpasture’s syndrome with concomitant immune complex mixed membranous and proliferative glomerulonephritis. Clin Nephrol. 2014;81(3):216–223. DOI: 10.5414/CN107454.
10. Online Mendelian Inheritance in Man (OMIM®). Goodpasture syndrome. (Electronic resourse.) URL: https://omim.org/entry/233450?search=Goodpasture%27s%20syndrome&highlight=goodpasture%20syndrome%20syndromic (access date: 10.11.2022).
11. The portal for rare diseases and orphan drags. (Electronic resourse.) URL: https://www.orpha.net/consor/cgi-in/Disease_Search.php?lng=EN&data_id=747&Disease_Disease_Search_diseaseGroup=Goodpasture-s-syndrome&Disease_Disease_Search_diseaseType=Pat&Disease(s)/group%20of%20diseases=Anti-glomerular-basement-membrane-disease&title=Anti-glomerular%20basement%20membrane%20disease&search=Disease_Search_Simple (access date: 10.11.2022).
12. Международная классификация болезней 10-го пересмотра. (Электронный ресурс.) URL: https://mkb-10.com (дата обращения: ). [The International Statistical Classification of Diseases and Related Health Problems. 10th revision (ICD-10). (Electronic resourse.) URL: https://mkb-10.com / (access date: 10.11.2022)].
13. Мухин Н.А. Синдром Гудпасчера. В кн.: Нефрология: руководство для врачей. Под ред. Тареевой Е.И. М.: Медицина; 2000. [Mukhin N.A. Goodpasture syndrome. In: Nephrology: a guide for physicians. Tareeva E.I., ed. M.: Meditsina; 2000 (in Russ.)].
14. Nasr S.H., Collins A.B., Alexander M.P. The clinicopathologic characteristics and outcome of atypical anti-glomerular basement membrane nephritis. Kidney Int. 2016;89(4):897–908. DOI: 10.1016/j.kint.2016.02.001.
15. Буланова М.Л., Потапов Д.В., Буланов Н.М. и др. Атипичное течение болезни Гудпасчера: клиническое наблюдение и обзор литературы. Терапевтический архив. 2018;90(6):130–136. [Bulanova M.L., Potapov D.V., Bulanov N.M. et al. Atypical Goodpasture’s disease: a clinical case report and literature review. Terapevticheskii arkhiv. 2018;90(6):130–136 (in Russ.)]. DOI: 10.26442/terarkh2018906130-136.
16. Головач И.Ю., Яременко О.Б., Стельмащук В.П. и др. Клинический случай успешного лечения синдрома Гудпасчера ритуксимабом. Почки. 2018;7(2):138–146. [Golovach I.Yu., Yaremenko O.B., Stelmashuk V.P. et al. Clinical case of successful treatment of Goodpasture’s syndrome with rituximab. Počki. 2018;7(2):138–146 (in Russ.)]. DOI: 10.22141/2307-1257.7.2.2018.127401.
17. Национальные рекомендации «Диагностика и лечение гломерулонефрита, обусловленного антителами к гломерулярной базальной мембране (при синдроме Гудпасчера)». М.; 2014. [National guidelines "Diagnosis and treatment of glomerulonephritis caused by antibodies to the glomerular basement membrane (in Goodpasture’s syndrome)". М.; 2014 (in Russ.)].
18. Диагностика и лечение гломерулонефрита, обусловленного антителами к базальной мембране клубочка. Клинические рекомендации. 2021. [Diagnosis and treatment of glomerulonephritis caused by antibodies to the glomerular basement membrane. Clinical guidelines. 2021 (in Russ.)].
19. Российские клинические рекомендации. Ревматология. Под ред. Насонова Е.Л. М.: ГЭОТАР-Медиа; 2017. [Russian clinical guidelines. Rheumatology. Nasonov E.L., ed. M.: GEOTAR-Media; 2017 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
