Применение теноксикама при активном аксиальном спондилоартрите: клинический и лабораторный ответ на терапию
Цель исследования: изучить клинико-лабораторный ответ на терапию теноксикамом (Тексаред®) у пациентов с активным аксиальным спондилоартритом (акСпА).
Материал и методы: в исследование включены 26 пациентов с активным акСпА и показателем BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) ≥4,0, принимавшие ранее различные нестероидные противовоспалительные препараты (НПВП). После предварительного обследования, при соответствии критериям включения, пациентам назначили постоянный прием теноксикама (Тексаред®) 20 мг/сут перорально. Исходно и через 30 дней пациенты заполняли электронные опросники для оценки активности заболевания, выраженности боли и скованности. Пациенты оценивали боль в нижней части спины в общем и интенсивность ночной боли в частности по визуально-аналоговой шкале. Врач рассчитывал показатели BASDAI и ASDAS-СРБ (Ankylosing Spondylitis Disease Activity Score-СРБ), оценивал активность заболевания, эффективность и переносимость проводимой терапии. Исходно и через 30 дней у всех пациентов исследовали биохимические показатели крови, показатели общего анализа крови и мочи, уровни интерлейкина (ИЛ) 6, ИЛ-17, фактора некроза опухоли α (ФНО-α).
Результаты исследования: у больных акСпА с высокой и очень высокой активностью, принимавших ранее различные НПВП, отмечено снижение активности заболевания на фоне терапии теноксикамом. При регулярном приеме препарата эффект развивается уже в течение первых 2 нед., а через 4 нед. отчетливо уменьшается выраженность боли в нижней части спины и продолжительность утренней скованности, снижается показатель BASDAI. Кроме того, на фоне терапии Тексаредом через 30 дней у пациентов было отмечено снижение уровней С-реактивного белка (СРБ), ИЛ-6 и ИЛ-17.
Заключение: положительное влияние на течение заболевания, динамика изменений уровней СРБ, ИЛ-6 и ИЛ-17 на фоне терапии Тексаредом в течение всего 4 нед. вселяет определенный оптимизм при планировании дальнейших исследований эффективности лечения активного акСпА.
Ключевые слова: аксиальный спондилоартрит, нестероидные противовоспалительные препараты (НПВП), теноксикам, постоянный прием НПВП, интерлейкин 6, интерлейкин 17, фактор некроза опухоли α.
Для цитирования: Ребров А.П., Никитина Н.М., Магдеева Н.А., Богдалова Л.Р. Применение теноксикама при активном аксиальном спондилоартрите: клинический и лабораторный ответ на терапию. РМЖ. Медицинское обозрение. 2023;31(2):38-42.
Tenoxicam in active axial spondyloarthritis: clinical and laboratory response to therapy
A.P. Rebrov, N.M. Nikitina, N.A. Magdeeva, L.R. Bogdalova
V.I. Razumovskiy Saratov State Medical University, Saratov
Aim: to study the clinical and laboratory response to tenoxicam (Texared®) therapy in patients with active axial spondyloarthritis (SpA).
Patients and Methods: the study included 26 patients with active axial SpA and BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) ≥4.0 who had previously taken various nonsteroidal anti-inflammatory drugs (NSAIDs). After a preliminary examination, in accordance with the inclusion criteria, patients were prescribed the regular administration of tenoxicam (Texared®) 20 mg/day orally. Initially and after 30 days, patients filled out electronic questionnaires to assess the disease activity, the severity of pain and stiffness. The patients assessed the pain in the lower back in general and the intensity of pain at night in particular on a visual analog scale (VAS). The doctor calculated BASDAI, ASDAS-CRP (Ankylosing Spondylitis Disease Activity Score-CRP), the disease activity, the efficacy and therapy tolerability. Initially and after 30 days, blood chemistry value, complete blood count and urine test, levels of interleukin 6 (IL-6), interleukin 17 (IL-17), tumor necrosis factor α (TNF-α) were examined in all patients.
Results: there was a decrease in the disease activity in the setting of therapy with tenoxicam in patients with axial SpA of high and very high activity, who had previously taken various NSAIDs. With regular administration of Texared, the effect developed within the first 2 weeks. After 4 weeks, the pain severity in the lower back and the duration of morning stiffness clearly decreased, as well as the BASDAI index. Besides, in the setting of Texared therapy for 30 days, patients showed a decrease in the levels of C-reactive protein (CRP), IL-6 and IL-17.
Conclusion: the positive effect on the disease course, the trend of changes in the levels of CRP, IL-6 and IL-17 during Texared® therapy for only 4 weeks inspired some optimism when planning further studies of the treatment efficacy of active axial SPA.
Keywords: axial spondyloarthritis, nonsteroidal anti-inflammatory drugs (NSAIDs), tenoxicam, regular administration of NSAIDs, interleukin 6, interleukin 17, tumor necrosis factor α.
For citation: Rebrov A.P., Nikitina N.M., Magdeeva N.A., Bogdalova L.R. Tenoxicam in active axial spondyloarthritis: clinical and laboratory response to therapy. RMJ. 2023;2:38–42.
Введение
Спондилоартриты (СпА) представляют собой группу заболеваний, включающую периферические и аксиальные СпА (акСпА). Для клинической картины СпА характерны воспалительная боль в спине; синовит (асимметричный с пре-имущественным поражением суставов нижних конечностей); дактилит; боли в местах прикрепления сухожилий, суставных капсул, связок к кости (энтезит); а также поражение кожи (псориаз), поражение глаз (увеит), хронические воспалительные заболевания кишечника (болезнь Крона или язвенный колит) [1]. В течение двух десятилетий большое внимание было привлечено к роли интерлейкина (ИЛ) 17 и ИЛ-23 в патогенезе СпА, а результаты этих исследований позволили разработать таргетные методы лечения [2].
В 1996 г. был открыт фактор, оказывающий влияние на выработку синовиоцитами ИЛ-6 и ИЛ-8 при ревматоидном артрите, названный ИЛ-17А [3]. Впоследствии были идентифицированы другие варианты ИЛ-17, включая ИЛ-17F, гомологичный ИЛ-17A приблизительно на 50%. Обе эти изоформы ассоциируются с выработкой фактора некроза опухоли α (ФНО-α) [4, 5].
Интерлейкин 17 продуцируют Т-клетки, например CD8+ Т-клетки, γδ Т-клетки, врожденные лимфоидные клетки 3-го типа и Т-клетки естественных киллеров [6]. Другие типы клеток, такие как нейтрофилы и тучные клетки, не экспрессируют мРНК ИЛ-17, но могут депонировать экзогенный ИЛ-17 [7–10].
Поскольку применение нестероидных противовоспалительных препаратов (НПВП) у пациентов со СпА рассматривают в качестве патогенетического лечения, эти препараты применяют как для первой линии стартовой терапии, так и для базисной длительной терапии [11–14]. Доказано, что у пациентов с анкилозирующим спондилитом (АС) длительный постоянный прием НПВП ассоциируется с уменьшением прогрессирования структурных изменений позвоночника, замедлением роста синдесмофитов [15, 16]. В то же время представляют несомненный интерес вопросы: каков характер изменения уровней интерлейкинов на фоне терапии НПВП, а также существует ли взаимо-связь между динамикой клинических проявлений заболевания и лабораторными маркерами.
Теноксикам относится к группе неселективных НПВП [17], обладает выраженным противовоспалительным, анальгетическим действием, помогает блокировать свободные радикалы, свободный гистамин, уменьшает поствоспалительное склерозирование тканей, активность коллагеназы и протеогликаназы. Его влияние на цитокины, ключевые в патогенезе СпА (ИЛ-17, ФНО-α, ИЛ-6), требует дальнейшего изучения, что и явилось целью нашего исследования.
Цель исследования: изучить клинико-лабораторный ответ на терапию теноксикамом (Тексаред®) у пациентов с активным акСпА, ранее принимавших различные НПВП.
Материал и методы
Обследуемая популяция — пациенты с активным акСпА, включая АС, ранее принимавшие различные НПВП.
Дизайн и методология исследования: открытое одноцентровое проспективное наблюдение. В исследование предполагалось включать пациентов с активным акСпА, получавших терапию НПВП не менее месяца, но не достигших значений BASDAI≤4,0 (день 0). На неделе 0 пациентам планировалось назначение теноксикама (Тексаред®) в суточной дозе 20 мг (по 20 мг 1 р/сут). Первичные конечные точки (достоверное снижение продолжительности скованности у пациентов с акСпА и число пациентов, в сыворотке крови которых снизились концентрации СРБ, ФНО-α, ИЛ-6, ИЛ-17 на неделе 4 по сравнению с неделей 0) определяли через 30 дней после назначения теноксикама (неделя 4). Для контроля безопасности лечения учитывали нежелательные явления, оценивали жизненно важные функции, выполняли физикальное обследование и лабораторные исследования.
Критериями включения в исследование являлись: возраст ≥18 лет, достоверный диагноз акСпА согласно критериям ASAS, включая АС согласно модифицированным Нью-Йоркским критериям, с показателем BASDAI ≥4. Все пациенты находились на стабильной базисной терапии в течение 4 нед. и более, предшествовавших исходному визиту. Ни один из пациентов не принимал теноксикам ранее. Все пациенты подписали письменное информированное согласие на участие в исследовании.
Критериями невключения являлись: беременность или кормление грудью; использование глюкокортикоидов в дозе >10 мг/сут; язвенное поражение желудочно-кишечного тракта (ЖКТ) или желудочно-кишечное кровотечение в анамнезе; неконтролируемая артериальная гипертензия; острые сердечно-сосудистые события в течение последних 6 мес.; артериальные и венозные тромбозы в анамнезе; сердечная недостаточность (NYHA III–IV); большие хирургические вмешательства за 12 нед. до скрининга; наличие тяжелой неконтролируемой патологии ЖКТ, печени, мочевыделительной, дыхательной, сердечно-сосудистой, нервной или эндокринной систем; любая активная инфекция на момент обследования; интеркуррентные, клинически значимые инфекционные заболевания в анамнезе, включая коронавирусную инфекцию, в течение последних 6 мес.; фибромиалгия; значимые лабораторные отклонения, включая снижение уровня гемоглобина <85 г/л, тромбоцитов <125×109/л, повышение уровня глюкозы крови натощак ≥7,0 ммоль/л, креатинина сыворотки крови >140 мкмоль/л для женщин или >160 мкмоль/л для мужчин, уровня аланинаминотрансферазы, аспартатаминотрансферазы в 3 раза больше нормы и выше.
В соответствии с критериями включения и невключения в исследование включены 26 пациентов с активными СпА: 18 пациентов (16 мужчин и 2 женщины) с АС, 8 пациентов (6 мужчин и 2 женщины) с акСпА. После исходного обследования пациентам был назначен постоянный пероральный прием теноксикама (Тексаред®) в дозе 20 мг/сут. Пациенты посещали врача дважды: исходно и через 30 дней от начала приема теноксикама.
Исходно и через 30 дней лечения проводили опрос, общий осмотр пациентов, оценивали эффективность и переносимость лечения. Для оценки активности заболевания, выраженности боли и скованности на 1-й и 30-й день пациенты заполняли электронные опросники. Пациенты оценивали боль в нижней части спины в общем и интенсивность ночной боли в частности по визуально-аналоговой шкале (ВАШ). На основании опросников, заполненных пациентами, врач рассчитывал показатели BASDAI, ASDAS-СРБ, оценивал активность заболевания по ВАШ.
Исходно и через 30 дней у всех пациентов исследовали биохимические показатели крови, показатели общего анализа крови и мочи, уровни ФНО-α, ИЛ-6, ИЛ-17. Для количественного анализа биомаркеров образцы крови брали из локтевой вены натощак в утренние часы. Концентрацию цитокинов (ФНО-α, ИЛ-6, ИЛ-17) в сыворотке определяли методом твердофазного иммуноферментного анализа (ИФА) с использованием соответствующих наборов реагентов ИФА-БЕСТ на анализаторах Stat Fax-2100, Shaker ST-3L.
Статистическую обработку данных проводили с использованием программы StatSoft Statistica 10.0. Качественные показатели представлены в виде абсолютных и относительных (%) значений. Для проверки соответствия распределения количественных признаков нормальному распределению применяли методы Колмогорова — Смирнова и Шапиро — Уилка, нормальным считали распределение при p>0,05. Для описания нормально распределенных признаков использовали среднее значение признака и среднее квадратичное отклонение (M±δ); для описания признаков с ненормальным распределением указывали медиану, верхний и нижний квартили (Me [Q1; Q3]). Для сравнения двух групп с нормальным распределением количественного признака использовали парный t-критерий Стьюдента, а для сравнения показателей с ненормальным распределением — критерий Вилкоксона. Различия считали статистически значимыми при p<0,05.
Исследование одобрено локальным этическим комитетом ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России.
Результаты исследования
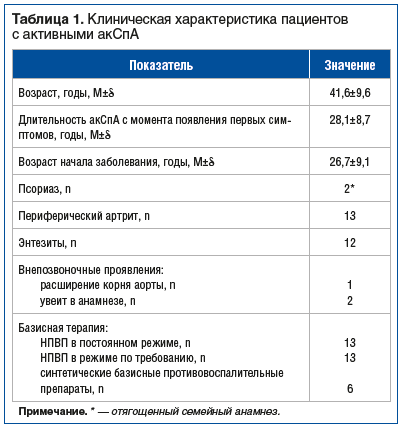
В исследование включали пациентов с BASDAI>4 (высокая активность) с недостаточным эффектом предшествующей терапии. Клиническая характеристика обследованных пациентов представлена в таблице 1. У 13 (50%) пациентов поражение позвоночника сочеталось с периферическим артритом.
По мнению врача, средняя активность заболевания по ВАШ составила 6 [5; 7] баллов до начала терапии и 3 [2; 5] балла на фоне приема Тексареда (p≤0,0001). Изменения показателей активности и клинического течения заболевания представлены в таблице 2.
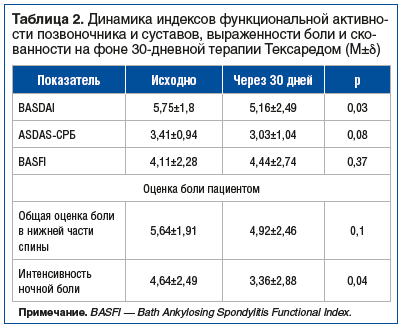
На фоне постоянного приема Тексареда отмечено статистически значимое снижение показателя BASDAI, интенсивности ночной боли. У 3 пациентов с высокой активностью акСпА на фоне терапии Тексаредом отмечено клинически значимое улучшение (снижение ASDAS на 1,1 балла). Среди пациентов с очень высокой исходной активностью заболевания по ASDAS-СРБ у одного пациента достигнуто снижение активности, тогда как клинически значимое улучшение наблюдалось еще у 4 пациентов. У части пациентов отмечена тенденция к улучшению показателя ASDAS-СРБ, однако у 6 пациентов с высокой активностью и у 3 пациентов с очень высокой активностью индекс ASDAS-СРБ существенно не изменился. Двум из этих пациентов с очень высокой активностью по индексу ASDAS-СРБ в дальнейшем были назначены биологические генно-инженерные препараты.
Установлен очень большой разброс уровней изучаемых интерлейкинов у пациентов. Наибольший диапазон колебаний отмечен для ИЛ-17. У 5 (19,2%) пациентов отмечено исходное повышение содержания ФНО-α, у 6 (23,1%) — ИЛ-6, у 15 (57,7%) — ИЛ-17. Одновременное снижение уровней ФНО-α и ИЛ-17 установлено у 4 пациентов, ИЛ-6 и ИЛ-17 — у 1 пациента (табл. 3).
![Таблица 3. Изменение средних показателей ФНО-α, ИЛ-6, ИЛ-17 на фоне 30-дневной терапии Тексаредом (Me [Q1; Q3]) Таблица 3. Изменение средних показателей ФНО-α, ИЛ-6, ИЛ-17 на фоне 30-дневной терапии Тексаредом (Me [Q1; Q3])](/upload/medialibrary/117/38-3.png)
Через 30 дней приема Тексареда повышение уровня ФНО-α отмечено у 4 пациентов с исходно повышенным уровнем, у 8 пациентов с исходно нормальным уровнем, у 13 пациентов уровень ФНО-α сохранялся прежним и у 1 пациента отмечено снижение уровня ФНО-α одновременно с резким снижением уровня ИЛ-17. Все пациенты с повышенным уровнем ФНО-α перенесли коронавирусную инфекцию в течение предыдущих 12 мес.
Уровень ИЛ-6 повысился у 2 пациентов, у 18 — сохранился на прежнем уровне, у 6 — отмечена тенденция к снижению. У всех пациентов со снижением уровня ИЛ-6 наблюдалось выраженное снижение концентрации СРБ. Повышенный уровень ИЛ-17 сохранялся у 6 пациентов, снижение отмечено у 8 пациентов, причем у всех уровень цитокина исходно был значимо повышен.
Не выявлено взаимосвязи между индексами активности и лабораторными показателями как исходно, так и в динамике.
По результатам анкетирования (влияние на боль в нижней части спины, на утреннюю скованность) положительный клинический эффект Тексареда в различной степени отметили 16 (61,5%) пациентов из 26 [18]. При этом ни у одного из этих пациентов не был снижен уровень ФНО-α. В то же время снижение концентрации ИЛ-6 и ИЛ-17 отмечено у 5 и 6 пациентов соответственно, повышение уровня ИЛ-6 выявлено у 1 пациента, а ИЛ-17 — у 3 пациентов.
После завершения исследования 4 (15,3%) пациента отметили, что эффект терапии значительно превосходил результат предыдущего лечения НПВП, и выразили желание продолжить терапию Тексаредом после окончания исследования. Остальные пациенты оценивали эффект Тексареда как сопоставимый с эффектом ранее применяемых препаратов.
Обсуждение
Лабораторное исследование биомаркеров в крови — полезный инструмент для диагностики заболевания на ранней стадии, оценки воспалительной активности, прогрессирования структурных изменений при СпА. Значение концентрации СРБ используют для подсчета индекса активности ASDAS-СРБ, при этом она умеренно коррелирует с индексами ASDAS, BASDAI и активностью локального воспаления [19]. Уровень СРБ также служит информативным маркером для оценки эффективности терапии СпА [20]. В нашем исследовании у пациентов за 30 дней лечения Тексаредом отмечено статистически значимое снижение уровня BASDAI, интенсивности ночной боли и параллельное снижение средней концентрации СРБ с 10,3 [4,04; 16,01] до 5,9 [2,6; 19,6], т. е. почти двукратное ее уменьшение (p<0,05).
Цитокины ФНО-α, ИЛ-23 и ИЛ-17 являются ключевыми патогенетическими маркерами и терапевтическими мишенями при АС и других СпА [21–23]. В сыворотке и плазме крови больных АС отмечено достоверное повышение концентрации ФНО-α, ИЛ-17, -23, -21, -6, -8 [20, 24]. Однако в нашем исследовании уровень ФНО-α чаще не был повышен, его повышение отмечено только у лиц, перенесших коронавирусную инфекцию. Концентрация ИЛ-6 в крови коррелирует с индексами BASDAI и ASDAS, уровнем СРБ и признаками воспалительной активности заболевания, выявленными при магнитно-резонансной томографии [19, 25, 26]. По результатам проведенного нами исследования отмечено снижение концентрации ИЛ-6 на фоне терапии Тексаредом у четверти пациентов в совокупности с выраженным снижением уровня СРБ.
Данные о связи концентрации других цитокинов с активностью патологического процесса противоречивы и нуждаются в уточнении. Ведется активная дискуссия по ряду вопросов. Через какое время от начала приема НПВП следует оценивать их эффективность, по каким параметрам? При оценке эффективности следует опираться только на динамику клинических параметров или целесообразно учитывать также некоторые лабораторные данные, помимо уровня СРБ? С одной стороны, полученные нами результаты свидетельствуют о том, что за период в 4 нед. не всегда фиксируются значимые изменения индексов активности. С другой стороны, уже через 4 нед. терапии у 50% пациентов с исходно высокой активностью заболевания отмечено уменьшение боли в спине в ночные часы, у 43,3% — уменьшение общей выраженности боли. Именно этим обстоятельством обосновано использование последних показателей для оценки эффективности лечения в ранние сроки приема препарата. Кроме того, снижение активности заболевания на основании анализа изменений показателей опросника ASDAS-СРБ, включающего, наряду с вопросами о функциональной активности, данные о концентрации СРБ, подтверждает выраженный противовоспалительный эффект Тексареда. В то же время изменение уровней интерлейкинов свидетельствует о высокой индивидуальной вариабельности, что, вероятно, связано с длительностью заболевания (от нескольких месяцев до 35 лет), особенностями его течения и предшествующего лечения.
Ограничения исследования. Исследование проведено на сравнительно небольшой выборке пациентов с активными акСпА, взятых под наблюдение на разных сроках заболевания, принимавших до начала исследования в течение 4 нед. и более различные НПВП в разных дозах. Проспективное наблюдение за большей выборкой пациентов, более однородной по предшествующей терапии, на этапе стартовой терапии НПВП позволит более подробно изучить динамику клинических и лабораторных параметров, включая изменение содержания основных патогенетически важных интерлейкинов. Следует осторожно экстраполировать выводы настоящего исследования на все категории пациентов с акСпА.
Заключение
У пациентов с высокой и очень высокой активностью акСпА, ранее принимавших различные НПВП, отмечен по- ложительный результат терапии теноксикамом (Тексаред®) в виде снижения активности заболевания . Эффект Тексареда развивается при регулярном приеме уже в течение первых 2 нед., а через 4 нед. установлено отчетливое снижение выраженности боли в нижней части спины, уменьшение продолжительности утренней скованности. При этом на фоне лечения Тексаредом в течение 30 дней у пациентов отмечено снижение уровней СРБ, ИЛ-6 и ИЛ-17. Эти изменения на фоне терапии Тексаредом в течение всего лишь 4 нед., положительно влияющие на течение заболевания, вселяют определенный оптимизм при планировании дальнейших исследований по оценке эффективности лечения НПВП пациентов с активными акСпА.Источники финансирования: статья подготовлена в рамках выполнения научной программы «Изменение выраженности Скованности и уровня провоспалительных цитокинов в сыворотке крови при применении ТЕНоксикама у пациентов с активным Аксиальным спондилоартритом — 4-недельное проспективное открытое наблюдение (СТЕНА)» при поддержке компании Dr. Reddy’s Laboratories.
2. Sieper J., Poddubnyy D., Miossec P. The IL-23–IL-17 Pathway as a Therapeutic Target in Axial Spondyloarthritis. Nat Rev Rheumatol. 2019;15:747–757. DOI: 10.1038/s41584-019-0294-7.
3. Fossiez F., Djossou O., Chomarat P. et al. T Cell interleukin-17 Induces Stromal Cells to Produce Proinflammatory and Hematopoietic Cytokines. J Exp Med. 1996;183:2593–2603. DOI: 10.1084/jem.183.6.2593.
4. Aggarwal S., Gurney A.L. Il-17: Prototype Member of an Emerging Cytokine Family. J Leukoc Biol. 2002;71:1–8.
5. Zrioual S., Ecochard R., Tournadre A. et al. Genome-wide comparison between IL-17A- and IL-17F-induced effects in human rheumatoid arthritis synoviocytes. J Immunol. 2009;182:3112–3120. DOI: 10.4049/jimmunol.0801967d.
6. Raychaudhuril S.P., Raychaudhuri S.K. IL-23/IL-17 axis in spondyloarthritis-bench to bedside. Clin Rheumatol. 2016;35(6):1437–1441. DOI: 10.1007/s10067-016-3263-4.
7. Raychaudhuri S.P., Raychaudhuri S.K. Mechanistic rationales for targeting interleukin-17A in spondyloarthritis. Arthritis Res Ther. 2017;19:51. DOI: 10.1186/s13075-017-1249-5.
8. Tamarozzi F., Wright H.L., Thomas H.B. et al. A lack of confirmation with alternative assays questions the validity of IL-17A expression in human neutrophils using immunohistochemistry. Immunol Lett. 2014;162:194–198. DOI: 10.1016/j.imlet.2014.10.025.
9. Noordenbos T., Blijdorp I., Chen S. et al. Human mast cells capture, store, and release bioactive, exogenous IL-17A. J Leukoc Biol. 2016;100:453–462. DOI: 10.1189/jlb.3HI1215-542R.
10. Boutet M.A., Nerviani A., Gallo Afflitto G., Pitzalis C. Role of the IL-23/IL-17 axis in psoriasis and psoriatic arthritis: the clinical importance of its divergence in skin and joints. Int J Mol Sci. 2018;19(2):530. DOI: 10.3390/ijms19020530.
11. Na Y.R., Yoon Y.N., Son D.I., Seok S.H. Cyclooxygenase-2 inhibition blocks M2 macrophage differentiation and suppresses metastasis in murine breast cancer model. PLoS One. 2013;8(5):e63451. DOI: 10.1371/journal.pone.0063451.
12. Kumagai K., Kubo M., Imai S. et al. The COX-2 selective blocker etodolac inhibits TNFα-Induced apoptosis in isolated rabbit articular chondrocytes. Int J Mol Sci. 2013;14(10):19705–19715. DOI: 10.3390/ijms141019705.
13. Dong X., Li R., Xiu P. et al. Meloxicam executes its antitumor effects against hepatocellular carcinoma in COX-2-dependent and —independent pathways. PLoS One. 2014;9(3):e92864. DOI: 10.1371/journal.pone.0092864.
14. Wang R., Dasgupta A., Ward M.M. Comparative efficacy of non-steroidal anti-inflammatory drugs in ankylosing spondylitis: a Bayesian network meta-analysis of clinical trials Ann Rheum Dis. 2015;0:1–9. DOI: 10.1136/annrheumdis-2015-207677.
15. Poddubnyy D., Rudwaleit M., Haibel H. et al. Rates and predictors of radiographic sacroiliitis progression over 2 years in patients with axial spondyloarthritis. Ann Rheum. Dis. 2011;70(8):1369–1374. DOI: 10.1136/ard.2010.145995.
16. Wanders A., Heijde Dv., Landewé R. et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum. 2005;52:1756–1765. DOI: 10.1002/art.2105.
17. Каратеев А.Е. Использование нестероидных противовоспалительных препаратов в реальной клинической практике: новые возможности. Consilium Medicum. 2018;20(9):88–94. [Karateev A.E. The use of nonsteroidal anti-inflammatory drugs in real clinical practice: new opportunities. Consilium Medicum. 2018;20(9):88–94 (in Russ.)]. DOI: 10.26442/2075-1753_2018.9.88-94.
18. Ребров А.П., Никитина Н.М., Магдеева Н.А., Богдалова Л.Р. Применение теноксикама при активном аксиальном спондилоартрите — акцент на эффективность и безопасность. Научно-практическая ревматология. 2022;60(6):612–617. [Rebrov A.P., Nikitina N.M., Magdeeva N.A., Bogdalova L.R. The use of tenoxicam in active axial spondyloarthritis — focus on efficacy and safety. Rheumatology Science and Practice. 2022;60(6):612–617 (in Russ.)]. DOI: 10.47360/1995-4484-2022-612-617.
19. Pedersen S.J., Sørensen I.J., Lambert R.G. et al. Radiographic progression is associated with resolution of systemic inflammation in patients with axial spondylarthritis treated with tumor necrosis factor α inhibitors: a study of radiographic progression, inflammation on magnetic resonance imaging, and circulating biomarkers of inflammation, angiogenesis, and cartilage and bone turnover. Arthritis Rheum. 2011;63(12):3789–3800. DOI: 10.1002/art.30627.
20. Prajzlerova K., Grobelna K., Pavelka K. et al. An update on biomarkers in axial spondyloarthritis. Autoimmun Rev. 2016;15(6):501–509. DOI: 10.1016/j.autrev.2016.02.002.
21. Davis J.C.Jr. Understanding the role of tumor necrosis factor inhibition in ankylosing spondylitis. Semin Athritis Rheum. 2005;34:668–677. DOI: 10.1016/j.semarthrit.2004.08.005.
22. Braun J., Baraliakos X., Heldmann F., Kiltz U. Tumor necrosis factor alpha antagonists in the treatment of axial spondyloarthritis. Expert Opin Investig Drug. 2014;23:647–659. DOI: 10.1517/13543784.2014.899351.
23. Sherlock J.P., Taylor P.C., Buckley C.D. The biology of IL-23 and IL-17 and their therapeutic targeting in rheumatic diseases. Curr Opin Rheumatol. 2015;27:71–75. DOI: 10.1097/BOR.0000000000000132.
24. Reveille J.D. Biomarkers for diagnosis, monitoring of progression, and treatment responses in ankylosing spondylitis and axial spondyloarthritis. Clin Rheumatol. 2015;34(6):1009–1018. DOI: 10.1007/s10067-015-2949-3.
25. Visvanathan S., Wagner C., Marini J.C. et al. Inflammatory biomarkers, disease activity and spinal disease measures in patients with ankylosing spondylitis after treatment with infliximab. Ann Rheum Dis. 2008;67(4):511–517. DOI: 10.1136/ard.2007.071605.
26. Gratacos J., Collado A., Filella X. et al. Serum cytokines (IL-6, TNF-alpha, IL-1 beta and IFN-gamma) in ankylosing spondylitis: a close correlation between serum IL-6 and disease activity and severity. Br J Rheumatol. 1994;33:927–931. DOI: 10.1093/rheumatology/33.10.927.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
