Необычный лихорадочный синдром как специфическая форма протекания генерализованной энтеровирусной инфекции на фоне анти-B-клеточной терапии
Расширение применения таргетных противоопухолевых и иммуносупрессорных препаратов сопровождается возрастанием риска развития редких оппортунистических инфекций и увеличением частоты необычного течения распространенных инфекций. В статье представлено клиническое наблюдение тяжелого протекания энтеровирусной инфекции с формированием специфической клинической картины у пациентки 38 лет, страдавшей В-клеточной лимфомой и получавшей обинутузумаб. Описаны применявшиеся методы дифференциальной диагностики, позволившие выявить энтеровирусную инфекцию, а также проводимое лечение с применением человеческого иммуноглобулина. Обсуждаются вопросы безопасности применения моноклональных антител, направленных против В-лимфоцитов. Приведенное в статье клиническое наблюдение представляет интерес для врачей различных специальностей, поскольку демонстрирует нечастую причину лихорадки неясного генеза, полимиозита и необычного отечного синдрома, возможные механизмы развития которого также обсуждаются авторами. Особенно полезным описание клинического наблюдения может оказаться для врачей, наблюдающих пациентов в процессе лечения анти-В-клеточными препаратами. Высокая значимость энтеровирусной инфекции у таких больных обусловлена неблагоприятным прогнозом в отсутствие специфического лечения и, вследствие этого, критическим значением своевременной постановки диагноза.
Ключевые слова: В-клеточная лимфома, обинутузумаб, энтеровирусная инфекция, дифференциальная диагностика, отеки, человеческий иммуноглобулин, моноклональные антитела..
Для цитирования: Кузьмина А.В., Логинов А.В., Жамбеев А.А., Глазунов П.А., Жиляев Е.В. Необычный лихорадочный синдром как специфическая форма протекания генерализованной энтеровирусной инфекции на фоне анти-B-клеточной терапии. РМЖ. Медицинское обозрение. 2021;29(7):66-69.
Uncommon fever as a specific form of generalized enterovirus infection during anti-B-cell therapy
A.V. Kuzmina1, A.V. Loginov1, A.A. Zhambeyev1, P.A. Glazunov1, E.V. Zhilyaev1–
1European Medical Center, Moscow
2Pirogov Russian National Research Medical University, Moscow
3Russian Medical Academy of Continuous Professional Education, Moscow
The advanced use of targeted immunosuppressive antitumor drugs is accompanied by an increase in the risk of rare opportunistic infections and in the incidence of unusual course of common infections. The article presents a clinical case of a severe enterovirus infection course with a specific clinical picture in a 38-year-old female patient suffering from B-cell lymphoma and receiving obinutuzumab. The methods of differential diagnosis used to detect enterovirus infection, as well as the ongoing treatment using human immunoglobulin, are described. The safety issues concerning the use of monoclonal antibodies directed against B-lymphocytes are also discussed. The clinical case presented in the article is of interest to doctors of various specialties, since it demonstrates the uncommon cause of fever of unknown origin, polymyositis and uncommon edematous syndrome, the possible m echanisms of which are also discussed by the authors. The description of the clinical case may be especially useful for doctors who follow-up patients during treatment with anti-B-cell drugs. The high significance of enterovirus infection in such patients is due to an unfavorable prognosis in the absence of specific treatment. Thus, timely diagnosis is crucial.
Keywords: B-cell lymphoma, obinutuzumab, enterovirus infection, differential diagnosis, edema, human immunoglobulin, monoclonal antibodies.
For citation: Kuzmina A.V., Loginov A.V., Zhambeyev A.A. et al. Uncommon fever as a specific form of generalized enterovirus infection during anti-B-cell therapy. RMJ. 2021;7:66–69.
Введение
В последние 15 лет значительно возросло использование генно-инженерных биологических препаратов в онкологии, гематологии, ревматологии, гастроэнтерологии и в других областях медицины. Расширение применения таргетных противоопухолевых и иммуносупрессорных препаратов сопровождается возрастанием как риска редких оппортунистических инфекций, так и частоты необычного течения распространенных.. Такая ситуация ставит перед врачами различных специальностей новые задачи по своевременному распознаванию и лечению ранее практически не встречавшихся клинических синдромов. Тяжелое течение энтеровирусной инфекции с формированием специфической клинической картины может быть проиллюстрировано следующим клиническим наблюдением.
Клиническое наблюдение
Пациентка З., 38 лет, обратилась в клинику 06.07.2020 с жалобами на выраженные диффузные отеки, увеличение размеров живота, осиплость голоса, повышение температуры тела до 39 °С без озноба, распространенные мышечные боли.
В 2018 г.. у пациентки выявлена В-клеточная лимфома, фолликулярная, 1–2 типа с нодулярно-диффузным ростом. Проведено 6 курсов полихиомиотерапии по схеме G (обинутузумаб) — СНОР. Переносила химиотерапию без особенностей.. Поддерживающая терапия проводилась обинутузумабом, последнее введение — 19.04.2020 в дозе 1000 мг. Спустя 7 дней после введения пациентка отметила появление мышечной боли, отеков ног и рук.. С течением времени боль нарастала, пациентка не могла садиться на унитаз. Постепенно нарастали отеки, отмечалась прибавка массы тела на 11 кг за 2 мес. после последнего введения обинутузумаба, появилась осиплость голоса. С середины июня пациентка отметила повышение температуры тела до 39 °С без озноба. Самостоятельно принимала антипиретики (ибупрофен, парацетамол) — без эффекта. Объективно при осмотре кожные покровы горячие и бледные, температура тела повышена до 39,6 °С. Обращали на себя внимание выраженные тестоватые диффузные отеки, выявлявшиеся и в проксимальных, и в дистальных частях конечностей, на туловище, лице. Аускультативно над поверхностью обоих легких выслушивалось жесткое везикулярное дыхание, которое не проводилось слева ниже VII ребра, справа — ниже V ребра. ЧСС 110–120 в минуту, ритм правильный.. АД 100/70 мм рт. ст. Живот увеличен в объеме за счет асцита, при пальпации безболезненный. Диурез снижен (со слов пациентки). Стул без особенностей.
В лабораторных данных отмечалось значительное повышение показателей острофазового воспалительного ответа (повышение уровней прокальцитонина, ферритина), признаки повреждения поперечно-полосатых мышц (повышение уровней креатинфосфокиназы (КФК), миоглобина), а также увеличение активности АЛТ, АСТ и лактатдегидрогеназы (ЛДГ), источником которых могли быть различные ткани и органы (табл.. 1).
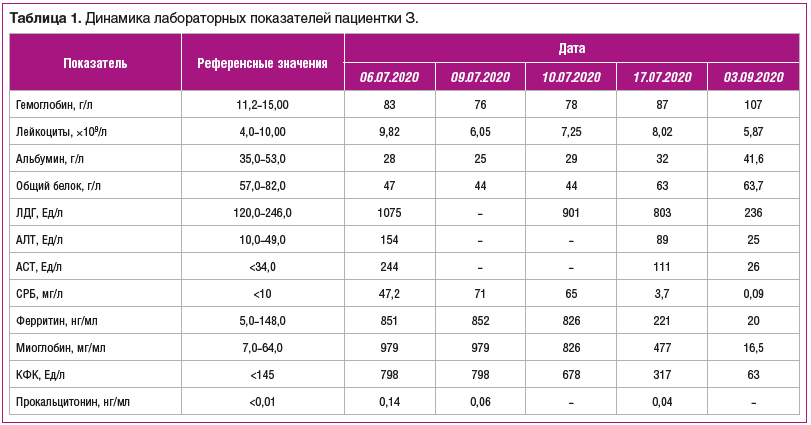
По данным ПЭТ/КТ с 18-фтордезоксиглюкозой и внутривенным контрастированием были выявлены: выраженный отек всей подкожной клетчатки (грудной стенки, брюшной стенки, спины, нижних конечностей), мезентериальной и забрюшинной клетчатки; отек стенки желчного пузыря; лимфоаденопатия забрюшинных, мезентериальных и тазовых лимфоузлов; умеренный выпот в брюшной полости и полости таза; минимальный двусторонний гидроторакс, повышенное накопление радиофармпрепарата в мышцах всех групп (рис. 1).
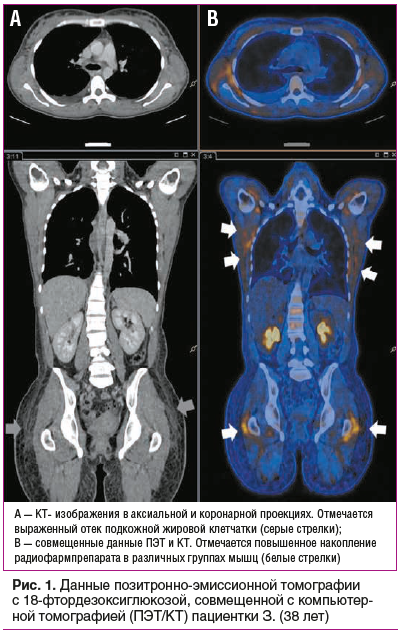
С учетом анамнеза длительной иммуносупрессивной терапии были проведены ПЦР-тесты на различные вирусные (учитывая изолированное повышение СРБ без выраженного повышения прокальцитонина) инфекции: парвовирус B19, вирус Эпштейна — Барр, цитомегаловирус (ЦМВ), герпесвирусы, бокавирус, аденовирус, вирус парагриппа, респираторно-синцитиальный вирус, SARS-CoV-2. Проведены серологические реакции на вирусы гепатитов.. Получены положительные результаты ПЦР-анализа крови и кала на энтеровирус 09.07.2020. Кроме того, была выявлена гипоглобулинемия: IgA 1,82 г/л (референсный интервал 0,4–3,5), IgM 0,4 г/л (0,5–3,0), IgG 5,33 г/л (6,5–16,0) и полная деплеция B-лимфоцитов (абсолютное число CD3/CD19 клеток 0×109/л). С учетом подтвержденной активной энтеровирусной инфекции и гипоглобулинемии начата терапия человеческим иммуноглобулином в суммарной дозе 0,8 г/кг массы тела в виде ежедневных внутривенных инфузий по 10 г. На фоне проводимой терапии отмечен выраженный положительный эффект: температура тела нормализовалась в течение 3 дней, отеки регрессировали, масса тела снизилась с 64 кг до 55 кг за 7 дней. Отмечена выраженная положительная динамика показателей острой фазы воспаления: уровень прокальцитонина снизился
с 0,14 нг/мл до 0,04 нг/мл, С-реактивного белка — с 71,2 мг/л до 3,7 мг/л, ферритина — с 852 нг/мл до 221 нг/мл, КФК — с 799 Ед/л до 317 Ед/л, миоглобина — с 980 нг/мл до 477 нг/мл (табл. 1). При контрольном исследовании 22.07.2020 ПЦР энтеровируса в крови и кале не обнаружено.. Пациентка была выписана на амбулаторное лечение.. В течение последующих 3 нед. отмечала субфебрильную температуру и боли в мышцах только при значительной физической нагрузке. Была повторно осмотрена через 4 мес.. после выписки: жалоб не предъявляет, состояние удовлетворительное, отеков нет, мышцы безболезненны..
Обсуждение
В настоящее время зарегистрировано в качестве лекарственных препаратов 5 моноклональных антител (табл. 2), направленных против В-лимфоцитов, из них четыре направлены против поверхностного маркера CD20 и одно (инебилизумаб) связывается с антигеном CD19.

Можно предполагать, что частота и структура инфекционных осложнений при их использовании будут одинаковыми, принимая во внимание схожий механизм действия. Однако точно это не известно, так как сравнительных исследований не проводилось. Данные о безопасности накоплены преимущественно в отношении ритуксимаба, поскольку его начали использовать раньше других препаратов.
В долгосрочном 11-летнем исследовании наблюдали 3595 пациентов с ревматоидным артритом: серьезные инфекционные осложнения возникали в группе ритуксимаба не чаще, чем в группе плацебо (3,76 события на 100 пациенто-лет в группе ритуксимаба и 3,79 события в группе плацебо) [1]. Самым частым осложнением была пневмония, которая развилась у 74/3595 (2%) больных. Однако наиболее опасными у пациентов, получавших ритуксимаб, представляются реактивация хронических вирусных инфекций и грибковые инфекции.. Монотерапия ритуксимабом довольно редко осложняется грибковыми инфекциями [2]. Наиболее важной из них следует считать пневмоцистную пневмонию.. Хотя частота развития инфекции, вызванной Pneumocystis jirovecii, не очень высока, летальность достигает 30% [3]. В 2011 г. Управлением по надзору за качеством пищевых продуктов и медикаментов США (U.S. Food and Drug Administration, FDA) в инструкцию по медицинскому применению ритуксимаба было добавлено особое предупреждение о возможности опасной реактивации вирусного гепатита B. Имеются сообщения о летальных исходах [4]. Риск реактивации вирусного гепатита B был выше при лечении лимфом, при комбинировании ритуксимаба с другими химиотерапевтическими препаратами или глюкокортикоидами [5].
В 2007 г. FDA выпустило еще одно предупреждение об опасности развития на фоне лечения ритуксимабом прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) — инфекции головного мозга, вызываемой JC-вирусом.. K.R. Carson et al. [6] описали 57 случаев ПМЛ. Болезнь диагностировали в среднем через 5,5 мес. после введения ритуксимаба, время до наступления летального исхода в среднем равнялось 2 мес. J.R. Berger et al. [7] указали, что при лечении ревматоидного артрита ритуксимабом ПМЛ выявляется в 2,56 случая на 100 000 пациентов, при лечении гранулематоза с полиангиитом — в менее чем 1 случае на 10 000 больных.. У всех пациентов выявлялись и другие факторы риска (прием высоких доз кортикостероидов, комбинация с другими иммуносупрессантами и т. д.).
Терапия ритуксимабом может осложняться ЦВМ-инфекцией, вызывающей пневмонит, эзофагит, гастрит, энтероколит, менингоэнцефалит, ретинит [8]. Применение ритуксимаба также увеличивает частоту инфекции вирусом Varicella zoster, иногда с летальным исходом [9].
Описано значительное число случаев тяжелой энтеровирусной инфекции на фоне ритуксимаба.. Так, S. Grisariu et al. [10] представили 6 собственных и проанализировали еще 10 наблюдений, описанных ранее, в которых энтеровирусная инфекция протекала с преимущественно неврологическими проявлениями. Во всех случаях диагноз был подтвержден выявлением РНК вируса в спинномозговой жидкости методом ПЦР.. Ритуксимаб в большинстве случаев использовался для лечения лимфом в сочетании с другими противоопухолевыми препаратами. Только в двух случаях он применялся у пациентов с аутоиммунными заболеваниями. Среди проявлений инфекции чаще всего были лихорадка, мышечные боли, мышечная слабость, когнитивные нарушения, снижение слуха, речевые нарушения.. В некоторых случаях упомянуты отеки. Среди лабораторных показателей часто регистрировались гипоглобулинемия и гипоальбуминемия.. В спинномозговой жидкости во всех случаях обнаруживался лимфоцитоз и повышенное содержание белка. В большинстве обсуждаемых случаев проводилось лечение внутривенным иммуноглобулином (ВИГ). Из 5 пациентов, не получавших ВИГ, умерли 4; среди 11 пациентов, которым вводили ВИГ, отмечено 4 летальных исхода.
Позже был описан еще один случай генерализованной энтеровирусной инфекции у пациентки, получавшей поддерживающую терапию ритуксимабом и ибратинибом по поводу лимфомы клеток мантийной зоны. В клинической картине превалировали явления полимиозита, распространенного отека подкожной клетчатки с последующей нарастающей сонливостью и психическими нарушениями. Миозит был подтвержден данными магнитно-резонансной томографии и биопсии. В спинномозговой жидкости также обнаруживались лимфоцитоз, повышенный белок и РНК энтеровируса.. Энтеровирус был также обнаружен в крови, стуле и биоптате мышцы. Лечение ВИГ привело к быстрому и полному регрессу симптомов [11].
Применение других анти-CD20 препаратов также повышает риск некоторых инфекционных осложнений, спектр и частота которых предположительно схожи с таковыми при использовании ритуксимаба, однако данных в отношении новых препаратов накоплено гораздо меньше.
Риск инфекций при применении обинутузумаба изучали V. Goede et al. [12] в рамках рандомизированного клинического исследования по применению препарата для начального лечения хронического миелолейкоза.. В исследование был включен 781 пациент.. Участников рандомизировали в 3 группы: группу хлорамбуцила, группу комбинации обинутузумаба и хлорамбуцила и группу комбинации ритуксимаба и хлорамбуцила.. Частота развития инфекционных осложнений 3–5-й степени составляла 11–14% и не отличалась во всех трех группах.. Наиболее часто развивались бактериальные осложнения.. Оппортунистических инфекций в этом исследовании зарегистрировано не было.
Как осложнение лечения обинутузумабом описана также жизнеопасная энтеровирусная инфекция. J.M. Heger et al. [13] сообщили о больной, погибшей от диссеминированной энтеровирусной инфекции на фоне лечения обинутузумабом по поводу фолликулярной лимфомы. Обинутузумаб использовался в качестве монотерапии для поддержания ремиссии после индукции бендамустином и ритуксимабом.. Попытка терапии внутривенным введением иммуноглобулина оказалась безуспешной.
C. Dendle et al. [14] описали 2 случая диссеминированной энтеровирусной инфекции, возникших в ходе монотерапии лимфомы обинутузумабом в качестве средства для поддержания ремиссии.. Клиническая картина включала развитие гепатита, генерализованных отеков и полимиозитоподобного синдрома. В обоих случаях назначение внутривенного иммуноглобулина привело к клиническому выздоровлению и исчезновению виремии. T. Eyckmans et al. [15] описали также случай развития энтеровирусного энцефалита у пациентки, которая получала обинутузумаб в качестве монотерапии для поддержания ремиссии неходжкинской лимфомы. Ее госпитализировали с нарушениями сознания, выраженной лимфопенией и гипогаммаглобулинемией. Лечение внутривенным иммуноглобулином привело к практически полному регрессу неврологических симптомов.
В приведенном нами клиническом наблюдении, в отличие от большинства вышеупомянутых случаев энтеровирусной инфекции, обинутузумаб на момент развития осложнения применялся в режиме монотерапии. Клиническая картина в целом соответствовала вышеописанной (лихорадка, полимиозит, мышечная и общая слабость, гипоглобулинемия, гипоальбуминемия). В нашем наблюдении обращал на себя внимание выраженный отечный синдром, который не мог быть объяснен гипоальбуминемией, поскольку развился раньше и не имел характерного гравитационного распределения: отеки не перемещались в ниже расположенные части тела, что характерно для гипоонкотических отеков. Более вероятным механизмом происхождения отечного синдрома представляется повреждение эндотелия и утечка белков плазмы в ткани.. Это предположение удовлетворительно объясняет и нарастающую гипоальбуминемию..
Клинический эффект от применения ВИГ у пациентки З. не вызывает сомнения. Положительная динамика состояния наблюдалась уже после первой инфузии. Через 3 дня после начала лечения у пациентки с высокой лихорадкой в предшествующие 2 нед. была достигнута полная нормализация температуры тела.
Заключение
Обсуждаемое клиническое наблюдение может представлять интерес для врачей различных специальностей, поскольку демонстрирует нечастую и непростую в диагностике причину лихорадки, полимиозита и необычного отечного синдрома. С другой стороны, данное описание может оказаться полезным для врачей, наблюдающих пациентов в процессе лечения анти-В-клеточными препаратами. Высокая значимость энтеровирусной инфекции у таких больных обусловлена неблагоприятным прогнозом при отсутствии специфического лечения и, вследствие этого, критическим значением своевременности установления диагноза для выживания пациента.
2. Kimby E. Tolerability and safety of rituximab (MabThera). Cancer Treat Rev. 2005;31(6):456–473. DOI: 10.1016/j.ctrv.2005.05.007.
3. Martin-Garrido I., Carmona E.M., Specks U., Limper A.H. Pneumocystis pneumonia in patients treated with rituximab. Chest. 2013 Jul;144(1):258–265. DOI: 10.1378/chest.12-0477.
4. Garcia-Rodriguez M.J., Canales M.A., Hernandez-Maraver D., Hernandez-Navarro F. Late reactivation of resolved hepatitis B virus infection: an increasing complication post rituximab-based regimens treatment? Am J Hematol. 2008;83:673–675. DOI: 10.1002/ajh.21214.
5. Gutierrez Garcia M.L., Lopez A.S., Rios M.D. et al. Hepatitis B virus reactivation in rituximab-treated patients: incidence and risk factors. Gastroenterol. Hepatol. 2015;38:1–6. DOI: 10.1016/j.gastrohep.2014.05.008.
6. Carson K.R., Evens A.M., Richey E.A. et al. Progressive multifocal leukoencephalopathy after rituximab therapy in HIV-negative patients: a report of 57 cases from the Research on Adverse Drug Events and Reports project. Blood. 2009;113:4834–4840. DOI: 10.1182/blood-2008-10-186999.
7. Berger J.R., Malik V., Lacey S. et al. Progressive multifocal leukoencephalopathy in rituximab-treated rheumatic diseases: a rare event. J. Neurovirol. 2018;24:323–331. DOI: 10.1007/s13365-018-0615-7.
8. Kelesidis T., Daikos G., Boumpas D., Tsiodras S. Does rituximab increase the incidence of infectious complications? A narrative review. Int. J Infect Dis. 2011;15:e2–e16. DOI: 10.1016/j.ijid.2010.03.025. DOI: 10.1016/j.ijid.2010.03.025.
9. McIlwaine L.M., Fitzsimons E.J., Soutar R.L. Inappropriate antidiuretic hormone secretion, abdominal pain and disseminated varicella zoster virus infection: an unusual and fatal triad in a patient 13 months post Rituximab and autologous stem cell transplantation. Clin Lab Haematol. 2001;23:253–254. DOI: 10.1046/j.1365-2257.2001.00397.x.
10. Grisariu S., Vaxman I., Gatt M. et al. Enteroviral infection in patients treated with rituximab for non-Hodgkin lymphoma: a case series and review of the literature. Hematol Oncol. 2017;35(4):591–598. DOI: 10.1002/hon.2365. DOI: 10.1002/hon.2365.
11. Higer M., Cana D., Podlech J. et al. Life-threatening disseminated enterovirus infection during combined rituximab and ibrutinib maintenance treatment for mantle cell lymphoma: a case report. J. Med. Case Rep. 2020;14(1):135. DOI: 10.1186/s13256-020-02457-y.
12. Goede V., Fischer K., Busch R. et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014;370:1101–1110. DOI: 10.1056/NEJMoa1313984.
13. Heger J.M., Eichenauer D.A., Kasper P. et al. Fatal disseminated enterovirus infection in a patient with follicular lymphoma undergoing obinutuzumab maintenance therapy. Eur J Haematol. 2019;103(3):268–271. DOI: 1 0.1111/ejh.13278.
14. Dendle C., Gilbertson M., Korman T.M. et al. Disseminated Enteroviral Infection Associated with Obinutuzumab. Emerg. Infect. Dis. 2015;21(9):1661–1663. DOI: 10.3201/eid2109.150104.
15. Eyckmans T., Wollants E., Janssens A. et al. Coxsackievirus A16 encephalitis during obinutuzumab therapy. Emerg Infect Dis. 2014;20(5):913–915. DOI: 10.3201/eid2005.131766.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

