Клиническое наблюдение криптококкового менингита у пациента с системной красной волчанкой
DOI: 10.32364/2587-6821-2023-7-3-174-180
Риск тяжелых инфекций значительно повышен у лиц, страдающих системной красной волчанкой (СКВ). В статье представлен клинический случай менингоэнцефалита, вызванного Cryptococcus neoformans, у пациентки 33 лет с СКВ, получавшей длительное лечение средними и высокими дозами глюкокортикоидов. Болезнь диагностирована на основании анализа спинномозговой жидкости (СМЖ), магнитно-резонансной томографии головного мозга, ретроспективного анализа данных компьютерной томографии органов грудной клетки. Антимикотическая терапия липосомальным амфотерицином В и флуконазолом была успешной. Особенностями данного случая являются поздняя диагностика ввиду медленного развития и неспецифичности неврологических симптомов, а также развитие острого почечного повреждения на фоне антимикотической терапии. В статье рассмотрены вопросы диагностики инфекционных осложнений у пациентов с СКВ, особенно грибковых инфекций, а также современные подходы к лечению криптококкового менингита. Представленное клиническое наблюдение может помочь терапевтам и ревматологам в своевременном распознавании криптококковых инфекций у больных СКВ. Авторы отметили, что исследование СМЖ играет ключевую роль в постановке диагноза криптококкового менингита.
Ключевые слова: церебральный криптококкоз, оппортунистическая инфекция, менингоэнцефалит при системной красной волчанке, клиническое наблюдение, грибковая инфекция, системная красная волчанка.
Для цитирования: Кузьминых Д.А., Елисеев Ю.В., Матросова М.С., Глазунов П.А., Жиляев Е.В. Клиническое наблюдение криптококкового менингита у пациента с системной красной волчанкой. РМЖ. Медицинское обозрение. 2023;7(3):174-180. DOI: 10.32364/2587-6821-2023-7-3-174-180.

Введение
Инфекционные осложнения у пациентов с системной красной волчанкой (СКВ) в настоящее время выходят на первые позиции в структуре причин госпитализации и смертности этих больных. Оппортунистические инфекции составляют значительную долю таких осложнений. Диагностика этих заболеваний, редко встречающихся у иммунокомпетентных лиц, часто имеющих преимущественно неспецифические проявления, сопряжена с объективными трудностями и нередко происходит со значительной задержкой. Иллюстрацией вышеописанных проблем может служить следующее клиническое наблюдение.
Клиническое наблюдение
Пациентка В., 33 года, госпитализирована в стационарное отделение АО «ЕМЦ» 20.09.2022 с жалобами на диффузную постоянную головную боль давящего характера, сопровождающуюся светобоязнью, усиливающуюся при движении и частично купирующуюся анальгетиками, интенсивностью до 6 баллов по визуально-аналоговой шкале (ВАШ).
Из анамнеза известно, что в 2003 г., со слов пациентки, после длительной инсоляции на кистях появились высыпания по типу крапивницы, эритема лица в области скул и спинки носа по типу «бабочки». Кроме того, в анамнезе отмечались язвочки ротовой полости, миалгии, лейкопения (точные значения неизвестны), артриты и артралгии. Со слов пациентки, при дообследовании обнаружен антинуклеарный фактор (титр и метод выявления неизвестны), антитела к двуспиральной ДНК, антитела к кардиолипину. Выставлен диагноз СКВ. Наблюдается у ревматолога с 2004 г. Проводилось лечение преднизолоном 60 мг/сут с постепенной деэскалацией до 4 мг/сут, метотрексатом в таблетированной форме (со слов пациентки, терапия метотрексатом проводилась в течение 6 мес., затем препарат был отменен ввиду развития лейкопении), гидроксихлорохином 400 мг/сут.
В 2015 г. пациентка обследовалась в Израиле, с учетом стабильного течения заболевания рекомендовано снижение дозы метилпреднизолона до 2 мг, на фоне чего осенью 2017 г. появились эритематозные высыпания, боли в мелких суставах кистей, отеки нижних конечностей. В 2018 г. отмечались отеки кистей, боли в мелких суставах кистей, в связи с чем доза метилпреднизолона повышена до 12 мг/сут.
В 2019 г. пациентка была повторно госпитализирована в ревматологическое отделение по месту жительства в связи с жалобами на болезненные язвы полости рта, полости носа. При дообследовании отмечена протеинурия 1 г/сут без признаков снижения фильтрационной функции почек (креатинин 55 мкмоль/л). В течение 3 лет (с 2019 по 2022 г.) пациентка находилась на терапии метилпреднизолоном 12 мг/сут, гидроксихлорохином 400 мг/сут. Обострений заболевания не наблюдалось.
Настоящее ухудшение состояния с 18.07.2022, когда пациентка стала отмечать стреляющую боль в левом ухе, на следующий день с утра появилась левосторонняя головная боль давящего характера, интенсивностью до 5 баллов по ВАШ. Головная боль и боль в левом ухе сохранялись в течение следующих 2 дней, интенсивность увеличилась до 10 баллов по ВАШ. В последующем головная боль приобрела диффузный характер, в течение недели присоединились боли мышечного характера в шейном отделе позвоночника, субфебрильная температура (максимально до 37,4 °C). Пациентка была консультирована врачом-терапевтом 27.07.2022, который предположил остеохондроз и обострение СКВ. По данным магнитно-резонансной томографии (МРТ) головного мозга без контрастного усиления патологии выявлено не было. Однократно консультирована оториноларингологом, а также мануальным терапевтом, после посещения которого субъективно отмечалось кратковременное (на несколько часов) уменьшение головной боли.
17.08.2022 пациентка доставлена бригадой скорой медицинской помощи в больницу г. Москвы в экстренном порядке в связи с жалобами на внезапное нарушение речи (со слов мужа: стала с трудом формулировать мысли, говорила несвязно), эпизод кратковременной утраты сознания. Госпитализирована в отделение реанимации с направительным диагнозом «острое нарушение мозгового кровообращения». Очаговой неврологической симптоматики выявлено не было. В психическом статусе отмечены аспонтанность, замедление психических процессов, снижение беглости речи с уменьшением словарного запаса и амнестический синдром с нарушением заучивания и воспроизведения ранее известной информации. Данные МРТ головного мозга без контрастного усиления: в проекции головки хвостатого ядра определяется неправильной формы очаг измененного сигнала, без выраженного масс-эффекта, неоднородного гиперинтенсивного по Т2 и Flair, несколько неоднородного изо-гипоинтенсивного по Т1, с признаками ограничения диффузии по DWI, размерами 0,4×1 см (рис. 1). Изменения трактовались как более характерные для подострого периода ишемического повреждения в бассейне левой средней мозговой артерии. Также были выявлены признаки левостороннего сфеноидита.
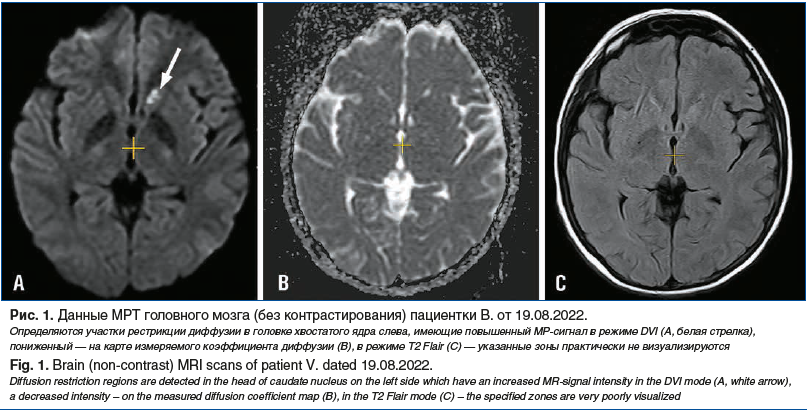
На фоне проводимой терапии (бетагистин, этилметилгидроксипиридина сукцинат, эноксапарин натрия, хлорпротиксен, церебролизин, аминофиллин, галоперидол) 22.08.2022 у пациентки развился галлюцинаторно-бредовый синдром, в связи с чем она была переведена в психиатрическую больницу с целью исключения шизофреноподобного расстройства. Диагноз не подтвердился, галлюцинаторно-бредовый синдром купирован, пациентка выписана 23.08.2022.
На электроэнцефалограмме от 09.09.2022: регионарных изменений и эпиактивности выявлено не было.
При осмотре 09.09.2022 в связи с планируемой госпитализацией пациентке был проведен иммунохроматографический тест на COVID-19 (экспресс-тест), который дал положительный результат. В связи с этим по рекомендации семейного врача с 12.09.2022 доза метилпреднизолона была увеличена до 100 мг/сут внутрь, терапия продолжалась в течение 9 дней.
Пациентка была госпитализирована в неврологическую клинику АО «ЕМЦ» 20.09.2022. При поступлении: состояние расценено как удовлетворительное. Температура тела 36,6 °C. Кожные покровы нормальной окраски и влажности. Частота дыхания 18 в 1 мин, артериальное давление 120/80 мм рт. ст., частота сердечных сокращений 70 в 1 мин. В неврологическом статусе: сознание ясное, ориентирована в месте, времени, собственной личности правильно. Критика сохранена. Речь не нарушена. Ригидность затылочных мышц. Минимальное расстояние подбородок — грудина 3 см. Зрачки равные, фотореакция симметричная. Диплопия при взгляде вправо вверх. Нистагм единичный установочный при взгляде влево. Данные лабораторных исследований приведены в таблице. В результатах анализа спинномозговой жидкости (СМЖ) обращали на себя внимание значительный цитоз (305 кл/мкл), преимущественно лимфоцитарный, существенное присутствие эритроцитов (63 кл/мкл), низкое содержание глюкозы 0,20 ммоль/л (градиент с сывороткой 0,04), повышение уровня белка до 0,56 г/л. При микроскопии СМЖ обнаружены дрожжеподобные клетки — грибы Cryptococcus neoformans.
Пациентка консультирована ревматологом: признаков активности СКВ выявлено не было. Лабораторные данные от 22.09.2022: антитела к двуспиральной ДНК — 10,9 ЕД/мл (в норме менее 25), антитела к кардиолипину IgA — 0,8 ЕД/мл (в норме менее 10,0), IgG — 1,9 ЕД/мл, антитела к β2-гликопротеину — 12,0 ЕД/мл (в норме менее 10), компоненты системы комплемента С3 — 0,65 г/л (в норме 0,9–1,8), С4 — 0,13 г/л (в норме 0,1–0,4), данные коагулограммы (АЧТВ, протромбин, протромбиновое время, МНО, фибриноген) в пределах референсных значений.
При поступлении: креатинин сыворотки 55 мкмоль/л, СКФ 119 мл/мин/1,73 м2. При эхокардиографии выявлено небольшое количество жидкости в полости перикарда.
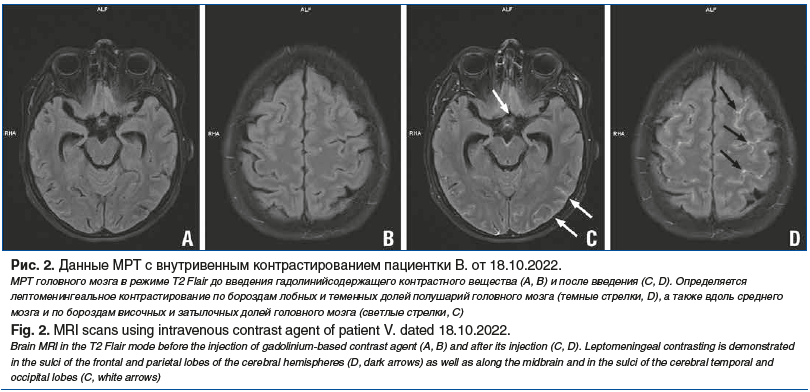
По данным МРТ головного мозга от 18.10.2022 выявлено повышенное накопление контраста по мозговым оболочкам, что расценено как признак менингита (рис. 2).
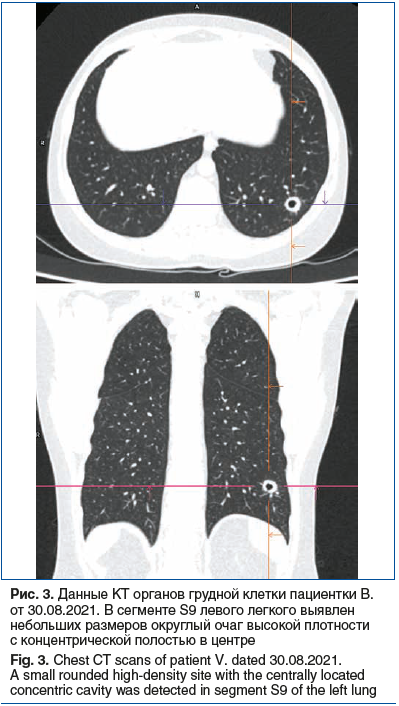
При пересмотре изображений мультиспиральной КТ органов грудной клетки, выполненной 30.08.2021, обращено внимание на участок плотной консолидации с концентрической зоной кавитации в S9 сегменте левого легкого, ретроспективно расцененный как характерное для криптококка легочное поражение (рис. 3).
На основании наличия клинических признаков менингоэнцефалита, данных общего и микроскопического анализа СМЖ установлен диагноз «криптококковый менинго-энцефалит». Начата противогрибковая терапия (амфотерицин В (липидассоциированная форма) в дозе 5 мг/кг/сут, флуконазол 800 мг/сут). Доза метилпреднизолона быстро снижена (до 12 мг/сут за неделю). Выполнялись повторные люмбальные пункции с целью коррекции внутричерепного давления.
На 4-й день после начала противогрибковой терапии состояние осложнилось развитием острого почечного повреждения (повышение уровня креатинина сыворотки до 146 мкмоль/л). Данные изменения были трактованы как нежелательное явление от применения амфотерицина В (тубулоинтерстициальный нефрит), введение препарата было временно прекращено, доза флуконазола была снижена до 600 мг/сут.
В последующие дни отмечалась положительная динамика в виде улучшения функции почек (снижение уровня креатинина сыворотки до 89 мкмоль/л), однако наблюдался рост содержания С-реактивного белка до 35 мг/л.
Через 4 дня после отмены амфотерицина В (27.09.2022) значительно вырос общий неврологический дефицит (угнетение сознания, дизартрия), что в совокупности с резким ростом провоспалительных маркеров (С-реактивный белок 155 мг/л), изменениями ликвора (см. таблицу) было расценено как прогрессирование грибковой инфекции. Возобновлено введение амфотерицина В 5 мг/кг/сут, доза флуконазола увеличена до 800 мг/сут.
При последующем наблюдении на фоне возобновления противогрибковой терапии в полном объеме неоднократно отмечалось повышение уровня сывороточного креатинина (максимально до 172 мкмоль/л) с последующим спонтанным снижением. Несмотря на это, с учетом рисков жизнеугрожающего поражения ЦНС, а также по настоятельному желанию пациентки было принято решение продолжить терапию.
Комбинированная антимикотическая терапия проводилась суммарно в течение 14 дней. Пациентка выписана 02.10.2022. В амбулаторных условиях продолжена монотерапия флуконазолом 600 мг/сут. Проводилось постепенное снижение суточной дозы метилпреднизолона до 6 мг/сут (в течение 3 нед. после выписки).
За время дальнейшего амбулаторного наблюдения состояние пациентки оставалось стабильным с тенденцией к улучшению. Периодически беспокоили диффузная головная боль и боль в поясничной области до 7 баллов по ВАШ, купируемая с помощью нестероидных противовоспалительных препаратов, парацетамола, а также тошнота. Пациентка самостоятельно передвигается по квартире. Через 1 мес. после выписки пациентка перенесла атаку опоясывающего герпеса (получала ацикловир 10 мг/кг 3 р/сут в течение 7 дней с положительным эффектом). Показатели азотвыделительной функции почек оставались в пределах референсных значений. На контрольной рентгенограмме органов грудной клетки новых очагов выявлено не было.
Обсуждение
Риск инфекционных заболеваний пациентов с СКВ значительно превосходит их риск в общей популяции. Риск серьезных инфекций повышен в 3 раза, туберкулеза — в 6,1 раза, пневмонии — в 2,6 раза, опоясывающего герпеса — в 2,5 раза [1]. Инфекции являются основной причиной госпитализации этих пациентов, а также причиной примерно трети всех летальных исходов при СКВ. До половины всех больных переносят по крайней мере одну тяжелую инфекцию в течение болезни. Факторами риска инфицирования являются высокая активность заболевания, иммуносупрессивная терапия, сосудистое и почечное поражение, необратимое органное поражение [1]. В 2011 г. пациенты с СКВ в США госпитализировались по поводу серьезных инфекций в 12 раз чаще, чем лица без СКВ [2].
Пациенты с СКВ демонстрируют повышенную чувствительность к различным типам возбудителей. Инфекции могут быть бактериальными, вирусными, грибковыми или паразитарными. Бактерии являются наиболее частым этиологическим агентом, среди них лидирует Streptococcus pneumoniae [3]. По данным испанского регистра (The Registry of Systemic Lupus Erythematosus Patients of the Spanish Society of Rheumatology), бактериальные инфекции составили 51,9% всех инфекций, за бактериями следуют вирусы (11,9%) и грибы (2,3%). В том же исследовании наиболее частыми очагами инфекции были дыхательные пути (35,5%), мочевыводящие пути (15,0%) и мягкие ткани (13,3%). При этом за период с 2000 по 2011 г. отмечено возрастание частоты госпитализаций пациентов с СКВ по поводу пневмоний, бактериемий, оппортунистических грибковых инфекций, herpes zoster [1]. По данным европейского регистра, грибковые инфекции при СКВ в основном вызваны Candida spp., Pneumocystis jirovecii (ранее Pneumocystis carinii) и Cryptococcus neoformans [4]. В одноцентровом исследовании в университетской клинике Китая среди возбудителей инвазивных микозов преобладали Cryptococcus neoformans и представители рода Aspergillus (случаи пневмоцистной пневмонии в этот анализ не включались) [5].
Риск поражения ЦНС у пациентов с СКВ значительно возрастает при приеме доз глюкокортикостероидов (ГКС), эквивалентных 30 мг/сут преднизолона или больших. Если анализировать этиологическую структуру инфекций ЦНС, то у пациентов с СКВ на первый план выходят менингиты, вызываемые Mycobacterium tuberculosis и Cryptococcus neoformans, причем на криптококковую инфекцию приходится до 58,8% инфекций ЦНС у больных с СКВ [6]. Это следует учитывать у пациентов с СКВ и с подозрением на инфекцию ЦНС, особенно при приеме высоких доз ГКС [7]. Проблема несвоевременной постановки диагноза осложняется тем, что у значительной части (38%) пациентов с криптококковым менингитом на фоне СКВ не наблюдается существенной активности основного заболевания (SLEDAI-2K <4) [6].
Что касается криптококковой инфекции, следует отметить, что первый очаг чаще всего обнаруживается в легочной ткани как результат заражения воздушно-пылевым путем (вдыхание базидиоспор или мелких дрожжеподобных клеток). В месте инвазии может формироваться очаг гранулематозного воспаления. При этом легочное поражение протекает, как правило, субклинически или малосимптомно [8]. C. neoformans у лиц с нарушенным иммунным ответом может эффективно уклоняться от фагоцитоза легочными макрофагами и дендритными клетками вследствие способности выживать в фаголизосомах и даже покидать фагоцитировавшую его клетку. Кроме того, полисахариды гриба позволяют ему подавлять активацию адаптивного иммунитета, блокируя пути передачи воспалительных сигналов через активацию ядерного фактора κB. Способность к длительному выживанию внутри макрофагов может привести к диссеминации гриба по организму, включая преодоление гематоэнцефалического барьера. Криптококкозом могут поражаться различные органы: кости (чаще позвоночник и длинные кости), суставы (преимущественно коленные), глаза (хориоретиниты, ретиниты, витриты, эндофтальмиты), предстательная железа. Но наиболее часто поражается ЦНС. Кроме того, особенности микроорганизма способствуют развитию окклюзионной внутричерепной гипертензии, являющейся важным фактором инвалидизации и летальности [9, 10].
В основе защиты организма-хозяина от криптококка лежит врожденный (за счет макрофагов и естественных киллеров) и Т-опосредованный (клеточный) иммунитет. Заболеванию подвержены пациенты в посттрансплантационном периоде, с аутоиммунными заболеваниями, получающие иммуносупрессивную терапию [11]. По-видимому, наибольшее значение имеет прием ГКС. Так, в исследовании, основанном на популяции из 9132 пациентов с ревматоидным артритом, все 20 случаев криптококкоза развились у пациентов, получавших до этого ГКС на протяжении 3,9±3,3 года. Это же исследование продемонстрировало повышение риска при использовании ингибитора фактора некроза опухоли α адалимумаба [12].
Для лечения криптококкового менингита рекомендуют в качестве терапии первой линии комбинированную терапию амфотерицином В (0,7–1,0 мг/кг/сут) в течение 2 нед. в сочетании с флуцитозином 100 мг/кг/сут. Если флуцитозин недоступен, рекомендуется комбинация амфотерицина В с флуконазолом 800 мг/сут. Лечение обычно предусматривает 3 стадии: индукцию (комбинированная терапия в течение 2 нед.), консолидацию (флуконазол 400–600 мг/сут в течение 6–8 нед.) и поддерживающую терапию (флуконазол 200 мг/сут или итраконазол 200 мг 2 р/сут в течение 1 года или более) [8, 13, 14].
Летальность от криптококкового менингита в эпоху до распространения ВИЧ-инфекции составляла около 30% [15]. Своевременное и оптимальное лечение криптококкового менингита способствует повышению долгосрочной выживаемости [13, 16]. Однако есть данные о сохранении когнитивных, моторных, слуховых/зрительных нарушений у 20–70% пациентов по истечении 1 года после перенесенного криптококкового менингита, что определяет важность реабилитации у данной категории пациентов [15, 16].
Приведенный случай в определенном смысле можно рассматривать как типичный: криптококковый менингит является характерной оппортунистической инфекцией у пациентов с СКВ, получающих длительную терапию ГКС. Тем не менее у него имеется ряд особенностей. Во-первых, следует отметить значительную задержку при постановке диагноза инвазивного микоза. Легочное поражение, обнаруженное за 1 год до появления симптомов менингита (в августе 2021 г.) у пациентки с СКВ, получающей 12 мг/сут метилпреднизолона, могло вызвать по крайней мере подозрение в отношении грибкового заболевания. Следует заметить, что наблюдавшаяся КТ-картина является характерной для криптококкоза. Действительно, исследования показывают, что первичное легочное вовлечение чаще представлено одним или несколькими (чаще в одном сегменте) округлыми узелками, иногда с кавитацией, расположенными в большинстве случаев в нижних долях [17]. К сожалению, на этой стадии криптококкоз может быть подтвержден только прямым выявлением гриба в легочной ткани [8].
С момента появления неврологических симптомов до постановки диагноза менингита прошло 2 мес. Действительно, диагностика криптококкового менингита представляет собой непростую задачу вследствие длительности времени его развития (обычно несколько недель) и разнообразия его проявлений (головная боль, лихорадка, поражение краниальных нервов, нарушение мышления, спутанность, летаргия, потеря памяти и симптомы раздражения твердой мозговой оболочки). При этом каждый из симптомов, включая головную боль, наблюдается лишь в части случаев. В этой фазе заболевания диагноз может быть установлен обнаружением гриба или его полисахаридных антигенов в ликворе или выявлением полисахаридного криптококкового антигена в крови [8].
Еще одной особенностью случая стало развитие острого почечного повреждения на фоне лечения липидассоциированной формой амфотерицина B, что было расценено как нежелательное явление, связанное с препаратом. Однако отчетливое ухудшение неврологической картины, последовавшее после отмены амфотерицина В, привело к непростому решению о возобновлении терапии. Нефротоксичность амфотерицина В является его самым частым нежелательным явлением. Несмотря на то, что липосомальная (липидассоциированная) форма препарата вызывает его в 2–3 раза реже обычной, повышение уровня креатинина в 2 и более раза в сравнении с исходным при ее использовании наблюдается в 10–19% случаев [18]. Однако мы не обнаружили сообщений о случаях необходимости заместительной почечной терапии в такой ситуации. В исследовании J. Youngs et al. [19] отмечалось восстановление почечной функции в течение 90 дней во всех наблюдениях. Дальнейшее развитие событий подтвердило правильность выбранного подхода: прогрессирования почечной недостаточности отмечено не было, впоследствии фильтрационная функция почек полностью восстановилась, и при этом был достигнут ожидаемый терапевтический эффект от противогрибковой терапии.
Заключение
Криптококковый менингит — одна из наиболее частых оппортунистических нейроинфекций у пациентов с СКВ, получающих длительную терапию ГКС. Медленное развитие неврологических симптомов, возможность их смешения с проявлениями активности аутоиммунного заболевания, малая выраженность изменений на МРТ могут приводить к значительной задержке в установлении диагноза. В то время как своевременность диагностики данного осложнения имеет критическое значение ввиду высокой летальности и риска формирования необратимых неврологических дефектов. Исследование СМЖ играет ключевую роль в постановке диагноза. Приведенное клиническое описание может помочь терапевтам и ревматологам в своевременном распознавании криптококковых инфекций у больных СКВ.
Сведения об авторах:
Кузьминых Дарья Андреевна — клинический ординатор кафедры факультетской терапии им. академика А.И. Нестерова РНИМУ им. Н.И. Пирогова Минздрава России; 117997, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-0877-0715.
Елисеев Юрий Вячеславович — врач-невролог АО «ЕМЦ»; 129090, Россия, г. Москва, ул. Щепкина, д. 35; ORCID iD 0000-0002-8252-788X.
Матросова Мария Сергеевна — врач-рентгенолог ФГБНУ НЦН; 125367, г. Москва, Волоколамское ш., д. 80; врач-рентгенолог АО «ЕМЦ»; 129090, Россия, г. Москва, ул. Щепкина, д. 35; ORCID iD 0000-0003-4604-7288.
Глазунов Петр Александрович — к.м.н., заведующий стационаром АО «ЕМЦ»; 129090, Россия, г. Москва, ул. Щепкина, д. 35; ORCID iD 0000-0001-8236-645X.
Жиляев Евгений Валерьевич — д.м.н., профессор кафед-ры факультетской терапии им. А.И. Нестерова лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; заместитель главного врача по лечебной работе АО «ЕМЦ»; 129090, Россия, г. Москва, ул. Щепкина, д. 35; профессор кафедры ревматологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-9443-1164.
Контактная информация: Жиляев Евгений Валерьевич, e-mail: zhilyayevev@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 20.01.2023.
Поступила после рецензирования 14.02.2023.
Принята в печать 14.03.2023.
About the authors:
Daria A. Kuzminykh — resident of the Academician A.I. Nesterov Department of Faculty Therapy, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-0877-0715.
Yuri V. Eliseev — neurologist, JSC European Medical Center; 35, Shchepkin str., Moscow, 129090, Russian Federation; ORCID iD 0000-0002-8252-788X.
Maria S. Matrosova — roentgenologist, Research Center of Neurology, 80, Volokolamskoe road, Moscow, 125367, Russian Federation; roentgenologist, JSC European Medical Center; 35, Shchepkin str., Moscow, 129090, Russian Federation; ORCID iD 0000-0003-4604-7288.
Petr A. Glazunov — C. Sc. (Med.), Head of the Hospital, JSC European Medical Center; 35, Shchepkin str., Moscow, 129090, Russian Federation; ORCID iD 0000-0001-8236-645X.
Evgeniy V. Zhilyaev — Dr. Sc. (Med.), Professor the Academician A.I. Nesterov Department of Faculty Therapy, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Deputy Chief Doctor for Clinical Care, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-9443-1164.
Contact information: Evgeniy V. Zhilyaev, e-mail: zhilyayevev@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 20.01.2023.
Revised 14.02.2023.
Accepted 14.03.2023.
2. Tektonidou M.G., Wang Z., Dasgupta A., Ward M.M. Burden of Serious Infections in Adults With Systemic Lupus Erythematosus: A National Population-Based Study, 1996-2011. Arthritis Care Res (Hoboken). 2015;67(8):1078–1085. DOI: 10.1002/acr.22575.
3. Dorgham D.A., Anwar S., Khaled A.S. Infection in systemic lupus erythematosus patients. The Egyptian Rheumatologist. 2021;43(2):115–118. DOI: 10.1016/j.ejr.2020.12.007.
4. Silva M.F., Ferriani M.P., Terreri M.T. et al. A Multicenter Study of Invasive Fungal Infections in Patients with Childhood-onset Systemic Lupus Erythematosus. J Rheumatol. 2015;42(12):2296–2303. DOI: 10.3899/jrheum.
5. Fan Y.-C., Li W.-G., Zheng M.-H. et al. Invasive fungal infection in patients with systemic lupus erythematosus: experience from a single institute of Northern China. Gene. 2012;506(1):184–187. DOI: 10.1016/j.gene.2012.06.059.
6. Fang W., Chen M., Liu J. et al. Cryptococcal meningitis in systemic lupus erythematosus patients: pooled analysis and systematic review. Emerg Microbes Infect. 2016;5(9):e95. DOI: 10.1038/emi.2016.93.
7. Molooghi K., Sheybani F., Naderi H. et al. Central nervous system infections in patients with systemic lupus erythematosus: a systematic review and meta-analysis. Lupus Sci Med. 2022;9(1):e000560. DOI: 10.1136/lupus-2021-000560.
8. Maziarz E.K., Perfect J.R. Cryptococcosis. Infect Dis Clin North Am. 2016;30(1):179–206. DOI: 10.1016/j.idc.2015.10.006.
9. Esher S.K., Zaragoza O., Alspaugh J.A. Cryptococcal pathogenic mechanisms: a dangerous trip from the environment to the brain. Mem Inst Oswaldo Cruz. 2018;113(7):e180057. DOI: 10.1590/0074-02760180057.
10. Gushiken A.C., Saharia K.K., Baddley J.W. Cryptococcosis. Infect Dis Clin North Am. 2021;35(2):493–514. DOI: 10.1016/j.idc.2021.03.012.
11. Ventura Aguiar P., Lopes V., Martins L.S. et al. Cryptococcal infection in non-HIV immunosuppressed patients — Three case reports in a nephrology setting. Med Mycol Case Rep. 2013;3:14–16. DOI: 10.1016/j.mmcr.2013.11.003.
12. Liao T.L., Chen Y.M., Chen D.Y. Risk factors for cryptococcal infection among patients with rheumatoid arthritis receiving different immunosuppressive medications. Clin Microbiol Infect. 2016;22(9):815.e1–815.e3. DOI: 10.1016/j.cmi.2016.05.030.
13. Abassi M., Boulware D.R., Rhein J. Cryptococcal Meningitis: Diagnosis and Management Update. Curr Trop Med Rep. 2015;2(2):90–99. DOI: 10.1007/s40475-015-0046-y.
14. Perfect J.R., Dismukes W.E., Dromer F. et al. Clinical practice guidelines for the management of cryptococcal disease: 2010 update by the infectious diseases society of America. Clin Infect Dis. 2010;50(3):291–322. DOI: 10.1086/649858.
15. Diamond R.D., Bennett J.E. Prognostic factors in cryptococcal meningitis. A study in 111 cases. Ann Intern Med. 1974;80(2):176–181. DOI: 10.7326/0003-4819-80-2-176.
16. Pasquier E., Kunda J., De Beaudrap P. et al. Long-term Mortality and Disability in Cryptococcal Meningitis: A Systematic Literature Review. Clin Infect Dis. 2018;66(7):1122–1132. DOI: 10.1093/cid/cix870.
17. Suwatanapongched T., Sangsatra W., Boonsarngsuk V. et al. Clinical and radiologic manifestations of pulmonary cryptococcosis in immunocompetent patients and their outcomes after treatment. Diagn Interv Radiol. 2013;19(6):438–446. DOI: 10.5152/dir.2013.13049.
18. Groll A.H., Rijnders B.J.A, Walsh T.J. et al. Clinical Pharmacokinetics, Pharmacodynamics, Safety and Efficacy of Liposomal Amphotericin B. Clin Infect Dis. 2019;68(Suppl 4):S260–S274. DOI: 10.1093/cid/ciz076.
19. Youngs J., Low J.M., Whitney L. et al. Safety and Efficacy of Intermittent High-Dose Liposomal Amphotericin B Antifungal Prophylaxis in Haemato-Oncology: An Eight-Year Single-Centre Experience and Review of the Literature. J Fungi (Basel). 2020;6(4):385. DOI: 10.3390/jof6040385.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
