К вопросу о клинической значимости прямого обезболивающего эффекта таргетных препаратов у больных ревматоидным артритом
DOI: 10.32364/2587-6821-2020-4-8-483-486
Цель исследования: оценка клинически значимого обезболивающего действия тофацитиниба у пациентов с ревматоидным артритом (РА) в условиях реальной клинической практики.
Материал и методы: проанализированы данные пациентов с РА из Московского единого регистра артрита. В качестве субъективных оценок рассматривались показатели: число болезненных суставов (ЧБС), индекс функциональной способности HAQ (Health Assessment Questionnaire), индекс активности заболевания RAPID3 (Routine Assessment of Patient Index Data 3). В качестве объективных показателей воспалительной активности анализировались число припухших суставов (ЧПС) и уровень С-реактивного белка (СРБ). Выполнена оценка частных от деления субъективных показателей на объективные во всех возможных сочетаниях для различных таргетных препаратов, использовавшихся в изучаемой группе пациентов. С учетом наблюдательного характера исследования проводился поиск конфаундеров для всех указанных отношений (частных от деления). Сравнение рассчитанных индексов на фоне лечения различными таргетными препаратами производилось с поправкой на выявленные конфаундеры. Процесс отбора конфаундеров осуществлялся в 2 этапа: 1) предварительный отбор показателей, имеющих достоверную однофакторную связь с зависимой переменной; 2) последующий обратный пошаговый отбор переменных в рамках обобщенной линейной модели.
Результаты исследования: в анализ включили 944 эпизода лечения у 832 пациентов. Длительность эпизодов составила 1312±1006 дней. В том числе было проанализировано 93 эпизода лечения тофацитинибом (средняя длительность 836±453 дня). При анализе с поправкой на выявленные конфаундеры обнаружено, что показатели ЧБС/(ЧПС+1), HAQ/(ЧПС+1) и RAPID3/(ЧПС+1) на фоне приема тофацитиниба были достоверно ниже средних значений, полученных при использовании таргетных препаратов в целом. Достоверных различий между препаратами по отношениям изучаемых субъективных показателей к уровню СРБ выявить не удалось.
Заключение: выраженность субъективных ощущений и функциональных нарушений у пациентов, получающих лечение тофацитинибом, может быть меньше при той же выраженности объективных признаков артрита в сравнении с генно-инженерными противовоспалительными препаратами.
Ключевые слова: таргетный препарат, генно-инженерный противовоспалительный препарат, тофацитиниб, ревматоидный артрит, реальная клиническая практика.
Для цитирования: Жиляев Е.В., Лукина Г.В., Кольцова Е.Н., Шмидт Е.И., Лыткина К.А. К вопросу о клинической значимости прямого обезболивающего эффекта таргетных препаратов у больных ревматоидным артритом. РМЖ. Медицинское обозрение. 2020;4(8):483-486. DOI: 10.32364/2587-6821-2020-4-8-483-486.
E.V. Zhilyaev1–3, G.V. Lukina4,5, E.N. Koltsova6, E.I. Shmidt7, K.A. Lytkina8
1AO “EMC”, Moscow, Russian Federation
2Russian Medical Academy of Continuous Professional Education, Moscow, Russian Federation
3Pirogov Russian National Research Medical University, Moscow, Russian Federation
4Loginov Moscow Clinical Scientific Center, Moscow, Russian Federation
5Research Institute of Rheumatology named after V.A. Nasonova, Moscow, Russian Federation
6Research Institute for Healthcare and Medical Management of Moscow Healthcare Department, Moscow, Russian Federation
7City Clinical Hospital No. 1 named after N.I. Pirogov, Moscow, Russian Federation
8City Clinical Hospital No. 4, Moscow, Russian Federation
Aim: to evaluate the possibility of clinically significant analgesic effect of tofacitinib in patients with rheumatoid arthritis (RA) under the conditions of actual clinical practice.
Patients and Methods: data of patients with RA from the Moscow Unified Register of Arthritis (MERA) were analyzed. The subjective indicators included tender joint count (TJC), the HAQ (Health Assessment Questionnaire) Functional Capacity Index, the RAPID3 (Routine Assessment of Patient Index Data 3) Disease Activity Index. Swollen joint count (SJC) and the level of C-reactive protein (CRP) were analyzed as objective indicators of inflammatory activity. The estimation was conducted of the quotient obtained when subjective indicators were divided by objective indicators in all possible combinations for various targeted medications used in the studied group of patients. Given the observational nature of the study, the search was carried out for confounding factors for all of these quoti ents. The calculated indices were compared during treatment with various targeted medications, adjusted for detected confounding factors. The process of selecting confounding factors was carried out in 2 stages — preliminary selection of indicators that have a significant one-factor association with the dependent variable, and subsequent reverse stepwise selection of variables within the framework of a generalized linear model.
Results: the analysis included 944 episodes of treatment in 832 patients. The duration of episodes was 1312±1006 days. In particular, 93 episodes of tofacitinib treatment were analyzed (average duration — 836±453 days). When the analysis was adjusted for the detected confounding factors, it was found that the indicators of TJC/(SJC+1), HAQ/(SJC+1) and RAPID3/(SJC+1) during tofacitinib therapy were significantly lower than the average values obtained with target medications. There were no significant differences between the medications in relat ion to the studied subjective indicators and the level of CRP.
Conclusions: the severity of subjective perceptions and functional disorders in patients treated with tofacitinib may be less with the same severity of arthritis objective indicators compared to genetically engineered anti-inflammatory drugs.
Keywords: targeted medication, genetically engineered anti-inflammatory drug, tofacitinib, rheumatoid arthritis, real clinical practice.
For citation: Zhilyaev E.V., Lukina G.V., Koltsova E.N. et al. Clinical significance of the direct analgesic effect of targeted medications in patients with rheumatoid arthritis. Russian Medical Review. 2020;4(8):483–486. DOI: 10.32364/2587-6821-2020-4-8-483-486.
Введение
Исследования последних лет привели к внедрению в клиническую практику лечения ревматоидного артрита (РА) и псориатического артрита (ПсА) нового класса таргетных иммуносупрессоров — ингибиторов янус-киназ (JAK), низкомолекулярных средств, прерывающих внутриклеточную передачу многих провоспалительных сигналов. Первым из препаратов этого класса для клинического применения зарегистрирован тофацитиниб, который блокирует преимущественно янус-киназу-1 (JAK1) и янус-киназу-3 (JAK3) и в меньшей степени — янус-киназу-2 (JAK2) [1].
Некоторые теоретические данные позволяют предполагать наличие у блокатора JAK-киназ тофацитиниба прямого обезболивающего эффекта. Так, продемонстрирована способность интерлейкина-6 (ИЛ-6) усиливать гипералгезию как на уровне нервных окончаний, так и на уровне центральной нервной системы. Сигнал от рецептора ИЛ-6 проводится через JAK/STAT-путь, включающий JAK1, JAK2 и транскрипционные факторы семейства STAT (signal transducer and activator of transcription) — STAT1, STAT3-молекулы, и может быть прерван тофацитинибом [2]. Блокада JAK/STAT3-пути приводит к уменьшению гипералгезии, вызванной длительной компрессией нервных окончаний [3].
A. Ogdie et al. (2020) продемонстрировали, что тофацитиниб достоверно уменьшает боль, оцененную с помощью различных опросников, у пациентов с РА, анкилозирующим спондилитом (АС) и ПсА [4]. Однако дизайн этого исследования не позволяет решить, в какой мере уменьшение боли опосредовано противовоспалительным действием препарата, а в какой — прямым анальгетическим эффектом. Известно, что и другие таргетные иммуносупрессоры купируют выраженность боли и других показателей, субъективно оцениваемых пациентами, при РА, АС и ПсА [5–8].
В то же время можно было бы предположить, что при наличии у препарата клинически значимого прямого анальгетического эффекта будет наблюдаться диспропорция между субъективными и объективными проявлениями заболевания, заметная в сравнении с эффектами других лекарств похожего действия. То есть препарат со значимым обезболивающим действием при том же уровне воспалительной активности у пациента будет демонстрировать существенно лучшую в сравнении с другими препаратами динамику субъективных симптомов заболевания.
Целью настоящего исследования стала оценка клинически значимого обезболивающего действия тофацитиниба у пациентов с РА в условиях реальной клинической практики.
Материал и методы
Были проанализированы данные пациентов с РА из Московского единого регистра артрита (МЕРА). В регистр включаются пациенты, получающие генно-инженерную биологическую или таргетную синтетическую противовоспалительную терапию за счет бюджетных средств, проживающие в Москве.
В качестве субъективных оценок рассматривались число болезненных суставов (ЧБС), индекс функциональной способности HAQ (Health Assessment Questionnaire), индекс активности заболевания RAPID3 (Routine Assessment Of Patient Index Data 3). В качестве объективных показателей воспалительной активности анализировались число припухших суставов (ЧПС), уровень С-реактивного белка (СРБ). Произведена оценка частных от деления субъективных показателей на объективные во всех возможных сочетаниях для различных таргетных препаратов, использовавшихся в изучаемой группе пациентов. Таким образом, рассчитывались следующие показатели: ЧБС/(ЧПС+1), HAQ/(ЧПС+1), RAPID3/(ЧПС+1), ЧБС/(СРБ+1), HAQ/(СРБ+1), RAPID3/(СРБ+1). Прибавление единицы к делителю применялось во избежание ошибочных и несоразмерно высоких больших значений частного при нулевых или близких к нулю значениях делителя. С учетом наблюдательного характера исследования проводился поиск конфаундеров для всех указанных отношений (частных от деления). Сравнение рассчитанных индексов на фоне лечения различными таргетными препаратами проводилось с поправкой на выявленные конфаундеры. Процесс отбора конфаундеров осуществлялся в 2 этапа: 1) предварительный отбор показателей, имеющих достоверную однофакторную связь с зависимой переменной; 2) последующий обратный пошаговый отбор переменных в рамках обобщенной линейной модели.
Результаты и обсуждение
В анализ было включено 944 эпизода лечения у 832 пациентов. Проанализированная длительность эпизодов составила 1312±1006 дней. В том числе проанализировано 93 эпизода лечения тофацитинибом, их средняя длительность составила 836±453 дня. Общая характеристика пациентов, включенных в исследование, приведена в таблице 1.

Конфаундеры, выбранные по вышеописанному протоколу, представлены в таблице 2. При анализе с поправкой на выявленные конфаундеры обнаружено, что показатели ЧБС/(ЧПС+1), HAQ/(ЧПС+1) и RAPID3/(ЧПС+1) на фоне приема тофацитиниба были достоверно ниже средних значений, полученных при применении таргетных препаратов в целом. Достоверных различий между препаратами по отношениям изучаемых субъективных показателей к уровню СРБ выявить не удалось.
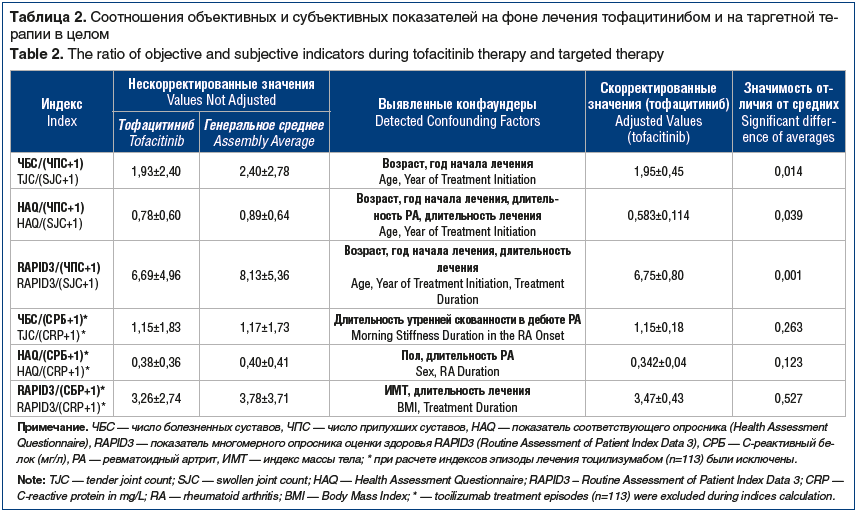
На фоне терапии тофацитинибом при том же ЧПС выявляются существенно меньшее по сравнению с другими таргетными препаратами ЧБС, меньшая выраженность функциональных нарушений, лучшая субъективная оценка общего состояния здоровья по опроснику RAPID3. Этот факт, с одной стороны, может служить косвенным подтверждением ранее предполагавшегося обезболивающего действия тофацитиниба. В таком случае этот эффект следует рассматривать как клинически значимый, поскольку он проявляется в важных для самочувствия пациента показателях.
С другой стороны, обнаруженные особенности эффекта тофацитиниба дают повод считать, что методы измерения эффективности препаратов, основанные на оценке их влияния на воспалительную активность, возможно, недооценивают действие тофацитиниба, поскольку клиническое улучшение и возрастание функциональных способностей пациента при его использовании могут быть непропорциональны достигнутому снижению воспалительной активности. По-видимому, для понимания результатов лечения тофацитинибом у пациентов с РА в качестве более корректных следует рассматривать субъективные показатели (например, RAPID3 и HAQ). Тофацитиниб не отличался от других препаратов по отношениям субъективных показателей к уровню СРБ. Возможным объяснением этого факта может быть особое действие препарата и на этот показатель. Учитывая механизм действия тофацитиниба (блокирование проведения сигнала от рецептора ИЛ-6), можно предположить, что подобно ингибиторам ИЛ-6 этот препарат способен угнетать продукцию СРБ непропорционально степени подавления воспаления. В таком случае СРБ не может рассматриваться как корректная оценка уровня воспаления при использовании тофацитиниба.
Заключение
Выраженность субъективных ощущений и функциональных нарушений у пациентов, получающих лечение тофацитинибом, может быть меньше при той же выраженности объективных признаков артрита в сравнении с таковой на фоне генно-инженерных противовоспалительных препаратов. Это означает, что клиническая эффективность препарата может недооцениваться при использовании показателей, основанных на объективных проявлениях воспаления (например, ЧПС). Полученные результаты также подчеркивают важность функциональных показателей для оценки эффекта тофацитиниба. Изучение анальгетической активности таргетных препаратов может значительно повлиять на понимание механизмов их клинической эффективности.
Сведения об авторах:
1–3Жиляев Евгений Валерьевич — д.м.н., профессор, главный врач, профессор кафедры ревматологии, ведущий научный сотрудник НИЛ ревматических болезней; ORCID iD 0000-0002-9443-1164.
4,5Лукина Галина Викторовна — д.м.н., профессор, заведующая научно-исследовательским отделом ревматологии, руководитель Московского городского ревматологического центра, ведущий научный сотрудник лаборатории изучения коморбидных инфекций и мониторинга безопасности лекарственной терапии; ORCID iD 0000-0001-7958-5926.
6Кольцова Екатерина Николаевна — заведующая организационно-методическим отделом по ревматологии; ORCID iD 0000-0002-5202-4878.
7Шмидт Евгения Исаковна — к.м.н., заведующая ревматологическим отделением; ORCID iD 0000-0001-8814-9704.
8Лыткина Каринэ Арнольдовна — к.м.н., заведующая ревматологическим отделением; ORCID iD 0000-0001-9647-7492.
1АО «ЕМЦ». 129090, Россия, г. Москва, ул. Щепкина, д. 35.
2ФГБОУ ДПО РМАНПО Минздрава России. 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
3ФГАУО ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
4ГБУЗ МКНЦ имени А.С. Логинова ДМЗ. 111123, Россия, г. Москва, Энтузиастов шоссе, д. 86, стр. 6.
5ФГБНУ НИИР им. В.А. Насоновой. 115522, Россия, г. Москва, Каширское шоссе, д. 34А.
6ГБУ «НИИОЗММ ДМЗ». 115088, Россия, г. Москва, ул. Шарикоподшипниковская, д. 9.
7ГКБ № 1 им. Н.И. Пирогова. 119049, Россия, г. Москва, Ленинский просп., д. 8.
8ГБУЗ «ГКБ № 4 ДМЗ». 115093, Россия, г. Москва, ул. Павловская, д. 25.
Контактная информация: Жиляев Евгений Валерьевич, e-mail: zhilyayevev@mail.ru. Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 15.06.2020, поступила после рецензирования 30.06.2020, принята в печать 16.07.2020.
About the authors:
1–3 Eugenii V. Zhilyaev — Dr. of Sci. (Med.), Professor, Chief Medical Officer, Professor of the Department of Rheumatology, Leading Researcher of the Research Laboratory of Rheumatological Diseases; ORCID iD 0000-0002-9443-1164.
4,5 Galina V. Lukina — Dr. of Sci. (Med.), Professor, Head of the Research Department of Rheumatology, Head of the Moscow City Rheumatology Center; ORCID iD 0000-0001-7958-5926.
6Ekaterina N. Koltsova — Head of the Organizational and Methodological Department of Rheumatology, ORCID iD 0000-0002-5202-4878.
7Evgeniya I. Shmidt — Cand. of Sci. (Med.), Head of the Department of Rheumatology; ORCID iD 0000-0001-8814-9704.
8Karine A. Lytkina — Cand. of Sci. (Med.), Head of the Department of Rheumatology; ORCID iD 0000-0001-9647-7492.
1AO “EMC”. 35, Schepkina str., Moscow, 129090, Russian Federation.
2Russian Medical Academy of Continuous Professional Education. 2/1, Barrikadnaya str., bld. 1, Moscow, 125993, Russian Federation.
3Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation.
4Loginov Moscow Clinical Scientific Center. 86, Entusiastov road, bld. 6, Moscow, 111123, Russian Federation.
5Research Institute of Rheumatology named after V.A. Nasonova. 34A, Kashirskoe road, Moscow, 115522, Russian Federation.
6Research Institute for Healthcare and Medical Management of Moscow Healthcare Department. 9, Sharikopodshipnikovskaya str., Moscow, 115088, Russian Federation.
7City Clinical Hospital No. 1 named after N.I. Pirogov. 8, Leninskii prospect, Moscow, 119049, Russian Federation.
8City Clinical Hospital No. 4. 25, Pavlovskaya str., Moscow, 115093, Russian Federation.
Contact information: Eugenii V. Zhilyaev, e-mail: zhilyayevev@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.06.2020, revised 30.06.2020, accepted 16.07.2020.
2. Busch-Dienstfertig M., González-Rodríguez S. IL-4, JAK-STAT signaling, and pain. JAK-STAT. 2013;2:e27638; http://dx.doi.org/10.4161/ jaks.27638.
3. Dominguez E., Mauborgne A., Mallet J. et al. SOCS3-mediated blockade of JAK/STAT3 signaling pathway reveals its major contribution to spinal cord neuroinflammation and mechanical allodynia after peripheral nerve injury. J Neurosci. 2010;30(16):5754–5766.
4. Ogdie A., de Vlam K., Mcinnes I.B. et al. efficacy of tofacitinib in reducing pain in patients with rheumatoid arthritis, psoriatic arthritis or ankylosing spondylitis. RMD Open. 2020;6:e001042. DOI: 10.1136/rmdopen-2019-001042.
5. Jansen J.P., Buckley F., Dejonckheere F. et al. Comparative efficacy of biologics as monotherapy and in combination with methotrexate on patient reported outcomes (PROs) in rheumatoid arthritis patients with an inadequate response to conventional DMARDs a systematic review and network meta-analysis. Health Qual Life Outcomes. 2014;12:102.
6. Gladman D.D., Mease P.J., Cifaldi M.A. et al. Adalimumab improves joint-related and skin-related functional impairment in patients with psoriatic arthritis: patient-reported outcomes of the Adalimumab Effectiveness in Psoriatic Arthritis Trial. Ann Rheum Dis. 2007;66:163–168. DOI: 10.1136/ard.2006.057901.
7. Gladman D., Fleischmann R., Coteur G. et al. Effect of certolizumab pegol on multiple facets of psoriatic arthritis as reported by patients: 24-week patient-reported outcome results of a phase III, multicenter study. Arthritis Care Res (Hoboken). 2014;66:1085–1092. DOI: 10.1002/acr.22256.
8. Mease P.J., Woolley J.M., Singh A. et al. Patient-Reported outcomes in a randomized trial of etanercept in psoriatic arthritis. J Rheumatol. 2010;37:1221–1227.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.