Интерфероны I типа, потребность в глюкокортикостероидах и коморбидность у пациентов с системной красной волчанкой
DOI: 10.32364/2587-6821-2023-7-3-118-123
Введение: коморбидность является одним из факторов, значимо снижающих продолжительность и качество жизни пациентов с системной красной волчанкой (СКВ). Интерфероны (ИФН) являются молекулами, изменение концентрации которых может способствовать формированию активных клинических проявлений СКВ и увеличению риска развития и тяжести коморбидных заболеваний. Участие ИФН-α в формировании коморбидности взрослой популяции больных СКВ при ее дебюте в детском и взрослом возрасте может отличаться и нуждается в уточнении.
Цель исследования: оценить взаимосвязь уровня ИФН-α с потребностью в глюкокортикостероидах (ГКС) и встречаемостью коморбидности у взрослых пациентов с разным возрастом дебюта СКВ.
Материал и методы: в неинтервенционное исследование включены пациенты с СКВ (n=71) (критерии SLICC (2012) / EULAR (2019)), не получавшие генно-инженерных биологических препаратов: 43 (60%) пациента с дебютом СКВ в возрасте до 18 лет составили группу ювенильной СКВ (юСКВ), 28 (40%) пациентов с дебютом СКВ в 18 лет и старше были включены в группу взрослой СКВ (вСКВ). Активность заболевания оценивали на момент осмотра с помощью расчета индекса SLEDAI-2K. Уровень сывороточного ИФН-α был определен с помощью метода иммуноферментного анализа. Коморбидность оценивали с помощью индексов коморбидности Чарлсон и CIRS-G.
Результаты исследования: уровень сывороточного ИФН-α был выше у пациентов с вСКВ и ассоциировался с большими дозами ГКС. У пациентов с вСКВ индексы коморбидности Чарлсон и CIRS-G были выше, а среди сопутствующих заболеваний достоверно чаще встречались язвенная болезнь желудка и двенадцатиперстной кишки и нарушение менструального цикла у женщин. Указанная коморбидность была взаимосвязана с уровнем ИФН-α.
Выводы: уровень сывороточного ИФН-α ассоциирован с применением больших доз ГКС и большими индексами коморбидности Чарл-сон и CIRS-G, а также встречаемостью поражения ЖКТ и нарушениями менструального цикла у женщин. Применение противоинтерфероновой терапии может быть перспективным путем уменьшения стероидозависимости и связанной с ней коморбидности.
Ключевые слова: системная красная волчанка, интерферон, анифролумаб, глюкокортикостероиды, коморбидность.
Для цитирования: Алиев Д.Б., Инамова О.В., Маслянский А.Л., Костик М.М., Гайдукова И.З. Интерфероны I типа, потребность в глюкокортикостероидах и коморбидность у пациентов с системной красной волчанкой. РМЖ. Медицинское обозрение. 2023;7(3):118-123. DOI: 10.32364/2587-6821-2023-7-3-118-123.
D.B. Aliev1, O.V. Inamova1,2, A.L. Maslyansky3, M.M. Kostik4, I.Z. Gaydukova1,2
1Clinical Rheumatological Hospital No. 25, St. Petersburg, Russian Federation
2I.I. Mechnikov North-Western State Medical University, St. Petersburg, Russian Federation
3V.A. Almazov National Medical Research Center, St. Petersburg, Russian Federation
4St. Petersburg State Pediatric Medical University, St. Petersburg, Russian Federation
Background: сomorbidity is one of the factors which considerably reduce life expectancy and affect quality of life of patients with systemic lupus erythematosus (SLE). Interferons (IFNs) are molecules whose changing concentrations may induce the active clinical manifestations of SLE and the increase in risk of comorbidities and their higher severity. The involvement of IFN-α in the development of comorbidities in the adult population of SLE patients may have distinguishing characteristics in cases of childhood-onset SLE and will need further research for better understanding its role.
Aim: to assess the relationship between the level of IFN-α and the need for glucocorticosteriods (GCs) and the prevalence of comorbidities in adult SLE patients with different onset ages.
Patients and Methods: this non-interventional study included SLE patients (n=71) (SLICC (2012) / EULAR (2019) Criteria) who did not receive genetically engineered biological agents: 43 (60%) patients with SLE onset under the age of 18 years comprised the group of juvenile SLE (jSLE) and 28 (40%) patients with SLE onset at 18 years or older age were included in the group of adult SLE (aSLE). For determining SLE activity during physical examination of patients, the SLEDAI-2K index was used. Serum IFN-α levels were measured by enzyme-linked immunosorbent assay (ELISA). The Charlson comorbidity index (CCI) and the CIRS-G scale were used for assessing comorbidities.
Results: in patients with aSLE, serum IFN-α levels were higher and associated with higher GC doses. Also, aSLE patients had higher CCI and CIRS-G scores. As regards comorbid diseases, a statistically significant higher prevalence of peptic (stomach and duodenal) ulcers and menstrual disorders in women was observed. These comorbidities correlated with IFN-α levels.
Conclusion: serum IFN-α levels are associated with the use of high GS doses and high CCI and CIRS-G scores, as well as the prevalence of GI diseases and menstrual disorders in women. The anti-interferon therapy seems to be a promising option for reducing "steroid addiction" and related comorbidities.
Keywords: systemic lupus erythematosus, interferon, anifrolumab, glucocorticosteroids, comorbidity.
For citation: Aliev D.B., Inamova O.V., Maslyansky A.L. et al. Type I interferon, the need for glucocorticosteroids and comorbidities in patients with systemic lupus erythematosus. Russian Medical Inquiry. 2023;7(3):118–123 (in Russ.). DOI: 10.32364/2587-6821-2023-7-3-118-123.
Введение
Системная красная волчанка (СКВ) относится к ауто-иммунным заболеваниям неизвестной этиологии, характеризуется клинической гетерогенностью, поражением жизненно важных органов, что приводит к накоплению повреждения органов и тканей и развитию коморбидных заболеваний [1, 2]. Несмотря на появление возможностей ранней диагностики заболевания, наличие новых методов лечения, при СКВ сохраняется высокий риск развития сопутствующих заболеваний и смертности. В настоящее время важнейшую роль в патогенезе СКВ отводят интерферонам (ИФН) I типа (ИФН-α, ИФН-β) [3]. Данные исследований свидетельствуют о том, что наследственно обусловленные высокие уровни ИФН-α являются определяющими в патогенезе СКВ [4], также ИФН-α является маркером тяжелого течения СКВ с поражением жизненно важных органов [5]. V. Oke et al. [6] в своем исследовании показали, что высокая активность ИФН I типа связана с поражением почек, суставов, кожи и слизистых и с высокими титрами анти-SSA и анти-SSB антинуклеарных антител. Согласно данным M.G. Tektonidou et al. [7], которые проанализировали выживаемость пациентов с ювенильным и взрослым дебютом СКВ, выживаемость пациентов улучшалась с 1950 по 1990 г. Затем этот показатель вышел на плато, несмотря на появление новых методов диагностики и лечения СКВ [7]. Это указывает на недостаточную эффективность используемых подходов и обосновывает актуальность поиска новых препаратов для лечения СКВ, особенно направленных на блокаду интерферонового механизма развития заболевания.
Важно оценить роль ИФН-α в формировании коморбидных состояний, в том числе при разном возрастном дебюте, так как ранее было показано, что при начале заболевания до 18 лет уровень ИФН не повышен и эффективность противоинтерфероновой терапии ниже [8, 9]. Изучение роли ИФН при разных клинических вариантах СКВ позволит лучше понять профиль пациентов, у которых блокада ИФН будет клинически наиболее эффективной.
Цель исследования: оценить взаимосвязь уровня ИФН-α с потребностью в глюкокортикостероидах (ГКС) и встречаемостью коморбидности у взрослых пациентов с разным возрастом дебюта СКВ.
Материал и методы
Исследование носило неинтервенционный характер, в него были включены пациенты (n=71), проходившие лечение на базе СПб ГБУЗ «КРБ № 25» г. Санкт-Петербурга. Критериями включения в исследование были: согласие пациента участвовать в исследовании; возраст старше 18 лет на момент включения в исследование; установленный диагноз СКВ, соответствующий критериям SLICC (2012) / EULAR (2019). В исследование не включали пациентов, клинический или лабораторный профиль которых мог быть изменен по причине наличия сопутствующих заболеваний или их лечения (инфекции, опухоли, прием препаратов интерферонов и др.), в том числе с использованием генно-инженерной биологической терапии (ГИБТ). Исследование было одобрено комитетом по этике СПб ГБУЗ «КРБ № 25».
Пациенты были разделены на группы в зависимости от возраста дебюта клинических проявлений СКВ: 43 (60%) пациента с дебютом клинических проявлений СКВ в возрасте до 18 лет составили группу ювенильной СКВ (юСКВ), 28 (40%) пациентов с дебютом СКВ в 18 лет и старше были включены в группу взрослой СКВ (вСКВ).
Активность заболевания оценивали на момент осмотра с помощью расчета индекса SLEDAI-2K [10]. Для оценки тяжести и исходов СКВ использовали индекс повреждения SLICC/DI (SDI).
Коморбидность оценивали с помощью индексов коморбидности Чарлсон [11] и CIRS-G [12]. Данные о сопутствующих заболеваниях были получены из карт пациентов, а также по результатам обследования в СПб ГБУЗ «КРБ № 25».
Для определения уровня сывороточного ИФН-α использовали иммуноферментный анализ, который проводили на аппарате Hitachi c применением реактивов «Биотех» в соответствии с рекомендованной производителем методикой. Чувствительность метода составила не менее 20 пг/мл.
Статистический анализ проводили с использованием пакета программного обеспечения Statistica 12.0 (StatSoft Inc, США). Характер распределения данных оценивали графическим методом и с использованием критерия Шапиро — Уилка. Показатели, распределение которых соответствовало нормальному, представлены как среднее ± стандартное отклонение (M±SD). Для сравнения показателей применяли критерий χ2, критерий Фишера. Силу корреляционной связи оценивали с помощью коэффициента корреляции Пирсона (r). Различия и взаимосвязи считали статистически значимыми при p<0,05.
Результаты исследования
Демографическая характеристика пациентов, включенных в исследование, представлена в таблице 1.
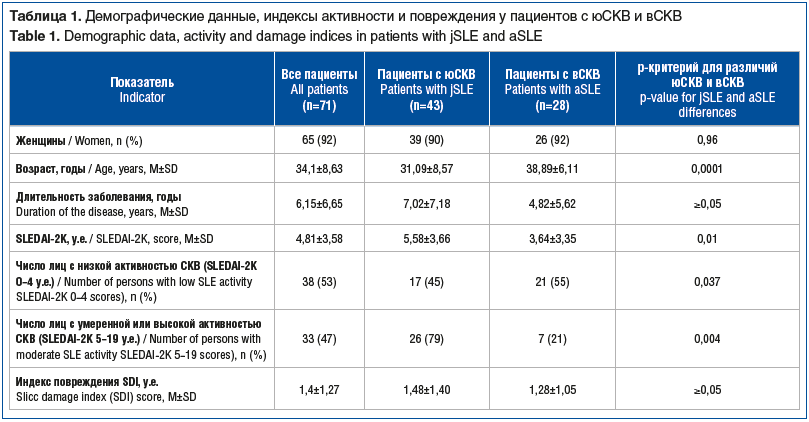
Различия, выявленные у пациентов с юСКВ и вСКВ, закономерны. Пациентов с индексом активности SLEDAI-2К ≥5 было больше при ювенильном дебюте заболевания, тогда как среди пациентов с ремиссией и низкой степенью активности СКВ было больше лиц с дебютом заболевания после 18 лет. У пациентов с разным дебютом СКВ достоверной разницы по индексу повреждения SDI не было (р≥0,05), но обнаружена прямая корреляционная связь с уровнем ИФН-α (r=0,39, p<0,05) для пациентов с вСКВ.
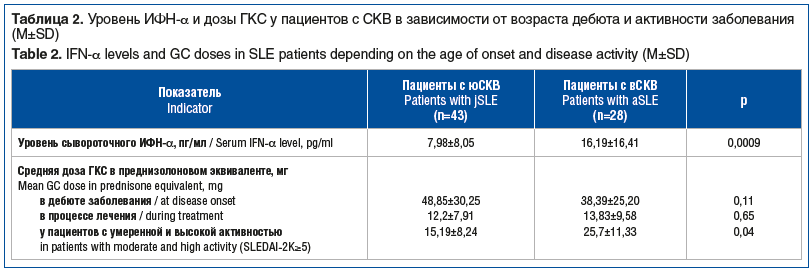
Ранее мы установили и в настоящей работе подтвердили, что у пациентов с вСКВ, прежде не получавших ГИБТ, уровень сывороточного ИФН-α выше, чем у пациентов с юСКВ (p=0,0009) [9]. Пациентам с вСКВ с активной СКВ требовалось назначение более высоких доз ГКС в сравнении с пациентами с юСКВ (15,19±8,24 и 25,7±11,33 мг/сут соответственно, p=0,04), тогда как средняя доза ГКС вне зависимости от активности заболевания достоверно не различалась у пациентов с разным дебютом СКВ (табл. 2).
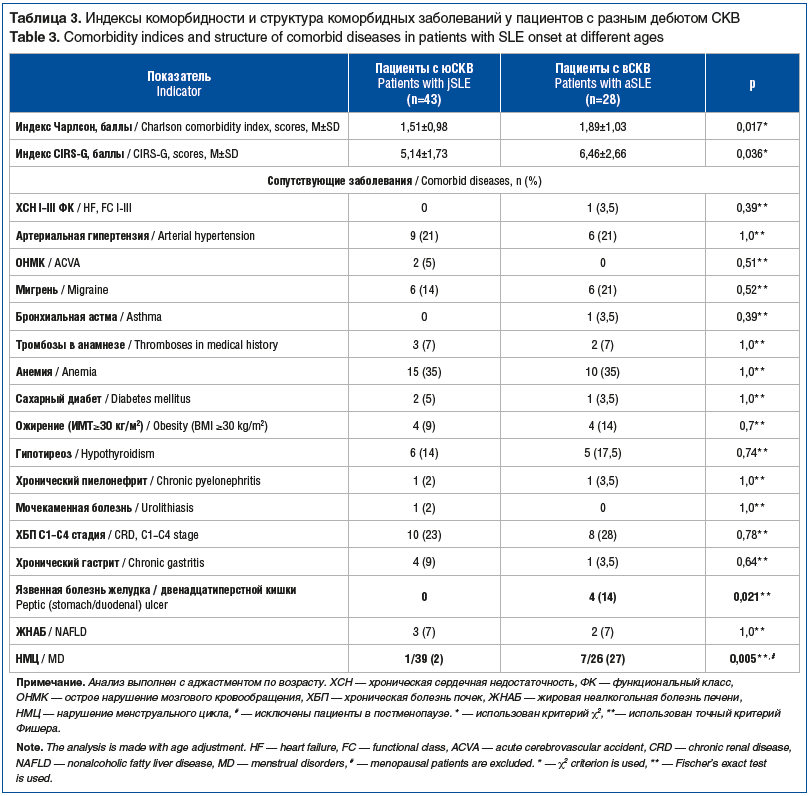
В таблице 3 приведены данные индексов коморбидности Чарлсон и CIRS-G, согласно которым у пациентов с вСКВ они были статистически значимо выше, чем у пациентов с юСКВ (p=0,017 и p=0,036 соответственно). Также обращала на себя внимание прямая корреляция дозы ГКС, назначенной в дебюте заболевания, с индексом коморбидности CIRS-G у пациентов с вСКВ (r=0,44, p<0,05). В структуре сопутствующих заболеваний у пациентов с вСКВ чаще, чем при юСКВ, встречалась язвенная болезнь желудка и двенадцатиперстной кишки (14 и 0% соответственно, p=0,021); у 27% женщин из этой же когорты пациентов отмечалось НМЦ (p=0,005) (см. табл. 3). Нужно отметить, что различий в частоте использования терапии циклофосфамидом у пациенток с вСКВ и юСКВ обнаружено не было (46 и 44% соответственно, p=0,8). Несмотря на отсутствие достоверных различий в заболеваемости ХБП у пациентов с юСКВ и вСКВ, установлена корреляция с индексом коморбидности CIRS-G у пациентов с вСКВ (r=0,50, p<0,05).
Обсуждение
Первые предположения об участии ИФН-α в патогенезе СКВ были опубликованы в 1969 г. Было показано, что введение ИФН мышам приводило к увеличению выработки аутоантител (АТ), в том числе АТ к ДНК [13]. Связь экспрессии генов ИФН с уровнем АТ к ДНК показана в работе М. Petri et al. [14]: у пациентов с СКВ высокий уровень экспрессии генов ИФН был достоверно связан с иммунологическим феноменом в виде повышения уровня АТ к ДНК и вследствие этого — с агрессивным течением заболевания, что подтверждают данные нашего исследования [14].
Мы впервые показали, что лица с дебютом СКВ во взрослом возрасте демонстрируют более высокий уровень ИФН-α, чем при юСКВ, и разную потребность в глюкокортикоидной терапии, в частности назначение значительных доз ГКС пациентам, не получающим лечение генно-инженерными препаратами [9]. Полученные нами результаты согласуются с данными исследований TULIP, продемонстрировавшими большую эффективность подавления активности ИФН-α анифролумабом при вСКВ по сравнению с юСКВ [15]. При этом в дебюте заболевания пациентам с юСКВ назначалась более высокая доза ГКС, что говорит о том, что интерфероновый механизм развития СКВ в разной степени представлен при юСКВ и вСКВ. Это определяет различную активность СКВ с разным возрастным дебютом и разный коморбидный профиль взрослых пациентов, заболевших до и после 18 лет [16].
Так, нами обнаружено, что коморбидность была выше у пациентов с вСКВ, в структуре заболеваний преобладали язвенное поражение желудочно-кишечного тракта (ЖКТ) и НМЦ у женщин, эти результаты мы связываем с большей стероидной нагрузкой в данной когорте пациентов. Указанная нагрузка взаимосвязана с большей активацией интерферонового звена у взрослых пациентов. В литературе отсутствуют данные о прямом влиянии ИФН на заболевания ЖКТ и нарушения гормонального фона у женщин, в связи с чем можно сделать вывод, что данные состояния связаны с терапией большими дозами ГКС.
Несмотря на неоднозначное влияние уровня ИФН-α на активность СКВ, которое продемонстрировано во многих работах, включая исследование H. Enocsson et al., показавших обратную взаимосвязь между активностью заболевания и уровнем ИФН-α [17], и в нашей ранее опубликованной работе [9], мы считаем, что уровень ИФН-α определяет активное течение заболевания у пациентов с вСКВ, требующее назначения больших доз ГКС, что обусловливает нарастание общего бремени коморбидности и встречаемость отдельных коморбидных состояний в данной популяции. Высокий уровень ИФН-α при высокой потребности в ГКС у пациентов позволяет предположить, что пациенты с дебютом СКВ после 18 лет в первую очередь будут нуждаться в лечении ингибитором ИФН. Подтверждением этому могут служить результаты работы, посвященной опыту применения анифролумаба в лечении резистентных форм СКВ [18].
Ограничениями настоящего исследования являются отсутствие информации об уровне ИФН у пациентов с СКВ на момент дебюта заболевания (в его безлекарственной фазе), отсутствие данных об экспрессии генов, ответственных за синтез ИФН, а также данных проспективного наблюдения за изучаемыми группами пациентов с оценкой выявленных взаимосвязей в динамике. Потому указанная работа будет продолжена: будет изучена экспрессия генов, ответственных за синтез ИФН (так называемая «интерфероновая подпись»), продолжено проспективное наблюдение за пациентами.
Выводы
-
У взрослых пациентов с дебютом СКВ после 18 лет по сравнению со взрослыми пациентами с развитием болезни до 18 лет отмечается более высокий уровень ИФН-α и большая потребность в ГКС в процессе лечения, а также с большими индексами коморбидности Чарлсон и CIRS-G, более частой встречаемостью язвенного поражения верхних отделов ЖКТ и НМЦ.
-
Снижение уровня ИФН посредством назначения антиинтерфероновых препаратов представляется перспективным способом преодоления стероидозависимости и связанной с ней коморбидности.
Сведения об авторах:
Алиев Дамир Бурганович — врач-ревматолог СПб ГБУЗ «КРБ № 25»; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-8367-4622.
Инамова Оксана Владимировна — к.м.н., главный врач СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; заместитель директора по работе с клиническими базами НИИ ревматологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, доцент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-9126-3639.
Маслянский Алексей Леонидович — д.м.н., заведующий научно-исследовательской лабораторией ревматологии и иммунопатологии ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0003-2427-4148.
Костик Михаил Михайлович — главный внештатный детский специалист ревматолог Северо-Западного федерального округа Российской Федерации, профессор кафедры госпитальной педиатрии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-1180-8086.
Гайдукова Инна Зурабиевна — д.м.н., заместитель директора НИИ ревматологии, профессор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0003-3500-7256.
Контактная информация: Гайдукова Инна Зурабиевна, e-mail: ubp1976@list.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 03.02.2023.
Поступила после рецензирования 02.03.2023.
Принята в печать 28.03.2023.
About the authors:
Damir B. Aliev — rheumatologist, Clinical Rheumatological Hospital No. 25; 40, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-8367-4622.
Oksana V. Inamova — C. Sc. (Med.), Chief Medical Officer of the Clinical Rheumatological Hospital No. 25; 30, Bolshaya Podyakskaya str., St. Petersburg, 190068, Russian Federation; Deputy Director for Work with Clinical Bases of the Research Institute of Rheumatology, I.I. Mechnikov North-Western State Medical University; Associate Professor of the Department of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-9126-3639.
Aleksey L. Maslyansky — Dr. Sc. (Med.), Head of the Research Rheumatology and Immunology Laboratory, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0003-2427-4148.
Mikhail M. Kostik — Chief outsourcing pediatric specialist-rheumatologist of the Northwestern Federal District of the Russian Federation, Professor of the Department of Hospital Therapy, St. Petersburg State Pediatric Medical University, 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-1180-8086.
Inna Z. Gaydukova — Dr. Sc. (Med.), Deputy Director of the Research Institute of Rheumatology, Professor of the Department of Internal Medicine, Rheumatology, Examination of Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Clinical Rheumatological Hospital No. 25; 40, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-3500-7256.
Contact information: Inna Z. Gaydukova, e-mail: ubp1976@list.ru.
Financial Disclosure: no authors have a financial or property
interest in any material or method mentioned.
There is no conflict of interests.
Received 03.02.2023.
Revised 02.03.2023.
Accepted 28.03.2023.
2. Kuo C.F., Chou I.J., Rees F. et al. Temporal relationships between systemic lupus erythematosus and comorbidities. Rheumatology (Oxford). 2019;58(5):840–848. DOI: 10.1093/rheumatology/key335.
3. Bengtsson A.A., Sturfelt G., Truedsson L. et al. Activation of type I interferon system in systemic lupus erythematosus correlates with disease activity but not with antiretroviral antibodies. Lupus. 2000;9(9):664–671. DOI: 10.1191/096120300674499064.
4. Niewold T.B., Hua J., Lehman T.J. et al. High serum IFN-alpha activity is a heritable risk factor for systemic lupus erythematosus. Genes Immun. 2007;8(6):492–502. DOI: 10.1038/sj.gene.6364408.
5. Baechler E.C., Batliwalla F.M., Karypis G. et al. Interferon-inducible gene expression signature in peripheral blood cells of patients with severe lupus. Proc Natl Acad Sci U S A. 2003;100(5):2610–2615. DOI: 10.1073/pnas.0337679100.
6. Oke V., Gunnarsson I., Dorschner J. et al. High levels of circulating interferons type I, type II and type III associate with distinct clinical features of active systemic lupus erythematosus. Arthritis Res Ther. 2019;21(1):107. DOI: 10.1186/s13075-019-1878-y.
7. Tektonidou M.G., Lewandowski L.B., Hu J. et al. Survival in adults and children with systemic lupus erythematosus: a systematic review and Bayesian meta-analysis of studies from 1950 to 2016. Ann Rheum Dis. 2017;76(12):2009–2016. DOI: 10.1136/annrheumdis-2017-211663. Erratum in: Ann Rheum Dis. 2018;77(3):472.
8. Morand E.F., Furie R., Tanaka Y. et al.; TULIP-2 Trial Investigators. Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020;382(3):211–221. DOI: 10.1056/NEJMoa1912196.
9. Алиев Д.Б., Гайдукова И.З. Интерферон-α и особенности системной красной волчанки у пациентов с ювенильным и взрослым началом заболевания. РМЖ. 2022;6:3–6. [Aliyev D.B., Gaуdukova I.Z. Interferon-α and patterns of systemic lupus erythematosus in patients with juvenile and adult disease onset. RMJ. 2022;6:3–6 (in Russ.)].
10. Gladman D.D., Ibañez D., Urowitz M.B. Systemic lupus erythematosus disease activity index 2000. J Rheumatol. 2002;29(2):288–291. PMID: 11838846.
11. Charlson M.E., Pompei P., Ales K.L., McKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chron Dis. 1987;40(5):373–383. DOI: 10.1016/0021-9681(87)90171-8.
12. Miller M.D., Paradis C.F., Houck P.R. et al. Rating chronic medical illness burden in geropsychiatric practice and research: application of the Cumulative Illness Rating Scale. Psychiatry Res. 1992;41(3):237–248. DOI: 10.1016/0165-1781(92)90005-n.
13. Steinberg A.D., Baron S., Talal N. The pathogenesis of autoimmunity in New Zealand mice, I. Induction of antinucleic acid antibodies by polyinosinic-polycytidylic acid. Proc Natl Acad Sci U S A. 1969;63(4):1102–1107. DOI: 10.1073/pnas.63.4.1102.
14. Petri M., Fu W., Ranger A. et al. Association between changes in gene signatures expression and disease activity among patients with systemic lupus erythematosus. BMC Med Genomics. 2019;12(1):4. DOI: 10.1186/s12920-018-0468-1.
15. Vital E.M., Merrill J.T., Morand E.F. et al. Anifrolumab efficacy and safety by type I interferon gene signature and clinical subgroups in patients with SLE: post hoc analysis of pooled data from two phase III trials. Ann Rheum Dis. 2022;81(7):951–961. DOI: 10.1136/annrheumdis-2021-221425.
16. Fayed A., El Menyawi M.M., Ghanema M. et al. Measurement of serum interferon alpha in Egyptian patients with systemic lupus erythematosus and evaluation of its effect on disease activity: a case-control study. Reumatismo. 2020;72(3):145–153. DOI: 10.4081/reumatismo.2020.1308.
17. Enocsson H., Wetterö J., Eloranta M.L. et al. Comparison of Surrogate Markers of the Type I Interferon Response and Their Ability to Mirror Disease Activity in Systemic Lupus Erythematosus. Front Immunol. 2021;12:688753. DOI: 10.3389/fimmu.2021.688753.
18. Лейнеман Я.А., Бессалова А.Ю., Алиев Д.Б. и др. Опыт применения ингибитора интерферона I типа при системной красной волчанке. Современная ревматология. 2022;16(4):69–73. DOI: 10.14412/1996-7012-2022-4-69-73. [Leineman Ya.A., Bessalova A.Yu., Aliev D.B. et al. Experience with type I interferon inhibitor in systemic lupus erythematosus. Sovremennaya Revmatologiya=Modern Rheumatology Journal. 2022;16(4):69–73 (in Russ.)]. DOI: 10.14412/1996-7012-2022-4-69-73.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
