Эффективность фебуксостата у пациентов с подагрой в зависимости от функции почек
DOI: 10.32364/2587-6821-2022-6-3-140-147
Цель исследования: определить вероятность достижения целевого уровня мочевой кислоты (МК) при проведении терапии фебуксостатом в таблетированной форме у пациентов с подагрой, стратифицированных в зависимости от функции почек, в том числе у пациентов с сахарным диабетом 2 типа (СД2).
Материал и методы: в исследование включили пациентов в возрасте старше 18 лет с диагнозом «подагра», не принимавших ранее фебуксостат или иные уратснижающие препараты как минимум на протяжении 2 нед. до включения, с уровнем МК сыворотки крови >360 мкмоль/л. Всем назначался фебуксостат в таблетированной форме 80 мг/сут, при недостижении целевого уровня МК сыворотки (<360 мкмоль/л) доза увеличивалась до 120 мг/сут. Лабораторные исследования включали определение сывороточного уровня глюкозы, креатинина, МК. Пациенты исходно были разделены на группы в зависимости от стадий хронической болезни почек (ХБП) по уровню расчетной скорости клубочковой фильтрации (рСКФ), определяемой по формуле CKD-EPI: С1 — высокая или оптимальная функция почек (>90 мл/мин/1,73 м2), С2 — незначительно сниженная функция почек (60–89 мл/мин/1,73 м2), С3 — умеренно/существенно сниженная функция почек (30–59 мл/мин/1,73 м2), С4 — резко сниженная функция почек (15–29 мл/мин/1,73 м2). Отдельно проанализированы данные пациентов с СД2. Период наблюдения охватывал не менее 26 нед., первичной конечной точкой было достижение целевого уровня МК сыворотки, также оценивалась динамика рСКФ.
Результаты исследования: обследовано 136 пациентов c подагрой. СД2 был у 38 (27,9%) пациентов. ХБП С0–1 выявлена у 30 (22,1%) пациентов, С2 — у 28 (20,6%), С3 — у 62 (45,6%), С4 — у 16 (11,8%). Получали фебуксостат в таблетированной форме в дозе 80 мг/сут 98 (72,1%) пациентов, 120 мг/сут — 38 (27,9%). Был назначен профилактический прием противовоспалительной терапии: колхицин — 59 (43,4%) пациентам, НПВП — 51 (37,5%), глюкокортикоиды — 12 (8,8%), не принимали препаратов 14 (10,3%) пациентов. Уровень МК достоверно уменьшился во всех группах, среднее значение Δ МК и частота достижения целевого уровня МК сыворотки были сопоставимы. Достигли целевого уровня МК сыворотки в целом 84% пациентов, при С0–1, С2, С3, С4 — 83, 89, 82 и 81% пациентов соответственно. Средние значения рСКФ относительно исходных к концу исследования увеличились во всех группах, но достоверными различия были лишь у пациентов с С0–1: 101,3±18,1 мл/мин/1,73 м2 против 102,8±28,6 мл/мин/1,73 м2 (р=0,002). Из 38 пациентов с СД2 33 (87%) достигли целевого уровня МК сыворотки крови. У 2 пациентов с ХБП С3 отмечалось повышение уровня АЛТ и АСТ до 2 норм (при приеме фебуксостата 120 мг/сут).
Заключение: возможность достижения целевого уровня МК при приеме фебуксостата в таблетированной форме у пациентов с подагрой не зависит от функции почек, в том числе у пациентов с СД2.
Ключевые слова: подагра, фебуксостат, скорость клубочковой фильтрации, хроническая болезнь почек, сахарный диабет.
Для цитирования: Елисеев М.С., Желябина О.В., Чикина М.Н., Тхакоков М.М. Эффективность фебуксостата у пациентов с подагрой в зависимости от функции почек. РМЖ. Медицинское обозрение. 2022;6(3):140-147. DOI: 10.32364/2587-6821-2022-6-3-140-147.
Aim: to determine the probability of achieving the target serum uric acid (UA) level during therapy with febuxostat (in the tablet form) in patients with gout stratified depending on kidney function, including patients with type 2 diabetes mellitus (DM2).
Patients and Methods: the study included patients over 18 years of age with gout who had not previously taken febuxostat or other urate-lowering drugs for at least 2 weeks before inclusion, with a serum UA level >360 µmoL/L. All were prescribed with febuxostat in the tablet form 80 mg/day. If the target serum UA level was not reached (<360 µmoL/L), the dosage level was increased up to 120 mg/day. Laboratory tests included the determination of blood glucose, creatinine, UA. Initially, patients were divided into groups according to chronic kidney disease (CKD) stages by the level of estimated glomerular filtration rate (eGFR) by CKD-EPI: C1 — high or optimal renal function (>90 mL/min/1.73 m2), C2 — slightly reduced renal function (60–89 mL/min/1.73 m2), C3 — moderately/considerably reduced renal function (30–59 mL/min/1.73 m2), C4 — significantly reduced renal function (15–29 mL/min/1.73 m2). Patients with DM2 were analyzed separately. The follow-up period covered at least 26 weeks: the primary endpoint was to achieve the target serum UA level, and the eGFR tendency was also evaluated.
Results: 136 patients with gout were examined. DM2 was in 38 (27.9%) patients. CKD C0–1 was detected in 30 (22.1%) patients, C2 — in 28 (20.6%), C3 — in 62 (45.6%), C4 — in 16 (11.8%). Febuxostat (in the tablet form) was received at a dose of 80 mg/day in 98 (72.1%) patients, 120 mg/day in 38 (27.9%) patients. There was the following preventive administration of anti-inflammatory therapy: colchicine — 59 (43.4%) patients, NSAIDs — 51 (37.5%) patients, glucocorticosteroids — 12 (8.8%) patients, no drug therapy — 14 (10.3%) patients. UA level significantly decreased in all groups, the average value of Δ MK and the frequency of achieving the target serum UA level were comparable. Achievement of the target serum UA level in general was in 84% of patients; in C0–1, C2, C3, C4 — in 83, 89, 82 and 81% of patients, respectively. The mean eGFR values relative to the baseline increased by the end of the study in all groups, but significant differences were only in patients with C0–1: 101.3±18.1 mL/min/1.73 m2 vs 102.8±28.6 mL/min/1.73 m2 (p=0.002). Of the 38 patients with DM2, 33 (87%) achieved the target serum UA level. In 2 patients with CKD C3, ALT and AST increased up to two norms (when taking febuxostat 120 mg/day).
Conclusion: the possibility of achieving the target serum UA level when taking febuxostat (in the tablet form) in patients with gout does not depend on kidney function, including in patients with DM2.
Keywords: gout, febuxostat, glomerular filtration rate, chronic kidney disease, diabetes mellitus.
For citation: Eliseev M.S., Zhelyabina O.V., Chikina M.N., Thakokov M.M. Febuxostat efficacy in patients with gout depending on kidney function. Russian Medical Inquiry. 2022;6(3):140–147 (in Russ.). DOI: 10.32364/2587-6821-2022-6-3-140-147.
Введение
Вопреки распространенному ранее мнению о том, что мочевая кислота (МК) является инертным метаболитом, она может быть активным участником сложной сети патологических процессов, включая не только сердечно-сосудистые заболевания, но и нарушения углеводного и липидного обменов, а также болезни почек [1]. Известно, что как в виде кристаллов, так и в растворенном виде МК может способствовать развитию и прогрессированию хронической болезни почек (ХБП) [2, 3]. Снижение функции почек у пациентов с подагрой встречается намного чаще, чем в популяции [4].
Основным направлением лечения подагры, в том числе при наличии ХБП, является уратснижающая терапия (УСТ), которая показана практически всем пациентам с данным заболеванием, а наиболее часто используемыми с этой целью препаратами являются ингибиторы ксантиноксидазы аллопуринол и фебуксостат. Применение указанных лекарственных средств направлено на достижение основной цели терапии — снижение уровня МК сыворотки <360 мкмоль/л, что возможно в большинстве случаев и позволяет полностью контролировать заболевание [5, 6]. Помимо уратснижающего действия для данных препаратов предполагается возможность замедления прогрессирования ХБП у пациентов с подагрой и гЦ 8перурикемией при поддержании уровня МК сыворотки <360 мкмоль/л [2, 7], хотя далеко не все исследования подтверждают это [8, 9].
В то же время единого мнения относительно выбора тактики ведения пациентов с подагрой при сочетании с ХБП нет. Если в последней редакции рекомендаций Американской коллегии ревматологов (American College of Rheumatology, ACR) в качестве препарата первой линии терапии предлагается аллопуринол, независимо от исходного состояния почечной функции и без коррекции дозы, с учетом расчетной скорости клубочковой фильтрации (рСКФ) [10], то в рекомендациях по управлению подагрой Европейской антиревматической лиги (The European Alliance of Associations for Rheumatology, EULAR) при ХБП предполагается использование только низких доз аллопуринола, в случае его неэффективности — фебуксостата внутрь [11], а в рекомендациях Французского общества ревматологов (The French Society of Rheumatology) в этом случае предпочтение отдается фебуксостату в таблетированной форме [12]. Таким образом, надлежащее использование уратснижающих препаратов у больных подагрой и ХБП — один из самых спорных вопросов лечения подагры [13, 14]. Принятие однозначного решения осложняется отсутствием должного количества проспективных исследований, в которых перед назначением уратснижающих препаратов была бы проведена стратификация пациентов с учетом исходной функции почек [14]. Кроме того, на клинические эффекты уратс edижающих препаратов в отношении функции почек могут влиять сопутствующие подагре заболевания, в частности сахарный диабет 2 типа (СД2) [9].
Цель исследования: определить вероятность достижения целевого уровня МК при проведении терапии фебуксостатом в таблетированной форме у пациентов с подагрой, стратифицированных в зависимости от функции почек, в том числе у пациентов с СД2.
Материал и методы
В исследование включались пациенты с подагрой, обследованные на базе ФГБНУ НИИР им. В.А. Насоновой и соответствующие перечисленным ниже критериям. Протокол исследования одобрен локальным этическим комитетом, все пациенты подписали информированное согласие.
Критерии включения:
пациенты обоих полов в возрасте старше 18 лет с установленным диагнозом «подагра» (классификационные критерии ACR/EULAR 2015 г.);
пациенты, не принимавшие ранее фебуксостат и не принимающие иные уратснижающие препараты как минимум на протяжении 2 нед. до включения в исследование;
сывороточный уровень МК сыворотки крови >360 мкмоль/л;
подписанная форма информированного согласия.
Критерии невключения:
наличие противопоказаний, перечисленных в инструкциях по медицинскому применению фебуксостата [15];
некорригируемая артериальная гипертензия, хроническая сердечная недостаточность (ХСН) III стадии и выше по классификации Нью-Йоркской ассоциации сердца (New York Heart Association Functional Classification, NYHA), ишемическая болезнь сердца: стенокардия, постинфарктный кардиосклероз, безболевая ишемия миокарда, ишемическая кардиомиопатия, операции на сердце (аортокоронарное шунтирование, эндоваскулярное стентирование и др.), ишемический инсульт; транзиторная ишемическая атака;
повышение уровня аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (АСТ) более 2 норм; рСКФ <15 мл/мин/1,73 м2 (терминальная стадия ХБП).
Всем пациентам назначался фебуксостат (Азурикс®) в таблетированной форме в начальной дозе 80 мг/сут, которая при недостижении целевого уровня МК сыворотки (<360 мкмоль/л) увеличивалась до 120 мг/сут. Период наблюдения за каждым пациентом охватывал не менее 26 нед. непрерывного применения фебуксостата, по истечении которых проводилось повторное обследование. Оценивались антропометрические параметры исходно: рост, масса тела, индекс массы тела (ИМТ) по формуле Кеттле [отношение массы тела в килограммах к длине тела в метрах, возведенной в квадрат (кг/м2)], наличие подкожных тофусов, сопутствующих заболеваний. Лабораторные исследования включали клинический анализ крови, определение сывороточного уровня глюкозы, креатинина, МК, АСТ, АЛТ, КФК до и после терапии.
Скорость клубочковой фильтрации (рСКФ) рассчитывали с помощью уравнения CKD-EPI до и после терапии [16]. Классификация и стратификация стадий ХБП проводились по уровню рСКФ: С1 (высокая или оптимальная функция почек) — рСКФ >90 мл/мин/1,73 м2, С2 (незначительно сниженная функция почек) — рСКФ 60–89 мл/мин/1,73 м2, С3 (умеренно/существенно сниженная функция почек) — рСКФ 30–59 мл/мин/1,73 м2, С4 (резко сниженная функция почек) — рСКФ 15–29 мл/мин/1,73 м2, С5 (терминальная почечная недостаточность) — рСКФ <15 мл/мин/1,73 м2 [17]. Пациенты были разделены на группы в зависимости от стадий ХБП по уровню рСКФ (С0–1, С2, С3, С4). Отдельно проанализированы данные пациентов с СД2, они также были разделены на 4 группы в зависимости от исходных значений рСКФ. Профилактический прием противовоспалительной терапии был обязательным и включал прием колхицина, НПВП или низких доз глюкокортикоидов. Выбор препарата для профилактики приступов артрита осуществлялся при помощи алгоритма, разработанного в ФГБНУ НИИР им. В.А. Насоновой [18].
Статистическая обработка полученных данных проведена на персональном компьютере с использованием методов параметрической и непараметрической статистики, прикладных программ Statistica 12.0 (StatSoft. Inc., США). Для качественных признаков представлены абсолютные и отно f1ительные величины (n, %), для количественных — медиана, 25-й и 75-й перцентили, M±SD. При сравнении двух независимых групп по количественным признакам применяли критерий Манна — Уитни, по качественным — χ2. При сравнении зависимых групп использовали критерий Вилкоксона. Различия считали статистически значимыми при р<0,05.
Результаты исследования
В исследование включено 136 пациентов (женщин — 13, мужчин — 123) c подагрой, в том числе 38 (27,9%) пациентов с СД2. Клиническая характеристика пациентов представлена в таблице 1.

Хроническая болезнь почек С0–1 выявлена у 30 (22,1%) пациентов, С2 — у 28 (20,6%), С3 — у 62 (45,6%), С4 — у 16 (11,8%). Фебуксостат в дозе 80 мг/сут получали 98 (72,1%) пациентов, в дозе 120 мг/сут — 38 (27,9%) пациентов. С целью профилактики приступов артрита пациенты получали: колхицин — 59 (43,4%), НПВП — 51 (37,5%), глюкокортикоиды — 12 (8,8%), не принимали — 14 (10,3%) пациентов из-за наличия противопоказаний к приему любой из перечисленных групп противовоспалительных препаратов. Сравнительная характеристика пациентов, стратифицированных по уровню рСКФ, представлена в таблице 2.
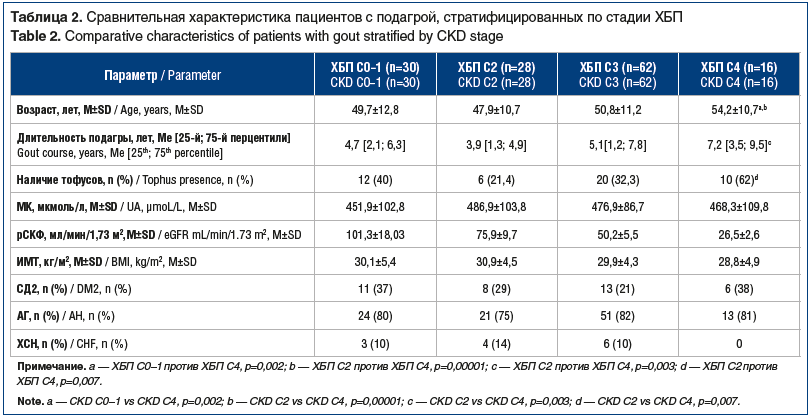
Пациенты с ХБП С4 были старше, чем пациенты с ХБП С2 (р=0,00001) и ХБП С0–1 (р=0,002); имели большую длительность подагры (р=0,003), у них чаще выявлялись подкожные тофусы среди всех групп и достоверно больше, чем среди пациентов с ХБП С2 (р=0,007). Частота выявления СД2, АГ, а также сывороточный уровень МК в группах не различались.
По завершении исследования были проанализированы изменения рСКФ, средних значений уровня МК в динамике при приеме фебуксостата и вероятность достижения целевого уровня МК в каждой группе (табл. 3).
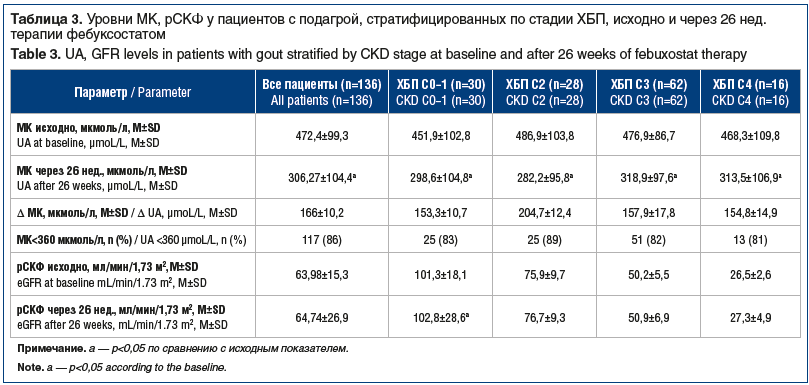
Как видно из представленных данных, при приеме фебуксостата в таблетированной форме уровень МК статистически значимо уменьшился как при нормальной, так и при сниженной функции почек, при этом средние значения Δ МК также были сопоставимы, как и вероятность достижения целевого уровня МК сыворотки в группах. Достижение целевого уровня МК сыворотки в целом было зафиксировано у 86% пациентов, при ХБП С0–1 — у 83%, при ХБП С2 — у 89%, при ХБП С3 — у 82%, при ХБП С4 — у 81%, т. е. даже в группе пациентов с ХБП С4 целевой уровень МК был достигнут более чем у 80% пациентов. Средние значения рСКФ увеличились во всех группах, но статистически значимыми различия были лишь у пациентов с ХБП С0–1 (р=0,002).
Отдельно были рассмотрены результаты терапии фебуксостатом в таблетированной форме у пациентов с СД2, также после их стратификации по уровню рСКФ (табл. 4).
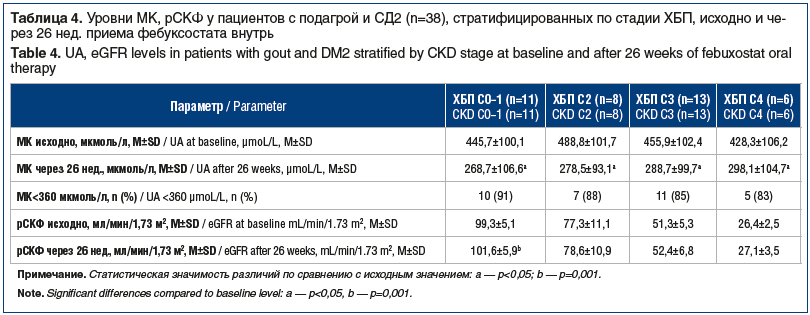
Целевого уровня МК достигли 33 (87%) пациента с СД2, вероятность этого не зависела от исходного значения рСКФ, средние изменения которого в группах также имели тенденцию к увеличению показателя у пациентов как с нормальной, так и со сниженной функцией почек. У пациентов с ХБП С0–1 средние значения рСКФ через 26 нед. приема фебуксостата в таблетированной форме по сравнению с исходными достоверно увеличились: 99,3±5,1 мл/мин/1,73 м2 против 101,6±5,9 мл/мин/1,73 м2 через 26 нед. терапии (p=0,001).
У 2 пациентов с ХБП С3 отмечалось повышение уровня АЛТ и АСТ до 2 норм (при приеме фебуксостата внутрь в дозе 120 мг/сут). Отмены препарата не требовалось, из исследования пациенты не выбыли. У 5 пациентов, принимавших колхицин, отмечалось развитие диареи в первые дни приема препарата. Препарат был отменен. Других нежелательных явлений зарегистрировано не было.
Обсуждение
Данное исследование — одно из немногих, где исходно была проведена стратификация пациентов с подагрой в зависимости от функции почек с целью получения данных о возможности достижения целевого уровня МК при терапии фебуксостатом в таблетированной форме и параллельно о динамике функции почек, оцененной по рСКФ, и в которое включались пациенты с рСКФ <30 мл/мин/1,73 м2. Чаще всего пациентов со значительным нарушением функции почек исключают из клинических исследований, что значительно ограничивает данные, на основании которых можно принимать решения о том, как лучше лечить подагру в этой популяции [19]. Во многом именно из-за недостатка данных — малого числа проспективных исследований, подобных проведенному нами, вопрос о выборе конкретного препарата, эффективности и безопасности применения различных лекарственных средств у пациентов с тяжелой степенью ХБП остается одним из наиболее обсуждаемых и наименее изученных [14].
Интерес представляют уже собственно исходные результаты стратификации по значению рСКФ — у 78% пациентов с подагрой в нашем исследовании выявлялась ХБП С2 и более, что больше, чем, например, распространенность ХБП (рСКФ <90 мл/мин/1,73 м2) среди пациентов с подагрой в США — 39% [20] и распространенность нарушения функции почек (сывороточный креатинин >0,11 ммоль/л) у пациентов в Новой Зеландии — 38% [21]. В первом из цитируемых исследований из 3122 пациентов с подагрой, принимавших аллопуринол, только 25,6% не имели диагноза ХБП и 22,2% пациентов с ХБП достигли концентрации МК в сыворотке <6,0 мг/дл (р=0,0409), при этом пациенты с ХБП принимали аллопуринол чаще (p<0,01) и его дозы не корректировались [20].
Мы показали, что эффективность фебуксостата при приеме внутрь не зависела от функции почек, как и вероятность достижения целевого уровня МК, при этом отличительной особенностью было включение нами в исследование пациентов независимо от исходных значений рСКФ и без лимитации дозы и коррекции схемы терапии. В этой связи не менее отрадным представляется подтверждение нами хорошей и не зависящей от функции почек переносимости препарата. Данный факт также нашел подтверждение в других исследованиях — например, по результатам исследования APEX частота возникновения любого нежелательного явления (НЯ) была одинаково низкой как в группе фебуксостата в таблетированной форме, так и в группах аллопуринола и плацебо, большинство связанных с лечением побочных эффектов были от легкой до умереннeй степени тяжести [22].
В исследовании P.A. Juge et al. [23] НЯ были зарегистрированы только у 1 пациента из 73 в виде отеков нижних конечностей, которые купировались после прекращения приема фебуксостата, сообщений о сердечно-сосудистых событиях и других серьезных НЯ не было. В работе A. Yamaguchi et al. [24] из 178 пациентов с ХБП (рСКФ <60 мл/мин/1,73 м2) и гиперурикемией, получавших терапию фебуксостатом внутрь, лишь у 1 пациента отмечалось небольшое повышение уровня трансаминаз, но это событие не было признано клинически значимым. Следует отметить, что оба исследования, в отличие от нашего, были ретроспективными.
В целом оказавшаяся весьма высокой вероятность достижения целевого уровня МК сыворотки (86%) сопоставима с данными наиболее крупных исследований по назначению фебуксостата в таблетированной форме пациентам с подагрой. Мы продемонстрировали, что вероятность достижения целевого уровня МК у пациентов даже с тяжелой ХПБ ничуть не ниже, чем у пациентов с нормальной функцией почек. Например, по данным Y. Shibagaki et al. [25], а также F. Borghi et al. [26], назначение фебуксостата внутрь пациентам с ХБП С3b–5 и гиперурикемией в течение 24 нед. характеризовалось снижением уровня МК сыворотки <6 мг/дл (360 мкмоль/л) более чем у 70% пациентов, снижение уровней МК сыворотки составило >40% при ХБП С3b и >50% при ХБП С4–5. Так, аналогичным образом в 3 рандомизированных клинических исследованиях у пациентов с подагрой фебуксостат в таблетированной форме более эффективно снижал и поддерживал целевые уровни уратов в сыворотке крови, чем аллопуринол, в том числе в случае наличия легких и умеренных нарушений функции почек, причем различия в эффективности препаратов в большей мере проявлялись именно в субгруппах пациентов с Х81П [22, 27, 28]. Так, в исследовании CONFIRMS, целью которого было сравнение эффективности и безопасности уратснижающей терапии, в группах фебуксостата при приеме внутрь в дозах 40 или 80 мг/сут и аллопуринола (300 мг/сут, при снижении функции почек — 200 мг/сут) доля пациентов, достигших сывороточного уровня МК <6 мг/дл, составила 45,
67 и 42% соответственно. Среди пациентов с любым (легким или умеренным) нарушением функции почек частота ответа на терапию в группе фебуксостата в таблетированной форме 80 мг/сут (71,6%; 360 из 503 пациентов) значительно превышала таковую, наблюдаемую в группе фебуксостата 40 мг/сут (49,7%; 238 из 479 пациентов) и группе аллопуринола 200–300 мг/сут (42,3%; 212 из 501 пациента) (р≤0,001 для каждого сравнения). Кроме того, среди всей группы пациентов с почечной недостаточностью частота ответа на терапию в группе фебуксостата 40 мг/сут, т. е. минимальной дозы препарата, была значительно выше, чем в группе аллопуринола (р=0,021) [27, 28].
Интересны данные, представленные H. Farquhar et al. [29], которые проанализировали 10 наиболее крупных исследований из 36, с анализом возможности достижения целевого уровня уратов в сыворотке <360 мкмоль/л и безопасности УСТ у пациентов с подагрой и ХБП III–V стадий. Показано, что доля участников, получавших аллопуринол и достигших целевого значения МК<360 мкмоль/л, варьировала в зависимости от функции почек: для участников с рСКФ ≥60 мл/мин — от 23,3% до 75%, для пациентов с рСКФ 30–60 мл/мин — от 20,2% до 76,4%, а для пациентов с рСКФ <30 мл/мин — от 18,8% до 64,3%. И если для аллопуринола наблюдалась значительная вариабельность доз применяемого препарата и эффективности с точки зрения снижения уровня уратов на всех стадиях ХБП, то для фебуксостата при приеме внутрь, как и в нашем исследовании, такой закономерности выявлено не было.
По нашим данным, функция почек у пациентов при приеме фебуксостата в таблетированной форме оставалась стабильной. Проведенный анализ изменения рСКФ у пациентов с подагрой с максимально сниженной функцией почек (<30 мл/мин/1,73 м2) на фоне приема фебуксостата показал, что рСКФ существенно не изменилась, кроме того, отмечалась тенденция к повышению показателя: 26,5±2,6 мл/мин/1,73 м2 против 27,3±4,9 мл/мин/1,73 м2 через 26 нед. терапии (р=0,42). Более того, у пациентов с нормальной функцией почек уровень рСКФ повысился с 101,3±18,03 мл/мин/1,73 м2 до 102,8±28,6 мл/мин/1,73 м2 (p=0,02). Этот результат представляется очень важным. С одной стороны, несколько недавних исследований показали, что снижение уровня МК не приводит к замедлению прогрессирования ХБП [30–32], с другой — есть данные, что терапия именно фебуксостатом при приеме внутрь стабилизирует функцию почек [33–35]. Так, D. Sircar et al. [36] в плацебо-контролируемом рандомизированном исследовании с участием 93 пациентов с ХБП показали, что 6-месячная терапия фебуксостатом в таблетированной форме в дозе 40 мг/сут способствовала увеличению средней рСКФ на 10% по сравнению с исходной (с 31,5±13,6 мл/мин/1,73 м2 до 34,7±18,1 мл/мин/1,73 м2 ), а в случае приема плацебо, напротив, снижалась (с 32,6±11,6 мл/мин/1,73 м2 до 28,2±11,5 мл/мин/1,73 м2 , p=0,003). В цитируемом выше исследовании P.A. Juge et al. [23] при назначении фебуксостата внутрь на 3 мес. и более пациентам с подагрой и тяжелой ХБП (рСКФ <30 мл/мин/1,73 м2) у 57,6% пациентов функция почек либо улучшилась, либо не изменилась. Возможно, что при более длительном приеме фебуксостата в таблетированной форме динамика рСКФ может быть более благоприятной именно в отношении отдаленного исхода ХБП (развитие терминальной стадии заболевания, потребность в гемодиализе и трансплантации почки), особенно у пациентов с незначительным или умеренным снижением почечной функции. Так, одно из самых крупных проспективных рандомизированных исследований с участием пациентов с ХБП С3 и гиперурикемией показало, что, по результатам 108-недельного наблюдения, фебуксостат 40 мг/сут внутрь по сравнению с плацебо замедлял скорость снижения функции почек за счет контроля урикемии. Анализ подгрупп продемонстрировал значительную пользу фебуксостата у пациентов без протеинурии (р=0,005) и при концентрации креатинина в сыворотке ниже медианы (p=0,009) [31]. В нашем исследовании среди пациентов с подагрой была выделена группа пациентов с наличием подагры и СД2. Так как СД2 был выявлен у 38 пациентов, что составило почти треть от их общего числа, было интересно проанализировать данные этих пациентов отдельно, учитывая, что пациенты с СД2 подвержены повышенному риску прогрессирования ХБП [37]. Результаты были сопоставимы с таковыми в общей группе: целевой уровень МК сыворотки был достигнут у 87% пациентов. И в общей группе пациентов, и у пациентов с СД2 достоверное увеличение рСКФ (р=0,004) отмечалось только при ХБП С0–1. В остальных группах больных с СД2 рСКФ оставалась стабильной, что может косвенно свидетельствовать о замедлении прогрессирования ХБП. Интересно, что, по данным исследования F.S .Yen et al. [9], основанного на результатах 13-летнего популяционного ретроспективного когортного исследования пациентов с подагрой, сравнение групп из 7126 пациентов, получавших УСТ, и 7126 пациентов, не получавших УСТ, не показало различий в риске ХБП, тогда как в подгруппе пациентов с СД2 и без АГ УСТ ассоциировалась с более низким риском развития ХБП (скорригированное отношение рисков 0,52; 0,95% ДИ 0,28–0,97). Однако в работе не приводятся данные о том, какой уровень урикемии поддерживался у больных, какие (средние) дозы уратснижающих препаратов они получали и как долго, а также как регулярно проводилась терапия. Можно предположить, что сам факт приема препаратов имеет меньше e5 значение, чем факт поддержания низких, не превышающих целевых значений, уровней МК сыворотки. Авторы также предполагают, что после возникновения АГ структурное повреждение почек становится основным медиатором развития ХБП и снижение уровня МК сыворотки в этом случае существенно не влияе f2 на развитие и прогрессирование ХБП [38].
Заключение
Очевидно, что возможность достижения целевого уровня МК при приеме фебуксостата у пациентов с подагрой не зависит от функции почек, в том числе у пациентов с СД2. Не менее важной представляется хорошая переносимость терапии фебуксостатом в таблетированной форме, которая, как было показано, также не зависит от наличия и стадии ХБП, сопутствующего приема препаратов для профилактики приступов артрита и применяемой дозы. Также важно, что динамика рСКФ была обнадеживающей — снижение рСКФ не происходило, а при нормальной или минимально сниженной функции почек наблюдалось статистически значимое увеличение показателя, причем независимо от наличия СД2. Таким образом, назначение максимально допустимой дозы фебуксостата внутрь пациентам с подагрой при сниженной функции почек представляется полностью оправданным.
Сведения об авторах:
Елисеев Максим Сергеевич — к.м.н., заведующий лабораторией микрокристаллических артритов ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское ш., д. 34А; ORCID iD 0000-0003-1191-5831.
Желябина Ольга Владимировна — младший научный сотрудник лаборатории микрокристаллических артритов ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское ш., д. 34А; ORCID iD 0000-0002-5394-7869.
Чикина Мария Николаевна — младший научный сотрудник лаборатории микрокристаллических артритов ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия,
г. Москва, Каширское ш., д. 34А; ORCID iD 0000-0002-8777-7597.
Тхакоков Мурадин Мухадинович — к.м.н., врач-онколог; ГБУЗ МО «ВРКБ»; 142700, Россия, г. Видное, ул. Заводская, д. 15; ORCID iD 0000-0002-4504-4977.
Контактная информация: Елисеев Максим Сергеевич, e-mail: elicmax@yandex.ru.
Источник финансирования: работа выполнена в рамках научного исследования «Оптимизация методов симптоматической противовоспалительной терапии у пациентов с микрокристаллическими артритами (подагра, болезнь депонирования кристаллов пирофосфата кальция)» (№ 2020-397-007).
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 22.12.2021.
Поступила после рецензирования 21.01.2022.
Принята в печать 15.02.2022.
About the authors:
Maxim S. Eliseev — C. Sc. (Med.), Head of the Laboratory of Microcrystalline Arthritis, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoe road, Moscow, 115522, Russian Federation; ORCID iD 0000-0003-1191-5831.
Olga V. Zhelyabina — Junior Researcher at the Laboratory of Microcrystalline Arthritis, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoe road, Moscow, 115522, Russian Federation; ORCID iD 0000-0002-5394-7869.
Maria N. Chikina — Junior Researcher at the Laboratory of Microcrystalline Arthritis, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoe road, Moscow, 115522, Russian Federation; ORCID iD 0000-0002-8777-7597.
Muradin M. Thakokov — C. Sc. (Med.), oncologist; Vidnovskaya Regional Clinical Hospital; 15, Zavodskaya str., Vidnoye, 142700, Russian Federation; ORCID iD 0000-0002-4504-4977.
Contact information: Maxim S. Eliseev, e-mail: elicmax@yandex.ru.
Funding source: the work was carried out within the framework of the scientific study "Optimization of methods concerning symptomatic anti-inflammatory therapy in patients with microcrystalline arthritis (gout, calcium pyrophosphate dihydrate crystal deposition disease)" (No. 2020-397-007).
Financial Disclosure: the author has no financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 22.12.2021.
Revised 21.01.2022.
Accepted 15.02.2022.
2. Uchida S., Kumagai T., Chang W.X. et al. Time to Target Uric Acid to Retard Chronic Kidney Disease Progression. Contrib Nephrol. 2018;192:56–68. DOI: 10.1159/000484279.
3. Елисеев М.С. Хроническая болезнь почек: роль гиперурикемии и возможности уратснижающей терапии. Современная ревматология. 2018;12(1):60–65. DOI: 10.14412/1996-7012-2018-1-60-65. [Eliseev M.S. Chronic kidney disease: the role of hyperuricemia and the possibility of urate-lowering therapy. Modern Rheumatology Journal. 2018;12(1):60–65 (in Russ.). DOI: 10.14412/1996-7012-2018-1-60-65].
4. Jaffe D.H., Klein A.B., Benis A. et al. Incident gout and chronic Kidney Disease: healthcare utilization and survival. BMC Rheumatol. 2019;3:11. DOI: 10.1186/s41927-019-0060-0.
5. Чикина М.Н., Елисеев М.С., Желябина О.В. Практическое применение национальных клинических рекомендаций по лечению подагры (предварительные данные). Современная ревматология. 2020;14(2):97–103. DOI: 10.14412/1996-7012-2020-2-97-103. [Chikina M.N., Eliseev M.S., Zhelyabina O.V. Practical application of national clinical guidelines for the management of gout (preliminary data). Modern Rheumatology Journal. 2020;14(2):97–103 (in Russ.). DOI: 10.14412/1996-7012-2020-2-97-103].
6. Чикина М.Н., Желябина О.В., Елисеев М.С. Влияние уратснижающей терапии на показатели качества жизни у пациентов с подагрой. Современная ревматология. 2021;15(3):62–68. DOI: 10.14412/1996-7012-2021-3-62-68. [Chikina M.N., Zhelyabina O.V., Eliseev M.S. Impact of urate-lowering therapy on quality of life indicators in patients with gout. Modern Rheumatology Journal. 2021;15(3):62–68 (in Russ.). DOI: 10.14412/1996-7012-2021-3-62-68].
7. Kumagai T., Ota T., Tamura Y. et al. Time to target uric acid to retard CKD progression. Clin Exp Nephrol. 2017;21(2):182–192. DOI: 10.1007/s10157-016-1288-2.
8. Jeyaruban A., Hoy W., Cameron A. et al. Hyperuricaemia, gout and allopurinol in the CKD Queensland registry. J Nephrol. 2021;34(3):753–762. DOI: 10.1007/s40620-020-00937-4.
9. Yen F.S., Wei J.C., Chang C.L. et al. Urate-lowering Therapy and Chronic Kidney Disease Development in Patients with Gout. Int J Med Sci. 2021;18(12):2599–2606. DOI: 10.7150/ijms.59698.
10. FitzGerald J.D., Dalbeth N., Mikuls T. et al. 2020 American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res (Hoboken). 2020;72(6):744–60. DOI: 10.1002/acr.24180.
11. Richette P., Doherty M., Pascual E. et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017;76(1):29–42. DOI: 10.1136/annrheumdis-2016-209707.
12. Pascart T., Latourte A., Flipo R.M. et al. 2020 recommendations from the French Society of Rheumatology for the management of gout: Urate-lowering therapy. Joint Bone Spine. 2020;87(5):395–404. DOI: 10.1016/j.jbspin.2020.05.002.
13. Premachandra K.H., Day R.O., Roberts D.M. Managing hyperuricemia and gout in chronic kidney disease: a clinical conundrum. Curr Opin Nephrol Hypertens. 2021;30(2):245–251. DOI: 10.1097/MNH.0000000000000691.
14. Stamp L.K., Farquhar H., Pisaniello H.L. et al. Management of gout in chronic kidney disease: a G-CAN Consensus Statement on the research priorities. Nat Rev Rheumatol. 2021;17(10):633–641. DOI: 10.1038/s41584-021-00657-4.
15. Государственный реестр лекарственных средств. Фебуксостат. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/grls.aspx?s=фебуксостат&m=mnn (дата обращения: 20.12.2021). [State register of medicines. Febuxostat. (Electronic resource.) URL: https://grls.rosminzdrav.ru/grls.aspx?s=фебуксостат&m=mnn (access date: 20.12.2021) (in Russ.)].
16. Levey A.S., Stevens L.A., Schmid C.H. et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604–612. DOI: 10.7326/0003-4819-150-9-200905050-00006.
17. Клинические рекомендации. Хроническая болезнь почек. (Электронный ресурс.) URL: https://rusnephrology.org/wp-content/uploads/2020/12/CKD_final.pdf (дата обращения: 20.12.2021). [Clinical recommendations. Chronic kidney disease. (Electronic resource.) URL: https://rusnephrology.org/wp-content/uploads/2020/12/CKD_final.pdf (access date: 20.12.2021) (in Russ.)].
18. Чикина М.Н., Елисеев М.С., Желябина О.В. Сравнение эффективности и безопасности различных противовоспалительных препаратов при инициации уратснижающей терапии у пациентов с подагрой (предварительные данные). Современная ревматология. 2021;15(2):50–56. DOI: 10.14412/1996-7012-2021-2-50-56. [Chikina M.N., Eliseev M.S., Zhelyabina O.V. Comparison of the efficacy and safety of various anti-inflammatory drugs in urate-lowering therapy initiation in patients with gout (preliminary data). Modern Rheumatology Journal. 2021;15(2):50–56 (in Russ.). DOI: 10.14412/1996-7012-2021-2-50-56].
19. Becker M.A., Schumacher H.R. Jr., Wortmann RL. et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med. 2005;353(23):2450–2461. DOI: 10.1056/NEJMoa050373.
20. Fuldeore M.J., Riedel A.A., Zarotsky V. et al. Chronic kidney disease in gout in a managed care setting. BMC Nephrol. 2011;12:36. DOI: 10.1186/1471-2369-12-36.
21. Kumar S., Gow P. A survey of indications, results and complications of surgery for tophaceous gout. N Z Med J. 2002;115(1158):U109. PMID: 12362184.
22. Schumacher H.R. Jr., Becker M.A., Wortmann R.L. et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum. 2008;59(11):1540–1548. DOI: 10.1002/art.24209.
23. Juge P.A., Truchetet M.E., Pillebout E. et al. Efficacy and safety of febuxostat in 73 gouty patients with stage 4/5 chronic kidney disease: A retrospective study of 10 centers. Joint Bone Spine. 2017;84(5):595–598. DOI: 10.1016/j.jbspin.2016.09.020.
24. Yamaguchi A., Harada M., Yamada Y. et al. Identification of chronic kidney disease patient characteristics influencing the renoprotective effects of febuxostat therapy: a retrospective follow-up study. BMC Nephrol. 2017;18(1):162. DOI: 10.1186/s12882-017-0572-z.
25. Shibagaki Y., Ohno I., Hosoya T., Kimura K. Safety, efficacy and renal effect of febuxostat in patients with moderate-to-severe kidney dysfunction. Hypertens Res. 2014;37(10):919–925. DOI: 10.1038/hr.2014.107.
26. Borghi C., Perez-Ruiz F. Urate lowering therapies in the treatment of gout: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci. 2016;20(5):983–992. PMID: 27010159.
27. Becker M.A., Schumacher H.R., Espinoza L.R. et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther. 2010;12(2):R63. DOI: 10.1186/ar2978.
28. Gunawardhana L., Becker M.A., Whelton A. et al. Efficacy and safety of febuxostat extended release and immediate release in patients with gout and moderate renal impairment: phase II placebo-controlled study. Arthritis Res Ther. 2018;20(1):99. DOI: 10.1186/s13075-018-1593-0.
29. Farquhar H., Vargas-Santos A.B., Pisaniello H.L. et al. Efficacy and safety of urate-lowering therapy in people with kidney impairment: a GCAN-initiated literature review. Rheumatol Adv Pract. 2021;5(1):rkaa073. DOI: 10.1093/rap/rkaa073.
30. Peng Y.L., Tain Y.L., Lee C.T. et al. Comparison of uric acid reduction and renal outcomes of febuxostat vs allopurinol in patients with chronic kidney disease. Sci Rep. 2020;10(1):10734. DOI: 10.1038/s41598-020-67026-1.
31. Kimura K., Hosoya T., Uchida S. et al. Febuxostat Therapy for Patients With Stage 3 CKD and Asymptomatic Hyperuricemia: A Randomized Trial. Am J Kidney Dis. 2018;72(6):798–810. DOI: 10.1053/j.ajkd.2018.06.028.
32. Kanji T., Gandhi M., Clase C.M., Yang R. Urate lowering therapy to improve renal outcomes in patients with chronic kidney disease: systematic review and meta-analysis. BMC Nephrol. 2015;16:58. DOI: 10.1186/s12882-015-0047-z.
33. Hsu Y.O., Wu I.W., Chang S.H. et al. Comparative Renoprotective Effect of Febuxostat and Allopurinol in Predialysis Stage 5 Chronic Kidney Disease Patients: A Nationwide Database Analysis. Clin Pharmacol Ther. 2020;107(5):1159–1169. DOI: 10.1002/cpt.1697.
34. Tsuruta Y., Mochizuki T., Moriyama T. et al. Switching from allopurinol to febuxostat for the treatment of hyperuricemia and renal function in patients with chronic kidney disease. Clin Rheumatol. 2014;33(11):1643–1648. DOI: 10.1007/s10067-014-2745-5.
35. Chou H.W., Chiu H.T., Tsai C.W. et al. Comparative effectiveness of allopurinol, febuxostat and benzbromarone on renal function in chronic kidney disease patients with hyperuricemia: a 13-year inception cohort study. Nephrol Dial Transplant. 2018;33(9):1620–1627. DOI: 10.1093/ndt/gfx313.
36. Sircar D., Chatterjee S., Waikhom R. et al. Efficacy of febuxostat for slowing the GFR decline in patients with CKD and asymptomatic hyperuricemia: a 6-month, doubleblind, randomized, placebo-controlled trial. Am J Kidney Dis. 2015;66(6):945–950. DOI: 10.1053/j.ajkd.2015.05.017.
37. Alicic R.Z., Rooney M.T., Tuttle K.R. Diabetic Kidney Disease: Challenges, Progress, and Possibilities. Clin J Am Soc Nephrol. 2017;12(12):2032–2045. DOI: 10.2215/CJN.11491116.
38. Chobanian A.V., Bakris G.L., Black H.R. et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension. 2003;42(6):1206–1252. DOI: 10.1161/01.HYP.0000107251.49515.c2.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.