Современные подходы к диагностике и лечению тикозных гиперкинезов у детей
РМЖ. Медицинское обозрение. №3 от 27.03.2019 стр. 39-44
Рубрика:
Педиатрия
Тикозные расстройства представляют собой актуальную проблему в связи с высокой частотой встречаемости, достигающей 1–6% в детской популяции, коморбидностью с синдромом дефицита внимания, стереотипиями, тревожностью, трудностями обучения, перепадами настроения и нарушениями сна. В статье рассмотрены новые положения МКБ-11 о переводе тиков и синдрома Туретта (СТ) из раздела психических заболеваний в неврологический раздел. Основной патогенетической моделью является дисбаланс медиаторов дофамина, ГАМК и глутамата в системе кора — таламус — стриатум — кора. Нами впервые обнаружены электромиографические паттерны тиков, которые включают веретенообразную и ромбовидную залповую активность, что позволяет объективизировать тяжесть и прогноз заболевания, а также расширить представления о нейрофизиологических аспектах тиков. По данным электромиографии обнаружены четкие различия между группами больных моторными, моторно-вокальными тиками и СТ, параметры исходного фона биоэлектрической активности мышц, количества серийных (кластерных) залпов и их амплитуды показали прямую корреляцию с тяжестью гиперкинезов по Йельской шкале оценки тяжести тиков YGSST. В качестве препарата первой линии терапии в стадии дебюта тиков у детей дошкольного и младшего школьного возраста возможно применение аминофенилмасляной кислоты. На стадии экспрессии симптомов целесообразно начинать лечение с Анвифена, в случае отсутствия динамики симптомов переходить на лечение антиконвульсантами и нейролептиками.
Ключевые слова: гиперкинезы, моторные тики, вокальные тики, синдром Туретта.
Ключевые слова: гиперкинезы, моторные тики, вокальные тики, синдром Туретта.
V.P. Zykov1, E.A. Kashirina2, Yu.V. Naugolnykh2, I.B. Komarova1, E.B. Novikova1
1Russian Medical Academy of Continuous Professional Education, Moscow
2Children City Clinical Hospital No. 110, Moscow
Tic disorders represent a relevant problem due to a high incidence, reaching 1–6% in children population, comorbidity with attention deficit disorder, stereotypes, anxiety, learning disorders, mood swings, and sleep disorders. The article deals with the ICD-11 new provisions on the tics and Tourette’s syndrome transfer from “Mental Diseases” section to “Neurology” section. The main pathogenetic model is the imbalance of dopamine, GABA and glutamate mediators in the cortex — thalamus — striatum — cortex system. For the first time, we have discovered tic electromyographic patterns, which include fusiform and rhomboid bursting activity, which allows objectifying the severity and prognosis of the disease, as well as to broaden the understanding of tic neurophysiological aspects. There were clear differences between the groups of patients with motor, motor-vocal tics, and Tourette’s syndrome according to electromyography; bioelectric muscle activity parameters of the baseline background and the number of serial (cluster) bursts and their amplitude showed a direct correlation with the hyperkinesis severity by Yale Global Tic Severity Scale (YGTSS). Aminophenylbutyric and gopantenic acids can be used as a first-line drug during the onset stage in children of preschool and primary school age. At the stage of symptom expression, it is advisable to use anticonvulsants and neuroleptics.
Keywords: hyperkinesis, motor tics, vocal tics, Tourette’s syndrome.
For citation: Zykov V.P., Kashirina E.A., Naugolnykh Yu.V. et al. Current approaches to the diagnosis and treatment of tic hyperkinesis in children. RMJ. Medical Review. 2019;3:43–48.
В статье представлены современные подходы к диагностике и лечению тикозных гиперкинезов у детей.

Введение
Тикозные расстройства представляют собой актуальную проблему в связи с высокой частотой встречаемости, достигающей 1–6% в детской популяции, коморбидностью с синдромом дефицита внимания, стереотипиями, тревожностью, трудностями обучения, перепадами настроения и нарушениями сна [1, 2].Тик представляет собой стереотипный гиперкинез, включающий различные группы мышц, напоминает произвольные движения или звуки, усиливается при эмоциональных и физических нагрузках, исчезает во сне [3]. В последней версии Международной классификации болезней (МКБ-11) [4], которая представлена для обсуждения, тикозные расстройства и синдром Туретта (СТ) из раздела психических заболеваний переведены в раздел болезней нервной системы. Проект МКБ-11 будет утвержден Генеральной Ассамблеей ВОЗ в мае 2019 г. Планируется полный переход на новую версию с 2022 г. Надо отметить, что данное нововведение оправданно, т. к. родители обращаются в первую очередь к детскому неврологу при появлении тикозных гиперкинезов, а не к психиатру.
Классификация тикоподобных расстройств по МКБ-11
09 Болезни нервной системы / Двигательные нарушения8A05.0 Первичные тики или тиковые расстройства
8A05.00 Синдром Туретта
8A05.01 Хронический моторный синдром
8A05.02 Хроническое звуковое расстройство
8A05.0Y Другие уточненные первичные тики или тиковые расстройства
8A05.0Z Первичные тики или тиковые расстройства, неуточненные
8A05.1 Вторичные тики
8A05.10 Инфекционные или постинфекционные тики
8A05.11 Тики, связанные с нарушениями развития
8A05.1Y Другие уточненные вторичные тики
8A05.1Z Вторичные тики, неуточненные
8A05.Y Другие уточненные тиковые расстройства
8A05.Z Тиковые расстройства, неуточненные
Первичные тики
Под первичными тиками подразумевают наследственные, с клинических позиций целесообразно составление родословных, поиск родственников, у которых были тики в детском возрасте или наблюдаются в настоящее время. В ряде случаев ретроспектива гиперкинезов родственников пробанда позволяет представить индивидуальный прогноз для больного. СТ рассматривают как множественные генерализованные моторные тики, один или более вокальные, возникающие в течение 12 мес. с ремиссией не более 3 мес. Гиперкинезы значительно ухудшают профессиональную деятельность (у взрослых) или обучение в школе и колледже (у детей). Имеются сложности дифференциальной диагностики между СТ и хроническими моторными и вокальными тиками, в связи с чем изучают генетические, нейрофизиологические маркеры заболевания и данные нейровизуализации. Тики наследуются по аутосомно-доминантному типу, встречается полудоминантный тип с пропусками поколений, с усилением симптомов при передаче признаков заболевания. Предполагается как аутосомно-рецессивный тип наследования, так и спорадические варианты заболевания. Последним успехом нейрогенетики было обнаружение при спорадических случаях СТ особой мутации гена RICTOR, в результате которой изменяется регуляция внутриклеточной передачи сигнала в нейронах и миоцитах независимо от конкретных нейромедиаторных моделей болезни [5, 6]. При наших исследованиях составление родословных при семейных формах заболевания показало наличие тиков у родственников I и II степени родства до 70% случаев. В МКБ-10, так же как и в 11-й версии, представлена классификация тиков на примере взрослых пациентов. Надо подчеркнуть, что только у детей наблюдаются возраст-зависимые стадии заболевания: дебют тиков — от 3 до 7 лет, стадия экспрессии симптомов — от 8 до 12 лет, резидуальная стадия — после 15 лет.Семиотика тиков и топография гиперкинезов имеют следующую особенность перехода хронических тиков в СТ, а именно генерализацию моторных тиков с включением верхних и нижних конечностей, мышц-разгибателей спины и живота. Хронические тики отличаются от СТ тяжестью гиперкинезов по Йельской шкале оценки тяжести тиков
YGTSS [7], длительностью периодов обострения, трудностями социальной адаптации. В МКБ-11 присутствует нозология «хронический моторный и вокальный тик», только для детского возраста имеется сочетание хронических моторных и вокальных тиков, но по выраженности проявлений они не достигают СТ. В семиотике гиперкинезов мы выделяем клонические и дистонические тики (табл. 1).
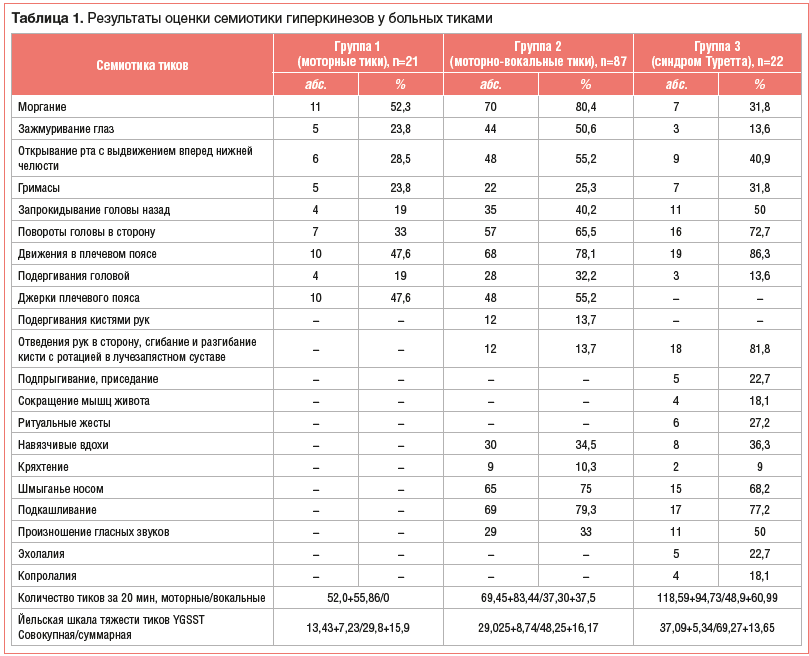
Вторичные тики
Вторичные тики: постинфекционные, в рамках последствий стрептококковой инфекции, педиатрический аутоиммунный синдром, вызванный стрептококком, и педиатрический иммунный синдром, вызванный любой инфекцией. По нашим данным, до 17% больных после респираторных инфекций имели антитела к хвостатому ядру. Клиническими критериями инфекционных тиков являются дебют гиперкинезов и обострение после респираторных инфекций, незначительный эффект от антитикозных препаратов — нейролептиков. Согласно нозологическому классификатору DSM–IV, тики по длительности делят на транзиторные (длительность менее 12 мес. и ремиссия более 3 мес.) и хронические (длительность не менее 12 мес., ремиссия не больше 3 мес.) [8].Такое деление довольно условно и зависит от качества сбора анамнеза и воспоминаний родителей о проявлениях симптомов болезни. Наиболее удачный вариант, когда врач наблюдает больного перед тем, как выставить диагноз. Тики, связанные с нарушением развития, выделены в отдельную рубрику, однако не уточняется, связаны они с развитием речи, памяти, внимания, нарушениями координации, вероятно, это тики при аутизме или снижении интеллекта. В данном случае гиперкинезы протекают без возрастных фаз обострения, ведущее клиническое значение имеют нарушение развития ребенка и методы его коррекции.Решающими факторами для определения нозологической формы являются семиотика и количество серий тиков за 20 мин. Как видно из таблицы 1, СТ отличается от хронических тиков полиморфизмом моторных гиперкинезов, включая тики верхних и нижних конечностей, наличие сложных вокализмов. Обострения заболевания протекают с высокой частотой тиков за 20 мин до 100 и более и высоким уровнем баллов по Йельской шкале оценки тяжести тиков. Гиперкинезы приводят к нарушению адаптации и обучения в школе. D. Martino et al. (2015) [10] считают, что синдром дефицита внимания, обсессивно-компульсивный синдром и сенсорные симптомы (предчувствие тика) являются основными критериями СТ.
Клиническое наблюдение
Мы обследовали 130 больных с тикозными расстройствами в возрасте 6–14 лет, средний возраст составил 10±4 года. В таблице 1 представлены семиотика и топография гиперкинезов, оценка тяжести методом подсчета за 20 мин и по шкале тяжести тиков YGSST.Обращает на себя внимание тот факт, что отличие СТ от хронических моторно-вокальных тикозных расстройств состояло в генерализации гиперкинезов на верхние и нижние конечности, наличии 3 и более различных вариантов моторных тиков, статусных вокализмов и появлении эхо-копролалии. Результаты подсчета тиков за 20 мин соответствовали результатам балльной оценки по шкале YGTSS. Максимальное количество моторных и вокальных тиков при подсчете за 20 мин было выявлено у больных СТ, как и балльная оценка суммарной и совокупной тяжести тиков. Достоверные различия наблюдались только между группами больных с изолированными моторными симптомами и СТ. С целью поиска нейрофизиологических паттернов для дифференциального диагноза СТ от хронических моторно-вокальных тиков проведена электромиография (ЭМГ).
Наши исследования показали целесообразность разделения тиков на клонические: быстрые движения длительностью до 0,5 с и дистонические гиперкинезы длительностью более 0,5–1 с. По данным поверхностной ЭМГ, для клонических тиков характерна веретенообразная залповая активность (ВЗА), а для дистонических тиков — ромбовидная.
В таблице 2 представлена клинико-электромиографическая верификация гиперкинезов. У больных 1-й группы при проведении исследования в интерференционном режиме ЭМГ кластерная залповая активность (КЗА) не выявлялась. У больных 2-й группы КЗА чаще всего обнаруживалась в мышцах лица (круговая мышца глаза), у больных 3-й группы — в мышцах лица и плечевого пояса. У больных всех трех групп обнаруживались залпы без тика в мышцах лица, плечевого пояса, верхних конечностях. Длительность залпа без тика составляла не более 12 мс. У больных 3-й группы субклинические залпы регистрировались достоверно чаще, чем у больных 1-й и 2-й групп (p<0,001 и p<0,05 соответственно). По нашим наблюдениям, КЗА регистрировалась преимущественно в период обострения заболевания либо при его тяжелом течении.
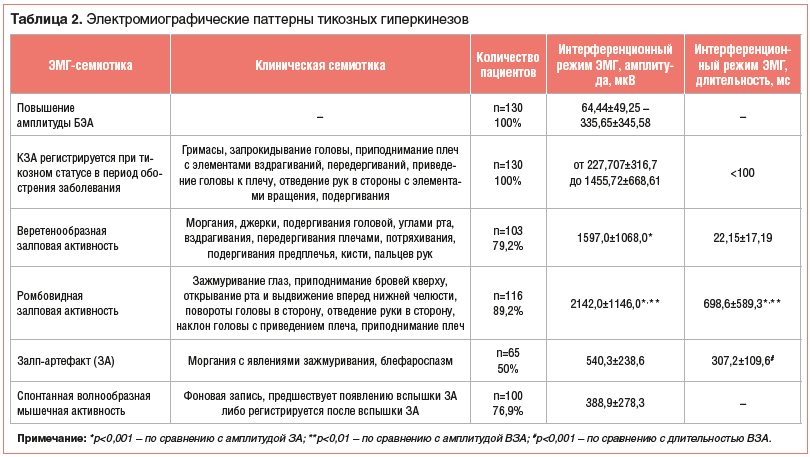
Амплитуда биоэлектрической активности (БЭА) лобной мышцы (при записи слева), мышц плечевого пояса (трапециевидной, надостной мышц при записи справа) у больных моторными тиками (1-я группа) не отличалась от таковой в группе контроля. Обнаруживалось значимое увеличение амплитуды БЭА мышц лица (лобная мышца при записи справа, круговая мышца глаза, круговая мышца рта), плечевого пояса (трапециевидной мышцы, надостной мышцы при записи слева), мышц верхних конечностей без регистрации КЗА, эти параметры достоверно превышали соответствующие показатели в контрольной группе (p<0,01).
У пациентов 2-й группы амплитуда БЭА лобной мышцы (при записи справа) не отличалась от таковой в группе контроля (табл. 2). Было обнаружено достоверное увеличение амплитуды БЭА лобной мышцы при записи слева по сравнению с таковой в группе контроля (p<0,01), круговой мышцы рта (p<0,01), надостной мышцы при записи справа (p<0,01). КЗА была зафиксирована в мышцах лица — в круговой мышце глаза, в мышцах плечевого пояса — трапециевидных мышцах, надостной мышце при записи слева, мышцах верхних конечностей с амплитудой залпов 350,33+356,63 мкВ длительностью до 100 мс.
У больных СТ (3-й группы) БЭА лобной мышцы была достоверно выше, чем в контрольной группе (p<0,01). КЗА обнаруживалась во всех исследуемых мышцах — лица (круговая мышца глаза, круговая мышца рта), плечевого пояса, верхних конечностей с амплитудой ЗА 380,24+512,55 мкВ длительностью осцилляции в пределах 100 мс. У пациентов 3-й группы отмечалось значимое преобладание БЭА лобной мышцы при записи слева по сравнению с больными 1-й (p<0,01) и 2-й групп (p<0,05). Наблюдалось достоверное увеличение длительности КЗА мышц плечевого пояса (трапециевидная и надостная мышцы слева), мышц верхних конечностей (поверхностный сгибатель пальцев слева) у пациентов 3-й группы по сравнению со 2-й группой (p<0,05).
Таким образом, только по данным ЭМГ обнаружены четкие различия между группами больных моторными, моторно-вокальными тиками и СТ по параметрам исходного фона БЭА мышц, количеству серийных (кластерных) залпов и их амплитуды, получена прямая корреляция с тяжестью гиперкинезов по шкале YGSST.
Патогенетические концепции, которые рассматриваются в современной литературе, касаются дисфункции нейромедиаторных систем дофамина, норадреналина, ГАМК, серотонина и глутамата в кортико-стриато-амигдало-таламо-кортикальной системе [10–12]. Последние исследования с использованием функциональной МРТ показали связь эмоциональных факторов со зрительной корой, инсулярной областью и стриарной системой у больных СТ по сравнению со здоровыми обследуемыми [13]. Данное исследование позволило объяснить роль психоэмоционального фактора, провоцирующего тик, зону дебюта гиперкинеза рассматривать как дополнительную моторную кору. МРТ с режимом анизотропии определила связь тяжести тиков, нарушений плотности связей и нейронов в корковых отделах сенсомоторной коры левого полушария, что было расценено как врожденные или приобретенные изменения, которые объясняют длительное течение заболевания и продолжение его у взрослых [14].
Лечение тиков
Лечение тиков представляет собой длительную программу — от 4–6 мес. до нескольких лет. В период обострения рекомендуется ограничить просмотр телепрограмм и занятия на персональном компьютере. В режим ввести длительные пешие прогулки. Лечение коморбидных синдромов рекомендуется проводить после стабилизации тикозных гиперкинезов. В стадии дебюта в дошкольном и младшем школьном возрасте рекомендуется назначение гопантеновой или аминофенилмасляной кислоты (Анвифен®).Аминофенилмасляная кислота представляет собой фенильное производное гамма-аминомасляной кислоты (ГАМК). Фармакологические характеристики, включая влияние на GABA, допаминергические и бензодиазепиновые рецепторы, оказались сопоставимы с таковыми у диазепама и пирацетама. Аминофенилмасляная кислота и ГАМК обладают одинаковым действием на ионные каналы, что было доказано в исследовании на изолированных нейронах беспозвоночных [15]. Кроме того, препарат оказывает сходное с бензодиазепинами нейрохимическое действие на подкорковые ядра [16, 17]. Показано, что введение фенибута до воздействия стрессового фактора повышает чувствительность бензодиазепиновых рецепторов [16, 17].
Л.С. Мехилане и соавт. провели двойное плацебо-контролируемое слепое исследование эффективности аминофенилмасляной кислоты у пациентов с невротическими и психотическими расстройствами [18]. В данном исследовании было показано, что назначение препарата в дозе 0,25-0,5 г трижды в день приводит к активизации интеллектуальных функций, увеличению физической выносливости, мотивационной активности, уменьшает симптомы астении и раздражительности.
В детском возрасте аминофенилмасляная кислота используется преимущественно для коррекции негрубых тикозных расстройств и заикания [19, 20]. До последнего времени препарат был представлен исключительно в дозе 0,25 г (Фенибут), что при лечении детей дошкольного возраста вызывало необходимость деления таблеток и было неудобно. Кроме того, существовала вероятность негативного раздражающего действия на желудочно-кишечный тракт. В последние годы появился новый препарат Анвифен®, преимуществами которого являются капсулированная форма и наличие детской дозировки (50 мг). Это сделало возможным использование лекарства с 3-летнего возраста.
Мы использовали препарат аминофенилмасляной кислоты для лечения 25 больных тиками в стадии дебюта в возрасте 5–10 лет с целью действия на тормозные ГАМК-ергические системы мозга. Дозы составляли, исходя из инструкции к препарату, для детей 5–8 лет 50–100 мг 3 раза в день, 8–10 лет 250 мг 3 раза в день [21], курс лечения — 3–6 мес. Наряду со снижением симптоматики тиков (учащенного мигания) и движения крыльев носа уменьшились проявления заикания, улучшилась речь. Через 10–12 мес. все больные были без терапии, и у 3 из них отмечалось обострение симптоматики тиков с увеличением гиперкинезов от исходных показателей в 2 раза, в связи с чем назначили клоназепам. Использование аминофенилмасляной кислоты приводит к полному исчезновению единичных локальных тиков в период ее приема, одновременно препарат оказывает положительное воздействие на заикание клонической формы. При отсутствии эффекта лечения препаратом можно повысить дозировку до максимально переносимой дозы и удлинить курс лечения до 12 мес.
Критерием стадии экспрессии — пика клинических проявлений тиков — является более 50 тиков за 20 мин подсчета (тикозный статус). В стадии экспрессии симптомов детям 8–12 лет мы рекомендуем начинать лечение с Анвифена, в случае отсутствия динамики симптомов через 3–4 нед. переходить к лечению антиконвульсантами и нейролептиками:
антиконвульсанты: клоназепам, топирамат, леветирацетам;
нейролептики: тиаприд 100–300 мг, галоперидол 1,5–3 мг (уровень доказательности А), рисперидон 2–4 мг, арипипразол (уровень доказательности С), оланзапин (уровень доказательности В) [22, 23]. Перспективно использование поведенческой терапии у детей начиная с 9–10 лет в качестве дополнительного или альтернативного лечения, тренинг купирования симптомов, предотвращения привычных тиков или замены одних движений другими (в англоязычном варианте — Habit reversal training), цель которого — обучить ребенка навыкам предотвращения тика до его появления [24]. Предложенные в нашей работе ЭМГ-критерии тиков позволят контролировать медикаментозное лечение, а также выводить на экран перед больным залповую и фоновую активность мышц во время сеанса поведенческой терапии.
Отмену антитикозной терапии целесообразно проводить в период ремиссии заболевания, желательно в период школьных каникул.
Литература
1. Назарова Е.К. Клинико-генетическая характеристика тиков у детей: дис. … канд. мед. наук. М., 2003. [Nazarova E.K. Clinical and genetic characteristics of tics in children: dis. … Cand. honey. sciences. M., 2003 (in Russ.)].
2. Зыков В.П., Каширина Э.А., Наугольных Ю.В. Тики и коморбидные симптомы детского возраста. РМЖ. 2017;21:1581–1585. [Zykov V.P., Kashirina E.A., Nagalnykh Yu.V. Tics and comorbid symptoms of childhood. RMJ. 2017;21:1581–1585 (in Russ.)].
3. Зыков В.П. Тики у детей. М.: Триада-Х; 2003. [Zykov V.P. Tics in children. M.: Triada-X; 2003 (in Russ.)].
4. ICD-11 for Mortality and Morbidity Statistics (ICD-11 MMS) 2018 version. (Electronic resource). URL: https://icd.who.int/browse11/l-m/en (access date: 12.20.2018).
5. Eriguchi Y., Kuwabara H., Inai A. et al. Identification of candidate genes involved in the etiology of sporadic Tourette syndrome by exome sequencing. Am J Med Genet B Neuropsychiatr Genet. 2017;174(7):712–723.
6. Sarbassov D.D., Ali S.M., Kim D.H. et al. Rictor, a novel binding partner of mTOR, defines a rapamycin-insensitive and raptor-independent pathway that regulates the cytoskeleton. Curr. Biol. 2004;14:1296–1302.
7. Leckman J.F., Riddle M.A., Hardin M.T. et al. The Yale Global Tic Severity Scale; initial testing of a clinical-rated scale of tic severity. J Am Acad Child Adolesc Psychiatry. 1989;28:566–573.
8. Делягин В.М. Тики у детей. РМЖ. Мать и дитя. 2013;14:784. [Delyagin V.M. Tics in children. RMJ. Mother and child. 2013;14:784 (in Russ.)].
9. Martino D., Ganos C., Pringsheim T.M. Tourette Syndrome and Chronic Tic Disorders: The Clinical Spectrum Beyond Tics. Int Rev Neurobiol. 2017;134:1461–1490.
10. Nordstrom E.J., Bittner K.C., McGrath M.J. et al. Hyperglutamatergic cortico-striato-thalamo-cortical circuit breaker drugs alleviate tics in a transgenic circuit model of Tourette´s syndrome. Brain Res. 2015;1629:38–53.
11. Singer H.S. Merging the Pathophysiology and Pharmacotherapy of Tics. Tremor Other Hyperkinet Mov (NY). 2019;8:595.
12. Caligiore D., Mannella F., Michael A. et al. Dysfunctions of the basal ganglia-cerebellar-thalamo-cortical system produce motor tics in Tourette syndrome. PLoS Comput Biol. 201;13 (3).
13. Rae C.L., Polyanska L., Gould van Praag C.D. et al. Face perception enhances insula and motor network reactivity in Tourette syndrome. Brain. 2018;141(11):3249–3261.
14. Thomalla G., Rossbach D.P., Rosenkranz M. Negative fluid‐attenuated inversion recovery imaging identifies acute ischemic stroke at 3 hours or less. Ann Neurology. 2009;16:637.
15. Завадская Л.Н. Влияние GABA и ее производных на ионные каналы мембран выделенных нейронов Planorbarius corneus. Изв. АН КазССР. Серия биол. 1984;6:13–19. [Zavadskaya L.N. Effect of GABA and its derivatives on the ion channels of the membranes of isolated neurons of Planorbarius corneus. Izv. AN KazSSR. Biol Series. 1984;6:13–19 (in Russ.)].
16. Талалаенко А.Н., Панфилов М.Ю., Воздиган С.А. и др. Нейрохимический профиль прилежащего ядра перегородки в анксиолитическом действии транквилизаторов на различных моделях тревоги. Экспериментальная и клиническая фармакология. 1997;60(4):7–9. [Talalaenko A.N., Panfilov M.Yu., Vozdigan S.A. et al. The neurochemical profile of the adjacent septum nucleus in the anxiolytic action of tranquilizers on various models of anxiety. Experimental and clinical pharmacology. 1997;60(4):7–9 (in Russ.)].
17. Талалаенко А.Н., Гордиенко Д.В., Маркова О.П. Нейрохимический профиль хвостатого ядра в анксиолитическом действии бензодиазепиновых и небензодиазепиновых транквилизаторов на различных моделях тревоги. Эксп. и клин. фармакология. 2000;1:14–18. [Talalaenko A.N., Gordienko D.V., Markova OP Neurochemical profile of the caudate nucleus in the anxiolytic action of benzodiazepine and nonbenzodiazepine tranquilizers on various models of anxiety. Exp. and wedge. pharmacology. 2000;1:14–18 (in Russ.)].
18. Мехилане Л.С., Ряго Л.К., Алликметс Л.Х. Фармакология и клиника фенибута. Тарту; 1990. [Mekhilane L.S., Ryago L.K., Allikmets L. Kh. Pharmacology and Phenibut Clinic. Tartu; 1990 (in Russ.)].
19. Зыков В.П., Комарова И.Б., Назарова Е.К. и др. Состояние вегетативной сердечно-сосудистой регуляции у больных тиками и синдромом Туретта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2003;11:10–14. [Zykov V.P., Komarova I.B., Nazarova E.K. and others. The state of vegetative cardiovascular regulation in patients with tics and Tourette syndrome. Journal of Neurology and Psychiatry named after SS Korsakov. 2003;11:10–14 (in Russ.)].
20. Зыков В.П., Айвазян С.О., Ширяев Ю.С. Дифференциальная диагностика гиперкинезов с эпилептическими приступами у детей. РМЖ. Педиатрия. 2012;2:41–14. [Zykov V.P., Ayvazyan S.O., Shiryaev Yu.S. Differential diagnosis of hyperkinesis with epileptic seizures in children. RMJ. Pediatrics. 2012;2:41–14 (in Russ.)].
21. Государственный реестр лекарственных средств. Инструкция по медицинскому применению препарата Анвифен®. (Электронный ресурс). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=282a67f2-5003-4224-8ce8-d8b08aa8e440andt= (дата обращения: 22.03.2019). [State register of medicines. Instructions for medical use of the drug Anvifen®. (Electronic resource). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=282a67f2-5003-4224-8ce8-d8b08aa8e440andt= (access date: 03.22.2019) (in Russ.)].
22. Зыков В.П., Каширина Э.А. Наугольных Ю.В. Современные подходы к терапии тикозных гиперкинезов с использованием препаратов антиконвульсантного ряда. Эпилепсия и пароксизмальные состояния. 2016;3:45–51. [Zykov V.P., Kashirina E.A., Uagolnykh Yu.V. Modern approaches to the treatment of tic hyperkinesis with the use of anticonvulsant drugs. Epilepsy and paroxysmal states. 2016;3:45–51 (in Russ.)].
23. European clinical guidelines for Tourette Syndrome and other tic disorders. Eur Child Adolesc Psychiatry. 2011;20:155–171.
24. Woods D.W., Piancentini J.C., Chang S.W. at al. Managing Tourette Syndrome. A Behavioral Intervention for Children and Adults. Oxford University Press; 2008.
2. Зыков В.П., Каширина Э.А., Наугольных Ю.В. Тики и коморбидные симптомы детского возраста. РМЖ. 2017;21:1581–1585. [Zykov V.P., Kashirina E.A., Nagalnykh Yu.V. Tics and comorbid symptoms of childhood. RMJ. 2017;21:1581–1585 (in Russ.)].
3. Зыков В.П. Тики у детей. М.: Триада-Х; 2003. [Zykov V.P. Tics in children. M.: Triada-X; 2003 (in Russ.)].
4. ICD-11 for Mortality and Morbidity Statistics (ICD-11 MMS) 2018 version. (Electronic resource). URL: https://icd.who.int/browse11/l-m/en (access date: 12.20.2018).
5. Eriguchi Y., Kuwabara H., Inai A. et al. Identification of candidate genes involved in the etiology of sporadic Tourette syndrome by exome sequencing. Am J Med Genet B Neuropsychiatr Genet. 2017;174(7):712–723.
6. Sarbassov D.D., Ali S.M., Kim D.H. et al. Rictor, a novel binding partner of mTOR, defines a rapamycin-insensitive and raptor-independent pathway that regulates the cytoskeleton. Curr. Biol. 2004;14:1296–1302.
7. Leckman J.F., Riddle M.A., Hardin M.T. et al. The Yale Global Tic Severity Scale; initial testing of a clinical-rated scale of tic severity. J Am Acad Child Adolesc Psychiatry. 1989;28:566–573.
8. Делягин В.М. Тики у детей. РМЖ. Мать и дитя. 2013;14:784. [Delyagin V.M. Tics in children. RMJ. Mother and child. 2013;14:784 (in Russ.)].
9. Martino D., Ganos C., Pringsheim T.M. Tourette Syndrome and Chronic Tic Disorders: The Clinical Spectrum Beyond Tics. Int Rev Neurobiol. 2017;134:1461–1490.
10. Nordstrom E.J., Bittner K.C., McGrath M.J. et al. Hyperglutamatergic cortico-striato-thalamo-cortical circuit breaker drugs alleviate tics in a transgenic circuit model of Tourette´s syndrome. Brain Res. 2015;1629:38–53.
11. Singer H.S. Merging the Pathophysiology and Pharmacotherapy of Tics. Tremor Other Hyperkinet Mov (NY). 2019;8:595.
12. Caligiore D., Mannella F., Michael A. et al. Dysfunctions of the basal ganglia-cerebellar-thalamo-cortical system produce motor tics in Tourette syndrome. PLoS Comput Biol. 201;13 (3).
13. Rae C.L., Polyanska L., Gould van Praag C.D. et al. Face perception enhances insula and motor network reactivity in Tourette syndrome. Brain. 2018;141(11):3249–3261.
14. Thomalla G., Rossbach D.P., Rosenkranz M. Negative fluid‐attenuated inversion recovery imaging identifies acute ischemic stroke at 3 hours or less. Ann Neurology. 2009;16:637.
15. Завадская Л.Н. Влияние GABA и ее производных на ионные каналы мембран выделенных нейронов Planorbarius corneus. Изв. АН КазССР. Серия биол. 1984;6:13–19. [Zavadskaya L.N. Effect of GABA and its derivatives on the ion channels of the membranes of isolated neurons of Planorbarius corneus. Izv. AN KazSSR. Biol Series. 1984;6:13–19 (in Russ.)].
16. Талалаенко А.Н., Панфилов М.Ю., Воздиган С.А. и др. Нейрохимический профиль прилежащего ядра перегородки в анксиолитическом действии транквилизаторов на различных моделях тревоги. Экспериментальная и клиническая фармакология. 1997;60(4):7–9. [Talalaenko A.N., Panfilov M.Yu., Vozdigan S.A. et al. The neurochemical profile of the adjacent septum nucleus in the anxiolytic action of tranquilizers on various models of anxiety. Experimental and clinical pharmacology. 1997;60(4):7–9 (in Russ.)].
17. Талалаенко А.Н., Гордиенко Д.В., Маркова О.П. Нейрохимический профиль хвостатого ядра в анксиолитическом действии бензодиазепиновых и небензодиазепиновых транквилизаторов на различных моделях тревоги. Эксп. и клин. фармакология. 2000;1:14–18. [Talalaenko A.N., Gordienko D.V., Markova OP Neurochemical profile of the caudate nucleus in the anxiolytic action of benzodiazepine and nonbenzodiazepine tranquilizers on various models of anxiety. Exp. and wedge. pharmacology. 2000;1:14–18 (in Russ.)].
18. Мехилане Л.С., Ряго Л.К., Алликметс Л.Х. Фармакология и клиника фенибута. Тарту; 1990. [Mekhilane L.S., Ryago L.K., Allikmets L. Kh. Pharmacology and Phenibut Clinic. Tartu; 1990 (in Russ.)].
19. Зыков В.П., Комарова И.Б., Назарова Е.К. и др. Состояние вегетативной сердечно-сосудистой регуляции у больных тиками и синдромом Туретта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2003;11:10–14. [Zykov V.P., Komarova I.B., Nazarova E.K. and others. The state of vegetative cardiovascular regulation in patients with tics and Tourette syndrome. Journal of Neurology and Psychiatry named after SS Korsakov. 2003;11:10–14 (in Russ.)].
20. Зыков В.П., Айвазян С.О., Ширяев Ю.С. Дифференциальная диагностика гиперкинезов с эпилептическими приступами у детей. РМЖ. Педиатрия. 2012;2:41–14. [Zykov V.P., Ayvazyan S.O., Shiryaev Yu.S. Differential diagnosis of hyperkinesis with epileptic seizures in children. RMJ. Pediatrics. 2012;2:41–14 (in Russ.)].
21. Государственный реестр лекарственных средств. Инструкция по медицинскому применению препарата Анвифен®. (Электронный ресурс). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=282a67f2-5003-4224-8ce8-d8b08aa8e440andt= (дата обращения: 22.03.2019). [State register of medicines. Instructions for medical use of the drug Anvifen®. (Electronic resource). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=282a67f2-5003-4224-8ce8-d8b08aa8e440andt= (access date: 03.22.2019) (in Russ.)].
22. Зыков В.П., Каширина Э.А. Наугольных Ю.В. Современные подходы к терапии тикозных гиперкинезов с использованием препаратов антиконвульсантного ряда. Эпилепсия и пароксизмальные состояния. 2016;3:45–51. [Zykov V.P., Kashirina E.A., Uagolnykh Yu.V. Modern approaches to the treatment of tic hyperkinesis with the use of anticonvulsant drugs. Epilepsy and paroxysmal states. 2016;3:45–51 (in Russ.)].
23. European clinical guidelines for Tourette Syndrome and other tic disorders. Eur Child Adolesc Psychiatry. 2011;20:155–171.
24. Woods D.W., Piancentini J.C., Chang S.W. at al. Managing Tourette Syndrome. A Behavioral Intervention for Children and Adults. Oxford University Press; 2008.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
