Синдром стафилококкового токсического шока у ребенка. Клиническое наблюдение
DOI: 10.32364/2618-8430-2021-4-3-302-307
Синдром токсического шока — симптомокомплекс, включающий лихорадку, экзантему, полиорганную дисфункцию, а также артериальную гипотонию. Наиболее частой причиной данного синдрома принято считать Staphylococcus aureus или стрептококки группы А. Синдром характеризуется выраженной тяжестью течения, при отсутствии специфической комплексной терапии — высокими показателями летальности. Представлено клиническое наблюдение развития синдрома стафилококкового шока у ребенка 5 лет. Формирование первичного очага — инфицированной раны правой голени, а также наличие «факторов прорыва» — отсутствие адекватного ухода за раной привели к диссеминации возбудителя с развитием синдрома стафилококкового токсического шока. Несмотря на тяжесть состояния, раннее назначение комплексного этиотропного (комбинированная антибактериальная терапия) и патогенетического (инфузионная терапия, глюкокортикостероиды) лечения привело к быстрой стабилизации состояния и успешному излечению. Представленное клиническое наблюдение демонстрирует классическую картину стафилококкового токсического шока у педиатрических пациентов и будет полезно практикующим врачам как актуализация информации об указанном синдроме и напоминание о необходимой настороженности относительно возможного развития данного патологического состояния.
Ключевые слова: инфекционные болезни, золотистый стафилококк, синдром токсического шока, цитокиновый шторм, синдром полиорганной недостаточности, педиатрия.
Для цитирования: Карпович Г.С., Куимова И.В., Краснова Е.И., Марамыгин Д.С., Еникеев А.Ю. Синдром стафилококкового токсического шока у ребенка. Клиническое наблюдение. РМЖ. Медицинское обозрение. 2021;4(3):302-307. DOI: 10.32364/2618-8430-2021-4-3-302-307.
G.S. Karpovich1,2, I.V. Kuimova1, E.I. Krasnova1, D.S. Maramygin2, A.Yu. Enikeev2
1Novosibirsk State Medical University, Novosibirsk, Russian Federation
2Children’s City Clinical Hospital No. 3, Novosibirsk, Russian Federation
Toxic shock syndrome (TSS) is a complex of symptoms that includes fever, exanthem, multiple organ dysfunction syndrome, and hypotension. The most common causative agents are S. aureus and group A Streptococcus. TSS is characterized by severe course and high mortality in the lack of specific complex treatment. This article addresses a case report of staphylococcal TSS in a 5-year-old girl. The primary focus of infection (infected right leg wound) and breakthrough factors (the lack of adequate wound care) resulted in the dissemination of causative agent and TSS development. Despite disease severity, early complex etiological (antibiotics) and pathogenically-oriented (infusions, corticosteroids) treatment improved the patient’s condition and promoted recovery. This case report illustrating the classic presentations of staphylococcal TSS in children is helpful for pediatricians in terms of awareness of this pathological condition.
Keywords: infectious diseases, staphylococcus aureus, toxic shock syndrome, cytokine storm, multiple organ failure syndrome, pediatrics.
For citation: Karpovich G.S., Kuimova I.V., Krasnova E.I. et al. Staphylococcal toxic shock syndrome in a child. Case report. Russian Journal of Woman and Child Health. 2021;4(3):302–307 (in Russ.). DOI: 10.32364/2618-8430-2021-4-3-302-307.
Введение
Синдром токсического шока (СТШ) представляет собой острое полисистемное заболевание, развивающееся на фоне гипоперфузии тканей в результате инфицирования организма штаммами бактерий, способных к продукции высокотоксичных веществ. Клинико-лабораторные признаки СТШ, как правило, включают интоксикацию, кожные проявления в виде скарлатиноподобной сыпи с последующей десквамацией на ладонях и подошвах через 1–2 нед., рвоту, диарею, выраженную гуморальную активность в крови, развитие тканевой гипоперфузии вследствие стойкой артериальной гипотонии, синдром полиорганной недостаточности (СПОН) различной степени выраженности [1, 2]. Наиболее частыми бактериальными патогенами, ассоциированными с СТШ, традиционно являются Staphylococcus aureus и стрептококки группы А. В настоящее время широкое распространение S. aureus, массивная контаминация кожного покрова данным бактериальным агентом, а также устойчивый рост числа мультирезистентных форм позволяют считать S. aureus одной из ведущих причин развития бактериальных инфекций у человека, в том числе и таких тяжелых, как СТШ [3].
Синдром токсического шока, связанный с S. aureus, был впервые описан в серии педиатрических случаев в 1978 г. [4, 5]. Заболеваемость резко возросла в 1980 г.: было зарегистрировано более 800 случаев СТШ, связанных с менструацией, в основном среди молодых женщин европеоидной расы [6, 7]. Клиническое заболевание возникало во время менструации и было связано с использованием абсорбирующих тампонов [5, 8]. Заболеваемость СТШ резко снизилась после отказа от некоторых марок тампонов. В настоящее время стафилококковый СТШ принято делить на менструальный и неменструальный. В то время как доля менструального СТШ продолжает снижаться, частота СТШ, не связанного с менструацией, увеличивается в структуре данной патологии и составляет до 50% случаев [9].
Пусковым моментом развития СТШ является образование S. aureus специфических супертоксинов (TSST-1, реже — энтеротоксинов В и С). Входными воротами для инфекции при менструальном СТШ может служить слизистая наружных половых органов, при неменструальном СТШ — места повреждения кожи, возможно распространение возбудителя из других очагов стафилококковой инфекции в организме. В клинической практике описаны примеры ожогового, раневого, посттравматического, а также послеродового неменструального СТШ [10–12].
Патогенез развития стафилококкового СТШ обусловлен действием фактора вирулентности S. aureus — токсина TSST-1, который способен взаимодействовать с CD40-клетками или другими неопределенными рецепторами эпителиальных клеток. В результате такого взаимодействия происходит гиперпродукция провоспалительных хемокинов: IL-8/СХCL8, CCL20, которые рекрутируют нейтрофилы и дендритные клетки. Содействие TSST-1 S. aureus в процессе активации CD4+ Т-лимфоцитов приводит к продукции широкого спектра цитокинов: IL-1β, IL-2, IL-6, IFN-γ, TNF-α, причем не только местно, но и на системном уровне. Так, было показано, что TSST-1 способствует продукции IL-2 Т-клетками не только в очаге поражения, но и в селезенке [13]. Таким образом, можно сделать вывод, что в ответ на действие TSST-1 S. aureus первично активируются CD4+ Т-клетки, которые в последующем способствуют усилению секреции IL-6, IFN-γ, TNF-α макрофагами и дендритными клетками. В результате происходит массированный выброс в ткани провоспалительных цитокинов, формирующих системный воспалительный ответ [14]. Бурная реакция со стороны практически всех органов и систем на токсины получила определение «цитокинового шторма». Именно он рассматривается многими исследователями в качестве основной причины возникновения СТШ [15–17].
Как уже было сказано ранее, для развития СТШ необходимы первичный очаг (входные ворота) и условия для распространения токсинов и возбудителей инфекции из очага («факторы прорыва»). Входными воротами могут служить мочевые пути (восходящий пиелонефрит), желчевыводящие пути (холангит, холецистит), брюшина (гнойный перитонит), стенки кишечника (псевдомембранозный энтероколит), трахеобронхиальное дерево (пневмония, абсцессы), кожный покров и подкожная жировая клетчатка (флегмона, ожоговая поверхность кожи, раны кожного покрова и др.), гениталии (септический аборт, хориоамнионит, ретроплацентарная гематома и др.), катетеризация вены (периферической или центральной), особенно при длительном нахождении катетера, трансфузия бактериально загрязненных жидкостей и др. [18]. Однако на современном этапе главными входными воротами для S. aureus, особенно в педиатрической практике, является кожный покров [19]. Это обусловлено высокой контаминацией кожного покрова данным возбудителем. «Факторы прорыва» (вторичная обработка гнойной раны протеолитическими ферментами, отсутствие первичной хирургической обработки и адекватного ухода за раневой поверхностью и др.) вызывают повреждение биологических барьеров, локализующих инфекцию в первичном очаге.
Клиническая картина СТШ обычно характеризуется выраженной интоксикацией, лихорадкой, прогрессирующей гипотензией, развитием СПОН: клинико-лабораторной картины острого почечного повреждения (олигоанурия, повышение уровня в крови креатинина и мочевины, гемоглобинурия), острого респираторного дистресс-синдрома, развития энцефалопатии (нарушение сознания разной степени выраженности, возможны проявления агрессивности), клиники отека и набухания головного мозга, прогрессирующего ДВС-синдрома. При стафилококковом СТШ прогноз серьезный: летальность колеблется от 3% до 22% [20–22]. Применение высокоэффективных методов этиопатогенетического лечения, включая антибактериальные препараты и инфузионную терапию, позволило снизить летальность и частоту данного состояния, однако значительно снизило настороженность практикующих врачей относительно возможности развития СТШ.
Представляем клиническое наблюдение развития стафилококкового СТШ у пациентки 5 лет.
Клиническое наблюдение
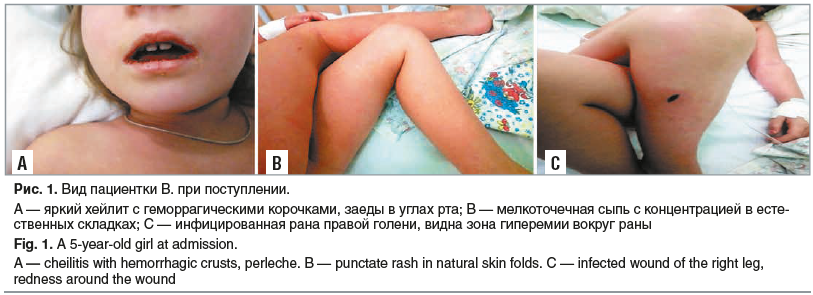
Пациентка В., 5 лет. Анамнез заболевания: известно, что 30.10.2020 битым стеклом был поврежден кожный покров голени. В связи с этим 30.10.2020 осмотрена хирургом: был проведен первичный туалет раны, рекомендованы ежедневные перевязки с антисептическими препаратами. Однако рекомендации хирурга не выполнялись, туалет раны и перевязки не проводились. Началом заболевания считают 04.11.2020, когда появилась рвота до 4 раз, храп во сне, температура тела повысилась до 38,4 °С. К 05.11.2020: максимальное повышение температуры тела до 37,9 °С, жидкий стул трехкратно, появление сыпи и яркой гиперемии вокруг раны. 06.11.2020 температура повысилась до 39,0 °С, отмечалась выраженная слабость, за сутки практически не вставала, аппетит резко снижен, от воды отказывалась. Участковым врачом-педиатром было принято решение о направлении на госпитализацию в стационар бригадой скорой медицинской помощи. В приемный покой ГБУЗ НСО «ДГКБ № 3» девочка была доставлена 06.11.2020.
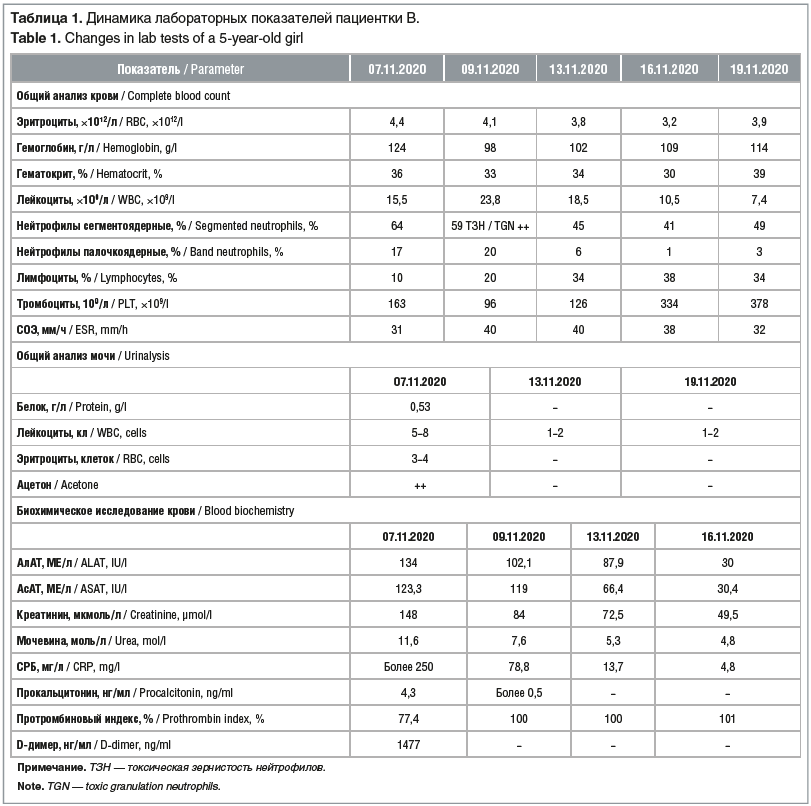
Объективно при осмотре в приемном покое: частота дыхательных движений 26 в минуту, ЧСС 120 в минуту, АД 85/55 мм рт. ст. Состояние тяжелое. Ребенок вялый, лежит, не встает, к осмотру относится негативно. Лицо одутловато, склеры гиперемированы, инъецированы, губы яркие с выраженной сухостью, покрыты геморрагическими корочками, в углах рта — заеды (рис. 1А). Кожа сухая, по всей поверхности тела визуализируется обильная мелкоточечная сыпь с концентрацией в естественных складках (рис. 1В). В области переднебоковой поверхности правой голени — резаная рана длиной около 4 см, заживающая вторичным натяжением, с образованием геморрагической корочки. Вокруг раны определяется зона яркой гиперемии диаметром около 7 см (рис. 1С). При осмотре зева определяется ярчайшая гиперемия дужки, uvule с обеих сторон, гипертрофия миндалин 2-й степени с очагами обильного гнойного налета, исходящего из лакун, размерами до 5 мм. Язык яркий, выраженная гипертрофия сосочков языка. Аускультативно определялось жесткое дыхание, хрипы не выслушивались. При исследовании сердечно-сосудистой системы определялся негрубый систолический шум на верхушке. Тоны сердца несколько приглушены. Пульс частый, слабого наполнения. Симптом бледного пятна исчезает за 4 с. Живот при пальпации мягкий, умеренно болезненный в параумбиликальной области. Печень выступает из-под края реберной дуги на 2,5 см, селезенка — на 1,5 см. Диурез снижен, за прошедшие сутки составил 0,8 мл/кг/ч. Моча концентрированная. Лабораторные показатели пациентки В. при поступлении в стационар, а также их динамика представлены в таблице 1.
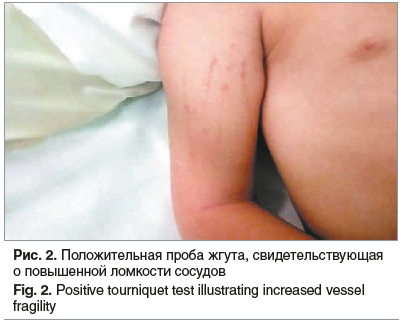
Указанная клиническая картина требовала проведения дифференциальной диагностики СТШ с генерализованной стрептококковой и иерсиниозной инфекциями (смешанные и генерализованные формы псевдотуберкулеза и кишечного иерсиниоза). Учитывая данные анамнеза и объективного осмотра, тяжесть состояния, проявления инфекционно-токсического шока 1-й степени и данные лабораторных методов исследования, начали интенсивную терапию: антибактериальные препараты цефалоспоринового и аминогликозидового ряда (цефотаксим + амикацин) в возрастных дозировках; массивную инфузионную терапию глюкозо-солевыми растворами в объеме, равном физиологической потребности; однократное введение глюкокортикостероидов в шоковой дозировке. Учитывая признаки гипокоагуляции, в терапию добавили препараты витамина К. Симптоматическая терапия включала местную обработку входных ворот антисептическими веществами, десенсибилизирующую и местную гемостатическую терапию. Осуществляли мониторинг жизненно важных показателей, в том числе АД и сатурацию кислорода. Отмечалось появление симптомов повышенной ломкости сосудов в виде положительных проб щипка, жгута (рис. 2). На фоне интенсивной терапии к 09.11.2020 удалось окончательно купировать гипотонию со стойким достижением целевого возрастного АД, что позволило отказаться от дальнейшей массивной инфузионной терапии. Отмечалось несколько эпизодов носового кровотечения, которые были купированы тампонадой с местными гемостатиками. Клиническое состояние пациентки 09.11.2020 с некоторой положительной динамикой: появился аппетит, выросла толерантность к физической нагрузке. Однако сохранялась лихорадочная реакция в виде периодических подъемов температуры тела до фебрильных цифр, в связи с чем была проведена коррекция антибактериальной терапии с назначением цефалоспорина IV поколения (цефепим). Посев на S. aureus с раневой поверхности, миндалин (от 07.11.2020), кала (от 08.11.2020) подтвердил стафилококковую этиологию заболевания. Посевы мочи (от 08.11.2020) и крови (от 09.11.2020) роста микрофлоры не выявили. Отрицательный уровень антистрептолизина-О, а также отсутствие нарастания титра в дальнейшем позволили исключить стрептококковую природу инфекционного процесса.
Данные инструментальных методов обследования: УЗИ органов брюшной полости от 11.11.2020 — признаки гепатоспленомегалии и пиелоэктазии на фоне умеренно наполненного мочевого пузыря; ЭхоКГ от 15.11.2020 — без существенных патологических изменений.
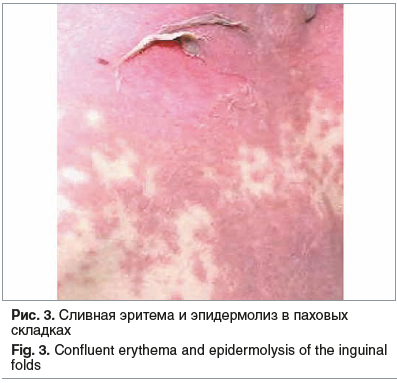
К 12.11.2020 на фоне проводимой терапии отмечалась стабилизация состояния. Состояние средней степени тяжести. Лихорадочная реакция купирована. Кожный синдром в динамике претерпел стереотипные изменения: мелкоточечные элементы разрешились, отмечалось формирование средне- и крупнопятнистых элементов, в местах крупных складок сливные эритематозные элементы, с единичными проявлениями эпидермолиза (в паховых складках) (рис. 3). В дистальных отделах конечностей отмечалось необильное отрубевидное шелушение с последующим усилением процесса. На миндалинах сохранялись точечные гнойные налеты, исходящие из лакун. Активность пациентки с выраженным улучшением, встает, ходит по палате. Аппетит восстановлен.
В дальнейшем отмечалась положительная динамика клинических и лабораторных показателей. К 19.11.2020 состояние ребенка расценено как удовлетворительное, наблюдалось полное разрешение клинических проявлений, нормализация лабораторных параметров. Сохранялось выраженное пластинчатое шелушение дистальных отделов конечностей. 20.11.2020 пациентка выписана с рекомендациями на амбулаторный этап, под дальнейшее наблюдение участкового педиатра, с консультацией узких специалистов по показаниям. Заключительный диагноз: Генерализованная бактериальная инфекция, вызванная S. aureus (посевы на микрофлору из раны, кала, с миндалин — рост S. aureus): инфицированная рана правой голени, тонзиллит, гастроэнтерит, гепатит, нефрит. Синдром стафилококкового токсического шока. Острое почечное повреждение I стадии. Анемия легкой степени
тяжести.
Обсуждение
Представленное клиническое наблюдение демонстрирует типичное течение СТШ. Развитие первичного аффекта в виде инфицированной раны правой голени с последующим ненадлежащим уходом за раневой поверхностью предрасположило к развитию генерализованного воспалительного процесса с вовлечением печени, почек, миндалин, желудочно-кишечного тракта. Системная сосудистая реакция проявлялась гипотонией, гипокоагуляцией в сочетании с признаками повышенного тромбообразования и ломкости сосудов. Олигурия, азотемия свидетельствовали о развитии у пациентки острого почечного повреждения, однако адекватные лечебные мероприятия в виде массивной инфузионной, а также системной комбинированной антибактериальной терапии позволили купировать данный патологический процесс на ранней стадии. Кожно-слизистые проявления стафилококкового СТШ также отличались стереотипностью: развитие воспалительных изменений вокруг «первичного аффекта», появление мелкоточечной сыпи с концентрацией в естественных складках с последующим формированием сливных пятнистых эритематозных элементов и единичных очагов эпидермолиза, разрешающихся пластинчатым шелушением, максимально выраженных в дистальных отделах конечностей. Выраженные воспалительные изменения в слизистых верхних дыхательных путей, миндалинах характеризуют определенную тропность стафилококка к указанным тканям, а малиновый цвет языка говорит о выраженной токсичности возбудителя. Обращает на себя внимание высокая гуморальная активность в крови: высокий уровень СРБ, прокальцитонина, выраженное ускорение СОЭ и токсическая зернистость нейтрофилов крови, также указывающая на генерализованный септический процесс.
В рамках диагностики СТШ большое значение имеет дифференциальная диагностика с генерализованными формами инфекций, вызываемых другими токсичными возбудителями, в частности иерсиниями и стрептококками группы А. Кишечный иерсиниоз и псевдотуберкулез отличаются частым развитием абдоминально-болевого синдрома, морфологическим субстратом для которого является мезентериальный лимфаденит. В свою очередь, с целью исключения данных инфекций целесообразно широко применять современные методы этиологической верификации указанных возбудителей — полимеразную цепную реакцию и иммуноферментный анализ [23]. В рамках дифференциальной диагностики стрептококковой инфекции рационально широкое применение главного серологического маркера стрептококка — антистрептолизина-О. Указанная диагностика крайне важна для выбора наиболее адекватной этиотропной терапии.
Заключение
Таким образом, стафилококковый СТШ представляет собой тяжелое состояние с характерной клинической картиной в виде «первичного аффекта», с последующим развитием генерализованного бактериального процесса, включающего СПОН и артериальную гипотонию. Ввиду быстрого ухудшения клинического состояния таких пациентов требуется незамедлительная диагностика и проведение интенсивной терапии.
Сведения об авторах:
Карпович Глеб Сергеевич — ассистент кафедры инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; врач-инфекционист детского инфекционного отделения № 3 ГБУЗ НСО «ДГКБ № 3»; 630040, Россия, г. Новосибирск, ул. Охотская, д. 81; ORCID iD 0000-0003-0982-6952.
Куимова Ирина Валентиновна — д.м.н., профессор кафедры инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0003-4727-1636.
Краснова Елена Игоревна — д.м.н., профессор, заведующая кафедрой инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ОRCID iD 0000-0003-3168-9309.
Марамыгин Данил Сергеевич — врач-педиатр детского инфекционного отделения № 1 ГБУЗ НСО «ДГКБ № 3»; 630040, Россия, г. Новосибирск, ул. Охотская, д. 81; ORCID iD 0000-0002-0111-2640.
Еникеев Антон Юрьевич — врач-педиатр детского инфекционного отделения № 3 ГБУЗ НСО «ДГКБ № 3»; 630040, Россия, г. Новосибирск, ул. Охотская, д. 81; ORCID iD 0000-0002-4297-6226.
Контактная информация: Карпович Глеб Сергеевич, e-mail: karpovich.gleb@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.06.2021.
Поступила после рецензирования 16.07.2021.
Принята в печать 10.08.2021.
About the authors:
Gleb S. Karpovich — assistant of the Department of Infectious Diseases, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; infectiologist of the Children’s Department of Infectious Diseases No. 3, Children’s City Clinical Hospital No. 3; 81, Okhotskaya str., Novosibirsk, 630040, Russian Federation; ORCID iD 0000-0003-0982-6952.
Irina V. Kuimova — Dr. Sc. (Med.), professor of the Department of Infectious Diseases, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0003-4727-1636.
Elena I. Krasnova — Dr. Sc. (Med.), Professor, Head of the Department of Infectious Diseases, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ОRCID iD 0000-0003-3168-9309.
Danil S. Maramygin — pediatrician of the Children’s Department of Infectious Diseases No. 1, Children’s City Clinical Hospital No. 3; 81, Okhotskaya str., Novosibirsk, 630040, Russian Federation; ORCID iD 0000-0002-0111-2640.
Anton Yu. Enikeev — pediatrician of the Children’s Department of Infectious Diseases No. 3, Children’s City Clinical Hospital No. 3; 81, Okhotskaya str., Novosibirsk, 630040, Russian Federation; ORCID iD 0000-0002-4297-6226.
Contact information: Gleb S. Karpovich, e-mail: karpovich.gleb@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 23.06.2021.
Revised 16.07.2021.
Accepted 10.08.2021.
2. Hans D., Kelly E., Wilhelmson K., Katz E.D. Rapidly fatal infections. Emerg Med Clin North Am. 2008;26(2):259–279. DOI: 10.1016/j.emc.2008.01.003.
3. Dayan G.H., Mohamed N., Scully I.L. et al. Staphylococcus aureus: the current state of disease, pathophysiology and strategies for prevention. Expert Rev Vaccines. 2016;15(11):1373–1392. DOI: 10.1080/14760584.2016.1179583.
4. Todd J., Fishaut M., Kapral F., Welch T. Toxic-shock syndrome associated with phage-group-I Staphylococci. Lancet. 1978;2(8100):1116–1118. DOI: 10.1016/s0140-6736(78)92274-2.
5. Reingold A.L., Hargrett N.T., Shands K.N. et al. Toxic shock syndrome surveillance in the United States, 1980 to 1981. Ann Intern Med. 1982;96(6 Pt 2):875.
6. Davis J.P., Chesney P.J., Wand P.J., LaVenture M. Toxic-shock syndrome: epidemiologic features, recurrence, risk factors, and prevention. N Engl J Med. 1980;303:1429.
7. Centers for Disease Control (CDC). Update: toxic-shock syndrome-United States. MMWR Morb Mortal Wkly Rep. 1983;32:398.
8. Osterholm M.T., Davis J.P., Gibson R.W. et al. Toxic shock syndrome: relation to catamenial products, personal health and hygiene, and sexual practices. Ann Intern Med. 1982;96:954.
9. Sharma H., Smith D., Turner C.E. et al. Clinical and Molecular Epidemiology of Staphylococcal Toxic Shock Syndrome in the United Kingdom. Emerg Infect Dis. 2018;24(2):258–266. DOI: 10.3201/eid2402.170606.
10. Costa Orvay J.A., Caritg Bosch J., Morillo Palomo A. et al. [Toxic shock syndrome: experience in a pediatric intensive care unit]. UCIP. An Pediatr (Barc). 2007;66(6):566–572 (in Spanish). DOI: 10.1157/13107390.
11. Javouhey E., Pierre-Adrien Bolze, Claire Jamen C. et al. Similarities and differences between staphylococcal and streptococcal toxic shock syndromes in children: results from a 30-case cohort. Front Pediatr. 2018;6:360. DOI: 10.3389/fped.2018.00360.
12. Adalat S., Dawson T., Hackett S.J., Clark J.E. In association with the British Paediatric Surveillance Unit. Toxic shock syndrome surveillance in UK children. Arch Dis Child. 2014;99:1078–1082. DOI: 10.1136/archdischild-2013-304741.
13. Stich N., Waclavicek M., Model N., Eibl M.M. Staphylococcal superantigen (TSST-1) mutant analysis reveals that t cell activation is required for biological effects in the rabbit including the cytokine storm. Toxins (Basel). 2010;2(9):2272–2288. DOI: 10.3390/toxins2092272.
14. Becker R.E., Berube B.J., Sampedro G.R. et al. Tissue-specific patterning of host innate immune responses by Staphylococcus aureus a-toxin. J Innate Immun. 2014;6(5):619–631. DOI: 10.1159/000360006.
15. Козлов В.К. Цитокинотерапия: патогенетическая направленность при инфекционных заболеваниях и клиническая эффективность. СПб.; 2010. [Kozlov V.K. Cytokine therapy: pathogenetic orientation in infectious diseases and clinical efficacy. St. Petersburg; 2010 (in Russ.)].
16. Hotchkiss R.S., Karl I.E. The pathophysiology and treatment of sepsis. N Eng J Med. 2003;348(2):138–150. DOI: 10.1056/NEJMra021333.
17. Wang H., Ma S. The cytokine storm and factors determining the sequence and severity of organ dysfunction in multiple organ dysfunction syndrome. Am J Emerg Med. 2008;26(6):711–715.
18. Kaplan S.L. Staphylococcus aureus infections in children: the implications of changing trends. Pediatrics. 2016;137(4):e20160101. DOI: 10.1542/peds.2016-0101.
19. Rayala B.Z., Morrell D.S. Common skin conditions in children: skin infections. FP Essent. 2017;453:26–32.
20. Schmitz M., Roux X., Huttner B., Pugin J. Streptococcal toxic shock syndrome in the intensive care unit. Ann Intensive Care. 2018;8(1):88.
21. Lappin E., Ferguson A.J. Gram-positive toxic shock syndromes. Lancet Infect Dis. 2009;9(5):281–290.
22. Robinson K.A., Rothrock G., Phan Q. et al. Active bacterial core surveillance/emerging infections program network. Risk for severe group A streptococcal disease among patients’ household contacts. Emerg Infect Dis. 2003;9(4):443–447.
23. Краснова Е.И., Карпович Г.С., Васюнин А.В. и др. Особенности клинико-лабораторных показателей в различные периоды псевдотуберкулезной инфекции у детей на территории Новосибирской области. Лечащий врач. 2020;23(11):40–45. [Krasnova E.I., Karpovich G.S., Vasyunin A.V. and other. Features of clinical and laboratory parameters in different periods of pseudotuberculosis infection in children in the Novosibirsk region. Attending doctor. 2020;23(11):40–45 (in Russ.)]. DOI: 10.26295 / OS.2020.68.84.009.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
