Результаты международного многоцентрового исследования релиз-активных антител к интерферону гамма в лечении гриппа и острых респираторных вирусных инфекций у детей
Введение: разнообразие респираторных вирусов и незрелость иммунной системы у детей обусловливают поиск эффективного и безопасного противовирусного препарата широкого спектра действия для лечения острых респираторных вирусных инфекций (ОРВИ) в детской популяции.
Цель исследования: изучить влияние релиз-активных антител к интерферону гамма (РА АТ к ИФНγ) на течение различных ОРВИ, в т. ч. гриппа.
Материал и методы: в рандомизированное контролируемое исследование было включено 569 амбулаторных пациентов от 3 до 12 лет с гриппом/ОРВИ в течение первых суток от начала заболевания. Верификация возбудителя в назофарингеальных образцах проводилась методом real-time RT-PCR (ПЦР в реальном времени). Пациенты были рандомизированы на 2 группы (1:1) и получали в составе комплексной терапии (жаропонижающие, отхаркивающие средства, муколитики, деконгестанты) Анаферон детский либо плацебо. Продолжительность лечения составила 5 дней, наблюдения — 14 дней. В качестве первичного критерия эффективности оценивали среднюю продолжительность заболевания. У пациентов с выявленными вирусами гриппа дополнительно оценивалась вирусная нагрузка на 3, 5 и 7-й дни наблюдения.
Результаты исследования: в ITT-анализ вошли данные 498 пациентов (n=258, группа Анаферон детский; n=240, группа плацебо). Были выявлены возбудители: вирус гриппа А — у 80 (16,1%), гриппа В — у 24 (4,8%), риновирус — у 74 (14,9%), респираторно-синцитиальный вирус — у 39 (7,8%), метапневмовирус — у 36 (7,2%), парагрипп — у 25 (5,0%), аденовирус — у 22 (4,4%); у 208 пациентов (41,8%) вирусы не обнаружены. Применение Анаферона детского способствовало сокращению длительности заболевания (4,6±1,4 сут) по сравнению с группой плацебо (4,9±1,3 сут), p=0,0242 и снижению вирусной нагрузки (концентрация вирусной РНК для вирусов гриппа А/В на 7-й день наблюдения составила 2,1±2,4 против 4,0±1,5, p=0,0011).
Заключение: доказано, что включение Анаферона детского в комплексную терапию ОРВИ у детей обеспечивает более быстрое выздоровление и более эффективную элиминацию вирусов гриппа А/В со слизистой носоглотки. Ограничением данного исследования является отсутствие информации о вакцинации от гриппа.
Ключевые слова: грипп, острые респираторные вирусные инфекции, дети, противовирусная терапия, интерферон гамма, рандомизированное плацебо-контролируемое исследование, Анаферон.
Для цитирования: Заплатников А.Л., Блохин Б.М., Геппе Н.А., Кондюрина Е.Г., Сукало А.В., Войтович Т.Н. Результаты международного многоцентрового исследования релиз-активных антител к интерферону гамма в лечении гриппа и острых респираторных вирусных инфекций у детей. РМЖ. Медицинское обозрение. 2019;3(8):18-24.
A.L. Zaplatnikov1, B.M. Blokhin2, N.A. Geppe3, E.G. Kondyurina4, A.V. Sukalo5,6, T.N. Voytovich5,7
1Russian Medical Academy of Continuous Professional Education, Moscow
2Pirogov Russian National Research Medical University, Moscow
3Sechenov University, Moscow
4Novosibirsk State Medical University
5Belarusian State Medical University, Minsk, Belarus
617th City Children Outpatient Department, Minsk, Belarus
713th City Children Outpatient Department, Minsk, Belarus
Background: the diversity of respiratory viruses and immaturity of immune system in children require effective and safe broad-spectrum antiviral agent for acute respiratory viral infections in children.
Aim: to study the effect of release-active antibodies to interferon gamma on the course of various acute respiratory viral infections including flu.
Patients and Methods: 569 outpatients aged 3–12 years with flu / acute respiratory viral infection within the first few days of illness were enrolled in this randomized controlled study. Causative agent was verified by real-time PCR in nasopharyngeal swabs. The patients were randomized (1:1) to receive complex treatment (expectorants, mucolytic agents, decongestants, and Anaferon for children) or placebo. Treatment duration was 5 days, follow-up was 14 days. The primary efficacy endpoint was average duration of disease. In patients with verified influenza virus, viral load was measured on days 3, 5, and 7 of the follow-up.
Results: ITT analysis included 498 patients (Anaferon for children group, n=258; placebo group, n=240). Influenza A virus was identified in 80 patients (16.1%), influenza B virus in 24 patients (4.8%), rhinovirus in 74 patients (14.9%), respiratory syncytial virus in 39 patients (7.8%), metapneumovirus in 36 patients (7.2%), parainfluenza virus in 25 patients (5.0%), and adenovirus in 22 patients (4.4%). In 208 patients (41.8%), no viruses were identified. Anaferon for children has reduced the duration of disease (4.6±1.4 days in the study group and 4.9±1.3 days in placebo group, p=0.0242) and viral load (on day 7 of the follow-up, RNA concentrations of influenza A and B viruses were 2.1±2.4 and 4.0±1.5, respectively, p=0.0011).
Conclusion: Anaferon for children in the complex treatment of acute respiratory viral infections in children has provided more rapid recovery and more effective eradication of influenza A and B viruses from nasopharyngeal mucosa. The limitation of this study was the lack of the information on flu vaccination.
Keywords: flu, acute respiratory viral infections, children, antiviral treatment, interferon gamma, randomized placebo-controlled study, Anaferon.
For citation: Zaplatnikov A.L., Blokhin B.M., Geppe N.A. et al. An international multicenter study of release-active antibodies against interferon gamma for flu and acute respiratory viral infections in children. RMJ. Medical Review. 2019;8:19–24.
В статье представлены результаты международного многоцентрового исследования, посвященного оценке эффективности релиз-активных антител к интерферону гамма в лечении гриппа и острых респираторных вирусных инфекций у детей.

Введение
Грипп и другие острые респираторные вирусные инфекции (ОРВИ) — самые распространенные заболевания в детской популяции [1–3]. Ежегодные вспышки ОРВИ вызываются респираторными вирусами 5 групп, включающих более 300 подтипов, что определяет разнообразную клиническую симптоматику, с одной стороны, и сложности этиотропной терапии и вакцинопрофилактики — с другой [1, 3–5]. Наиболее тяжелые формы респираторных инфекций вызываются вирусами гриппа [1, 3]. Особую опасность представляют пандемичные штаммы вируса гриппа [3, 5, 6]. Другие ОРВИ, вызываемые различными респираторными вирусами, также отличаются высокой контагиозностью, формированием микст-инфекций и развитием вторичных бактериальных осложнений [1].
Этиотропную терапию ОРВИ проводить достаточно сложно, поскольку выбор врача ограничен ингибиторами нейраминидазы, активными против вирусов гриппа [4, 5], и препаратами, противовирусное действие которых опосредовано интерферон-индуцирующим либо другим первичным эффектом [7–8]. В последние годы именно индукторы эндогенных интерферонов становятся препаратами выбора для лечения гриппа и других ОРВИ в амбулаторной практике [8], что обусловлено, прежде всего, возможностью обеспечить противовирусный ответ в отношении широкого спектра патогенов.
Известно, что ключевым цитокином противовирусного иммунного ответа является интерферон гамма (ИФНγ); его клеточные эффекты разнообразны и включают регуляцию распознавания вирусного антигена, участие в антиген-процессинге и антиген-презентации, активацию микробицидных эффекторных функций, влияние на миграцию лейкоцитов, интеграцию функций других цитокинов и т. д. [7]. Таргетное воздействие на ИФНγ и мишень-ассоциированные рецепторы — отличительное свойство препарата Анаферон детский, созданного ООО «Материа Медика Холдинг» на основе антител к ИФНγ [9]. Наиболее важным эффектом препарата при лечении гриппа и других ОРВИ является адекватная продукция эндогенных интерферонов, в т. ч. ИФНγ и ИФНα/β, что в большинстве случаев обеспечивает легкое или абортивное течение вирусной инфекции [7].
Противовирусная активность Анаферона детского при лечебном, профилактическом и лечебно-профилактическом введении была доказана в серии доклинических исследований в условиях заражения экспериментальных животных вирусами гриппа, включая грипп А (H1N1)
pdm09 [10–12]. Лечебная эффективность была продемонстрирована в рандомизированных клинических исследованиях, в которых участвовали более 11 тыс. детей в возрасте от 1 мес. и старше с респираторными инфекциями, вызванными различными респираторными вирусами [13–17].
Цель исследования: получение дополнительных данных по терапевтической эффективности Анаферона детского с учетом этиологии ОРВИ, а также данных о его влиянии на скорость элиминации вирусов гриппа со слизистой носоглотки.
Материал и методы
Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в параллельных группах проводилось на базе 29 амбулаторных центров Российской Федерации, Беларуси и Украины в период с октября 2014 г. по апрель 2018 г. во время сезонного подъема заболеваемости.
В исследование включались дети обоего пола в возрасте от 3 до 12 лет с клиническими проявлениями гриппа/ОРВИ в течение первых суток от начала заболевания.
Критериями включения были: клинически установленный диагноз ОРВИ (температура тела не менее 38 °C на момент осмотра, выраженность симптомов ≥4 баллов: как минимум 1 общий симптом ≥2 баллов и 1 симптом со стороны носа / горла / грудной клетки ≥2 баллов либо большее количество симптомов выраженностью ≥1 балла), первые 24 ч от начала проявлений гриппа/ОРВИ, возможность начала терапии в течение суток с момента появления первых симптомов ОРВИ.
Критериями невключения были: наличие показаний к госпитализации или назначению антибактериальных препаратов, подозрение на начальные проявления заболеваний, имеющих сходную с ОРВИ симптоматику (другие инфекционные заболевания, гриппоподобный синдром в дебюте системных заболеваний соединительной ткани), первичный или вторичный иммунодефицит, онкологические и аутоиммунные заболевания в анамнезе, поливалентная аллергия, непереносимость любого компонента препаратов, используемых в лечении, синдром мальабсорбции, обострение или декомпенсация хронического заболевания, прием запрещенных сопутствующих препаратов в течение 1 мес. до включения в исследование, а также психическое расстройство или злоупотребление алкоголем/наркотиками родителей/усыновителей пациента.
Дизайн исследования подробно представлен в таблице 1. После подписания формы информированного согласия проводили процедуры скрининга, включающие: сбор жалоб и анамнеза, объективный осмотр, забор назофарингеальных биообразцов для экспресс-диагностики гриппа и последующей детекции антигенов респираторных вирусов, регистрацию симптомов гриппа/ОРВИ.
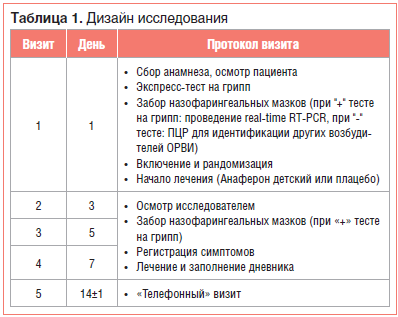
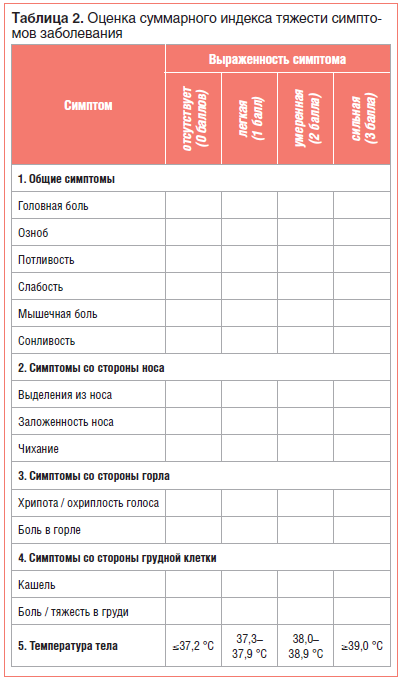
Результаты объективного осмотра отмечали в первичной документации, тяжесть симптомов гриппа/ОРВИ фиксировали в баллах в индивидуальной регистрационной карте. Родителям (законным представителям) пациента выдавался дневник и проводился инструктаж по его заполнению. В нем отмечались значения аксиллярной температуры тела (ежедневно утром и вечером) и выраженность основных симптомов ОРВИ в баллах (от 0 до 3). На основании выраженности каждого из симптомов при последующей статистической обработке данных подсчитывали суммарный балл тяжести гриппа/ОРВИ, который включал значения температуры тела, общие симптомы и симптомы со стороны носа / горла / грудной клетки, переведенные в баллы (табл. 2).
Экспресс-диагностику гриппа проводили по результатам качественного иммунохроматографического исследования мазка из носа, позволяющего в течение 10 мин определить наличие антигенов вирусов гриппа А/В. У пациентов с положительным результатом экспресс-теста на грипп брали назофарингеальный мазок для последующей количественной полимеразной цепной реакции (ПЦР) с обратной транскрипцией в режиме реального времени (real-time RT-PCR), позволяющей определить вирусную нагрузку (концентрацию вирусной РНК гриппа А/В log10 копий/мл) в образцах мазков из носа и глотки.
У пациентов с отрицательным результатом экспресс-теста на грипп проводилась качественная ПЦР для выявления и идентификации других возбудителей ОРВИ (РНК респираторно-синцитиального вируса, метапневмовируса, вирусов парагриппа 1, 2, 3 и 4 типов, коронавирусов, риновирусов, ДНК аденовируса и бокавируса).
При соответствии критериям включения и отсутствии критериев невключения на визите 1 (день 1) пациента рандомизировали в 1 из 2 групп: пациенты 1-й группы принимали Анаферон детский по следующей схеме: внутрь, вне приема пищи по 1 таблетке на прием, в первые 2 ч каждые 30 мин, затем до конца дня еще 3 раза через равные промежутки времени, со 2-х по 5-е сут — по 1 таблетке 3 р./сут. Продолжительность терапии — 5 сут. Пациенты 2-й группы получали плацебо, аналогичное по внешнему виду и органолептическим свойствам исследуемому препарату, по схеме приема Анаферона детского в течение 5 сут. В данном исследовании применялся двойной слепой плацебо-контроль. Пациент и врач не были информированы о назначенной исследуемой терапии (Анаферон детский или плацебо) до завершения исследования и закрытия базы данных.
Пациенты обеих групп могли получать симптоматическую терапию ОРВИ и гриппа, исходя из принятых стандартов лечения, включая отхаркивающие средства, муколитики, назальные деконгестанты, при необходимости — дезинтоксикационную терапию, при развитии бактериальных осложнений гриппа/ОРВИ — антибактериальные препараты. При повышении температуры тела > 38,5 °C (или 38,0 °C для пациентов с хроническими заболеваниями легких, сердца или нервной системы) были разрешены следующие жаропонижающие средства: парацетамол 120 мг/мл, ибупрофен 100 мг / 5 мл, метамизол натрия (для оказания неотложной помощи при некупируемой парацетамолом/ибупрофеном гипертермии, парентерально). Разрешенные жаропонижающие средства выдавались родителям при первом посещении. Другие жаропонижающие, все противовирусные (кроме исследуемого препарата), иммуностимуляторы и иммунодепрессанты, иммунные сыворотки и иммуноглобулины, вакцины, противоопухолевые препараты были запрещены.
Период наблюдения составил 14 сут. Всего было проведено 5 визитов: визиты на 1, 3, 5 и 7-й дни в медицинском центре или на дому и отсроченный телефонный контакт с врачом на 14-й день с целью опроса родителей о состоянии пациента, наличии/отсутствии у него бактериальных осложнений, применении антибактериальных препаратов.
Критерии эффективности (первичные и вторичные точки)
В качестве первичного критерия эффективности принимали среднюю длительность заболевания до разрешения симптомов ОРИ (температура ≤37,2 °С и отсутствие либо суммарная выраженность всех симптомов ОРИ ≤2 баллов). Вторичными конечными точками были: доля пациентов с выздоровлением/улучшением на 2–5-й дни наблюдения (по данным дневника пациента), на 3-й и 5-й дни лечения (по данным объективного осмотра врача), динамика лихорадки (изменение температуры на 2, 3, 4 и 5-й дни наблюдения по сравнению с исходным значением), доля пациентов с нормализацией температуры тела на 2–5-й дни наблюдения (≤37,0 °C), тяжесть клинических проявлений (в баллах) и течения гриппа/ОРВИ (по результатам площади под кривой для суммарного индекса тяжести на 1, 3, 5 и 7-й день, по данным объективного осмотра врача, и с 1-го по 7-й день по данным дневника пациента), число приемов жаропонижающих препаратов, динамика вирусной нагрузки, доля пациентов, у которых отмечено ухудшение заболевания (бактериальные осложнения, госпитализация).
Определение размера выборки и статистика
Оценка размера выборки для анализа эффективности основывалась на учете следующих правил и допущений: мощность статистических критериев, рассчитанная по формуле P = (1 - β), принималась равной 80% (вероятность корректного отвержения нулевой гипотезы равна 0,8); вероятность ошибки первого рода «α» допускалась менее 5% (вероятность ошибочного принятия альтернативной гипотезы — менее 0,05); использованные статистические критерии являлись двусторонними.
При расчете размера выборки предполагалось, что разница между средней длительностью заболевания в группе Анаферона детского и в группе плацебо составит не менее 0,5 дня, а стандартное отклонение в обеих группах не будет превышать 2 дня.
На основании вышеописанных правил и допущений минимально необходимый размер каждой из групп (Анаферон детский и Плацебо) составил 254 человека. С учетом коэффициента выбывания по ходу исследования, установленного в размере 10%, и с учетом коэффициента выбывания в процессе скрининга, установленного в размере 20%, было согласовано включение не менее 672 пациентов.
Обработка данных и все статистические расчеты по данному протоколу проводились с использованием статистического пакета SAS 9.4. Для сравнения долей (процентов) в 2 группах использовали частотный анализ: точный критерий Фишера; модификацию критерия χ2 для множественных сравнений (Кохран — Мантель — Хензель; CMH χ2). Применимость критерия Кохрана — Мантеля — Хензеля проверялась с помощью теста Бреслоу — Дэй. Для сравнения изменений показателей в 2 группах применяли двухфакторный ковариационный анализ (Mixed Procedure в SAS), факторы — группа (2 уровня) и визит (4 уровня), ковариата — визит 1 (1 уровень). Для анализа непрерывных переменных использовали критерий Краскела — Уоллеса.
Характеристики исследуемых групп
Период включения пациентов в исследование — с 8 октября 2014 г. по 16 апреля 2018 г. Всего в исследование было включено и рандомизировано 569 пациентов (Total set), 290 — в 1-ю группу (Анаферон детский) и 279 — во 2-ю группу (плацебо). Данные 71 пациента не вошли в анализ эффективности по разным причинам: ошибочное включение пациента, не отвечающего критериям включения (n=14, 1-я группа; n=15, 2-я группа), значительное отклонение от протокола (n=16, 1-я группа; n=23, 2-я группа), необходимость назначения пациенту препаратов, недопустимых к применению в рамках данного исследования (n=1, 2-я группа), невозможность или отказ родителя/усыновителя пациента следовать требованиям протокола (n=2, 1-я группа). Таким образом, выборку для анализа эффективности [ITT-анализ] составили 498 пациентов (n=258, 1-я группа; n=240, 2-я группа). В анализ безопасности были включены данные всех пациентов, получивших хотя бы 1 дозу исследуемого препарата (n=569).
Средний возраст пациентов, данные которых включили в анализ эффективности, в исследуемой группе составил 6,8±2,7 года, в группе сравнения — 6,7±2,7 года. Мальчиков было 53,2%, девочек — 46,8%. Пациенты обеих групп не отличались по возрасту (p=0,5920) и полу (р=0,6537).
35,3% пациентов группы Анаферон детский и 35,7% группы плацебо имели сопутствующие заболевания, в т. ч. болезни костно-мышечной системы (13,2% и 14,9% соответственно), болезни органов дыхания, включая аллергические заболевания и ЛОР-патологию (11,2% и 6,2%), врожденные, наследственные и генетические заболевания (9,7% и 12,0%), болезни глаз (5,8% и 5,4%), болезни нервной системы (5,8% и 5,0%), хронические очаги инфекции (3,5% и 5,0% соответственно). Частотный анализ (точный критерий Фишера) показал, что группы не различались по числу пациентов, у которых были зарегистрированы сопутствующие заболевания и состояния.
Все участники исследования при включении имели типичные для гриппа/ОРВИ клинические проявления: лихорадку в сочетании с другими общими (интоксикационными) и респираторными симптомами. Выраженность симптомов заболевания варьировала в широких пределах, поскольку этиология ОРВИ и местного поражения дыхательных путей была различной. Среднее значение температуры тела при включении в исследование было 38,5±0,4 0С в обеих группах; средние значения исходного суммарного балла общих симптомов — 5,9±2,7 в 1-й группе и 5,9±2,9 во 2-й группе (р=0,8377); симптомов со стороны носа / горла / грудной клетки — 5,1±3,0 и 5,3±3,0 соответственно (р=0,5462).
Результаты исследования
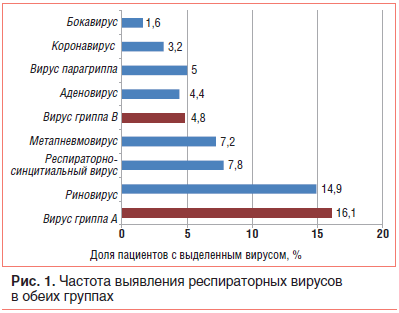
Частота выявления различных респираторных вирусов в назофарингеальных образцах пациентов обеих групп представлена на рисунке 1. Вирусы гриппа А/В выявлены у 19% детей 1-й группы и у 21,3% пациентов 2-й группы (р=0,5762). Из других возбудителей ОРВИ чаще всего выявлялись риновирус, респираторно-синцитиальный вирус, метапневмовирус и аденовирус. Частота выявления возбудителей гриппа и других ОРВИ в обеих группах не имела значимых различий. У 43% пациентов группы Анаферон детский и 40,4% пациентов группы плацебо вирусы в назофарингеальных образцах не обнаружены, что согласуется с результатами исследований, в которых частота выявления вирусных антигенов в назофарингеальных образцах с помощью сходных наборов реагентов для real-time RT-PCR не превышала 50% [18]. В соответствии с протоколом в анализ были включены данные всех пациентов с клинически диагностированной ОРВИ, независимо от результата real-time RT-PCR.
В обеих группах большинству пациентов были назначены разрешенные сопутствующие препараты, в основном жаропонижающие (>45% участников) и средства для ирригационно-элиминационной терапии (>70%). Антибактериальные препараты системного действия были назначены 2,7% детей группы Анаферон детский и 4,6% детей группы плацебо. Частотный анализ (точный критерий Фишера) не показал различий между группами по частоте применения препаратов сопутствующей терапии (р=0,18).
Анализ эффективности
Первичная конечная точка. Оценка результатов по первичной конечной точке показала, что применение РА АТ к ИФНγ в дополнение к симптоматической терапии гриппа/ОРВИ приводит к значимому сокращению длительности заболевания, которое у 95% детей продолжалось от 4,4 до 4,8 сут (среднее значение 4,6±1,4 сут), что было достоверно короче, чем в группе плацебо (4,9±1,3, p=0,0242, критерий Краскела — Уоллеса).
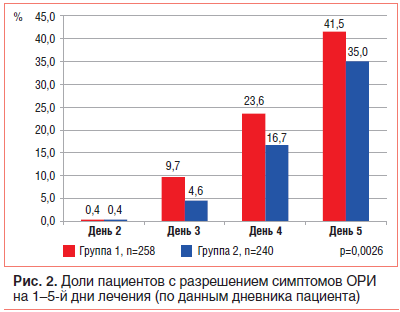
Вторичные конечные точки. Анализ эффективности по вторичным конечным точкам подтвердил преимущества применения Анаферона детского. По данным дневника пациента, на 3-й день лечения 9,7% детей имели улучшение симптомов заболевания, что было примерно в 2 раза больше, чем в группе плацебо (4,6%). На 4-й день процент детей с разрешением симптомов ОРИ в 1-й группе составил 23,6%, на 5-й день — 41,5%; (против 16,7% и 35,0% соответственно во 2-й группе). Анализ с помощью критерия Кохрана — Мантеля — Хензеля показал, что за все 5 дней лечения Анафероном детским доля детей с разрешением симптомов ОРИ была значимо больше, чем на фоне плацебо-терапии (р=0,0026) (рис. 2).
По данным объективного осмотра врача, у 12% детей исследуемой группы отмечено разрешение симптомов ОРИ на 3-й день лечения препаратом Анаферон детский, у 45% — на 5-й день, тогда как в группе сравнения доля детей с выздоровлением/улучшением на 3-й день составила 6,7%, на 5-й день — 37,5%. Общее количество детей с выздоровлением/улучшением на 3-й и 5-й дни, по данным критерия Кохрана — Мантеля — Хензеля, также свидетельствовало о значимой эффективности исследуемого препарата по сравнению с плацебо (р=0,0127).
На 3-й день лечения Анафероном значения температуры тела (37,4±0,8), суммарных баллов общих симптомов (2,0±2,2) и симптомов со стороны носа / горла / грудной клетки (4,4±2,9), а также суммарного балла всех симптомов (7,0±4,6) были ниже, чем у пациентов 2-й группы, где температура тела на 3-й день была 37,5±0,8, суммарный балл общих симптомов — 2,6±2,8, катаральных симптомов — 4,8±2,7, суммарный балл всех симптомов — 8,1±4,8. По данным дневника пациента, максимальный терапевтический эффект Анаферона детского проявлялся в те же сроки (на 2–4-й дни). В результате лечения РА АТ к ИФНγ тяжесть течения гриппа/ОРВИ была значимо меньше, что подтверждал анализ с помощью модели «площадь под кривой» (AUC) для суммарных индексов симптомов заболевания по данным объективного осмотра (р=0,0233) и данным дневника пациента (р=0,0084).
Дополнительный анализ назофарингеальных образцов методом real-time RT-PCR у пациентов с положительным экспресс-тестом на грипп А/В показал, что на фоне лечения РА АТ к ИФНγ вирусная нагрузка была достоверно ниже. Причем динамика снижения вирусной нагрузки в исследуемой группе показана как отдельно, так и суммарно для вирусов гриппа А/В (рис. 3).
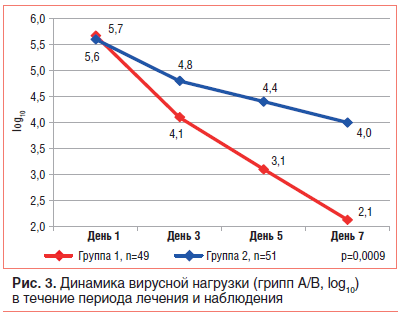
Анализ безопасности
Всего в течение периода лечения и наблюдения было отмечено 77 нежелательных явлений (НЯ) у 56 пациентов, в т. ч. 31 НЯ у 26 (9,0%) пациентов 1-й группы и 46 НЯ у 30 (10,7%) участников 2-й группы. Наиболее часто регистрировали различные инфекции, в т. ч. бронхит (3 в 1-й группе и 4 во 2-й группе), острый средний отит (4 и 5 соответственно), обострения хронических заболеваний (аденоидит, пиелонефрит). Желудочно-кишечные расстройства (тошнота, диарея) были отмечены у 1,7% детей 1-й группы и у 3,6% детей 2-й группы (р=0,20). Статистический анализ (точный критерий Фишера) не показал значимых различий между числом пациентов с НЯ в обеих группах (р=0,57). Степень тяжести большинства НЯ была легкой (48,4% случаев в 1-й группе и 50,0% во 2-й группе) и средней (48,4% и 47,8% соответственно); 2 НЯ (в 1-й группе — кишечная колика, во 2-й группе — тошнота) расценены как тяжелые. Причинно-следственная связь НЯ с исследуемым препаратом отсутствовала (87,1% в 1-й группе и 84,8% во 2-й группе) или была маловероятной (12,9% и 15,2%). В обоих случаях серьезных НЯ связь с приемом препарата отсутствовала.
В ходе исследования не зарегистрировано случаев взаимодействия исследуемого препарата с лекарственными средствами различных классов, в т. ч. нестероидными противовоспалительными препаратами, анальгетиками, деконгестантами, антибиотиками, бронхолитиками, ингаляционными кортикостероидами, муко- и секретолитиками.
Лечение РА АТ к ИФНγ хорошо переносилось пациентами. Среднее значение показателя комплаентности было близким к 100%.
Обсуждение результатов
В ходе исследования доказано, что применение Анаферона детского приводит к более успешному лечению и более быстрому выздоровлению пациентов с гриппом/ОРВИ. Положительное влияние препарата на выраженность всех симптомов, включая лихорадку, снижение тяжести течения заболевания, а также более эффективная элиминация вирусов гриппа А/В со слизистой носоглотки свидетельствуют о преимуществах включения препарата Анаферон детский в комплекс симптоматической терапии гриппа/ОРВИ.
Итоги проведенного клинического исследования подтверждают данные предыдущих исследований и опыт клинической практики, показывающий эффективность препарата Анаферон детский в лечении гриппа и других ОРВИ [13–18].
Преимуществами данного исследования являются многоцентровой двойной слепой дизайн, достаточные продолжительность (3 эпидемических сезона) и количество участников из разных стран.
Ограничением данного исследования было отсутствие данных о предыдущей вакцинации пациентов.
Заключение
Таким образом, двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в общей популяции детей с разнообразными сопутствующими заболеваниями доказало, что включение РА АТ к ИФНγ в комплексную терапию ОРВИ и гриппа способствует быстрому улучшению и более быстрому выздоровлению и обеспечивает эффективную элиминацию вирусов гриппа А/В со слизистой носоглотки. Препарат Анаферон детский является эффективным и безопасным в лечении гриппа/ОРВИ у детей.
Конфликт интересов
Анаферон детский — коммерческий препарат, производимый и реализуемый ООО «НПФ «Материа Медика Холдинг». Заплатников А.Л., Блохин Б.М., Геппе Н.А., Кондюрина Е.Г., Сукало А.В., Войтович Т.Н. получили грант исследователя от ООО «НПФ «Материа Медика Холдинг» на проведение клинических испытаний.
Источник финансирования
Исследование финансировалось за счет гранта ООО «НПФ «Материа Медика Холдинг» (Москва, Россия). Статистический анализ и текущие расходы на обработку статей были предоставлены ООО «НПФ «Материа Медика Холдинг».
Исследование было зарегистрировано на clinicaltrials.gov (NCT02072174).
2. Debiaggi M., Canducci F., Ceresola E.R., Clementi M. The role of infections and coinfections with newly identified and emerging respiratory viruses in children. Review. Virology Journal. 2012;9:247.
3. WHO: Global Influenza Strategy 2019–2030. (Electronic resource). URL: https://www.who.int/influenza/global_influenza_strategy_2019_2030/en/. Access date: 16.07.2019.
4. Antiviral Agents for the Treatment and Chemoprophylaxis of Influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). (Electronic resource). URL: https://www.cdc.gov/MMWR/preview/mmwrhtml/rr6001a1.htm. Access date: 16.07.2019.
5. WHO guidelines for pharmacological management of pandemic (H1N1) 2009 influenza and other influenza viruses. (Electronic resource). URL: https://www.who.int/csr/resources/publications/swineflu/h1n1_use_antivirals_20090820/en/. Access date: 16.07.2019.
6. Василевский И.В. Клинико-фармакологическая стратегия использования в педиатрической практике индукторов интерферона. Педиатрия. Восточная Европа. 2015;1(09):89–100. [Vasilevsky I.V. Clinical and pharmacological strategy of using interferon inducers in pediatric practice. Pediatrics. Eastern Europe. 2015;1(09):89–100 (in Russ.)].
7. Ревякина В.А., Ильина Н.И., Геппе Н.А. Прима: педиатрические рекомендации по иммуномодулирующим препаратам в амбулаторной практике (консенсус). М.: РГ-Пресс; 2015. [Revyakina V.A., Ilina N.I., Geppe N.A. Prima: pediatric recommendations on immunomodulatory drugs in outpatient practice (consensus). M.: RG-Press; 2015 (in Russ.)].
8. Савенкова М.С. Диагностика и лечение гриппа у детей. Детские инфекции. 2016;1:48–54. [Savenkova M.S. Diagnosis and treatment of influenza in children. Children’s infections. 2016;1:48–54 (in Russ.)].
9. Тарасов С.А., Качанова М.В., Горбунов Е.А. и др. Анаферон-эффективное средство для лечения и профилактики широкого спектра инфекционных заболеваний. Вестник Международной Академии наук. 2010;1:23-27. [Tarasov S.A., Kachanova M.V., Gorbunov E.A. et al. Anaferon - an effective remedy for the treatment and prevention of a wide range of infectious diseases. Bulletin of the International Academy of Sciences. 2010;1:23-27 (in Russ.)].
10. Don Е.S., Emelyanova A.G., Yakovleva N.N. et al. Dose-Dependent Antiviral Activity of Released-Active Form of Antibodies to Interferon-Gamma against influenza A/California/07/09 (H1N1) in Murine Model. Journal of Medical Virology. 2017;89(5):759–766. DOI: 10.1002/jmv.24717.
11. Шишкина Л.Н., Скарнович М.О., Кабанов А.С. и др. Противовирусная активность Анаферона детского у мышей, зараженных пандемическим вирусом гриппа А (H1N1/09). Бюллетень экспериментальной биологии и медицины. 2010;149(5):546-548. [Shishkina L.N., Skurkovich M.O., Kabanov A.S. et al. Antiviral activity of infant Anaferon in mice infected with pandemic influenza A virus (H1N1/09). Bulletin of experimental biology and medicine. 2010;149(5):546-548 (in Russ.)].
12. Емельянова А.Г., Никифорова М.В., Дон Е.С. и др. Результаты исследования влияния анаферона детского на жизненный цикл вируса гриппа A/H1N1 in vitro. Патологическая физиология и экспериментальная терапия. 2018;62(3):87–94. [Emelyanova A.G., Nikiforova M.V., Don E.S. et al. Effect of anaferon for children on the in vitro life cycle of influenza virus A/H1N1. Pathological Physiology and Experimental Therapy, Russian journal. 2018;62(3):87–94 (in Russ.)].
13. Геппе Н.А., Лыскина Г.А., Виноградова О.И. Ретроспективная оценка опыта применения анаферона для профилактики и лечения ОРВИ у детей из групп риска, находящихся на стационарном лечении. Доктор.Ру. 2010;5(56):16–20. [Geppe N.A., Lyskina G.A., Vinogradova O.I. Retrospective evaluation of the experience of using Anaferon for the prevention and treatment of ARVI in children at risk of inpatient treatment. Doctor.Ru. 2010;5(56):16–20 (in Russ.)].
14. Кондюрина Е.Г. Анаферон детский. Феномен современной российской фармации. Практика педиатра. 2015;2:56–63. [Kondurina E.G. Anaferon for children. The phenomenon of modern Russian pharmacy. Practice of a pediatrician. 2015;2:56–63 (in Russ.)].
15. Лобзин Ю.В., Де Роза Ф., Эсауленко Е.В. Отечественные и зарубежные исследования анаферона детского: эффективность, безопасность и опыт применения. Журнал инфектологии, 2015;7(4):23–31. [Lobzin Yu.V., De Rosa F., Esaulenko E.V. National and foreign research of Anaferon for children: efficacy, safety and experience of application. Journal of Infectology. 2015;7(4):23–31 (in Russ.)].
16. Заплатников А.Л., Бурцева Е.И., Гирина А.А. и др. Этиотропная терапия гриппа и других острых респираторных вирусных инфекций у детей. Consilium Medicum. 2016;18(11):36–40. [Zaplatnikov A.L., Burtseva E.I., Girina O.A. et al. Casual therapy of influenza and other acute respiratory viral infections in children. Consilium Medicum. 2016;18(11):36–40 (in Russ.)].
17. Усенко Д.В. Анаферон детский: эффективность и безопасность в профилактике и терапии вирусных и бактериальных инфекций. Consilium Medicum. Педиатрия. 2016;3:6–14. [Usenko D.V. Anaferon for children: efficacy and safety in the prevention and treatment of viral and bacterial infections. Consilium Medicum. Pediatrics. 2016;3:6–14 (in Russ.)].
18. Brittain-Long R., Westin J., Olofsson S. et al. Access to a polymerase chain reaction assay method targeting 13 respiratory viruses can reduce antibiotics: a randomised, controlled trial. BMC Medicine. 2011;9:44. DOI: 10.1186/1741-7015-9-44.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
