Коррекция тревожных расстройств у детей, перенесших новую коронавирусную инфекцию
Введение: в последнее время в практическом здравоохранении часто встречается понятие «постковидный синдром». Он включает в себя изменения со стороны различных систем организма человека. Большинство как зарубежных, так и отечественных исследователей отмечают в своих работах высокий риск развития психоневрологических нарушений, в том числе у детей.
Цель исследования: определить клиническую эффективность сиропа на основе холина, глицина, лизина, витаминов группы В, цинка, магния и экстрактов мелиссы и мяты для коррекции проявлений тревожных расстройств у детей, перенесших COVID-19.
Материал и методы: в проспективное исследование вошли 65 детей в возрасте 7–11 лет, перенесших COVID-19 в легкой форме, с проявлениями тревожных расстройств. Всем пациентам были рекомендованы диетотерапия, соблюдение режима сна и отдыха, прогулки на свежем воздухе, ограничение времяпрепровождения за телефоном, компьютером и телевизором. Сорок детей, из них 20 девочек, основной группы (ОГ) дополнительно получали БАД «Кидз (Kidz) сироп с мелиссой и мятой» по 1 стику (5 мл) 3 р/сут в течение 42 дней; 25 детей, из них 16 девочек, контрольной группы (КГ) получали только стандартное лечение. Срок наблюдения составил 42 дня. Проводили анкетирование родителей, оценивали выраженность астенического синдрома.
Результаты исследования: в ОГ уже через 1 мес. от начала терапии с добавлением БАД к стандартной схеме лечения имела место тенденция снижения выраженности всех симптомов астенического синдрома по сравнению с исходными данными (р<0,05, непарный критерий Стьюдента). В КГ этого не наблюдалось (р>0,05, непарный критерий Стьюдента), кроме снижения тревожности. Родители детей ОГ отмечали повышение активности, интереса, улучшение сна, аппетита, нормализацию поведения и улучшение взаимоотношений. В КГ при стандартной схеме лечения данные показатели были менее выражены. Семь человек из 40 принимали лечение без удовольствия из-за неудовлетворенности вкусовыми качествами сиропа. По этой причине 3 человека из 40 отказались от дальнейшего участия в исследовании. Аллергических реакций не отмечено ни у кого из детей.
Заключение: БАД «Кидз (Kidz) сироп с мелиссой и мятой» у детей младшего школьного возраста, перенесших COVID-19, с проявлениями тревожных расстройств, способствует повышению устойчивости организма к эмоциональным переживаниям, улучшению концентрации внимания и памяти, оказывает протективное действие при повышенных умственных нагрузках.
Ключевые слова: дети, COVID-19, постковидный синдром, тревожные расстройства, биологически активная добавка, мелисса, мята.
Для цитирования: Сагитова Г.Р., Шульдайс В.А., Клюева Н.В., Шафоростова Е.М., Конотопова И.Б. Коррекция тревожных расстройств у детей, перенесших новую коронавирусную инфекцию. РМЖ. Медицинское обозрение. 2022;5(4):340-345. DOI: 10.32364/2618-8430-2022-5-4-340-345.
G.R. Sagitova1, V.A. Shuldais2, N.V. Klyueva2, E.M. Shaforostova1, I.B. Konotopova2
1Astrakhan State Medical University, Astrakhan, Russian Federation
2Children’s City Polyclinic No.4, Astrakhan, Russian Federation
Background: currently, the term "post-COVID conditions" has been commonly used in healthcare practices. It includes impairments of multiple human organ systems. Many international and Russian researchers have mentioned in their studies that such patients, including children, are at a higher risk of developing psychoneurological disorders.
Aim: to assess the clinical efficacy of a syrup, containing choline, glycine, lysine, B vitamins, zinc, magnesium, lemon balm and mint extracts to cope with the manifestations of anxiety disorders developed in children after COVID-19 infection.
Patients and Methods: this prospective study involved 65 children, 7–11 years old, who had mild cases of COVID-19 and developed manifestations of anxiety disorders. All patients were given recommendations including nutritional therapy, sleep and rest routine, walking into the fresh air, and limiting the time children spend on their phones, computers and TV. 40 patients, 20 of whom were girls, of the treatment group (TG) additionally received a biologically active supplement (BAS), "Kidz Syrup with lemon balm and mint", at the dosage of 1 stick (5 ml) 3 times a day for 42 days. 25 children, 16 of whom were girls, were included in the control group (CG), receiving only routine treatment. The duration of follow-up period was 42 days. A questionnaire was filled out by children’s parents to assess the severity of asthenic syndrome.
Results: after one month of treatment with the BAS added to the routine therapy, the TG patients demonstrated trends in lower severity of all symptoms of asthenic syndrome vs that at the baseline (р<0.05, unpaired t-test). Such trends were not reported in the control group (р>0.05, unpaired t-test). Parents of the TG children reported more physical activity and interest, better sleep and appetite, normalizing kids’ behavior and improving relationships. In the CG patients, receiving routine therapy, these changes were less pronounced. Seven of 40 patients did not like taking the syrup because of the unpleasant syrup taste. It was the reason why three of 40 patients declined further participation in the study. None of the children reported allergic reactions.
Conclusion: a biologically active substance "Kidz syrup with lemon balm and mint" given to the primary school-aged children who survived COVID-19 and developed manifestations of anxiety disorders, helps to improve their ability to manage emotional distress, concentrate attention and memory, and has the protective effect against the increasing mental burdens.
Keywords: children, COVID-19, post-COVID conditions, anxiety disorders, biologically active supplement, lemon balm and mint.
For citation: Sagitova G.R., Shuldais V.A., Klyueva N.V. et al. Management of anxiety disorders in children who survived the novel coronavirus infection. Russian Journal of Woman and Child Health. 2022;5(4):340–345 (in Russ.). DOI: 10.32364/2618-8430-2022-5-4-340-345.
Введение
Современная нутрициология в педиатрии руководствуется фундаментальными научными исследованиями в части гигиены, биохимии и физиологии, разрабатывает концепции оптимального питания детей, изучает роль отдельных нутриентов в регулировании различных органов и систем, их воздействие на клеточные структуры, а также участие в регуляции метаболизма, совершенствует методы диетотерапии при различных заболеваниях детского возраста [1]. Это позволяет проанализировать степень программирующего влияния алиментарного фактора на формирование отдельных характеристик здоровья человека и совершенствовать пути нутритивной коррекции [2, 3]. Особое значение нутритивная обеспеченность приобретает для больного ребенка, когда она становится неотъемлемым компонентом общего терапевтического воздействия на организм.
Патогенетически аргументированная корректировка микронутриентами улучшает нутритивный и иммунный статус, активизирует репаративные и анаболические процессы, что определяет как течение, так и исход болезни, а также ускоряет выздоровление ребенка [1].
В начале 2020 г. весь мир охватила пандемия COVID-19. Заболевание проявляется клиникой острой респираторной инфекции, поражая верхние и нижние дыхательные пути с вовлечением в процесс желудочно-кишечного тракта, сердечно-сосудистой системы, кожи, почек и других органов.
В течение 2 лет ученые наблюдают за пациентами, перенесшими COVID-19. Установлено, что изменения в различных органах и системах не ограничиваются только периодом острого течения болезни, но имеют последствия в виде психологических, стойких физических и когнитивных расстройств [4]. Так появилось понятие «постковидный синдром». Его симптомы, первоначально называвшиеся «длительный COVID» или «долгосрочный COVID», теперь в совокупности называются «постострыми последствиями инфекции SARS-CoV-2» (PASC). Согласно определению Национальных институтов здравоохранения (2021) общие симптомы PASC включают усталость, одышку, туман в голове, нарушения сна, перемежающуюся лихорадку, желудочно-кишечные симптомы, тревогу и депрессию. Наиболее часто пациенты предъявляют жалобы на утомляемость, одышку, головные боли, кашель, стеснение в груди, миалгии, лихорадку, сердцебиение и другие конституциональные симптомы, и их список растет [5]. Указанные симптомы различной степени тяжести могут сохраняться в течение нескольких месяцев, при этом новые симптомы возникают значительно позже инфицирования [6], влияя на качество жизни. Около 80% случаев COVID-19 протекают бессимптомно или в легкой форме, и многие пациенты выздоравливают в течение 2–4 нед. Однако в 15% и 5% случаев развиваются тяжелая пневмония и критическая полиорганная недостаточность соответственно, продолжительность которых может составлять 3–6 нед. [7]. Число пациентов, перенесших COVID-19, у которых впоследствии развивается PASC, постоянно растет по мере увеличения числа инфицированных [8]. При этом следует отметить, что PASC может поражать молодых людей, детей и тех, у кого были только легкие симптомы COVID-19 и которые не нуждались ни в респираторной поддержке, ни в госпитализации [9, 10]. Большинство исследований показали, что тяжесть заболевания обусловливает вероятность ухудшения состояния или пролонгации симптомов.
К наиболее распространенным проявлениям PASC относятся мышечная слабость или астения, нарушение цикла «сон — бодрствование», изменение со стороны обоняния и вкуса вплоть до их потери, депрессия и тревожность, повышение либо резкое снижение температуры тела, головные боли, перепады АД, аритмии, запоры, сменяющиеся диареей, повышенная потливость, выпадение волос, гиперемия отдельных участков кожи, кожный зуд, сыпь [4].
Через 7 мес. после начала заболевания COVID-19 о симптомах стойкой усталости, постнагрузочного недомогания и когнитивной дисфункции сообщили более 77,9% пациентов [11]. Многие были не в состоянии работать или нуждались в сокращенном рабочем графике [12]. При анализе 1733 последовательных пациентов с лабораторно подтвержденным COVID-19 76% человек сообщили по крайней мере об одном из следующих симптомов через 6 мес. после выписки: утомляемость / мышечная слабость (63%), проблемы со сном (26%), выпадение волос (22%), нарушение обоняния (11%) и вкуса (9%), проблемы с подвижностью (7%) [13].
У тяжелобольных пациентов был более высокий риск развития усталости или мышечной слабости, нарушений легочной диффузии, тревоги или депрессии. Подобные наблюдения были подтверждены в многоцентровых исследованиях в США [14] и других странах [15, 16]. Исследователи из Италии [9] и других стран сообщили о высокой распространенности стойких системных симптомов после постановки диагноза COVID-19, которые чаще наблюдались среди выживших, получавших помощь в отделении интенсивной терапии.
Большинство исследователей (как зарубежных, так и отечественных) отмечают в своих работах высокий риск психоневрологических нарушений, при этом дети не являются исключением.
На работу нервной системы, восстанавливая баланс между процессами возбуждения и торможения, влияет ряд веществ, среди которых витамины, аминокислоты и растительные экстракты. К ним относятся: холин, глицин, лизин, цинк, магний, витамины группы B (B1, B3, B6), экстракты мелиссы и мяты.
Холин участвует в трех основных физиологических процессах: обеспечении структурной целостности мембран и липидной передачи через нее, холинергической нейротрансмиссии и метилировании [17]. Он положительно влияет на память и повышает работоспособность.
Глицин представляет собой уникальную аминокислоту, которая незаменима в построении каркаса значительного количества структурных белков и обычных метаболитов. Многие расстройства, связанные с недостатком глицина, ассоциированы с его синтезом и катаболизмом, а это означает, что любое изменение, происходящее либо в процессах его образования, либо в процессах потребления, может вызвать негативные последствия у человека [18], такие как астенический синдром, синдромы гипотонии мышц и сниженных рефлексов, а также угнетение центральной нервной системы. Достаточное его количество в организме положительно влияет на моторику и речь.
Витамины группы B нормализуют работу центральной и периферической нервной системы, улучшают умственную деятельность, участвуют в формировании хорошего настроения и психологического равновесия.
Лизин как нейромодулятор играет роль в центральных тормозных системах ГАМК, участвует во многих важных клеточных процессах, таких как передача сигнала, апоптоз и пролиферация [19].
Цинк является важным микроэлементом, который играет большую роль в физиологии иммунной системы, выступая в качестве сигнальной молекулы. Он действует не только как противовоспалительное средство, но и как антиоксидант, стабилизирующий мембрану [20]. Дефицит цинка препятствует выживанию иммунных клеток и неблагоприятно влияет на такие важные функции, как фагоцитоз, уничтожение клеток-мишеней и продукция цитокинов [21].
Экстракты мелиссы и мяты используют в фитотерапии. Данные растения входят в состав многих лекарственных препаратов. Они обладают седативным, антистрессорным, спазмолитическим, антидепрессивным, антиоксидантным и общеукрепляющим эффектами.
Все эти аминокислоты, витамины и растительные экстракты сбалансированно используются в биологически активных добавках (БАД). БАД «Кидз (Kidz) сироп с мелиссой и мятой» сочетает в себе тщательно подобранные, преимущественно природные компоненты, необходимые для правильной работы нервной системы и поддержки умственной деятельности. Представляется интересным оценить целесообразность использования данного комплекса для нормализации состояния детей, перенесших COVID-19.
Цель исследования: определить клиническую эффективность сиропа на основе холина, глицина, лизина, витаминов группы В, цинка, магния и экстрактов мелиссы и мяты для коррекции проявлений тревожных расстройств у детей, перенесших COVID-19.
Материал и методы
Проведено проспективное исследование с участием 65 детей младшего школьного возраста, перенесших 1,5–2 мес. назад новую коронавирусную инфекцию (COVID-19) легкой степени тяжести (клиника сопоставима с клиникой острой респираторной вирусной инфекции, ОРВИ), с проявлениями тревожных расстройств.
Критерии включения:
-
пациенты мужского или женского пола в возрасте от 7 до 11 лет, перенесшие новую коронавирусную инфекцию (COVID-19), с проявлениями тревожных расстройств;
-
письменное согласие родителя / законного представителя пациента на участие в исследовании.
Критерии невключения:
-
возраст пациентов младше 7 и старше 11 лет;
-
указания на непереносимость отдельных компонентов препарата в анамнезе;
-
применение препаратов, содержащих глицин, и/или холин, и/или лизин, и/или экстракты мелиссы или мяты, и/или витамины группы В, и/или магний, и/или цинк, за 2 нед. до начала исследования;
-
наличие тяжелых, клинически значимых других психических, неврологических, эндокринологических (в том числе нарушения углеводного обмена и сахарный диабет), сердечно-сосудистых, печеночных, почечных заболеваний в анамнезе;
-
железодефицитная анемия;
-
дефицит массы тела;
-
хронические инфекционные заболевания (туберкулез, вирусные гепатиты, ВИЧ и т. п.);
-
возникновение клинических проявлений заболевания после черепно-мозговой травмы или нейроинфекции;
-
наличие в анамнезе повторных эпилептических приступов;
-
умственная отсталость;
-
участие в другом клиническом исследовании любого лекарственного средства или БАД;
-
неспособность следовать врачебным рекомендациям.
На протяжении всего исследования все пациенты получали стандартное лечение. Оно включало в себя диетотерапию (исключение экстрактивных веществ, продуктов и напитков, оказывающих возбуждающее действие), соблюдение режима сна и отдыха, прогулки на свежем воздухе, ограничение времяпрепровождения за телефоном, компьютером и телевизором. Сорок детей (20 девочек и 20 мальчиков) основной группы (ОГ) дополнительно получали «Кидз (Kidz) сироп с мелиссой и мятой» (ООО «ВТФ», Россия) по 1 стику (5 мл) 3 р/сут в течение 42 дней, 25 детей (16 девочек и 9 мальчиков) контрольной группы (КГ) получали только стандартную терапию.
Если сопутствующая патология не являлась критерием невключения пациента в исследование, а используемые препараты не входили в список запрещенных препаратов, то лечение сопутствующей патологии проводилось по обычной схеме.
Исследование проводилось амбулаторно в течение 42 дней. На протяжении исследования пациенты посетили исследовательский центр 3 раза: визит 1 — визит включения, визиты 3 и 4 — через 28 и 42 дня после визита 1 соответственно и 1 телефонный звонок (через 7 дней от начала исследования, визит 2).
До проведения исследования после получения полной, объективной, достоверной и адаптированной к восприятию информации родитель / законный представитель пациента давал письменное согласие на участие своего ребенка в настоящем исследовании.
В ходе всех визитов среди родителей было проведено анкетирование, в котором оценивались критерии включения/невключения, аппетит ребенка, сон, поведение, физическая активность, трудности взаимоотношений с ребенком. В анкетах предлагалось выбрать варианты ответов, например: сон спокойный или ребенок боится заснуть в темноте; поведение — непослушный, раздражительный, плаксивый. Кроме того, используя визуально-аналоговые шкалы (ВАШ), родителям предлагалось оценить наличие/отсутствие и степень выраженности (интенсивность) следующих симптомов: физическая активность, утомляемость при выполнении школьной программы, успеваемость, настроение, степень нарушения взаимоотношений с родителями, тревожность. Для каждого показателя была своя шкала от 0 до 10, в которой 0 — отсутствуют изменения, 1–3 — изменения слабо выражены, 4–6 — изменения умеренно выражены, 7–8 — изменения сильно выражены, 9–10 — изменения очень сильно выражены. Вопросы на визите 1 содержали формулировки, касающиеся наличия/отсутствия симптома после заболевания, а в анкетах, предлагаемых на последующих визитах, появились варианты для оценки динамики лечения. В связи с этим для некоторых ВАШ поменялись формулировки вопроса. Так, например, при исходной оценке настроения по ВАШ к 10 баллам приравнивалось максимальное отрицательное состояние ребенка по данному критерию (плаксивость, раздражительность, агрессивность), а на следующих визитах 10 баллам соответствовало максимальное положительное изменение данного критерия (ребенок стал сдержаннее и спокойнее). Такие изменения в шкалах были, помимо настроения, в оценке успеваемости в школе и нарушения взаимоотношений между родителями и ребенком.
Оценивались все нежелательные реакции, возникшие в период лечения, частота и характер, их связь с исследуемым продуктом.
Статистическая обработка данных проводилась в электронной базе данных Excel. Для оценки статистической значимости различий между двумя независимыми и зависимыми группами использовали непарный критерий Стьюдента. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
Длительные последствия COVID-19 затрагивают несколько систем органов, что требует постоянного медицинского внимания даже после того, как острый период заболевания миновал [22]. Согласно оценке здоровья взрослого населения более трети пациентов с PASC испытывают более одного симптома [23], самыми распространенными из них являются нарастающая и убывающая усталость (15–87%), одышка (10–71%), боль или чувство стеснения в груди (12–44%), кашель (17–34%) и нарушение сна (24–26%) [24, 25]. Пациенты могут также жаловаться на субфебрилитет, миалгию и слабость, артралгию, сухость, ринит, головные боли, потерю аппетита, плохую концентрацию внимания, аносмию/гипосмию, алопецию, диарею, тревогу, депрессию и посттравматическое стрессовое расстройство [24, 25].
Согласно результатам, полученным в ходе настоящего исследования, прием БАД «Кидз (Kidz) сироп с мелиссой и мятой» способствует нормализации сна, повышению аппетита, активности, познавательности, улучшению неврологического профиля, что выражалось улучшением взаимоотношений с родителями.
Так, на визите 1 больше половины (62,5%) родителей детей из ОГ отметили изменения аппетита (плохо ест, избирателен) после перенесенной новой коронавирусной инфекции, в КГ таких было 92%. На последнем визите в обеих группах у всех пациентов отмечено улучшение аппетита. Проблемы со сном отмечались у 62,5% детей из ОГ и у 76% — из КГ. В конце исследования улучшение сна отметили все пациенты ОГ и 80% — КГ. До начала исследования нарушения поведения в виде раздражительности, непослушания, плаксивости, заторможенности отмечались у 82,5% детей из ОГ и у 92% — из КГ. К концу периода наблюдения у всех пациентов обеих групп отмечено улучшение поведения.
Родители детей, принимавших «Кидз (Kidz) сироп с мелиссой и мятой», отмечали повышение активности, интереса к окружающему миру, к учебе и улучшение взаимоотношений.
Ретроспективный анализ данных 236 379 человек, в том числе и детей 10-летнего возраста, перенесших COVID-19, а также пациентов контрольной группы, переболевших острыми респираторными инфекциями, выявил высокий риск развития в течение 6 мес. после COVID-19 неврологических и психических нарушений [4, 26], которые включали в себя бессонницу (5,4%), тревожность (17,4%), аносмию (10%), депрессию (17,4%) [26].
В настоящее время PASC у детей и подростков мало изучен. На протяжении двух лет ведется интенсивный анализ полученных клинических данных. Так, исследователи из г. Якутска выявили ряд особенностей у детей с PASC [27]. В исследовании участвовало 300 детей и подростков (от 1 года до 15 лет), перенесших COVID-19. Через 6 мес. после болезни PASC наблюдался у 70% реконвалесцентов. Среди симптомов доминировали: слабость и утомляемость, потеря массы тела, конъюнктивит, ОРВИ, кожная сыпь, обострение хронического тонзиллита. Также отмечались проявления со стороны нервной системы: нарушения сна, изменение вкуса, потеря обоняния, головокружения, головные боли.
Еще одно исследование [цит. по 4] с участием 153 детей, перенесших COVID-19, было проведено в ГБУЗ «НПЦ детской психоневрологии» (г. Москва). Астению с вегетативной дисфункцией констатировали в 35% наблюдений, утомляемость — в 49%, головные боли напряжения — в 14%. Наиболее редкими (2%) и самыми тяжелыми последствиями COVID-19 у детей явились COVID-19-ассоциированные демиелинизирующие заболевания.
В настоящем исследовании для оценки симптомов астенического синдрома и других показателей нами были использованы ВАШ. Поскольку начиная с визита 2 формулировки некоторых вопросов изменились (до исследования — отрицательная характеристика, начиная с визита 2 — положительная динамика), то не представляется возможным сравнить динамику некоторых симптомов с визитом 1, а именно: успеваемости, настроения, нарушения взаимоотношений (до начала исследования 10 баллов приравнивались к максимально «отрицательному» показателю, после начала исследования — к «положительному»).
Как видно из таблиц 1 и 2, при добавлении к стандартной схеме лечения БАД «Кидз (Kidz) сироп с мелиссой и мятой» показатели практически всех симптомов астенического синдрома снизились вдвое.
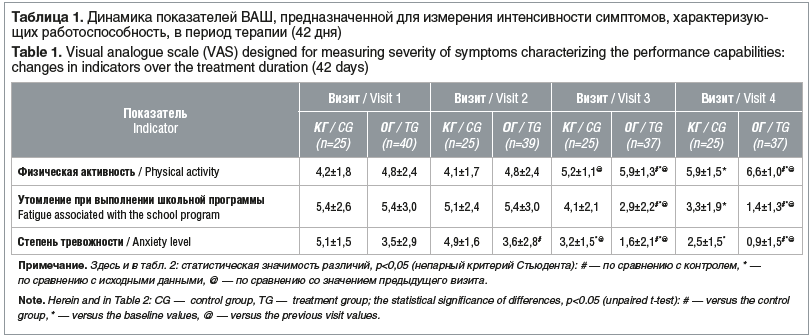
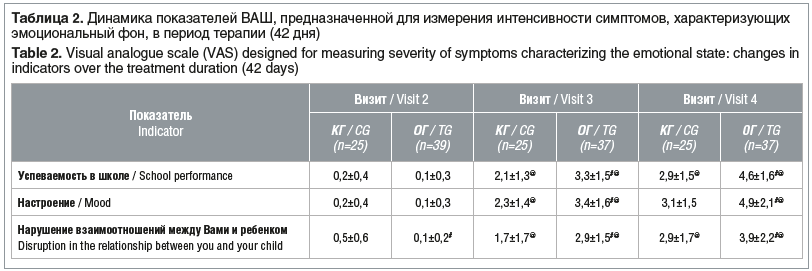
Через 1 нед. от начала исследования показатели астенического синдрома как в КГ, так и в ОГ не имели статистической значимости по сравнению с исходными данными. Уже через 1 мес. от начала терапии группа, в которой к стандартной схеме лечения была добавлена БАД, характеризовалась статистически значимым снижением выраженности всех симптомов астенического синдрома по сравнению с исходными данными (р<0,05, непарный критерий Стьюдента). В КГ этого не наблюдалось (р>0,05, непарный критерий Стьюдента), кроме снижения показателя тревожности.
В конце исследования статистически значимые отличия интенсивности симптомов по сравнению с исходными показателями отмечались в обеих группах, однако динамика была более выраженной в ОГ.
На последнем визите родителям предлагалось ответить на вопросы, связанные с оценкой БАД «Кидз (Kidz) сироп с мелиссой и мятой». Так, на вопрос «Нравится ли форма выпуска продукта Кидз?» все 40 родителей ответили «Да». Семь из 40 детей принимали сироп без удовольствия, что было связано со вкусом, который им не нравился. По этой причине 3 человека из 40 (1 — на визите 2 и 2 — на визите 3) отказались от дальнейшего участия в исследовании. Ни у кого из детей в процессе терапии не отмечалось аллергической реакции.
Заключение
Полученные в ходе настоящего исследования результаты свидетельствуют об эффективности применения БАД «Кидз (Kidz) сироп с мелиссой и мятой» у детей, перенесших COVID-19, с тревожными расстройствами. На фоне приема отмечено повышение устойчивости организма к эмоциональным переживаниям, улучшение концентрации внимания и памяти, протективное действие в условиях высоких умственных нагрузок.
Учитывая, что в проведенной работе наблюдался положительный эффект среди детей с тревожным и астеническим синдромом, предполагаем, что данный продукт можно принимать с профилактической целью детям, перенесшим новую коронавирусную инфекцию, входящим в группу риска по формированию постковидного синдрома.
Сведения об авторах:
Сагитова Гульнара Рафиковна — д.м.н., профессор, заведующая кафедрой госпитальной педиатрии с курсом последипломного образования ФГБОУ ВО Астраханский ГМУ Минздрава России; 414000, Россия, г. Астрахань, ул. Бакинская, д. 121; ORCID iD 0000-0002-8377-6212.
Шульдайс Владимир Александрович — главный внештатный специалист диетолог Министерства здравоохранения Астраханской области, главный врач ГБУЗ АО «ДГП № 4»; 414045, Россия, г. Астрахань, ул. Н. Островского, д. 66, к. 2.
Клюева Нонна Владимировна — руководитель Центра по грудному вскармливанию ГБУЗ АО «ДГП № 4»; 414045, Россия, г. Астрахань, ул. Н. Островского, д. 66, к. 2.
Шафоростова Елена Михайловна — ассистент кафедры госпитальной педиатрии с курсом последипломного образования ФГБОУ ВО Астраханский ГМУ Минздрава России; 414000, Россия, г. Астрахань, ул. Бакинская, д. 121; ORCID iD 0000-0002-0696-4690.
Конотопова Ирина Борисовна — детский невролог ГБУЗ АО «ДГП № 4»; 414045, Россия, г. Астрахань, ул. Н. Островского, д. 66, к. 2.
Контактная информация: Шафоростова Елена Михайловна, e-mail: lenchiknew@mail.ru.
Прозрачность финансовой деятельности: исследование проведено при поддержке ООО «ВТФ». Никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 14.09.2022.
Поступила после рецензирования 07.10.2022.
Принята в печать 01.11.2022.
About the authors:
Gul’nara R. Sagitova — Dr. Sc. (Med.), Professor, Head of the Department of Inpatient Pediatrics with the course of post-graduate education, Astrakhan State Medical University; 121, Bakinskaya str., Astrakhan, 414000, Russian Federation; ORCID iD 0000-0002-8377-6212.
Vladimir A. Shuldais — Chief outsource nutritionist of the Ministry of health of Astrakhan Region; Chief Physician of Children’s City Polyclinic No.4; 66, bldn. 2, N. Ostrovsky str., Astrakhan, 414045, Russian Federation.
Nonna V. Klyueva — Head of the Breast-Feeding Center, Children’s City Polyclinic No.4; 66, bldn. 2, N. Ostrovsky str., Astrakhan, 414045, Russian Federation.
Elena M. Shaforostova — assistant of the Department of Inpatient Pediatrics with the course of post-graduate education, Astrakhan State Medical University; 121, Bakinskaya str., Astrakhan, 414000, Russian Federation; ORCID iD 0000-0002-0696-4690.
Irina B. Konotopova — pediatric neurologist, Children’s City Polyclinic No.4; 66, bldn. 2, N. Ostrovsky str., Astrakhan, 414045, Russian Federation.
Contact information: Elena M. Shaforostova, e-mail: lenchiknew@mail.ru.
Financial Disclosure: the research was supported by LLC VTF. No authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 14.09.2022.
Revised 07.10.2022.
Accepted 01.11.2022.
2. Liotto N., Miozzo M., Gianni M.L. et al. Early nutrition: the role of genetics and epigenetics. Pediatr Med Chir. 2009;31(2):65–71.
3. Heijmans B.T., Tobi E.W., Stein A.D. et al. Persistent epigenetic differences associated with prenatal exposure to famine in humans. PNAS USA. 2008;105(44):17046–17049. DOI: 10.1073/pnas.0806560105.
4. Захарова И.Н., Османов И.М., Творогова Т.М. и др. Постковидный синдром у детей в структуре COVID-19. Педиатрия. Consilium Medicum. 2022;1:8–14. DOI: 10.26442/26586630.2022.1.201515. [Zakharova I.N., Osmanov I.M., Tvorogova T.M. et al. Postcoid syndrome in children in the structure of COVID-19. Pediatrics. Consilium Medicum. 2022;1:8–14 (in Russ.)]. DOI: 10.26442/26586630.2022.1.201515.
5. Goërtz Y.M.J., van Herck M., Delbressine J.M. et al. Persistent symptoms 3 months after a SARS-CoV-2 infection: the post-COVID-19 syndrome? ERJ Open Res. 2020;6(4):00542–2020. DOI: 10.1183/23120541.00542-2020.
6. Tenforde M.W., Kim S.S., Lindsell C.J. et al. Symptom duration and risk factors for delayed return to usual health among outpatients with COVID-19 in a multistate health care systems network — United States, March-June 2020. MMWR Morb Mortal Wkly Rep. 2020;69(30):993–998. DOI: 10.15585/mmwr.mm6930e1.
7. Hu B., Guo H., Zhou P., Shi Z.L. Characteristics of SARS-CoV-2 and COVID-19. Nat Rev Microbiol. 2021;19(3):141–154. DOI: 10.1038/s41579-020-00459-7.
8. Rubin R. As their numbers grow, COVID-19 "long haulers" stump experts. JAMA. 2020;324:1381–1383. DOI: 10.1001/jama.2020.17709.
9. Carfi A., Bernabei R., Landi F. Gemelli Against C-P-ACSG. Persistent symptoms in patients after acute COVID-19. JAMA. 2020;324(6):603–605. DOI: 10.1001/jama.2020.12603.
10. Mandal S., Barnett J., Brill S.E. et al.; ARC Study Group. ‘Long-COVID’: a cross-sectional study of persisting symptoms, biomarker and imaging abnormalities following hospitalisation for COVID-19. Thorax. 2021;76(4):396–398. DOI: 10.1136/thoraxjnl-2020-215818.
11. Moghimi N., Di Napoli M., Biller. et al. The Neurological Manifestations of Post-Acute Sequelae of SARS-CoV-2 infection. Curr Neurol Neurosci Rep. 2021;21(9):44. DOI: 10.1007/s11910-021-01130-1.
12. Davis H.E., Assaf G.S., McCorkell L. et al. Characterizing long COVID in an international cohort: 7 months of symptoms and their impact. EClinicalMedicine. 2021;38: 101019. DOI: 10.1101/2020.12.24.20248802.
13. Huang C., Huang L., Wang Y. et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397(10270):220–232. DOI: 10.1016/S0140-6736(20)32656-8.
14. Chopra V., Flanders S.A., O’Malley M. et al. Sixty-day outcomes among patients hospitalized with COVID-19. Ann Intern Med. 2021;174(4):576–578. DOI: 10.7326/ M20-5661.
15. Carvalho-Schneider C., Laurent E., Lemaignen A. et al. Follow-up of adults with noncritical COVID-19 two months after symptom onset. Clin Microbiol Infect. 2021;27(2):258–263. DOI: 10.1016/j. cmi.2020.09.052.
16. Garrigues E., Janvier P., Kherabi Y. et al. Post-discharge persistent symptoms and health-related quality of life after hospitalization for COVID-19. J Inf Secur. 2020;81(6):e4–6. DOI: 10.1016/j.jinf.2020.08.029.
17. Wortmann S.B., Mayr J.A. Choline-related-inherited metabolic diseases-A mini review. J Inherit Metab Dis. 2019;42(2):237–242. DOI: 10.1002/jimd.12011.
18. Pérez-Ràfols C., Liu Y., Wang Q. et al. Why Not Glycine Electrochemical Biosensors? Sensors (Basel). 2020;20(14):4049. DOI: 10.3390/s20144049.
19. Rowe E.M., Xing V., Biggar K.K. Lysine methylation: Implications in neurodegenerative disease. Brain Res. 2019;1707:164–171. DOI: 10.1016/j.brainres.2018.11.024.
20. Prasad AS. Zinc: role in immunity, oxidative stress and chronic inflammation. Curr Opin Clin Nutr Metab Care. 2009;12(6):646–52. DOI: 10.1097/MCO.0b013e3283312956.
21. Pal A., Squitti R., Picozza M. et al. Zinc and COVID-19: Basis of Current Clinical Trials. Biol Trace Elem Res. 2021;199(8):2882–2892. DOI: 10.1007/s12011-020-02437-9.
22. Munipalli B., Seim L., Dawson N.L. et al. Post-acute sequelae of COVID-19 (PASC): a meta-narrative review of pathophysiology, prevalence, and management. SN Compr Clin Med. 2022;4(1):90. DOI: 10.1007/s42399-022-01167-4.
23. Watkins L.E., Sprang K.R., Rothbaum B.O. Treating PTSD: a review of evidence-based psychotherapy interventions. Front Behav Neurosci. 2018;12:258. DOI: 10.3389/fnbeh.2018.00258.
24. Huang C., Huang L., Wang Y. et al. 6 month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397:220–232.
25. Carfi A., Bernabei R., Landi F. Gemelli Against COVID-19 Post-Acute Care Study Group. Persistent symptoms in patients after acute COVID-19. JAMA. 2020;324(6):603–605.
26. Taquet M., Geddes J.R., Husain M. et al. 6-month neurological and psychiatric outcomes in 236379 survivors of COVID-19: a retrospective cohort научно- study using electronic health records. Lancet Psychiatry. 2021;8:416–427. DOI: 10.1016/S2215-0366(21)00084-5.
27. Иванова О.Н. Постковидный синдром у детей. Международный исследовательский журнал. 2021;111(9):35–39. [Ivanova O.N. Postcovid syndrome in children. International Research Journal. 2021;111(9):35–39 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
