Влияние модифицированной неоадъювантной химиотерапии на результаты комплексного лечения больных местно-распространенным раком шейки матки
DOI: 10.32364/2587-6821-2021-5-8-531-537
Цель исследования: изучить возможности улучшения непосредственных и отдаленных результатов лечения больных местно-распространенным раком шейки матки (МРРШМ) за счет применения модифицированной неоадъювантной полихимиотерапии (НАПХТ).
Материал и методы: в исследование включены данные о 237 больных с плоскоклеточным МРРШМ T2а-3аN0-1M0 стадий в возрасте от 24 лет до 61 года. Всем больным лечение начинали с проведения курсов НАПХТ препаратами цисплатин и блеомицетин. Больным контрольной группы (n=84) проводили системную внутривенную НАПХТ без модификации; пациенткам 1-й основной группы (n=60) перед курсом НАПХТ проводили сеанс плазмафереза; больным 2-й основной группы (n=93) перед НАПХТ выполняли сеанс плазмафереза и параллельно с НАПХТ проводили курс неспецифической иммунотерапии препаратом аллоферон. Количество курсов НАПХТ варьировало от 1 до 3 и зависело от эффекта лечения. После достижения резектабельности опухоли больным выполняли операцию Piver III. Пациенткам с недостаточным ответом после НАПХТ назначали химиолучевую терапию.
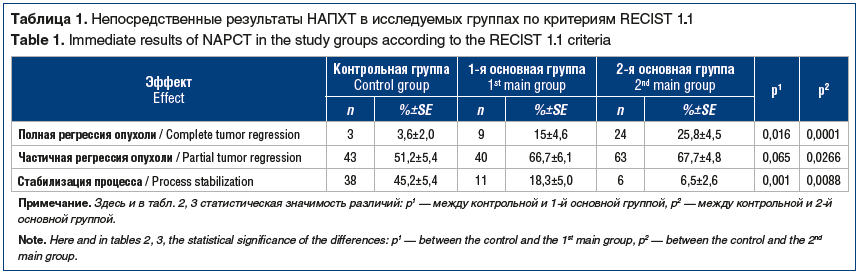
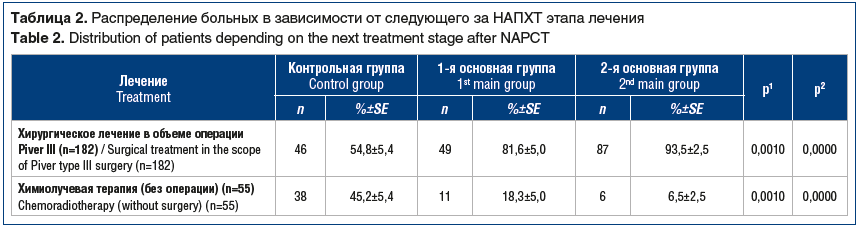
Результаты исследования: максимальное количество полных регрессий опухоли на НАПХТ наблюдалось во 2-й основной группе — 25,8%, в контрольной группе оно отмечено в 3,6% наблюдений. Значимо различалось количество прооперированных больных: 54,8% в контрольной группе, 81,6% в 1-й основной группе, 93,5% во 2-й основной группе. По мере увеличения числа компонентов проводимой НАПХТ уменьшалось количество курсов цитостатической терапии, необходимых для перевода опухоли в резектабельное состояние. Три курса НАПХТ в контрольной группе было проведено в 69% случаев, в 1-й основной — в 48%, во 2-й основной — в 22,6%. Пятилетняя безрецидивная выживаемость в контрольной группе составила 44,5±6,7%, в 1-й основной — 48,5±6,4%, во 2-й основной — 69,3±6,4%, общая выживаемость — 51,5±6,5, 66,7±6,4 и 83,5±4,4% соответственно. Различия показателей общей и безрецидивной выживаемости основных групп и контрольной группы были статистически значимы.
Заключение: плазмаферез обладает опосредованным иммуномодулирующим эффектом за счет деблокирования рецепторного аппарата клетки, позволяя реализоваться действию цитостатической терапии и прямому иммуномодулирующему и противовирусному действию аллоферона. Предлагаемый метод лечения больных МРРШМ с включением плазмафереза и неоадъювантной неспецифической иммунотерапии аллофероном в сочетании с НАПХТ позволяет в более короткие сроки у большего числа больных добиться регрессии опухоли, увеличить общую и безрецидивную выживаемость больных, что является главной целью противоопухолевого лечения любого онкологического заболевания.
Ключевые слова: местно-распространенный рак шейки матки, плоскоклеточная форма опухоли, неоадъювантная полихимиотерапия, плазмаферез, иммуномодулятор, аллоферон, хирургическое лечение, общая выживаемость, безрецидивная выживаемость.
Для цитирования: Меньшенина А.П., Моисеенко Т.И., Франциянц Е.М., Ушакова Н.Д., Вереникина Е.В., Адамян М.Л. Влияние модифицированной неоадъювантной химиотерапии на результаты комплексного лечения больных местно-распространенным раком шейки матки. РМЖ. Медицинское обозрение. 2021;5(8):531-537. DOI: 10.32364/2587-6821-2021-5-8-531-537.
A.P. Menshenina, T.I. Moiseenko, E.M. Frantsiyants, N.D. Ushakova,
E.V. Verenikina, M.L. Adamyan
National Medical Research Centre for Oncology, Rostov-on-Don, Russian Federation
Aim: to study the possibilities of improving the immediate and long-term treatment results of patients with locally advanced cervical cancer (LACC) via the modified neoadjuvant polychemotherapy (NAPCT).
Patients and Methods: the study included data on 237 patients with T2a-3aN0-1M0 squamous cell LACC at the age of 24 to 61 years. All patients were treated with NAPCT courses, including cisplatin and bleomycetin. Patients of the control group (n=84) underwent systemic intravenous NAPCT without modification; 60 patients of the 1st main group had plasmapheresis before the NAPCT course; 93 patients of the 2nd main group had plasmapheresis before NAPCT and a course of non-specific immunotherapy with alloferon was performed in parallel with NAPCT. The number of NAPCT courses varied from 1 to 3 and depended on the treatment effect. After achieving tumor resectability, patients underwent the Piver type III surgery. Patients with insufficient response after NAPCT were prescribed chemoradiotherapy.
Results: the maximum number of complete tumor regressions in NAPCT was observed in the 2nd main group — 25.8%, in the control group it was noted in 3.6% of cases. The number of operated patients significantly differed: 54.8% — in the control group, 81.6% — in the 1st main group, 93.5% — in the 2nd main group. As the number of components during NAPCT increased, the number of cytostatic therapy courses necessary for making the tumor resectable decreased. Three courses of NAPCT in the control group were conducted in 69% of cases, in the 1st main group — in 48%, in the 2nd main group — in 22.6%. Five-year relapse-free survival in the control group was 44.5±6.7%, in the 1st main group — 48.5±6.4%, in the 2nd main group — 69.3±6.4%, overall survival — 51.5±6.5, 66.7±6.4 and 83.5±4.4%. The differences in the overall and relapse-free survival rates of the main groups and the control group were statistically significant.
Conclusion: plasmapheresis has an indirect immunomodulatory effect due to the unblocking of the cell receptor triggering apparatus, allowing the cytostatic therapy action and the direct immunomodulatory and antiviral action of alloferon to be realized. The proposed method of treating patients with LACC (with the inclusion of plasmapheresis and neoadjuvant non-specific immunotherapy with alloferon in combination with NAPCT) makes it possible to achieve the tumor regression in a shorter period in a larger number of patients, to increase the overall and relapse-free survival of patients, which is the main goal of antitumor treatment of any oncological disease.
Keywords: locally advanced cervical cancer, squamous cell carcinoma, neoadjuvant polychemotherapy, plasmapheresis, immunomodulatory peptide, alloferon, surgical treatment, overall survival, relapse-free survival.
For citation: Menshenina A.P., Moiseenko T.I., Frantsiyants E.M. et al. The impact of modified neoadjuvant chemotherapy on the complex treatment results of patients with locally advanced cervical cancer. Russian Medical Inquiry. 2021;5(8):531–537 (in Russ.). DOI: 10.32364/2587-6821-2021-5-8-531-537.
Введение
Рак шейки матки (РШМ) по-прежнему остается чрезвычайно важной проблемой здравоохранения во всем мире. По данным Международного агентства по изучению рака, ежегодно в мире регистрируется около 570 тыс. случаев РШМ [1]. В России стандартизированный показатель заболеваемости РШМ в 2019 г. составил 15,4 на 100 тыс. населения, что соответствует 17 221 случаю [2]. В течение последнего десятилетия отмечен рост заболеваемости РШМ в возрастной группе 20–40 лет практически вдвое (41,2% среди всех возрастных групп) [3]. Летальность на первом году с момента установления диагноза в 2019 г. составила 13,5% [2]. По оценкам экспертов, при таких тенденциях к 2029–2033 гг. число новых случаев РШМ в России может достигнуть 22 100, а число смертей от этого заболевания — 10 500 [4].
Химиолучевая терапия является стандартом лечения местно-распространенного рака шейки матки (МРРШМ) [5]. Однако в последнее время все чаще публикуются работы, посвященные разработке новых подходов к комплексному лечению РШМ с включением различных вариантов индукционной химиотерапии [6].
Одним из основных достижений современной онкологии является раскрытие новых этиологических и патогенетических особенностей злокачественных процессов. РШМ с этой точки зрения является уникальной опухолью, так как область исследований, посвященных папилломавирусному канцерогенезу, в настоящее время очень обширна и довольно хорошо структурирована [7].
Цель исследования: изучить возможности улучшения непосредственных и отдаленных результатов лечения больных МРРШМ за счет применения модифицированной неоадъювантной полихимиотерапии (НАПХТ).
Материал и методы
Проспективное контролируемое одноцентровое исследование начато в 2012 г. В исследование включены данные о 237 больных МРРШМ стадий T2а-3аN0-1M0, находившихся на лечении в отделении онкогинекологии ФГБУ «НМИЦ онкологии» Минздрава России (Ростов-на-Дону). Основным критерием включения больных в исследование являлась морфологически подтвержденная плоскоклеточная форма РШМ. Критериями невключения в исследование были другие морфологические формы РШМ (опухоли из железистого эпителия, мезенхимальные и смешанные опухоли).
Общая характеристика больных. В исследование включены пациентки в возрасте от 24 лет до 61 года. Наибольший удельный вес (84,8%) пришелся на возрастную группу от 30 до 49 лет (n=201). В большинстве случаев первичная опухоль была расценена как соответствующая стадии T2b (опухоль шейки матки выходит за пределы матки, в опухолевую инфильтрацию вовлечен параметрий) — 204 (86,1%) женщины. В 11,4% наблюдений размеры первичной опухоли соответствовали стадии T2a (опухоль шейки матки выходит за пределы матки, параметральная инвазия отсутствует); в 2,5% случаев — Т3а (метастазы в нижнюю треть влагалища). Отдаленных метастазов не выявлено. Во всех группах больных преобладала умеренно дифференцированная карцинома — 150 (63,3%) пациенток и смешанная форма роста опухоли — 177 (74,7%) больных. По шкале ECOG-ВОЗ у 168 (70,9%) больных общее состояние оценено в 0 баллов, у 69 (29,1%) — в 1 балл.
Лечение начинали с проведения курсов НАПХТ. В зависимости от модификации неоадъювантного этапа лечения пациентки были разделены на три группы: контрольную и две основные. Набор в группы осуществлялся методом независимой последовательной рандомизации пациенток с помощью таблицы случайных чисел, сгенерированной в Statistica.
Контрольную группу составили 84 больных, получавших внутривенную химиотерапию препаратами цисплатин в дозе 75 мг/м2 в/в капельно в 1-й день и блеомицетин в дозе 20 мг/м2 в/в струйно в 1-й и в 5-й дни химиотерапии.
В 1-ю основную группу вошли 60 больных, которым в 1-й день программы лечения проводили сеанс лечебного плазмафереза, через сутки после которого начинали курс химиотерапии по схеме цисплатин 75 мг/м2 в/в капельно в 1-й день + блеомицетин 20 мг/м2 в 1-й и 5-й дни в/в струйно [8].
Во 2-й основной группе (n=93) в 1-й день программы лечения проводили сеанс лечебного плазмафереза; через сутки после которого начинали курс химиотерапии по схеме цисплатин 75 мг/м2 в/в капельно в 1-й день + блеомицетин 20 мг/м2 в 1-й и 5-й дни в/в струйно. Параллельно каждому курсу НАПХТ проводили курс неспецифической иммунотерапии индуктором эндогенного интерферона (ИФН) аллофероном (Аллокин-альфа), 6 инъекций подкожно через день [9].
Количество курсов было индивидуальным в каждом конкретном случае (от 1 до 3), но ни у одной больной не превышало 3 курсов. Спустя 3 нед. после завершения каждого курса НАПХТ проводили обследование больных, на основании чего принимали решение о дальнейшей тактике лечения. Следующим этапом проводили хирургическое лечение в объеме Piver III или химиолучевую терапию.
После планирования тактики лечения ex consilio все пациентки были детально информированы о способе и особенностях предстоящей терапии и подписывали информированное согласие. На внедрение нового варианта неоадъювантной химиотерапии получено разрешение этического комитета ФГБУ «НМИЦ онкологии» Минздрава России г. Ростова-на-Дону.
Результаты НАПХТ (т. е. непосредственные результаты лечения) оценивали по шкале RECIST1.1 (Response Evaluation Criteria In Solid Tumors). В качестве прямого критерия эффективности лечения была выбрана общая выживаемость — выживаемость больных от момента диагностики заболевания до летального исхода, независимо от любой причины. Безрецидивная выживаемость расценивалась как выживаемость от времени наступления ремиссии до возникновения рецидива [10]. Кроме того, оценивали побочные токсические проявления химиотерапии, используя классификацию CTCAE version 4.03.
Статистическую обработку проводили с помощью стандартного пакета программ Statistica 10.0. Использовали критерий достоверности Стьюдента (t), согласно которому статистически значимым считалось различие с вероятностью безошибочного прогноза не менее 95%, т. е. при р<0,05; непараметрический критерий Манна — Уитни. Для оценки отдаленных результатов (выживаемости) использовали метод Каплана — Мейера, при сравнительном анализе статистическую значимость различий оценивали с помощью Log-rank-теста.
Результаты исследования
Пациентки контрольной и обеих основных групп были сопоставимы по возрасту и общему состоянию, стадии распространения, степени дифференцировки и форме роста опухоли. Проведение предоперационной химиотерапии оказывало ингибирующее влияние на рост опухоли во всех случаях. Прогрессирование заболевания на фоне НАПХТ не отмечено ни у одной больной (табл. 1). Во всех группах преобладала частичная регрессия опухоли: 51,2% — в контрольной группе, 66,7% — в 1-й основной и 67,7% — во 2-й основной группах. При этом отмечена значительная разница по показателям полной регрессии опухоли и стабилизации процесса. Так, ответ опухоли на лечение, расцененный как стабилизация, был максимальным при стандартном внутривенном введении химиопрепаратов (45,2%). В обеих основных группах стабилизация отмечена у значительно меньшего количества больных: 18,3% при добавлении к НАПХТ только сеанса плазмафереза и лишь у 6,5% при сочетании плазмафереза, НАПХТ и аллоферона. На этом фоне во 2-й основной группе отмечено максимальное количество полных ответов опухоли на лечение среди всех больных — 25,8%, тогда как в контрольной группе полная регрессия опухоли была лишь в 3,6% наблюдений.
Следует отметить, что в нашем онкоцентре критерием отбора больных РШМ на хирургическое лечение после проведения инициальной цитостатической терапии является только полная и частичная регрессия опухоли. Стабилизацию процесса (т. е. сохраняющуюся инфильтрацию параметральной и парацервикальной клетчатки) рассматривают как неблагоприятный для проведения хирургического этапа лечения ответ в связи с крайне высоким риском наличия остаточной опухоли после выполнения оперативного пособия, а следовательно, с потенциально высоким риском параметральных рецидивов. Больные со стабилизацией опухолевого процесса после НАПХТ — кандидаты на последующее химиолучевое лечение.
Из всех 237 больных, включенных в исследование, после завершения неоадъювантного этапа лечения прооперированы 182 (76,8%) женщины в объеме операции Piver III (табл. 2). Больным, у которых после 3 курсов НАПХТ не достигнута полная или частичная регрессия опухоли, проводили химиолучевую терапию (55 (23,2%) женщин). В контрольной группе со стандартным внутривенным введением цитостатиков только в половине случаев выполнен хирургический этап лечения, а другая половина больных отправлена на химиолучевую терапию. В обеих основных группах прооперировано большинство больных, превышающих контроль на 26,8% в 1-й основной группе и на 38,7% — во 2-й.
Реализация эффекта и сроки выполнения радикальной операции от момента начала индукционной химиотерапии в разных группах имели существенные отличия. Сохраняя персонализированный подход к лечению, спустя 3 нед. после проведения каждого курса НАПХТ оценивали объективный эффект лечения (табл. 3).
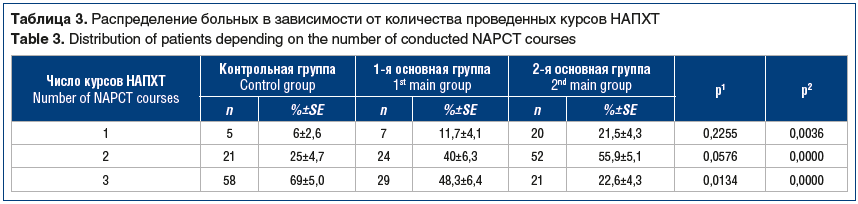
По мере увеличения числа компонентов проводимой НАПХТ уменьшалось количество курсов цитостатической терапии, необходимых для перевода опухоли в резектабельное состояние. Так, 3 курса химиотерапии при стандартной НАПХТ было проведено более чем в 2/3 случаев, при добавлении сеанса плазмафереза — в половине наблюдений, а при введении аллоферона — лишь в четверти случаев. Двух курсов НАПХТ для выполнения хирургического этапа лечения оказалось достаточным только 25% больных контрольной группы, тогда как в 1-й и 2-й основных группах после двух курсов были прооперированы 40% и 55,9% соответственно. В пятой части случаев больным, которым был выполнен плазмаферез и введен аллоферон на фоне НАПХТ, достаточно было всего 1 курса противоопухолевой химиоиммунотерапии.
Установлено, что в основной группе (в целом) нежелательные явления развивались реже и были менее выраженными: гастроинтестинальная токсичность не превышала 1-й степени и наблюдалась у 12,4% больных, алопеция — только у 5 (3,3%) пациенток, гематологической токсичности не отмечено ни в одном случае. Таким образом, включение в программу лечения плазмафереза и аллоферона не приводило к нарушению интервального режима, но ускоряло сроки проведения хирургического этапа, тогда как в контрольной группе у 25% больных гематологическая токсичность 2-й степени (в основном за счет развития лейкопении и нейтропении) требовала отсрочки последующих этапов лечения. Развитие гастроинтестинальной токсичности 2–3-й степени (за счет цисплатина) в группе получавших стандартную химиотерапию констатировали в 53,5% наблюдений, что требовало более длительного пребывания пациенток в стационаре и проведения дополнительной инфузионной детоксикационной и сопроводительной терапии. Алопеция в контрольной группе отмечена в 35,7% наблюдений (30 пациенток), гиперпигментация кожи была одинаково выраженной во всех группах. Легочной токсичности (побочное действие блеомицетина) в нашем исследовании не зафиксировано ни в одном случае.
При оценке 5-летней безрецидивной выживаемости больных мы получили следующие показатели. В группе больных со стандартным введением цитостатиков безрецидивная выживаемость была равна 44,5±6,7%, в группе больных с предварительным сеансом плазмафереза перед химиотерапией — 48,5±6,4%, а в группе больных с проведением плазмафереза, химиотерапии и введением индуктора эндогенного интерфероногенеза аллоферона — 69,3±6,4%. Медиана безрецидивного периода в 1-й основной группе составила 60,0±2,1 мес., в контрольной группе — 34,5±1,9 мес. Медиана безрецидивного периода во 2-й основной группе не достигнута (рис. 1).
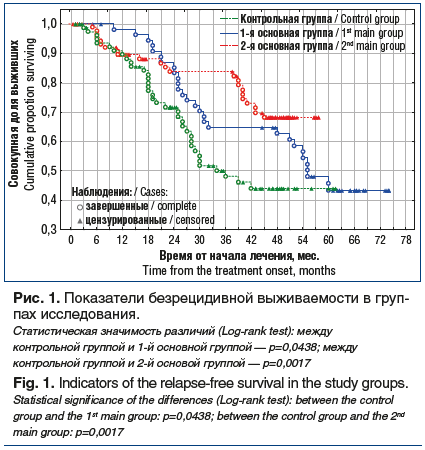
Общая 5-летняя выживаемость при использовании стандартных методик химиотерапии оказалась равной 51,5±6,5%, при предварительном проведении сеанса плазмафереза — 66,7±6,4%, а при добавлении в комплекс неоадъювантного лечения плазмафереза и неспецифической иммунотерапии препаратом аллоферон — 83,5±4,4%. Медиана общей 5-летней выживаемости не достигнута ни в одной группе (рис. 2).
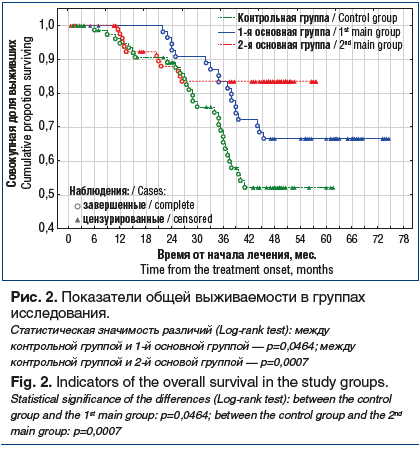
Обсуждение
Целесообразность применения индукционной химиотерапии при МРРШМ остается предметом дискуссий между онкогинекологами, химиотерапевтами и радиологами. Поиск путей увеличения эффективности лечения лежит в разных плоскостях. Так, ученые ФГБУ «РОНЦ им. Н.Н. Блохина», применяя 3 стандартных курса полихимиотерапии (по схеме: паклитаксел, цисплатин), доказали высокую эффективность предоперационной химиотерапии, достоверно увеличивающей общую и безрецидивную выживаемость больных [11]. Результаты исследования «ФГБУ НМИЦ онкологии им. Н.Н. Петрова» расширили перспективы лечения МРРШМ за счет применения дозоинтенсивной платиносодержащей химиотерапии в комбинации с доксорубицином [6].
Эффективность одних и тех же химиопрепаратов при введении их разным больным неодинакова [12]. Она зависит, в частности, от уровня эндогенной интоксикации пациента, которая в свою очередь приводит к развитию лекарственной резистентности и функциональному нарушению систем естественной детоксикации. Способностью деблокировать рецепторы клеток крови и транспортных белков от лигандов различной природы и тем самым сделать их доступными для новых лекарственных препаратов обладает один из методов экстракорпоральной гемокоррекции — плазмаферез [13, 14]. Также при предварительном проведении плазмафереза купируются явления печеночной дисфункции и восстанавливается монооксигеназное окисление, ответственное за метаболизм большинства известных химиопрепаратов [15]. Доказано, что плазмаферез способен нивелировать постхимиотерапевтическую иммуносупрессию за счет уменьшения остаточных концентраций цитостатиков в кровеносном русле [16]. Полученные нами данные об улучшении непосредственных и отдаленных результатов лечения с предварительным сеансом плазмафереза перед проведением курса НАПХТ подтверждают данные литературы об основных биологических эффектах плазмафереза [17, 18]. Таким образом, не увеличивая дозу и количество применяемых цитостатиков, можно влиять на биодоступность лекарственных препаратов.
Учитывая, что максимально эффективной терапией любого заболевания является этиотропное лечение, а РШМ — одно из немногих онкологических заболеваний с доказанной причиной возникновения (вирус папилломы человека), мы попытались использовать возможность влияния на причину опухоли [19]. В исследованиях [20, 21] доказана эффективность применения отечественного иммуномодулятора аллоферона в лечении больных пре- и микроинвазивным РШМ, что позволило нам использовать этот препарат в комплексном лечении больных МРРШМ. Основными точками приложения аллоферона являются: активация системы естественных киллеров, индукция синтеза эндогенных ИФН, преимущественно ИФН-γ, активация цитотоксических Т-клеток CD3+HLA-DR+ даже на фоне снижения абсолютного числа CD3+CD8+-клеток, что важно для реализации противоопухолевого ответа [22]. Как видно из представленных данных, в группе больных с модификацией НАПХТ плазмаферезом и аллофероном нам удалось достигнуть максимального количества объективных ответов на лечение и достоверного увеличения общей и безрецидивной выживаемости больных.
При внедрении любого нового метода лечения необходимо оценивать не только улучшение результатов терапии, но и возможность их достижения на фоне снижения частоты и выраженности побочных нежелательных явлений. В нашем исследовании уменьшение токсичности модифицированной химиотерапии можно связать с основными эффектами экстракорпоральной гемокоррекции и неспецифической иммунотерапии. Проведение плазмафереза способствовало уменьшению фоновой эндогенной интоксикации, вследствие чего гастроинтестинальная токсичность в основной группе больных была менее выраженной. Иммунокорригирующее действие плазмафереза и индуктора эндогенного интерфероногенеза аллоферона обусловило отсутствие гематологической токсичности в основных группах больных.
Заключение
Плазмаферез обладает опосредованным иммуномодулирующим эффектом за счет деблокирования рецепторного аппарата клетки, предоставляя возможность реализации прямого иммуномодулирующего и противовирусного действия аллоферона. Предлагаемый метод комплексного лечения больных МРРШМ с включением в программу лечения плазмафереза и неоадъювантной неспецифической иммунотерапии аллофероном в сочетании с цитотоксической терапией обладает усиленным противоопухолевым эффектом, позволяет в более короткие сроки и в большем проценте случаев добиться регрессии опухоли без развития серьезных нежелательных явлений, влияющих на качество жизни больных. Применение вышеописанного метода позволило увеличить общую выживаемость больных с 51,5% до 83,5% и безрецидивную выживаемость с 44,5% до 69,3%, что является главной целью противоопухолевого лечения любого онкологического заболевания.
Сведения об авторах:
Меньшенина Анна Петровна — к.м.н., ведущий научный сотрудник отдела опухолей репродуктивной системы ФГБУ «НМИЦ онкологии» Минздрава России; 344037, Россия, г. Ростов-на-Дону, ул. 14-я линия, д. 63; ORCID iD 0000-0002-7968-5078.
Моисеенко Татьяна Ивановна — д.м.н., профессор, главный научный сотрудник отдела опухолей репродуктивной системы ФГБУ «НМИЦ онкологии» Минздрава России; 344037, Россия, г. Ростов-на-Дону, ул. 14-я линия, д. 63; ORCID iD 0000-0003-4037-7649.
Франциянц Елена Михайловна — д.б.н., профессор, заместитель генерального директора по науке ФГБУ «НМИЦ онкологии» Минздрава России; 344037, Россия, г. Ростов-на-Дону, ул. 14-я линия, д. 63; ORCID iD 0000-0002-5191-1758.
Ушакова Наталья Дмитриевна — д.м.н., профессор, врач отделения анестезиологии и реанимации ФГБУ «НМИЦ онкологии» Минздрава России; 344037, Россия, г. Ростов-на-Дону, ул. 14-я линия, д. 63.
Вереникина Екатерина Владимировна — к.м.н., заведующая отделением онкогинекологии ФГБУ «НМИЦ онкологии» Минздрава России; 344037, Россия, г. Ростов-на-Дону, ул. 14-я линия, д. 63; ORCID iD 0000-0002-1084-5176.
Адамян Мери Людвиковна — к.м.н., научный сотрудник отдела опухолей репродуктивной системы ФГБУ «НМИЦ онкологии» Минздрава России; 344037, Россия, г. Ростов-на-Дону, ул. 14-я линия, д. 63; ORCID iD 0000-0003-4188-3746.
Контактная информация: Меньшенина Анна Петровна, e-mail: anna.menshenina.00@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.08.2021.
Поступила после рецензирования 25.08.2021.
Принята в печать 17.09.2021.
About the authors:
Anna P. Menshenina — C. Sc. (Med.), Leading Researcher of the Department of Reproductive System Tumors, National
Medical Research Centre for Oncology; 63, 14th Line str., Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0002-7968-5078.
Tatiana I. Moiseenko — Dr. Sc. (Med.), Professor, Leading Researcher of the Department of Reproductive System Tumors, National Medical Research Centre for Oncology; 63, 14th Line str., Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0003-4037-7649.
Elena M. Frantsiyants — Dr. Sc. (Bio.), Professor, Deputy Director for Science, National Medical Research Centre for Oncology; 63, 14th Line str., Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0002-5191-1758.
Natalia D. Ushakova — Dr. Sc. (Med.), Professor, Doctor of the Department of Anesthesiology and Resuscitation, National Medical Research Centre for Oncology; 63, 14th Line str., Rostov-on-Don, 344037, Russian Federation.
Ekaterina V. Verenikina — C. Sc. (Med.), Head of the Department of Oncogynecology, National Medical Research Centre for Oncology; 63, 14th Line str., Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0002-1084-5176.
Mery L. Adamyan — C. Sc. (Med.), Researcher of the Department of Reproductive System Tumors, National Medical Research Centre for Oncology; 63, 14th Line str., Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0003-4188-3746.
Contact information: Anna P. Menshenina, e-mail: anna.menshenina.00@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 02.08.2021.
Revised 25.08.2021.
Accepted 17.09.2021.
2. Каприн А.Д., Старинский В.В., Шахзадова А.О., ред. Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2020.
3. Пак Р.В. Эпидемиологические особенности рака шейки матки в мире. Вестник КазНМУ. 2019;1:678–680.
4. Barchuk A., Bespalov A., Huhtala H. et al. Breast and cervical cancer incidence and mortality treands in Russia 1980–2013. Cancer Epidemiol. 2018;55:73–80. DOI: 10.1016/j.canep.2018.05.008.
5. Мкртчян Л.С., Каприн А.Д., Иванов С.А. и др. Эффективность лечения местнораспространенного рака шейки матки в зависимости от факторов прогноза. Вопросы онкологии. 2019;65(4):584–589. DOI: 10.37469/0507-3758-2019-65-4-584-589.
6. Смирнова О.А., Бондарев Н.Э., Ульрих Е.А. и др. Оценка эффективности неоадъювантной дозоинтенсивной платиносодержащей химиотерапии в комбинированном лечении местно-распространенного рака шейки матки. Опухоли женской репродуктивной системы. 2018;14(4):56–64. DOI: 10.17650/1994-4098-2018-14-4-56-64.
7. McBride A.A., Münger K. Expert views on HPV infection. Viruses. 2018;10(2):94. DOI: 10.3390/v10020094.
8. Меньшенина А.П., Моисеенко Т.И., Ушакова Н.Д. и др. Патент РФ на изобретение № 25475969. Способ лечения больных местно-распространенным раком шейки матки. Опубл. 10.04.2015. Бюл. № 10.
9. Кит O.И., Меньшенина А.П., Моисеенко Т.И. и др. Патент РФ на изобретение RU 2648642. Способ неоадъювантного лечения больных местно-распространенным раком шейки матки. Опубл. 26.03.2018.
10. Давыдов М.И., Петровский А.В., ред. Онкология. Клинические рекомендации. 2-е изд. М.: Ассоциация онкологов России; 2018.
11. Морхов К.Ю., Нечушкина В.М., Кузнецов В.В. Индукционная химиотерапия местно-распространенного рака шейки матки. Вопросы онкологии. 2015;61(2):208–213.
12. Шихлярова А.И., Меньшенина А.П., Моисеенко Т.И., Ушакова Н.Д. Отражательная динамика общих адаптационных реакций при проведении плазмафереза и иммунотерапии в ходе лекарственного лечения рака шейки матки. Известия вузов. Северо-Кавказский регион. Естественные науки. 2015;1(185):114–118.
13. Ушакова Н.Д., Неродо Г.А., Горошинская И.А. и др. Оценка эффективности плазмафереза в лечении больных раком яичников. Российский медицинский журнал. 2014;3:21–26.
14. Bambauer R., Latzo R., Schiel R. Therapeutic plasma exchange and selective plasma separation methods. Fundamental technologies, pathology and clinical results. 4th ed. Pabst Science Publishers, D-49525 Lengerich, 2013:395–402.
15. Черний В.И., Тюменцева С.Г., Кутав О.В. и др. Применение эфферентных методов терапии в лечении фульминантной печеночной недостаточности. Бiль, знеболювання i iнтенсивна терапiя. 2007;1(д):59–67.
16. Бондарь Г.В., Олейников К.Н., Комендант В.В., Лисовская Н.Ю. Патогенетическое обоснование и методические аспекты лечебного плазмафереза у больных, получающих противоопухолевую лекарственную терапию. Новообразование. 2007;2:28–38.
17. Латипова Д.Х., Проценко С.А., Новик А.В. и др. Место эфферентной терапии в лечении солидных опухолей. Вопросы онкологии. 2015;61(2):174–179.
18. Кит О.И., Франциянц Е.М., Меньшенина А.П. и др. Роль плазмафереза и ксенон-терапии в коррекции острых последствий хирургической менопаузы у больных раком шейки матки. Научный журнал КубГАУ. Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. 2016;117:472–486.
19. Брико Н.И., Секачева М.И., Лопухов П.Д. и др. Клинико-эпидемиологические особенности проявлений папилломавирусной инфекции на примере рака шейки матки и аногенитальных (венерических) бородавок. Вестник РАМН. 2020;75(1):77–82. DOI: 10.15690/vramn1212.
20. Ковчур П.И., Курмышкина О.В., Волкова Т.О., Бахидзе Е.В. Иммунологические и молекулярно-генетические аспекты рака шейки матки до и после лечения. Петрозаводск: изд-во ПетрГУ; 2017.
21. Короленкова Л.И. Беременность при преинвазивном и микроинвазивном раке шейки матки — возможности донашивания, особенности диагностики, течения заболевания, исходы и прогноз. Акушерство и гинекология. 2015;6:53–58.
22. Menshenina A.P., Kit O.I., Moiseenko T.I. et al. Combination treatment with plasmapheresis and non-specific immunotherapy for locally advanced cervical cancer. Journal of Critical Reviews. 2020;7(12):2235–2241. DOI: 10.31838/jcr.07.12.329.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.