Потенциальные преимущества протонной терапии у пациентов с саркомой сердца
DOI: 10.32364/2587-6821-2020-4-3-155-160
Саркомы сердца — редко встречающиеся опухоли с неблагоприятным прогнозом. В силу их расположения возможности хирургического лечения крайне ограничены. Эффективность химиотерапии и лучевой терапии также не может быть признана удовлетворительной. Тем не менее применение радиотерапии может рассматриваться как метод выбора в случае локального рецидива после проведенного ранее хирургического и лекарственного лечения.
В работе описаны клинические наблюдения двух пациентов с саркомой сердца, проходивших курс протонной терапии, а также выполнено сравнение планов облучения с применением протонной и фотонной лучевой терапии. Период наблюдения составил 8 мес. Токсичности во время лечения и последующего наблюдения отмечено не было. Компьютерная и магнитно-резонансная томография, выполненная через 3 и 6 мес. после облучения, показала уменьшение размеров опухоли в обоих случаях. С целью проведения сравнительной оценки распределения дозы были сгенерированы планы облучения с применением фотонов. Показатели V5, V10 и средней дозы для левого легкого, V40 для сердца, средней дозы на правое легкое, а также лучевая нагрузка на спинной мозг оказа- лись существенно ниже при использовании протонного облучения.
Методика протонной лучевой терапии позволяет существенно снизить лучевую нагрузку на здоровые ткани по сравнению с таковой при фотонном облучении у пациентов с опухолями сердца, что может способствовать лучшей переносимости лечения, снижению частоты и выраженности лучевых реакций.
Ключевые слова: протонная терапия, саркома сердца, саркома Юинга, лучевая терапия, доза облучения.
Для цитирования: Воробьев Н.А., Мартынова Н.И., Бондарчук Д.В., Антипин Д.А., Кубасов А.В., Михайлов А.В., Любинский А.И., Андреев Г.И. Потенциальные преимущества протонной терапии у пациентов с саркомой сердца. РМЖ. Медицинское обозрение. 2020;4(3):155-160. DOI: 10.32364/2587-6821-2020-4-3-155-160.
N.A. Vorobyov1–3, N.I. Martynova1, D.V. Bondarchuk1, D.A. Antipin1, A.V. Kubasov1,
A.V. Mikhaylov1–3, A.I. Lyubinskiy1, G.I. Andreev1
1Berezin Sergey Medical Institute, St. Petersburg, Russian Federation
2St. Petersburg State University, St. Petersburg, Russian Federation
3I.I. Mechnikov North-Western State Medical University, St. Petersburg, Russian Federation
Cardiac sarcoma is a rare tumor with poor prognosis. These tumors have a very limited array of treatment options available due to their localization. The efficacy of chemotherapy and radiation therapy is poor as well. Nonetheless, radiation therapy may be considered first-line treatment in local recurrences after prior surgery and pharmacotherapy.
This article describes case histories of two patients with cardiac sarcoma who received proton therapy and compares two radiation treatment schedules using proton beam or photon beam therapy. Follow-up was 8 months. No toxicity throughout the treatment and follow-up was reported. CT and MRI performed 3 and 6 months after radiation therapy have demonstrated tumor mass reduction in both patients. Photon beam radiation treatment schedules were generated to compare dose distributions. V5, V10, and mean left lung dose, heart V40, mean right lung dose, and radiation exposure to spinal cord were significantly lower in proton beam therap y.
In cardiac tumors, proton beam therapy helps significantly reduce radiation exposure to healthy tissues as compared with photon beam therapy. The result is better treatment tolerance as well as lower rate and severity of adverse effects of radiation therapy.
Keywords: proton beam therapy, cardiac sarcoma, Ewing’s sarcoma, radiation therapy, radiation dose.
For citation: Vorobyov N.A., Martynova N.I., Bondarchuk D.V. et al. Potential benefits of proton beam therapy in patients with cardiac sarcoma. Russian Medical Inquiry. 2020;4(3):150–160. DOI: 10.32364/2587-6821-2020-4-3-155-160.

Введение
Первичные новообразования сердца представляют собой крайне редкую группу опухолей с частотой встречаемости 0,2%. При этом более 80% опухолей сердца являются доброкачественными, а доля сарком составляет не более 2% [1]. В силу труднодоступного расположения опухоли возможности хирургического лечения крайне ограничены. Эффективность химиотерапии и лучевой терапии также не может быть признана удовлетворительной. Тем не менее применение радиотерапии может рассматриваться как метод выбора в случае локального рецидива после проведенного ранее хирургического и лекарственного лечения [2–7]. К сожалению, даже современная 3D-конформная дистанционная лучевая терапия с применением модуляции по интенсивности не всегда позволяет подвести требуемую дозу излучения к мишени, не превысив при этом толерантных доз для здоровых тканей. При облучении опухоли сердца крайне важно обеспечить минимальную лучевую нагрузку на здоровую часть миокарда, легкие, пищевод, спинной мозг.
В последние годы в мире активно развивается метод протонной лучевой терапии. В отличие от других видов излучений глубинное распределение дозы для протонов имеет зону медленного подъема с увеличением глубины проникновения, называемую «плато», за которым следует дозовый максимум, называемый «пиком Брэгга». Амплитуда этого пика в 3–4 раза превышает дозу на поверхности среды. За пиком Брэгга доза очень быстро падает практически до нуля. В настоящее время протонная терапия является наиболее мощным средством для получения высокой конформности дозных распределений. Такая особенность протонной терапии позволяет значительно уменьшить лучевую нагрузку на здоровые ткани по сравнению с традиционными методами лучевой терапии пучками фотонов и электронов [8].
В данной работе описаны клинические наблюдения двух пациентов с саркомой сердца, проходивших курс протонной терапии, а также выполнено сравнение планов облучения с применением протонной и фотонной лучевой терапии.
Планирование протонной терапии осуществлялось при помощи планирующей системы Eclipse (Varian, США). Облучение проводилось на установке Varian ProBeam с использованием методики сканирования карандашным пучком.
Для создания планов фотонного облучения также использовалась система планирования Eclipse. Распределение дозы создавалось с применением методик модулированной по интенсивности лучевой терапии в виде статических полей (Intensity-Modulated Radiation Therapy — IMRT) или объемных арок (Volumetric Modulated Arc Therapy — VMAT).
Клиническое наблюдение 1
У пациентки А., 55 лет, при обследовании у кардиолога в июле 2017 г. выявлено новообразование правого желудочка (ПЖ), сопровождающееся стенокардией, стенозом пульмонального клапана. В августе 2017 г. проведено хирургическое лечение: пластика трикуспидального клапана, устранение стеноза пульмонального клапана с протезированием створки аутоперикардиальной заплатой. По результатам гистологического исследования установлено наличие плеоморфной саркомы. После хирургического лечения химиотерапия не проводилась, пациентке рекомендовано наблюдение. При выполнении позитронно-эмиссионной томографии (ПЭТ-КТ) с фтордезоксиглюкозой в октябре 2017 г. и марте 2018 г. очагов патологического накопления радиофармпрепарата не определялось.
При контрольном обследовании в сентябре 2018 г., по данным ПЭТ-КТ, отмечена отрицательная динамика в виде появления метаболически активного образования в полости ПЖ сцинтиграфическими размерами 20×17×15 мм, стандартизированный уровень захвата (standardized uptake value) SUVmax=11,09. Также отмечено появление лимфатических узлов передней медиастинальной, верхней паратрахеальной и параэзофагеальной групп с признаками повышенного метаболизма глюкозы.
Пациентка консультирована кардиохирургами, оперативное лечение выполнить технически невозможно. С учетом низкой ожидаемой эффективности химиотерапии совместно с онкологами принято решение о проведении протонной лучевой терапии.
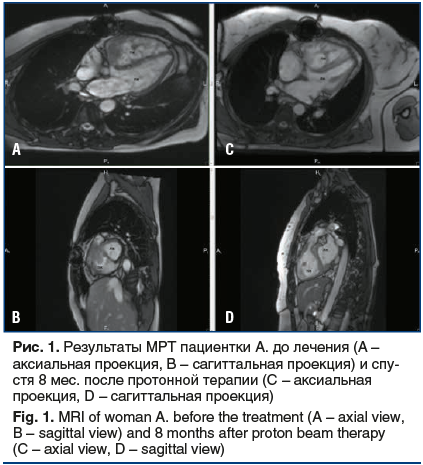
По данным магнитно-резонансной томографии (МРТ) сердца с контрастным усилением, выполненной в рамках предлучевой подготовки, в проекции базального отдела ПЖ определяется зона опухолевой инфильтрации с эндофитным распространением в полость ПЖ, распространением на область трикуспидального клапана, на область створок пульмонального клапана со стенозом просвета клапана. Общие размеры зоны опухолевой инфильтрации составляют 43×28×43 мм.
Суммарная доза облучения первичной опухоли составила 66 Гр при разовой очаговой дозе (РОД) 2,2 Гр за фракцию. Доза облучения пораженных лимфоузлов составила 60 Гр при РОД 2 Гр.
На протяжении 8 мес. наблюдения нежелательных проявлений, связанных с лучевым лечением, не отмечено. По данным контрольных МРТ, выполненных через 1, 3 и 8 мес. после лечения, отмечается постепенное уменьшение размеров зоны опухолевой инфильтрации ПЖ до 36×16×39 мм (рис. 1).
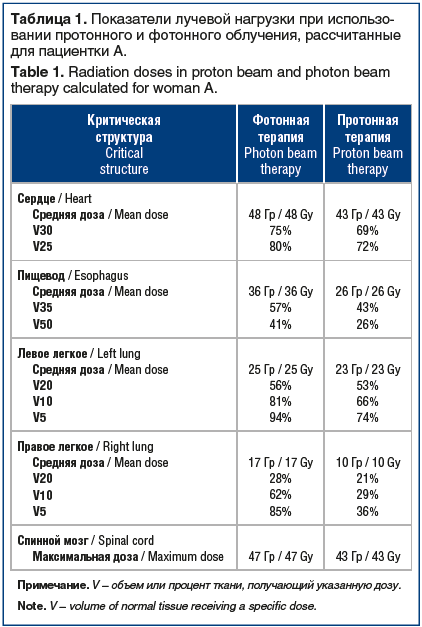
С целью сравнительной оценки лучевой нагрузки при использовании протонного и фотонного облучения выполнено планирование лучевой терапии фотонами с применением методики IMRT. Отмечено существенное снижение таких показателей, как средняя доза на правое и левое легкое, средняя и максимальная доза на спинной мозг, объем ткани легкого, получающий 5 и 20 Гр, объем сердца, получающий 40 Гр, в случае применения протонного облучения. Показатели лучевой нагрузки при использовании различных методик лучевой терапии представлены в таблице 1.
Клиническое наблюдение 2
Пациент Т. — 15-летний подросток, страдающий саркомой Юинга с поражением перикарда. В 2016 г. выполнено хирургическое лечение с последующей химиотерапией. В связи с прогрессированием в 2018 г. проведена 2-я линия химиотерапии с эффектом стабилизации. Однако спустя 3 мес. после окончания лечения вновь отмечен рост опухоли перикарда.
В связи с прогрессированием на фоне химиотерапии совместно с детскими онкологами принято решение о проведении протонной лучевой терапии.
В соответствии с данными МРТ, выполненной на этапе предлучевой подготовки, по передней стенке левого желудочка в области базальных и средних сегментов визуализируется объемное образование размерами 64×62×59 мм. Отмечается распространение образования по ходу задней стенки корня аорты и вдоль нижней стенки ее дуги, по ходу нижней стенки легочного ствола, с прилеганием к передней стенке левой нижней легочной вены.
Суммарная доза облучения первичной опухоли составила 55,8 Гр, РОД — 1,8 Гр.
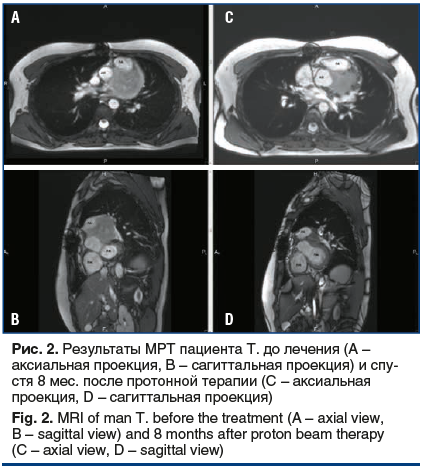
На протяжении 8 мес. наблюдения нежелательных проявлений, связанных с лучевым лечением, не отмечено. На контрольных МРТ, выполненных через 1, 4 и 8 мес. после лечения, отмечено постепенное уменьшение размеров образования левого желудочка до 47×24×33 мм (рис. 2). По данным эхокардиографии, за период наблюдения показатели сократимости миокарда не снизились, значение фракции выброса также не изменилось.
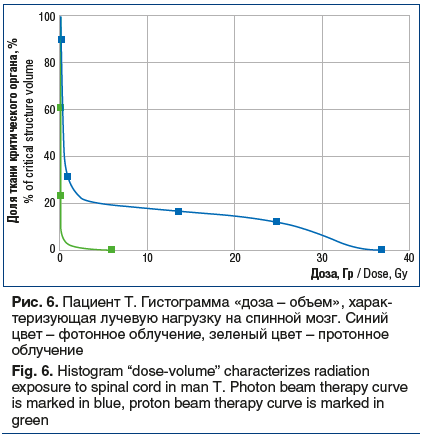
С целью проведения сравнительной оценки распределения дозы были сгенерированы планы облучения с применением фотонов. С учетом объема и расположения мишени наилучшее распределение дозы было получено при использовании методики IMRT с применением двух объемных арок (VMAT). Показатели V5, V10 и средней дозы для левого легкого, V40 для сердца, средней дозы на правое легкое, а также лучевая нагрузка на спинной мозг оказались существенно ниже при использовании протонного облучения. Показатели лучевой нагрузки при использовании различных методик лучевой терапии представлены в таблице 2.
Обсуждение
В настоящее время в мире идет активное накопление опыта клинического применения протонной терапии. Ежегодно стартуют новые проспективные исследования, посвященные изучению роли протонов в лечении онкологических заболеваний. Одним из методов оценки безопасности и потенциальной эффективности протонной терапии является сравнение планов облучения с определением качества покрытия мишени лечебной дозой и лучевой нагрузки на здоровые ткани.
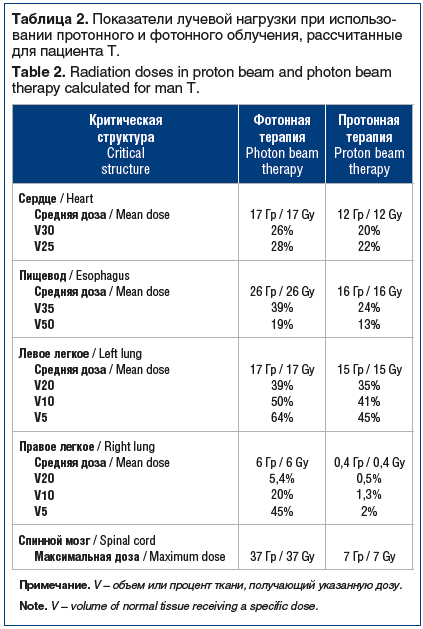
В клиническом наблюдении 1 планирование фотонного облучения выполнено с применением методики IMRT. С учетом сложной формы мишени и необходимости облучения лимфоузлов оптимального распределения дозы удалось добиться с использованием 7 статичных полей. План протонного облучения создан с применением 5 полей (рис. 3). В обоих планах облучения 98% от предписанной дозы покрывают 95% объема опухоли миокарда. При этом в случае фотонной терапии не удалось добиться приемлемого покрытия лечебной дозой зоны пораженных лимфоузлов (98% дозы покрывают лишь 80% объема мишени). В то же время при использовании протонов 98% дозы покрывало 94% объема лимфоузлов.
Применение протонной терапии позволило снизить показатель средней дозы на пищевод на 30%, а также уменьшить на 15% объем пищевода, получающий высокую дозу 50 Гр. Помимо этого, удалось добиться существенного снижения лучевой нагрузки на правое легкое.
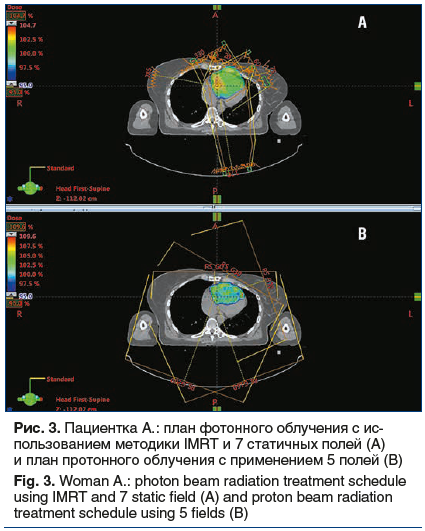
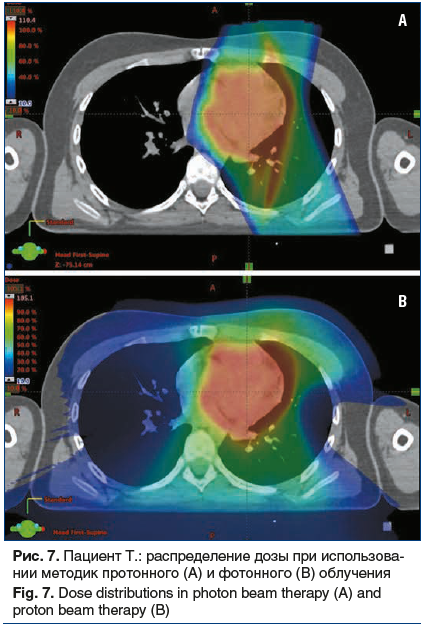
В клиническом наблюдении 2 планирование фотонного облучения выполнено с применением методики VMAT, благодаря чему покрытие мишени близко к идеальному (98% дозы покрывает 98% опухоли). План протонного облучения создан с применением всего двух полей, которые обеспечивают такое же покрытие мишени (рис. 4).
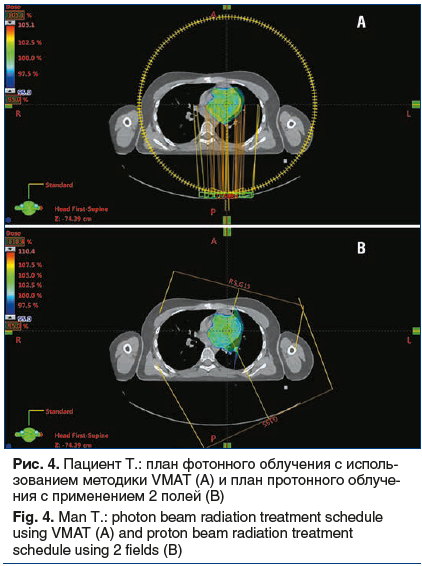
Использование методики VMAT позволяет добиться превосходных показателей покрытия опухоли лечебной дозой и снизить лучевую нагрузку на сердце, но в то же время приводит к увеличению лучевой нагрузки на правое легкое. Применение протонной терапии позволило снизить лучевую нагрузку на миокард, пищевод, левое легкое. Однако основное преимущество протонной терапии в данном клиническом примере заключается в минимальном воздействии на паренхиму правого легкого (величина средней дозы снижена в 15 раз) и на спинной мозг (снижение максимальной дозы в 5 раз) по сравнению с фотонным облучением (рис. 5–7). Это способствует существенному снижению рисков развития пневмонита, эзофагита, лучевого миелита.
Заключение
У пациентов с саркомой сердца лучевая терапия применяется в адъювантном режиме с целью улучшения локального контроля. В основном это пациенты с микроскопическими опухолевыми изменениями в крае резекции. У пациентов с макроскопической опухолью требуется подведение высоких доз излучения (60 Гр и более), что существенно превышает допустимую дозу для миокарда.
Протонная терапия при саркомах сердца позволяет значительно снизить лучевую нагрузку на здоровые ткани при одновременном подведении высоких доз к опухоли, тем самым обеспечивая локальный контроль над заболеванием. Результаты дальнейших сравнительных исследований должны помочь определить группы пациентов, для которых протонная терапия будет иметь решающее значение в улучшении контроля над заболеванием, повышении общей выживаемости и сохранении качества жизни.
Сведения об авторах:
Воробьев Николай Андреевич — к.м.н., заведующий отделением протонной терапии, ООО «ЛДЦ МИБС», 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А; ФГБОУ ВО СПбГУ, 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7/9; ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-6998-5771.
Мартынова Наталия Игоревна — врач-радиотерапевт отделения протонной терапии, ООО «ЛДЦ МИБС», 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А, ORCID iD 0000-0002-1679-5173.
Бондарчук Дмитрий Владимирович — врач-радиолог отделения лучевой диагностики, ООО «ЛДЦ МИБС», 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А, ORCID iD 0000-0001-8752-0591.
Антипин Денис Андреевич — врач-радиотерапевт отделения протонной терапии, ООО «ЛДЦ МИБС», 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А, ORCID iD 0000-0002-4198-3870.
Кубасов Антон Витальевич — медицинский физик, ООО «ЛДЦ МИБС», 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А, ORCID iD 0000-0001-7672-6703.
Михайлов Алексей Валерьевич — к.м.н., заведующий отделением лучевой терапии, ООО «ЛДЦ МИБС», 194354, Россия,
г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А; ФГБОУ ВО СПбГУ, 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7/9; ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-5240-7203.
Любинский Андрей Игоревич — медицинский физик, ООО «ЛДЦ МИБС», 194354, Россия, г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А, ORCID iD 0000-0002-5694-8701.
Андреев Георгий Ильич — руководитель отдела медицинской физики, ООО «ЛДЦ МИБС», 194354, Россия,
г. Санкт-Петербург, ул. Есенина, д. 2, корп. 3, лит. А, ORCID iD 0000-0001-7590-5187.
Контактная информация: Воробьев Николай Андреевич, e-mail: vorobyov@ldc.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 20.02.2020, поступила после рецензирования 02.03.2020, принята в печать 09.03.2020.
2. Hata A., Katakami N., Fujita S. et al. Angiosarcoma arising from right atrium: Remarkable response to concurrent chemoradiotherapy with carboplatin and paclitaxel. J Thorac Oncol. 2011;6:970–971. DOI: 10.1097/JTO.0b013e318215a22b.
3. Franceschini D., Scotti V., Simontacchi G. et al. Application of helical tomotherapy for the treatment of a right atrium angiosarcoma: A case report. Tumori. 2013;99: e233–e236. DOI: 10.1177/030089161309900520.
4. Fehr M., Kuhn M., Mayer K. et al. Metastatic angiosarcoma arising from the right atrium: Unusual presentation and excellent response to treatment in a young patient. J Thorac Oncol. 2010;5:1301–1302. DOI: 10.1097/JTO.0b013e3181dd1c78.
5. Aoka Y., Kamada T., Kawana M. et al. Primary cardiac angiosarcoma treated with carbon-ion radiotherapy. Lancet Oncol. 2004;5:636–638. DOI: 10.1016/S1470-2045 (04) 01600-6.
6. Elsayad K., Lehrich P., Yppaerilae-Wolters H. et al. Primary cardiac angiosarcoma treated with positron emission tomography/magnetic resonance imaging-guided adaptive radiotherapy. Can J Cardiol. 2016;32:829: e7–829.e10. DOI: 10.1016/j.cjca.2015.07.010.
7. Elsayad K., Scobioala S., Kriz J. et al. Advances in image-guided radiation therapy for primary cardiac angiosarcoma: The role of PET-CT and MRI. Oncol Res Treat. 2016;39:290–294. DOI: 10.1159/000445864.
8. Климанов В.А. Радиобиологическое и дозиметрическое планирование лучевой и радионуклидной терапии. Часть 2. Лучевая терапия пучками протонов, ионов, нейтронов и пучками с модулированной интенсивностью, стереотаксис, брахитерапия, радионуклидная терапия, оптимизация, гарантия качества. Учебное пособие. М.: НИЯУ МИФИ; 2011. [Klimanov V.A. Radiobiological and dosimetric planning of radiation and radionuclide therapy. Part 2. Radiation therapy with proton, ion, neutron and modulated-intensity beams, stereotaxis, brachytherapy, radionuclide therapy, optimization, quality assurance. Tutorial. M.: NRNU MEPhI; 2011 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.