Лимфома Беркитта и беременность. Возможности современной медицины
Последние годы ознаменованы увеличением частоты деторождения в возрасте после 30 лет, что ассоциировано с высоким риском для матери и ребенка, а также более частой диагностикой онкологических заболеваний во время беременности, в т. ч. неходжкинских лимфом (НХЛ). Основные данные по НХЛ, связанным с беременностью, ограничены описаниями отдельных клинических ситуаций, что затрудняет выработку тактики терапии лимфомы и ведения беременности на фоне онкогематологического заболевания. В статье представлено клиническое наблюдение редкого сочетания одного из вариантов НХЛ, лимфомы Беркитта, и беременности. На сроке беременности 20 нед. по данным магнитно-резонансной томографии у пациентки были выявлены признаки объемного образования правого яичника. Диагноз установлен на основании данных обследования и результатов биопсии удаленного яичника. Продолженный рост опухоли потребовал проведения химиотерапии. В нашем случае выбор программы химиотерапии R-DA-EPOCH позволил достичь успеха в лечении лимфомы и обеспечил возможность пролонгирования беременности с последующим благоприятным перинатальным исходом.
Ключевые слова: беременность, лимфома Беркитта, неходжкинская лимфома, химиотерапия, ремиссия, аднексэктомия.
Для цитирования: Котомина Т.С., Барях Е.А., Мисюрина Е.Н., Желнова Е.И., Кокоя И.Ю., Грабовский В.М., Лысенко М.А. Лимфома Беркитта и беременность. Возможности современной медицины. РМЖ. Медицинское обозрение. 2020;3(3):211-216. DOI: 10.32364/2618-8430-2020-3-3-211-216.
T.S. Kotomina, E.A. Baryakh, E.N. Misyurina, E.I. Zhelnova, I.Yu. Kokoya, V.M. Grabovskiy, M.A. Lysenko
City Clinical Hospital No. 52, Moscow, Russian Federation
Recent years have seen the increase in the rate of childbirth after the age of 30 years. This is associated with higher risks for a mother and a child as well as higher rate of cancers diagnosed during pregnancy including non-Hodgkin’s lymphoma (NHL). The data on pregnancy-associated NHLs are limited by individual case studies. This makes difficult to develop a therapeutic strategy for lymphoma and pregnancy management in women with hematologic malignancies. The paper addresses the case study of a rare combination of Burkitt’s lymphoma and pregnancy. At 20 weeks of the pregnancy, right ovarian tumor was identified by magnetic resonance imaging. Burkitt’s lymphoma was verified by the biopsy of the excised ovary. Progressive tumor growth required chemotherapy. R-DA-EPOCH chemotherapy program was successful and also allowed for pregnancy prolongation and led to favorable perinatal outcome.
Keywords: pregnancy, Burkitt’s lymphoma, non-Hodgkin’s lymphoma, chemotherapy, remission, adnexectomy.
For citation: Kotomina T.S., Baryakh E.A., Misyurina E.N. et al. Burkitt’s lymphoma and pregnancy. Advantages of today’s medicine. Russian Journal of Woman and Child Health. 2020;3(3):211–216. DOI: 10.32364/2618-8430-2020-3-3-211-216.
Введение
В последние годы жизнь многих женщин в развитых странах претерпела значительные изменения: формирование семьи и рождение ребенка откладывается на более поздний срок, а приоритет отдается профессиональной карьере. Именно поэтому частота деторождения в возрасте после 30 лет значительно увеличилась, что ассоциировано с высоким риском для матери и ребенка, а также более частой диагностикой онкологических заболеваний во время беременности [1].
До сих пор в отечественной клинической практике существует догма, согласно которой выявление онкогематологического заболевания во время беременности требует экстренного ее прерывания [2]. Появление в последние годы новых программ лечения с использованием препаратов, не нарушающих развитие плода, заставляет пересмотреть этот подход [3].
Лимфома является четвертым по распространенности злокачественным новообразованием, диагностируемым во время беременности. При этом лимфома Ходжкина (ЛХ) у беременных встречается чаще, чем неходжкинская лимфома (НХЛ). Встречаемость высокоагрессивных лимфом у беременных значительно выше, чем у небеременных женщин репродуктивного возраста [1]. Вовлечение в патологический процесс репродуктивных органов наблюдается почти у половины беременных с НХЛ [1].
Лимфома Беркитта (ЛБ) относится к редким вариантам НХЛ у взрослых, составляя около 2% от всех лимфом. Ее отличают агрессивное клиническое течение, преимущественно экстранодальная локализация, быстрый рост и высокая химиочувствительность. Мужчины болеют в 2–3 раза чаще, чем женщины. Медиана возраста начала заболевания у взрослых составляет 25–30 лет [4].
Как правило, анамнез заболевания составляет несколько недель. У большинства пациентов клиническая картина настолько выразительна, что позволяет заподозрить ЛБ при первичном осмотре. В большинстве случаев больные поступают в гематологический стационар в тяжелом и крайне тяжелом состоянии, обусловленном большой опухолевой массой, интоксикацией, истощением вплоть до кахексии, электролитными нарушениями. Чаще всего при ЛБ поражаются терминальный отдел тонкой кишки и илеоцекальный отдел толстой кишки, брыжейки, а также желудок, поперечная ободочная, восходящий и нисходящий отделы толстой кишки, брюшина и забрюшинное пространство, печень и селезенка, у женщин часто вовлекаются яичники. Как правило, заболевание проявляется быстрым увеличением живота за счет интенсивного роста опухоли и нарастающего асцита [5].
Гистологически ЛБ представлена диффузной пролиферацией мономорфной популяции лимфоидных клеток, которые тесно прилежат друг к другу («слипчивые»). Форма ядра опухолевых клеток округлая или овальная. В ядре обнаруживаются несколько базофильных нуклеол. В основе характерной картины «звездного неба» («starry sky») лежит способность макрофагов фагоцитировать апоптотические тельца, которые в большом количестве образуются при ЛБ [6].
При иммуногистохимическом исследовании опухолевые клетки sIgM+, экспрессируют В-клеточные антигены (CD19, CD20, CD22, CD79a), BCL-6+, CD10+, при отсутствии BCL2, Т-клеточных маркеров CD3, CD5, CD7 и антигенов клеток-предшественниц CD34, TdT [6]. Происхождение опухолевого субстрата из клеток герминального центра лимфоидного фолликула подтверждается экспрессией CD10 и ВCL-6 [6–8]. Индекс пролиферативной активности Ki67 опухолевых клеток чрезвычайно высок и приближается к 100% [4]. Транслокация t (8;14) (q24; q32) встречается в 80% случаев ЛБ и характеризуется перестройкой локусов генов с-MYC (8q24) и тяжелой цепи иммуноглобулинов Ig (14q32) [9]. Значительно реже выявляют вариантные транслокации, перестройки с-MYC c локусами легких цепей иммуноглобулинов: в 15% случаев определяется транслокация t (8;22) (q34; q11) — перестройка с локусом лямбда-цепи иммуноглобулинов и в 5% случаев — транслокация t (2;8) (p11; q24) — перестройка с локусом каппа-цепи иммуноглобулинов [4, 10].
Несмотря на агрессивное клиническое течение, ЛБ является высококурабельной лимфомой. Интенсивная полихимиотерапия, включающая ритуксимаб и высокие дозы цитарабина и метотрексата, позволяет достичь ремиссии у 80–90% больных, 5-летняя общая выживаемость составляет 70–85% [11–13].
В России НХЛ составляют 2,6% от всех злокачественных опухолей, занимая пятое место среди наиболее часто встречающихся опухолей у женщин (после рака молочной железы, легких, кишечника, прямой кишки и матки) [3]. Сочетание беременности с НХЛ отмечают гораздо реже, чем с ЛХ, что связано с более высокой медианой возраста манифестации заболевания.
С учетом того, что ЛБ встречается преимущественно у мальчиков (мужчин) и относится к редким вариантам НХЛ, представляем первый в России случай ведения и успешного пролонгирования беременности у пациентки с ЛБ.
Клиническое наблюдение
Пациентка П., 39 лет. Обратилась в женскую консультацию в Республике Крым в связи с наступлением самопроизвольной беременности.
Беременность 3-я. Роды предстоят 1-е.
В анамнезе: 1-я беременность (2005 г.) — самопроизвольный выкидыш на сроке гестации 12 нед., abrasio cavi uteri (без осложнений); 2-я беременность (2011 г.) — самопроизвольный выкидыш на сроке гестации 9 нед., abrasio cavi uteri (без осложнений).
Анамнез заболевания: на 6-й нед. настоящей беременности выявлена киста правого яичника. Находилась под наблюдением акушера-гинеколога женской консультации в Республике Крым. С октября в течение 3 мес. похудела на 20 кг. Активно жалоб не предъявляла.
01.12.2016 выполнена магнитно-резонансная томография (МРТ) органов малого таза. Заключение: беременность 20 нед. МР-признаки объемного образования правого яичника (правый яичник в типичном месте не визуализируется). Над маткой справа определяется образование размером 46×31×30 мм, по характеру сигнала сходное с яичником. Рядом с ним определяется, вероятно, исходящее из него, образование размером 174×152×128 мм с четкими, местами бугристыми контурами, интимно прилежит и умеренно компримирует верхнюю стенку матки. В паховых областях визуализируются увеличенные лимфоузлы: справа до 18 мм, слева до 14 мм. В позадиматочном пространстве и в брюшной полости определяется свободная жидкость, больше справа.
Учитывая данные МРТ, с целью дообследования и решения вопроса о дальнейшей тактике ведения пациентка была направлена в г. Москву и 09.12.2016 госпитализирована в один из стационаров г. Москвы. По результатам МРТ органов малого таза от 09.12.2016: МР-картина объемного образования, по-видимому, исходящего из правого яичника. Асцит.
20.12.2016 выполнены лапаротомия, аднексэктомия справа, множественная биопсия брюшины, субтотальная оментэктомия.
Результаты гистологического исследования удаленной опухоли от 20.12.2016: опухоль представлена диффузным инфильтратом мономорфных клеток с эозинофильной цитоплазмой, крупным ядром с 2–3 ядрышками, высокой митотической активностью и диффузно расположенными в опухоли макрофагами (картина «звездного неба»). Заключение: диффузная крупноклеточная лимфома яичника, вероятно, ЛБ.
Иммуногистохимическое исследование опухоли яичника от 20.12.2016: CD45, CD79a — выраженная цитоплазматическая экспрессия в 100% опухолевых клеток; Vimentin — выраженная экспрессия в опухолевой строме. Inhibin alpha, S100, Keratin Pan — экспрессия отсутствует.
FISH-исследование опухоли яичника от 20.12.2016: выявлена транслокация t (8;14) (q24; q32), перестройки генов BCL2 и BCL6 не обнаружено.
Для дообследования, лечения и определения дальнейшей тактики ведения 30.12.2016 пациентка переведена в ГБУЗ «ГКБ № 52 ДЗМ». На момент поступления присутствовали симптомы интоксикации, снижение массы тела на фоне беременности на 20 кг, ночная потливость.
МРТ брюшной полости и малого таза от 30.12.2016: в трех взаимоперпендикулярных плоскостях в режимах Т1, Т2 и с жироподавлением, в режиме диффузионно-взвешенного изображения, без внутривенного контрастирования: печень увеличена в размерах — 123 мм (сагиттальный переднезадний размер на уровне правой доли) × 82 мм (переднезадний размер левой доли) × 230 мм (фронтальный размер) × 160 мм (вертикальный размер правой доли), имеет ровные и четкие контуры, сигнальные характеристики паренхимы не изменены. Внутрипеченочные желчные протоки не расширены. Очаговых изменений паренхимы при нативном исследовании не выявлено. Желчный пузырь размером 70×32 мм, с неоднородным жидкостным содержимым (за счет седиментации желчи). Холедох расширен до 5,5 мм, конкременты в желчном пузыре и протоках достоверно не визуализируются. В месте операционных манипуляций слева рубцовые изменения с небольшим отеком подкожной жировой клетчатки. По передней брюшной стенке уплотнение мягких тканей, послеоперационные изменения. Поджелудочная железа не увеличена — 22×19×22 мм, структура неоднородна за счет мелких жировых включений, контуры железы четкие, мелкобугристые. Дополнительные образования в проекции поджелудочной железы не определяются. Вирсунгов проток не расширен, его диаметр до 2,5 мм, визуализируется на всем протяжении, не деформирован. Парапанкреатическая клетчатка без достоверных признаков воспаления и инфильтрации. Размеры селезенки 116×46×98 мм (сагиттальный × фронтальный × вертикальный), контуры ее четкие, ровные. Структура однородная. Правый и левый надпочечники без особенностей. Почки типично расположены, имеют размеры: правая — 108×58×56 мм, левая — 119×53×58 мм, паренхима не истончена, очаговых изменений в паренхиме не выявлено. Чашечно-лоханочная система не расширена, не деформирована. Лимфатические узлы не увеличены, количество мезентериальных лимфоузлов не увеличено. Свободная жидкость в брюшной полости и забрюшинном пространстве не выявлена. В проекции малого таза повышенное количество свободной жидкости не определяется. Прямая кишка без видимых изменений, утолщения стенок и новообразований не выявлено. Мочевой пузырь умеренно заполнен, стенки мочевого пузыря полностью не расправлены, без участков измененного сигнала, в т. ч. на диффузионно-взвешенных изображениях. Содержимое жидкостное, конкрементов не выявлено. Паравезикальная клетчатка без особенностей.
Беременность 24–25 нед. В полости матки визуализируется один плод. Количество вод умеренное. Плацента по передней стенке в области дна. Справа к матке прилежит широким радиусом (в проекции правого яичника) солидное образование с четкими крупнобугристыми контурами негомогенной структуры, преимущественно гипоинтенсивное в режимах Т2, Т1 и жироподавления, с высоким сигналом на изотропной серии диффузионно-взвешенного изображения — с размерами 46×21×48 мм (переднезадний × билатеральный × вертикальный). Левый яичник
размером 38×21×30 мм, содержит немногочисленные фолликулы размером до 7,5×3,0 мм, в остальном структура без особенностей, участков ограничения диффузии в режиме диффузионно-взвешенного изображения не выявлено. Контуры яичника четкие, ровные, скопление жидкости вокруг не определяется. Лимфатические узлы не увеличены: размеры подвздошных до 4–5 мм, паховых справа — до 11×5 мм, паховых слева — 8×12 мм. Дифференцировка их не нарушена. Костно-деструктивных изменений не выявлено. Заключение: МР-картина объемного образования справа (в проекции правого яичника). Беременность 24–25 нед. Картина нерезко выраженной гепатоспленомегалии, застойного желчного пузыря, диффузных изменений поджелудочной железы (рис. 1).
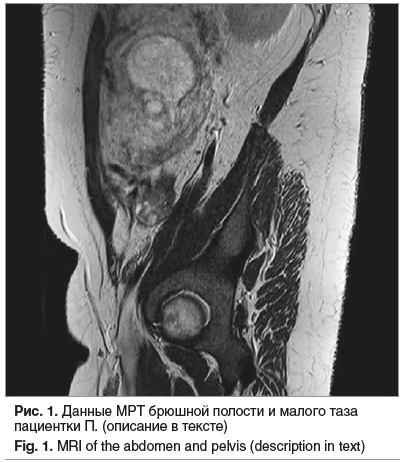
Миелограмма от 31.12.2016: бласты 0,8%, лимфоциты 6%. В ликворе от 31.12.2016 цитоз составил 2/3.
По данным УЗИ и допплерометрического исследования плода от 09.01.2016: беременность 26–27 нед. Тазовое предлежание. Показатели кровотока в норме.
На основании жалоб, данных анамнеза, результатов лабораторно-инструментальных исследований уставлен диагноз.
Основное заболевание. Лимфома Беркитта, III стадия по S.B. Murphy c поражением правого яичника (bulky), асцит. Состояние после лапаротомии, правосторонней аднексэктомии, множественной биопсии брюшины, субтотальной оментэктомии (20.12.2016). Продолженный рост опухоли. Беременность 27 нед.
С циторедуктивной целью с 31.12.2016 по 04.01.2017 проведена предфаза (циклофосфамид 400 мг, дексаметазон 20 мг).
С 05.01.2017 начата химиотерапия по программе R-DA-EPOCH (ритуксимаб — этопозид — преднизолон — винкристин — циклофосфан — доксорубицин) с интратекальным введением цитостатиков (профилактика нейролейкемии). После двух курсов по данным МРТ опухоль не определялась. Констатирована ремиссия заболевания. Проведен 3-й курс по программе R-DA-EPOCH.
Каждый межкурсовой период пациентка наблюдалась в отделении патологии беременности родильного дома ГКБ № 52. На сроке гестации 29–30 нед. течение беременности осложнилось развитием гестационной артериальной гипертензии. У беременной отмечали повышение артериального давления до 140/90–150/90 мм рт. ст., в анализах — умеренную протеинурию. На фоне гипотензивной терапии удалось достичь стабилизации гемодинамики, протеинурия сохранялась на одном уровне (суточная потеря белка менее 0,3 г/л, в общем анализе мочи протеинурия не превышала 0,3 г/л).
27.02.2017 при очередной госпитализации в межкурсовом периоде при допплерометрии выявлены нарушения маточно-плацентарного кровотока 3-й степени с нулевым диастолическим кровотоком. Учитывая декомпенсацию плацентарной недостаточности, критические нарушения кровотока у первородящей в возрасте 39 лет с отягощенным акушерско-гинекологическим и соматическим анамнезом, было решено родоразрешить беременную путем операции кесарева сечения в экстренном порядке в интересах плода.
27.02.2017 выполнена нижнесрединная лапаротомия, кесарево сечение в нижнем маточном сегменте поперечным разрезом под спинально-эпидуральной анестезией. Извлечена живая недоношенная девочка с массой тела 1930 г, длиной 46 см, с оценкой по шкале Апгар 6/6 баллов. Операция выполнена без технических сложностей. Ранний послеоперационный период протекал без осложнений.
С 02.03.2017 течение позднего послеродового периода осложнилось развитием миелотоксического агранулоцитоза после проведенного курса химиотерапии. 05.03.2017 отмечен вираж температуры до 38,1 °C без видимых очагов инфекции. В связи с развившимся осложнением родильница была переведена в отделение гематологии.
Данные мультиспиральной компьютерной томографии шеи, органов грудной и брюшной полости, малого таза от 09.03.2017: аксиллярные, медиастинальные лимфоузлы не увеличены, жидкости в плевральных полостях нет. Легочная паренхима без очаговых изменений. Мезентериальные, забрюшинные лимфоузлы не увеличены. Отмечен единичный лимфоузел в левой паховой области размером 23×8 мм. Селезенка обычных формы и размеров (вертикальный размер 81 мм), с четкими ровными контурами, структура и плотность паренхимы при нативном исследовании не изменены. Печень не увеличена, плотность паренхимы 47 HU, очагов патологической плотности при нативном исследовании не выявлено. В паренхиматозных органах, межкишечных пространствах объемных образований не обнаружено. Заключение: КТ-данных за лимфаденопатию не получено. Очаговых патологических изменений органов грудной клетки, брюшной полости и забрюшинного пространства, полости малого таза не выявлено. Таким образом, сохранялась ремиссия ЛБ.
С целью купирования нейтропенической лихорадки проводилась антибактериальная терапия пиперациллином, тазобактамом и амикацином внутривенно, на фоне терапии отмечены восстановление показателей крови, нормализация температуры тела.
С 16.03.2017 по 17.05.2017 проведено еще 3 курса полихимиотерапии по программе R-DA-EPOCH. По результатам позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ), после 6 курсов полихимиотерапии у больной получен полный метаболический ответ.
В последующем пациентка со здоровой новорожденной, которая благополучно была выписана со второго этапа выхаживания, отбыла к месту постоянного проживания.
В течение последующих двух лет пациентка находилась под наблюдением гематологов ГБУЗ «ГКБ № 52 ДЗМ»: каждые полгода проводилось КТ-исследование с контрастированием, оценивался клинический статус. Последнее контрольное обследование (ПЭТ-КТ) проведено 12.03.2019: у пациентки сохраняется ремиссия ЛБ. С учетом отсутствия при ЛБ поздних рецидивов заболевания (все события возникают в течение первого года после завершения лечения) можно говорить о выздоровлении пациентки [14].
Обсуждение
К 2009 г. в литературе описан 101 случай сочетания НХЛ и беременности [3]. К 2013 г. в зарубежной литературе было представлено 74 работы с описанием 121 клинического наблюдения [15]. При этом в последние десятилетия отмечается рост заболеваемости НХЛ, что делает данную проблему актуальной [16–18]. Наиболее часто на фоне беременности среди НХЛ выявляют первичную медиастинальную В-клеточную лимфому [16].
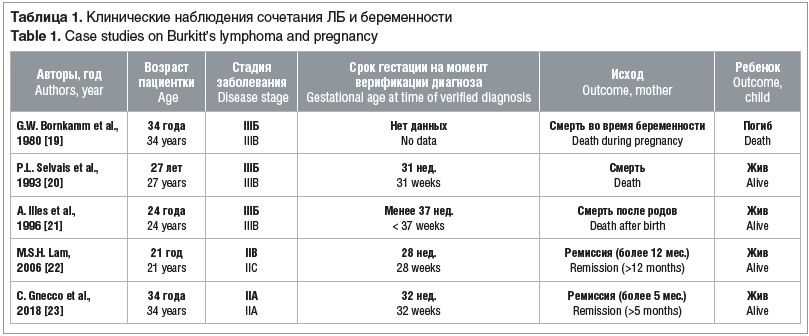
Основные данные по НХЛ, связанной с беременностью, ограничены отчетами об отдельных случаях, что затрудняет выработку тактики терапии лимфомы и ведения беременности на фоне онкогематологического заболевания [15]. Сочетание ЛБ и беременности встречается еще реже, в мире описаны единичные подобные случаи, некоторые из них представлены в таблице 1.
Для дальнейшей характеристики патофизиологических и клинических аспектов этого заболевания, осложняющего течение беременности, необходимы совместные проспективные исследования [15].
Ведение беременности в РФ в настоящее время проводится в соответствии с приказом № 736 Минздравсоцразвития России от 03.12.2007 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности». Прерывание беременности до 12 нед. показано пациенткам в следующих случаях: лимфомы из групп высокого риска (фолликулярная НХЛ, диффузная НХЛ, периферические и кожные Т-клеточные лимфомы, другие и неуточненные типы НХЛ, злокачественные иммунопролиферативные болезни, множественная миелома), лимфогранулематоз III–IV стадии. Во II и III триместрах вопрос о прерывании беременности решается в каждом отдельном случае консилиумом с участием гематолога, онколога, акушера-гинекола, неонатолога, терапевта и, конечно, матери будущего ребенка и ее родственников.
Стандартом лечения ЛБ являются протоколы, включающие высокие дозы метотрексата и цитарабина: R-Hyper-CVAD, R-CODOX–M/IVAC, NHL-BFM. Однако из-за способности проникать через гематоплацентарный барьер их нельзя использовать при беременности. Программа R-DA-EPOCH внесена в российские национальные клинические рекомендации как протокол для пациентов, которым по тяжести состояния невозможно провести более интенсивную химиотерапию. В нашем случае выбор данной программы химиотерапии позволил достичь ремиссии и обеспечил возможность пролонгирования беременности.
Заключение
Представленное клиническое наблюдение демонстрирует редкое сочетание ЛБ и беременности, возможность успешного лечения лимфомы, пролонгирования беременности и принятия адекватного решения в интересах матери и плода. Беременность во II и III триместрах не является противопоказанием к проведению полихимиотерапии.
Мы продемонстрировали один из вариантов ведения пациенток с НХЛ и беременностью. За этим простым на первый взгляд описанием скрывается работа огромного коллектива современной многопрофильной больницы крупного города.
Если конец ХХ и начало ХХI в. можно рассматривать как расцвет эпохи перинатального акушерства, то в настоящее время наблюдается мультидисциплинарный подход в акушерстве, позволяющий испытать радость материнства практически любой женщине.
Сведения об авторах:
Котомина Татьяна Сергеевна — к.м.н., заведующая родильным отделением филиала, ГБУЗ «ГКБ № 52 ДЗМ», 123182, Россия, г. Москва, ул. Сосновая, д. 11, ORCID iD 0000-0002-5660-2380.
Барях Елена Александровна — д.м.н., заведующая отделением гематологии и химиотерапии, ГБУЗ «ГКБ № 52 ДЗМ», 123182, Россия, г. Москва, ул. Пехотная, д. 3, ORCID iD 0000-0001-6880-9269.
Мисюрина Елена Николаевна — к.м.н., руководитель гематологической службы ГБУЗ «ГКБ № 52 ДЗМ», 123182, Россия, г. Москва, ул. Пехотная, д. 3, ORCID iD 0000-0003-2419-4850.
Желнова Евгения Ивановна — к.м.н., заведующая отделением гематологии и высокодозной химиотерапии, ГБУЗ «ГКБ № 52 ДЗМ», 123182, Россия, г. Москва, ул. Пехотная, д. 3, ORCID iD 0000-0002-0343-9348.
Кокая Инга Юрьевна — к.м.н., заведующая родильным домом, филиал ГБУЗ «ГКБ № 52 ДЗМ», 123182, Россия, г. Москва, ул. Сосновая, д. 11, ORCID iD 0000-0002-0637-1537.
Грабовский Василий Михайлович — заместитель главного врача по акушерско-гинекологической помощи, ГБУЗ «ГКБ № 52 ДЗМ», 123182, Россия, г. Москва, ул. Сосновая, д. 11, ORCID iD 0000-0002-7048-4827.
Лысенко Марьяна Анатольевна — д.м.н., главный врач, ГБУЗ «ГКБ № 52 ДЗМ», 123182, Россия, г. Москва, ул. Пехотная, д. 3, ORCID iD 0000-0001-6010-7975.
Контактная информация: Котомина Татьяна Сергеевна, e-mail: tatakotomina@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.01.2020, поступила после рецензирования 06.02.2020, принята в печать 20.02.2020.
About the authors:
Tat’yana S. Kotomina — Cand. of Sci. (Med.), Head of the Maternity Department, Branch of the City Clinical Hospital No. 52, 11, Sosnovaya str., Moscow, 123182, Russian Federation, ORCID iD 0000-0002-5660-2380.
Elena A. Baryakh — Doct. of Sci. (Med.), Head of the Department of Hematology and Chemotherapy, City Clinical Hospital No. 52, 3, Pekhotnaya str., Moscow, 123182, Russian Federation, ORCID iD 0000-0001-6880-9269.
Elena N. Misyurina — Cand. of Sci. (Med.), Head of the Hematological Service, City Clinical Hospital No. 52, 3, Pekhotnaya str., Moscow, 123182, Russian Federation, ORCID iD 0000-0003-2419-4850.
Evgeniya I. Zhelnova — Cand. of Sci. (Med.), Head of the Department of Hematology and High-Dose Chemotherapy, City Clinical Hospital No. 52, 3, Pekhotnaya str., Moscow, 123182, Russian Federation, ORCID iD 0000-0002-0343-9348.
Inga Yu. Kokaya — Cand. of Sci. (Med.), Head of the Maternity Department, Branch of the City Clinical Hospital No. 52, 11, Sosnovaya str., Moscow, 123182, Russian Federation, ORCID iD 0000-0002-0637-1537.
Vasiliy M. Grabovskiy — Deputy Head Doctor for Obstetrical Gynecological Service, Branch of the City Clinical Hospital No. 52, 11, Sosnovaya str., Moscow, 123182, Russian Federation, ORCID iD 0000-0002-7048-4827.
Mar’yana A. Lysenko — Doct. of Sci. (Med.), Head Doctor, City Clinical Hospital No. 52, 3, Pekhotnaya str., Moscow, 123182, Russian Federation, ORCID iD 0000-0001-6010-7975.
Contact information: Tat’yana S. Kotomina, e-mail: tatakotomina@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.01.2020, revised 06.02.2020, accepted 20.02.2020.
2. Скрябина Л.С., Россоха Е.И., Лазарева Д.Г. и др. Лимфома Ходжкина и беременность. Российский онкологический журнал. 2015;4:43–45.
3. Шмаков Р.Г., Демина Е.А., Комова Т.Д., Пилова И.В. Тактика ведения беременности у женщин с онкогематологическими заболеваниями (часть 1. Лимфопролиферативные заболевания). Клиническая онкогематология. 2009;2(1):32–37.
4. Swerdlow S.H., Campo E., Stefano A., Pileri S.A. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127(20);2375–2390. DOI: 10.1182/blood-2016-01-643569.
5. Барях Е.А. Диагностика и лечение лимфомы Беркитта: дисс. … канд. мед. наук. М.; 2007.
6. Ковригина А.М., Пробатова Н.А. Лимфома Ходжкина и крупноклеточные лимфомы. М.: Медицинское информационное агентство; 2007.
7. Луговская С.А., Почтарь М.Е., Тупицын Н.Н. Иммунофенотипирование в диагностике гемобластозов. М.; 2005.
8. Тупицын Н.Н., Шолохова Е.Н., Андреева Л.Ю. и др. Иммунодиагностика лимфом. Современная онкология. Экстравыпуск. 2002;4–12.
9. Croce C. Role of chromosome translocations in human neoplasia. Cell. 1987;49(2):155–156. DOI: 10.1016/0092-8674 (87) 90552-6.
10. Showe L.C., Moore R.C., Erikson J. et al. MYC oncogene involved in a t (8;22) chromosome translocation is not altered in it, s putative regulatory regions. Proc Natl Acad Sci USA. 1987;84(9):2824–2828. DOI: 10.1073/pnas.84.9.2824.
11. Thomas D.A., Faderl S.H., O’Brien S.M. et al. Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia. Cancer. 2006;106(7):1569–1580. DOI: 10.1002/cncr.21776.
12. Hoelzer D., Walewski J., Döhner H. et al. Improved outcome of adult Burkitt lymphoma/leukemia with rituximab and chemotherapy: report of a large prospective multicenter trial. Blood. 2014;124(26):3870–3879. DOI: 10.1182/blood-2014-03-563627.
13. Барях Е.А., Тюрина Н.Г., Воробьев В.И. и др. Двенадцатилетний опыт терапии лимфомы Беркитта по протоколу ЛБ-М-04. Терапевтический архив. 2015;87(7):4–14. DOI: 10.17116/terarkh20158774-14.
14. Барях Е.А. Диагностика и лечение агрессивных В-клеточных лимфом: автореф. дисс. … д-ра мед. наук. М.; 2019.
15. Horowitz N.A., Benyamini N., Wohlfart K. еt al. Reproductive organ involvement in non-Hodgkin lymphoma during pregnancy: a systematic review. Lancet Oncol. 2013;14(7):275–282. DOI: 10.1016/S1470-2045 (12) 70589-2.
16. Мангасарова Я.К., Барях Е.А., Воробьев В.И. и др. Первичная медиастинальная В-крупноклеточная лимфома у беременных. Терапевтический архив. 2014;7:53–58.
17. El-Messidi A., Patenaude V., Abenhaim H.A. Incidence and outcomes of women with non-Hodgkin’s lymphoma in pregnancy: a population-based study on 7.9 million births. J Obstet Gynaecol Res. 2015;41(4):582–589. DOI: 10.1111/jog.12597.
18. Chen G., Crispin P., Cherian M. et al. Placental involvement by non-Hodgkin lymphoma in a Crohn disease patient on long-term thiopurine therapy. Intern Med J. 2016;46(1):102–105. DOI: 10.1111/imj.12957.
19. Bornkamm G.W., Kaduk B., Kachel G. et al. Epstein-Barr virus-positive Burkitt’s lymphoma in a German woman during pregnancy. Blut. 1980;40(3):167–177. DOI: 10.1007/BF01008574.
20. Selvais P.L., Mazy G., Gosseye S. et al. Breast infiltration by acute lymphoblastic leukemia during pregnancy. Am J Obstet Gynecol. 1993 Dec;169 (6):1619–1620. DOI: 10.1016/0002-9378 (93) 90449-s.
21. Illés A., Bányai A., Jenei K. et al. Bilateral primary lymphoma of the breasts detected in pregnancy. Orv Hetil. 1996;137(24):1315–1317. PMID: 8927329.
22. Masha S.H. Lam. Treatment of Burkitt’s lymphoma during pregnancy. Ann Pharmacother. 2006;40(11):2048–2052. DOI: 10.1345/aph.1H289.
23. Gnecco C., Carlan S.J., McWhorter J. Burkitt’s lymphoma with placental invasion diagnosed at cesarean delivery: a case report. J Med Case Rep. 2018;12(1):30. DOI: 10.1186/s13256-017-1548-0.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

