Клиническое наблюдение применения перорального винорелбина при лечении диссеминированного эстроген-рецептор-позитивного, HER2-негативного рака молочной железы
DOI: 10.32364/2587-6821-2021-5-8-548-551
Люминальный В, HER2-негативный рак молочной железы (РМЖ) является наиболее распространенным вариантом РМЖ. Последовательное назначение линий гормонотерапии при диссеминированном эстроген-рецептор-позитивном, HER2-негативном РМЖ позволяет рассматривать данный вариант опухоли как хроническое заболевание с длительным периодом пероральной терапии. Проведение пероральной химиотерапии позволяет улучшить качество жизни пациенток, при этом обеспечить высокую эффективность проводимого лечения. При наличии стандарта проведения первых линий гормонотерапии оптимальный режим химиотерапии 1-й линии не установлен и определяется в каждом случае индивидуально. Авторы отмечают, что следует учитывать ожидаемую токсичность терапии и токсичность предшествующего лечения, а также готовность пациентки посещать клинику для внутривенных инфузий. В статье представлено клиническое наблюдение пациентки, страдающей диссеминированным эстроген-рецептор-позитивным, HER2-негативным РМЖ. В данном клиническом наблюдении показано, как при рациональном применении режимов гормонотерапии, а также пероральной химиотерапии возможно максимально отложить момент назначения внутривенной химиотерапии, тем самым улучшить качество жизни пациентки. В условиях пандемии COVID-19, предполагающих ограничение посещения лечебных учреждений, пероральная химиотерапия может рассматриваться как терапия выбора для таких пациенток.
Ключевые слова: химиотерапия, рак молочной железы, токсичность, винорелбин, эстроген-рецептор-позитивный рак, HER2-негативный рак.
Для цитирования: Глазкова Е.В., Стенина М.Б. Клиническое наблюдение применения перорального винорелбина при лечении диссеминированного эстроген-рецептор-позитивного, HER2-негативного рака молочной железы. РМЖ. Медицинское обозрение. 2021;5(8):548-551. DOI: 10.32364/2587-6821-2021-5-8-548-551.
E.V. Glazkova, M.B. Stenina
N.N. Blokhin National Medical Research Center of Oncology, Moscow, Russian Federation
Luminal B (HER2-negative) breast cancer is considered the most common type. The consistent prescription of hormone therapy lines for disseminated estrogen receptor-positive (ER+) HER2-negative breast cancer allows us to consider this variant of the tumor as a chronic disease with long-term oral therapy. Oral chemotherapy can improve the life quality of patients while ensuring the high efficiency of the treatment. If there is a standard for the first lines of hormone therapy, the optimal chemotherapy regimen of line 1 is not established and is determined individually in each case. The authors note that it is necessary to rely on the expected toxicity of therapy and the toxicity of previous treatment, as well as take into account the patient’s willingness to visit the clinic for intravenous infusions. The article presents a clinical case concerning a patient suffering from disseminated ER+ HER2-negative breast cancer. This clinical case shows how it is possible to p ostpone the prescription of intravenous chemotherapy as much as possible (with the rational use of hormone therapy regimens, as well as oral chemotherapy), thereby improving the patient’s life quality. In the context of the COVID-19 pandemic, which involves limiting visits to medical institutions, oral chemotherapy can be considered as the therapy of choice for such patients.
Keywords: chemotherapy, breast cancer, toxicity, vinorelbin, estrogen receptor-positive cancer, HER2-negative cancer.
For citation: Glazkova E.V., Stenina M.B. Clinical case on the use of oral vinorelbine in the treatment of disseminated estrogen receptor-positive HER2-negative breast cancer. Russian Medical Inquiry. 2021;5(8):548–551 (in Russ.). DOI: 10.32364/2587-6821-2021-5-8-548-551.
Введение
Лекарственное лечение диссеминированного эстроген-рецептор-позитивного (РЭ+), HER2-негативного рака молочной железы (РМЖ) на сегодняшний день представляет собой концепцию терапии хронической болезни. Основными целями проведения лекарственной терапии являются контроль над симптомами заболевания, а также обеспечение наиболее высокого качества жизни пациентки. Для данной категории пациенток на первом этапе терапии наиболее рациональным подходом является проведение последовательных линий гормонотерапии. При этом стандартом 1-й линии терапии являются комбинации, включающие ингибиторы циклин-зависимых киназ (CDK) 4 и 6 [1]. Последующие линии гормонотерапии могут включать эверолимус, а также алпелисиб для пациенток с мутацией PIK3CA [2, 3].
В отдельную группу РЭ+, HER2-негативного РМЖ могут быть выделены пациентки с герминальными мутациями BRCA1/2. Для данной группы больных эффективной опцией лечения после исчерпания резервов гормонотерапии является проведение терапии ингибиторами поли(АДФ-рибоза)-полимераз (PARP). Олапариб и талазопариб обладают сходным профилем токсичности — наиболее частым видом гематологической токсичности является анемия, которая в 30% случаев достигает 3-й степени [4, 5].
Для пациенток, которым ранее была проведена химиотерапия с включением таксанов и антрациклинов, в том числе в адъювантном режиме, на сегодняшний день нет «золотого стандарта» химиотерапии 1-й линии. Согласно рекомендациям Европейского общества медицинской онкологии (European Society for Medical Oncology) возможно проведение монохимиотерапии одним из следующих лекарственных препаратов: винорелбин, капецитабин, эрибулин, гемцитабин. При длительном интервале после проведения терапии таксанами возможен возврат к данной группе препаратов [1]. Применение комбинированных режимов при лечении диссеминированного РЭ+, HER2-негативного РМЖ не продемонстрировало значимого увеличения показателей выживаемости, но оказалось значительно более токсичным, чем проведение монохимиотерапии [6]. Комбинированная терапия может быть рассмотрена только в клинической ситуации, когда необходимо достижение быстрого объективного ответа и применяется преимущественно при тройном негативном варианте РМЖ.
Проведение пероральной химиотерапии позволяет улучшить качество жизни пациенток, при этом обеспечить высокую эффективность проводимого лечения. Применение перорального винорелбина в качестве 1-й линии химиотерапии у пациенток с невисцеральной распространенностью РЭ+, HER2-негативного РМЖ после исчерпания резервов гормонотерапии позволяет достигнуть длительной стабилизации заболевания (более 24 нед.) у 51% пациенток. При этом медиана длительности лечения пероральным винорелбином составила 5,8 мес., медиана выживаемости без прогрессирования — 8,2 мес. (95% доверительный интервал (ДИ) 5,5–9,8 мес.), а средняя продолжительность клинической эффективности — 10,9 мес. (95% ДИ 8,6–14,7 мес.). Наиболее частым нежелательным явлением 3-й и 4-й степени являлась нейтропения, которая развивалась у 38% пациенток, при этом не было зафиксировано ни одного случая фебрильной нейтропении. В спектре негематологической токсичности наиболее часто отмечено развитие артралгии 3-й степени [7]. Кроме того, применение цитостатических агентов в пероральной форме имеет значительные преимущества в отношении удобства их использования и возможности назначения в более широкой амбулаторной практике. По данным опроса пациенток было продемонстрировано, что большинство отдают предпочтение пероральной терапии по сравнению с внутривенными препаратами, при условии абсолютной эквивалентности эффективности лечения [8].
Обзор данных более 2000 пациенток, пролеченных антрациклинами и таксанами и получавших монотерапию капецитабином или винорелбином, показал эффективность этих химиотерапевтических препаратов, которые обеспечивают средние показатели контроля заболевания (общий ответ плюс стабилизация) примерно 55% и 50% соответственно [9]. Сравнительное проспективное рандомизированное исследование 2 фазы также показало сопоставимую эффективность этих лекарственных средств (табл. 1) [10].
![Таблица 1. Показатели эффективности и токсичности химиотерапии у пациентов предлеченных антрациклинами и таксанами [10] Table 1. Indicators of chemotherapy efficacy and toxicity in patients who were previously treated with anthracyclines and taxanes [10] Таблица 1. Показатели эффективности и токсичности химиотерапии у пациентов предлеченных антрациклинами и таксанами [10] Table 1. Indicators of chemotherapy efficacy and toxicity in patients who were previously treated with anthracyclines and taxanes [10]](/upload/medialibrary/f45/548-1.png)
Клиническое наблюдение
Пациентка К., 37 лет. В мае 2005 г. обнаружила узловое образование в левой молочной железе. По данным УЗИ — узловое образование 18×16 мм. 10.11.2005 выполнена секторальная резекция левой молочной железы, по данным планового гистологического исследования — «инвазивная аденокарцинома неспецифического типа II стадии злокачественности». 12.11.2005 была выполнена радикальная подкожная мастэктомия слева с одномоментной реконструкцией имплантатом. При гистологическом исследовании — в проекции рубца в ткани молочной железы — микрофокус рака, в 2 из 11 лимфатических узлов метастазы РМЖ с признаками экстранодальной инвазии. С 31.01.2006 по 10.05.2006 проведено 5 курсов адъювантной химиотерапии по схеме CAF. Далее проведена адъювантная дистанционная лучевая терапия (ДЛТ) на область левой молочной железы и зоны регионарного лимфооттока. Адъювантная гормонотерапия тамоксифеном 20 мг/сут на фоне овариальной супрессии гозерелином 3,6 мг 1 раз в 28 дней завершена в 2011 г. В марте 2015 г. пациентка отметила появление периодических болей в проекции грудины, а также болей в области крестца, связанных с движением. По данным ПЭТ-КТ от 27.04.2015 выявлено повышение специфической метаболической активности в области мягких тканей передней грудной стенки слева, в теле грудины, а также в теле S1 c переходом на боковые массы крестца.
18.04.2015 выполнено иссечение внутрикожного метастаза в проекции послеоперационного рубца. При гистологическом исследовании — инвазивная аденокарцинома неспецифического типа, РЭ 6б, РП 8б, HER2/neu — 0, Ki67 — 20%. C 08.05.2016 начато проведение гормонотерапии 1-й линии тамоксифеном 20 мг/сут, терапия золедроновой кислотой 4 мг 1 раз в 28 дней. С 17.06.2015 по 30.06.2015 проведена паллиативная ДЛТ на область крестца РОД 3 Гр, СОД 30 Гр. При обследовании в августе 2015 г. выявлена стабилизация очагов в костях. Продолжена терапия тамоксифеном и золедроновой кислотой.
При обследовании в апреле 2016 г. выявлена стабилизация очагов в костях, прогрессирование за счет появления очага в С7 печени до 10 мм и в С4 17×12 мм. С апреля 2016 г. начата овариальная супрессия гозерелином 3,6 мг п/к 1 раз в 28 дней, с мая 2016 г. к терапии добавлен летрозол 2,5 мг/сут; продолжена терапия золедроновой кислотой. При обследовании в июле 2016 г. — рост очага в С7 печени до 15 мм, в С4 — до 28×14 мм, появление нового очага в С4 до 3 мм. С учетом отсутствия у пациентки жалоб, а также отсутствия отклонений биохимического анализа крови продолжено проведение гормонотерапии 2-й линии ингибиторами ароматазы. По данным УЗИ в сентябре 2016 г. уменьшение размеров очагов в печени: в С7 до 9 мм, в С4 до 20×10 мм; продолжено проведение гормонотерапии 2-й линии.
В июле 2017 г. отмечено прогрессирование в виде увеличения размеров метастатического очага в С7 печени до 32×18 мм. Стабилизация метастатических очагов в костях. С июля 2017 г. начато проведение гормонотерапии 3-й линии фулвестрантом 500 мг в/м 1, 15, 28-й дни, затем 1 раз в 28 дней, с сентября 2017 г. к терапии добавлен палбоциклиб 125 мг/сут внутрь в 1–21-й дни 28-дневного цикла. На фоне терапии палбоциклибом отмечалось развитие дозолимитирующей нейропении, что потребовало редукции дозы до 100 мг/сут с 3-го курса терапии. По данным контрольного обследования в декабре 2017 г. — стабилизация очагов в печени и костях.
При контрольном обследовании в мае 2018 г. выявлены новые очаги в печени. В биохимическом анализе крови повышение активности трансаминаз до 2 норм. С целью достижения стойкой овариальной супрессии 22.06.2018 выполнена двусторонняя лапароскопическая овариэктомия. С июня 2018 г. начато проведение гормонотерапии 4-й линии по схеме: эксеместан 25 мг/сут + эверолимус 10 мг/сут ежедневно. По данным контрольного обследования в сентябре 2018 г. — стабилизация. В декабре 2018 г. отмечено появление опухоль-ассоциированной лихорадки, по данным контрольного обследования — рост очагов в печени, наибольший очаг в S5 до 56 мм.
С декабря 2018 г. начато проведение химиотерапии капецитабином 2000 мг/м2 площади поверхности тела внутрь в 1–14-й дни 21-дневного цикла. При контрольном обследовании в марте 2019 г. отмечена частичная регрессия очагов в печени. Токсичность терапии — ладонно-подошвенный синдром 3-й степени, в связи с чем с 5-го курса проведена редукция дозы капецитабина на 1 дозовый уровень (на 25%). На фоне терапии капецитабином отмечена стабилизация очагов в печени, последующая редукция дозы (до 1500 мг/м2 площади поверхности тела) в связи с ладонно-подошвенным синдромом 3-й степени проведена с 10-го курса терапии. Прогрессирование в марте 2020 г. — увеличение размеров очагов в печени. В биохимическом анализе крови отметили повышение активности трансаминаз до 3 норм. Выполнена core-биопсия очага в правой доле печени, по данным иммуногистохимического исследования — РЭ 7б, РП 5б, HER2/neu — 0, Ki67 — 40%, выявлена мутация PIK3CA.
C марта 2020 г. начата терапия пероральным винорелбином 60 мг/м2 площади поверхности тела в 1, 8, 15-й дни. В связи с удовлетворительной переносимостью со 2-го курса терапии доза винорелбина увеличена до 80 мг/м2 площади поверхности тела. По данным контрольного обследования в июне 2020 г. выявлена стабилизация очагов в печени, нормализация показателей биохимического анализа крови. Редукция дозы винорелбина до 60 мг/м2 площади поверхности тела с 5-го курса проведена в связи с развитием дозолимитирующей нейтропении 3-й степени.
В феврале 2021 г. отмечено прогрессирование заболевания: увеличение размеров очагов в печени, повышение трансаминаз до 2 норм, болевой синдром в правом подреберье 2-й степени. С февраля 2021 г. начато проведение химиотерапии по схеме: эрибулин 1,4 мг/м2 площади поверхности тела в 1-й, 8-й дни 21-дневного цикла. Лечение осложнилось развитием сенсорной полинейропатии 3-й степени после 3-го курса терапии, что потребовало отмены эрибулина. По данным контрольного обследования в апреле 2021 г. — стабилизация. С учетом непереносимой токсичности предшествующей линии терапии с мая 2021 г. начато проведение гормонотерапии фулвестрантом 500 мг в 1, 15, 28-й дни, затем 1 раз в 28 дней, алпелисибом 300 мг/сут внутрь. В связи с развитием кожной токсичности 3-й степени доза алпелисиба последовательно редуцирована до 200 мг/сут (рис. 1). По данным контрольного обследования в августе 2021 г. — стабилизация очагов в печени. Пациентка продолжает терапию комбинацией фулвестранта и алпелисиба.
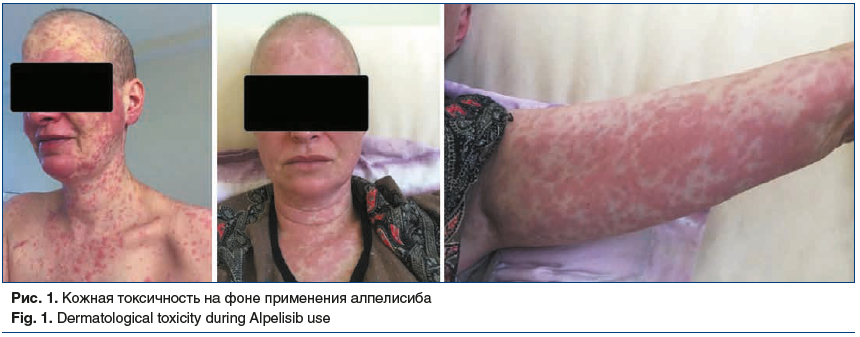
На примере данного клинического случая мы видим, что при рациональном назначении последовательных линий гормонотерапии возможно отложить начало проведения химиотерапии 1-й линии на 3,5 года и сохранить удовлетворительное качество жизни пациентки. В случае терапии диссеминированного РЭ+, HER2-негативного РМЖ мы можем обсуждать такой суррогатный показатель эффективности лечения, как время до начала проведения внутривенной химиотерапии. В случае данной пациентки проведение пероральной химиотерапии позволило обеспечить контроль заболевания в течение 26 мес. при минимальном ограничении качества жизни пациентки. Пероральная форма винорелбина в качестве монотерапии является оптимальным методом лечения у пациенток, основной целью лечения которых является контроль медленно прогрессирующего заболевания, или у пациенток, резистентных к гормональной терапии. Пероральный прием винорелбина еженедельно является простым и удобным методом лечения с одновременным сохранением высокого качества жизни у таких больных [11]. Кроме того, в условиях пандемии COVID-19, предполагающих ограничение посещения лечебных учреждений, пероральная химиотерапия, в частности винорелбином в капсулах, может рассматриваться как терапия выбора для таких пациенток.
Заключение
Таким образом, при планировании очередного режима терапии для больных диссеминированным РЭ+, HER2-негативным РМЖ мы, прежде всего, должны учитывать ожидаемую токсичность терапии, токсичность предшествующего лечения, а также мнение пациентки относительно ее готовности посещать клинику для внутривенных инфузий, оценивать влияние ожидаемой токсичности на качество жизни пациентки.
Сведения об авторах:
Глазкова Елена Владимировна — врач-онколог отделения лекарственных методов лечения (химиотерапевтического) № 1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115478, Россия, г. Москва, Каширское ш., д. 24.
Стенина Марина Борисовна — д.м.н., ведущий научный сотрудник отделения лекарственных методов лечения (химиотерапевтического) № 1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115478, Россия, г. Москва, Каширское ш., д. 24.
Контактная информация: Глазкова Елена Владимировна,
e-mail: mdglazkova@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 23.08.2021.
Поступила после рецензирования 15.09.2021.
Принята в печать 08.10.2021.
About the authors:
Elena V. Glazkova — oncologist of the Department No. 1 of Medicinal Treatment Methods (Chemotherapeutic), N.N. Blokhin National Medical Research Center of Oncology; 24, Kashirskoe road, Moscow, 115478, Russian Federation.
Marina B. Stenina — Dr. Sc. (Med.), Leading Researcher of the Department No. 1 of Medicinal Treatment Methods (Chemotherapeutic), N.N. Blokhin National Medical Research Center of Oncology; 24, Kashirskoe road, Moscow, 115478, Russian Federation.
Contact information: Elena V. Glazkova, e-mail: mdglazkova@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 23.08.2021.
Revised 15.09.2021.
Accepted 08.10.2021.
2. André F., Ciruelos E., Rubovszky G. et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor–Positive Advanced Breast Cancer. N Engl J Med. 2019;380(20):1929–1940. DOI: 10.1056/NEJMoa1813904.
3. Baselga J., Campone M., Piccart M. et al. Everolimus in Postmenopausal Hormone-Receptor–Positive Advanced Breast Cancer. N Engl J Med. 2012;366(6):520–529. DOI: 10.1056/NEJMoa1109653.
4. Robson M.E., Tung N., Conte P. et al. OlympiAD final overall survival and tolerability results: Olaparib versus chemotherapy treatment of physician’s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer. Ann Oncol. 2019;30(4):558–566. DOI: 10.1093/annonc/mdz012.
5. Litton J.K., Hurvitz S.A., Mina L.A. et al. Talazoparib versus chemotherapy in patients with germline BRCA1/2-mutated HER2-negative advancedbreast cancer: final overall survival results from the EMBRACA trial. Ann Oncol. 2020;31(11):1526–1535. DOI: 10.1016/j.annonc.2020.08.2098.
6. Dear R.F., McGeechan K., Jenkins M.C. et al. Combination versus sequential single agent chemotherapy for metastatic breast cancer. Cochrane Database Syst Rev. 2013;12: CD008792. DOI: 10.1002/14651858.CD008792.pub2.
7. Steger G.G., Dominguez A., Dobrovolskaya N. et al. Single-Agent Oral Vinorelbine as First-Line Chemotherapy for Endocrine-Pretreated Breast Cancer With Bone Metastases and No Visceral Involvement: NORBREAST-228 Phase II Study. Clin Breast Cancer. 2018;18(1):e41–47. DOI: 10.1016/j.clbc.2017.05.012.
8. Schott S., Schneeweiss A., Reinhardt J. et al. Acceptance of oral chemotherapy in breast cancer patients — a survey study. BMC Cancer. 2011;11:129. DOI: 10.1186/1471-2407-11-129.
9. Oostendorp L.J., Stalmeier P.F., Donders A.R. et al. Efficacy and safety of palliative chemotherapy for patients with advanced breast cancer pretreated with anthracyclines and taxanes: A systematic review. Lancet. Oncol. 2011;12:1053–1061. DOI: 10.1016/S1470-2045(11)70045-6.
10. Pajk B., Cufer T., Canney P. et al. Anti-tumor activity of capecitabine and vinorelbine in patients with anthracycline- and taxane-pretreated metastatic breast cancer: findings from the EORTC 10001 randomized phase II trial. Breast. 2008;17(2):180-5. doi: 10.1016/j.breast.2007.09.002.
11. Aapro M., Finek J. Oral vinorelbine in metastatic breast cancer: a review of current clinical trial results. Cancer Treat Rev. 2012;38(2):120–126. doi: 10.1016/j.ctrv.2011.05.005.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

