Факторы семейства VEGF, IGF и TGF-β1 в ткани сальника при раке яичников
DOI: 10.32364/2587-6821-2020-4-3-132-136
Цель исследования: изучить содержание уровней фактора роста эндотелия сосудов (Vascular endothelial growth factor, VEGF) VEGF-A, рецептора VEGFR1, VEGF-C, рецептора VEGFR3, трансформирующего фактора роста β (Transforming growth factor β, TGF-β), инсулиноподобного фактора роста (Insulin-like growth factor, IGF) IGF-1, IGF-2 и инсулиноподобного фактора роста — связывающего белка 3 (Insulin-like growth factor-binding protein 3, IGFBP3) в ткани метастатически пораженного и не пораженного большого сальника у больных раком яичников (РЯ) с целью выявления преметастатических ниш заболевания.
Материал и методы: в исследование вошли образцы тканей большого сальника 51 пациентки с РЯ Т2–3NxM0–1, группу контроля составили 17 больных, сопоставимых по возрасту, с неонкологическими заболеваниями. Уровни VEGF-A, VEGFR1, VEGF-C, VEGFR3, IGF-1, IGF-2, IGFBP3 и TGF-β1 определяли с помощью стандартных тест-систем иммуноферментного анализа.
Результаты исследования: экспрессия VEGF-A была выше не только в метастатически пораженном большом сальнике, но и в сальнике без морфологических признаков метастазирования, инициируя в нем процесс ангиогенеза. Высокая экспрессия VEGF-C и VEGFR3 инициирует процесс лимфангиогенеза в уже пораженном сальнике. Более выраженная экспрессия VEGF-A, VEGF-С и их рецепторов в метастазах подтверждает концепцию использования антиангиогенного лечения при диссеминированной карциноме и для лечения пациентов с резидуальными опухолями. Уровни IGF-2 и IGFBP3 не имели достоверного отличия между пораженными и непораженными участками большого сальника в организме больных РЯ, однако значимо превышали этот показатель в группе контроля. Нами получено более высокое содержание TGF-β1 в ткани большого сальника, еще не пораженного опухолевым процессом, по сравнению с метастатически измененными тканями сальника.
Заключение: взаимодействие между VEGF-A, IGF-1 и TGF-β может служить регулятором метаболического состояния органов для вторичных опухолей, маркируя преметастатическую нишу и обеспечивая мезенхимально-эпителиальный переход циркулирующих опухолевых клеток.
Ключевые слова: рак яичников, преметастатическая ниша, метастатически пораженный большой сальник, большой сальник без метастазов, фактор роста эндотелия сосудов, VEGF-A, VEGF-C, IGF-1, TGF-β.
Для цитирования: Франциянц Е.М., Моисеенко Т.И., Якубова Д.Ю., Черярина Н.Д., Меньшенина А.П., Вереникина Е.В., Адамян М.Л. Факторы семейства VEGF, IGF и TGF-β1 в ткани сальника при раке яичников. РМЖ. Медицинское обозрение. 2020;4(3):132-136. DOI: 10.32364/2587-6821-2020-4-3-132-136.
E.M. Frantsiyants, T.I. Moiseenko, D.Yu. Yakubova, N.D. Cheryarina, A.P. Men’shenina, E.V. Verenikina, M.L. Adamyan
National Medical Research Centre for Oncology, Rostov-on-Don, Russian Federation
Aim: to evaluate the levels of vascular endothelial growth factor (VEGF) A and C, VEGF receptor (VEGFR) 1 and 3, transforming growth factor β (TGF-β), insulin-like growth factor (IGF) 1 and 2, and insulin-like growth factor-binding protein 3 (IGFBP3) in women with and without omental metastasis of ovarian cancer to identify pre-metastatic niches.
Patients and Methods: omental samples obtained from 51 women with ovarian cancer (stage Т2–3NxM0–1) were examined. Controls were 17 age-matched women with non-oncological diseases. The levels of VEGF-A, VEGF-C, VEGFR1, VEGFR3, IGF-1, IGF-2, IGFBP3, and TGF-β1 were measured by standard ELISA protocols.
Results: VEGF-A expression was higher both in omental metastasis and omentum without morphological signs of metastasis thus initiating angiogenesis. High expression of VEGF-C and VEGFR3 initiates lymphangiogenesis in omental metastasis. Greater expression of VEGF-A, VEGF-С, and their receptors in metastases favors antiangiogenic treatment approach in disseminated carcinoma and residual cancer. The levels of IGF-2 and IGFBP3 were similar in omental metastasis and intact omentum in ovarian cancer but were significantly higher as compared with the control group. TGF-β1 level was higher in intact omentum as compared with omental metastasis.
Conclusion: the interaction between VEGF-A, IGF-1, and TGF-β may be a regulator of organ metabolic conditions by labelling pre-metastatic niches and providing mesenchymal-epithelial transition of circulating tumor cells.
Keywords: ovarian cancer, pre-metastatic niche, omental metastasis, greater omentum without metastases, vascular endothelial growth factor, VEGF-A, VEGF-C, IGF-1, TGF-β.
For citation: Frantsiyants E.M., Moiseenko T.I., Yakubova D.Yu. et al. VEGF family members, IGF, and TGF-β1 in the omentum in ovarian cancer. Russian Medical Inquiry. 2020;4(3):132–136. DOI: 10.32364/2587-6821-2020-4-3-132-136.
Введение
Рак яичников (РЯ) — фатальное гинекологическое злокачественное новообразование, характеризующееся диссеминированным перитонеальным метастазированием [1]. РЯ обладает специфическим метастатическим тропизмом к большому сальнику с высоким содержанием жиров. Имеются данные, свидетельствующие о том, что большой сальник играет ключевую роль в создании микроокружения метастатической опухоли в брюшной полости [2].
Распространение серозного РЯ представляет собой уникальный молекулярный механизм. Понимание молекулярных и клеточных детерминант образования метастатических клеток рака, высвобождения и взаимодействия их с микросредой поможет сформировать фундаментальную основу патогенеза РЯ, которая необходима для создания новых методов лечения, направленных на предотвращение перитонеальной диссеминации [3].
Исследования с использованием эксплантатов сальниковой ткани больных РЯ, адаптированных к условиям трехмерной культуры ex vivo, подтвердили наличие тесной взаимосвязи между популяциями клеток большого сальника и опухолями. А.К. Mitra et al. (2012) [4] предоставили доказательства того, что секреторные и провоспалительные свойства опухолей яичников изменяют сальниковые фибробласты в фибробласты, ассоциированные с раком, которые секретируют ростовые и хемотаксические молекулы для поддержки прогрессирования опухоли.
Сигнальные пути семейства VEGF (Vascular endothelial growth factor, фактора роста эндотелия сосудов) играют основную роль в ангиогенезе и лимфангиогенезе опухоли [5, 6]. VEGF-A, -B, -C и -D и PIGF (Placental growth factor, плацентарный фактор роста) передают сигналы через три рецептора тирозинкиназы: VEGFR1, 2 и 3. VEGF-A связывается с VEGFR1 и VEGFR2 и является основным стимулятором роста и распространения опухоли. Передача сигналов VEGF-A/VEGFR2 считается наиболее важным путем ангиогенеза опухоли, индуцируя эндотелиальную проницаемость и стимулируя накопление асцитической жидкости у больных РЯ [7, 8]. VEGF-C и -D действуют в основном через VEGFR3, стимулируя лимфангиогенез и способствуя образованию ангиогенных ростков [9].
Сигнальный путь IGF (Insulin-like growth factor, инсулиноподобный фактор роста) модулирует энергетический обмен и рост клеток в нормальных условиях. В последние годы было показано, что IGF и его активация передачи сигналов вовлечены в пролиферацию раковых клеток, антиапоптоз и метастазирование при различных видах рака, а сигнальный путь IGF-1 индуцирует эпителиально-мезенхимальный переход посредством активации сигнального преобразователя и активатора транскрипции 5 (Signal transducer and activator of transcription 5 — Stat5) [10].
TGF-β (Transforming growth factor β, трансформирующий фактор роста β) может вызывать эпителиально-мезенхимальный переход и миграцию опухолевых клеток, увеличивать их агрессивность и выживаемость, изменять характеристики клеток, реконструировать внеклеточную матрицу и повышать метаболизм клеток, благоприятный для инвазии РЯ и метастазирования [11].
Целью настоящего исследования явилось изучение содержания VEGF-A, VEGFR1, VEGF-C, VEGFR3, TGF-β, IGF-1, IGF-2 и IGFBP3 в ткани метастатически пораженного и не пораженного большого сальника у больных РЯ.
Материал и методы
В исследование вошли образцы тканей большого сальника 51 больной РЯ Т2–3NxM0–1 (группа 2), из них метастазы в сальник имели 37 пациенток, без метастазов — 14 пациенток. Средний возраст больных составил 60±1,9 года. Диагноз у всех больных был верифицирован на догоспитальном этапе, обследование проведено согласно рекомендуемым стандартам. Группу контроля составили 17 больных аналогичного возраста с неонкологическими заболеваниями.
Операция всем больным была выполнена в стандартно рекомендуемом объеме: пангистерэктомия, оментэктомия, оптимальное/субоптимальное удаление видимых метастатических очагов в пределах брюшной полости. Все удаленные органы и ткани подвергались морфологическому исследованию. Гистологически все удаленные опухоли являлись серозной цистаденокарциномой G2–G3. Для иммуноферментного анализа (ИФА) проводился интраоперационный забор образцов пораженных и непораженных фрагментов большого сальника.
Ткани гомогенизировали, получали 10% цитозольную фракцию, приготовленную на 0,1 молярном калий-фосфатном буфере рН 7,4, содержащем 0,1% Твин-20 и 1% бычий сывороточный альбумин. После центрифугирования образцы хранили при -80° C для анализов с помощью ИФА. Замороженные образцы медленно оттаивали при 4° С. За полчаса до экспериментов образцы оставались при комнатной температуре. Уровни VEGF-A, VEGFR1, VEGF-C, VEGFR3, IGF-1, IGF-2, IGFBP3 и TGF-β1 определяли с помощью стандартных тест-систем ИФА (Bendermedsystem, Австрия).
Все процедуры были одобрены комитетом по этике ФГБУ «НМИЦ онкологии» Минздрава России.
Статистическая обработка материала проводилась с помощью программы Statistica 10,0 c определением средних значений и указанием стандартных отклонений. Значимость различий средних показателей оценивалась с помощью критерия суммы рангов Вилкоксона. Существенными считали различия при p<0,05. При этом соблюдались общие рекомендации для медицинских исследований.
Результаты исследования
Результаты исследования представлены в таблице 1. Установлено, что в ткани сальника больных РЯ без метастатического процесса уровень VEGF-A был выше показателя в ткани контрольной группы в 2,6 раза, а VEGFR1 не имел достоверных отличий от показателей контрольной группы. В ткани сальника, пораженного метастазами, содержание VEGF-A и VEGFR1 было повышенным в 6,3 раза и 3,1 раза относительно таковых в группе контроля и в 2,5 раза и 2,8 раза — относительно ткани сальника без метастазов.
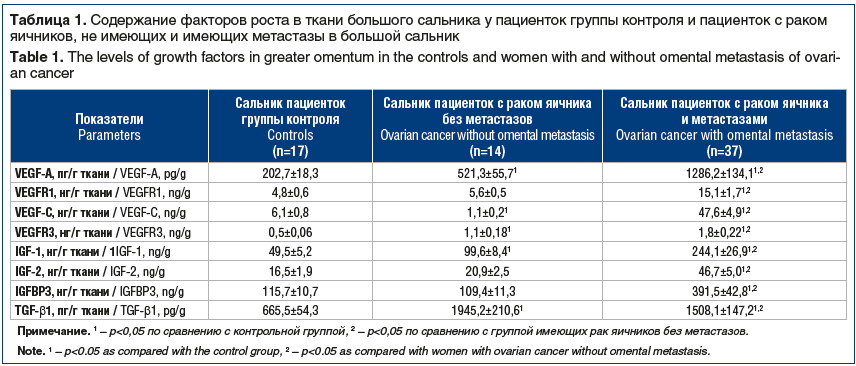
Содержание VEGF-C в ткани сальника больных РЯ без метастатического процесса было снижено относительно показателей в контрольной группе в 5,5 раза, а VEGFR3, напротив, повышено в 2,2 раза. В ткани сальника, пораженного метастазами, содержание VEGF-C и VEGFR3 было выше в 7,8 раза и 3,6 раза относительно величин в контрольной группе и в 43,3 раза и 1,6 раза (р<0,05) выше, чем в ткани сальника, не пораженного злокачественным процессом.
Уровень IGF-2 и IGFBP3 в ткани сальника, не пораженного метастазами, не имел достоверных отличий от показателей в контрольной группе. Вместе с тем содержание IGF-1 в указанных образцах превосходило значения контрольной группы в 2 раза. В ткани сальника, пораженного метастазами, уровень IGF-1, IGF-2 и IGFBP3 был выше значений контрольной группы в 4,9 раза, 2,8 раза и 3,4 раза соответственно и выше показателей в ткани сальника, не пораженного метастазами, в 2,5 раза, 2,2 раза и 3,6 раза соответственно.
Содержание TGF-β1 было повышено в ткани сальника, не пораженного метастатическим процессом, в 2,9 раза, а в ткани метастатического сальника — в 2,3 раза.
Таким образом, найдены изменения уровня некоторых факторов роста, связанные с метастатическим поражением сальника при РЯ.
Обсуждение результатов
70% вновь диагностированных больных РЯ и почти все рецидивирующие случаи имеют скопление многоклеточных опухолевых клеток в брюшной полости, взвешенных в перитонеальной жидкости [12]. Некоторые из отдельных опухолевых клеточных кластеров, взвешенных в асцитической жидкости, поддерживают жизнеспособность и колонизируют висцеральную и париетальную брюшины малого таза и брюшной полости посредством движения перитонеального выпота [13]. Исследование неклеточных фракций асцитической жидкости, выделенных у пациенток с РЯ, выявило наличие митогенных факторов, компонентов внеклеточного матрикса и различных провоспалительных молекул [14].
Чтобы обеспечить адекватное кровоснабжение, гемопоэтические клетки-предшественники инициируют процесс ангиогенеза в преметастатической нише [15]. Локальные эндотелиальные клетки-предшественники способствуют ангиогенезу посредством передачи сигналов VEGF [16]. Этот предшествующий ангиогенез делает преметастатическую нишу способной удовлетворить потребность опухоли в питательных веществах для последующего быстрого метастатического роста.
Наши результаты показывают, что VEGF-A, по-видимому, является перспективным ангиогенным маркером при метастатическом РЯ. Экспрессия VEGF-A была выше не только в метастатически пораженном большом сальнике, но и в сальнике без морфологических признаков метастазирования, инициируя в нем процесс ангиогенеза. Что касается лимфангиогенных факторов, высокая экспрессия VEGF-C и VEGFR3 инициирует процесс лимфангиогенеза в уже пораженном сальнике. Однако в преметастатической нише, какой можно считать большой сальник, еще не пораженный метастазами, но находящийся в организме больной РЯ, лимфангиогенез, вероятно, подавлен для снижения дренирующей функции. Наши нынешние результаты показали более сильную экспрессию VEGF-A, VEGF-С и их рецепторов в метастазах, подтверждая концепцию использования антиангиогенного лечения при диссеминированной карциноме и для лечения пациентов с резидуальными опухолями. Для повышения эффективности противоопухолевого лечения было бы полезно блокировать как ангиогенный, так и лимфангиогенный путь при РЯ.
Семейство IGF представляет собой сложный молекулярный сигнальный путь, который играет важную роль в онкогенезе, прогрессировании опухоли и метастазировании [17]. Одним из ключевых факторов в этом семействе является IGF-1, который является эндокринным и аутокринным/паракринным пептидом, экспрессирующимся в большинстве типов клеток. При развитии опухолевого процесса IGF-1 и IGFBP-3 участвуют в клеточной пролиферации, дифференцировке и апоптозе. Некоторые эпидемиологические исследования предполагают связь циркулирующих уровней IGF-1 / IGFBP-3 с риском развития РЯ [18].
Наши результаты показывают, что IGF-1 может служить регулятором метаболизма по аутокринно-паракринному пути в ткани еще не пораженного метастазами сальника, т. к. все члены этого семейства участвуют в метастазировании. Сообщалось, что секреция IGFBP-3 стимулируется VEGF, а секреция IGF, IGFBP-3 и VEGF вызывается индуцируемым гипоксией фактором (Hypoxia-inducible factor 1-α, HIF-1α) [19].
TGF-β является плейотропным цитокином, который контролирует пролиферацию, дифференцировку, эмбриональное развитие, ангиогенез, заживление ран и другие функции во многих типах клеток. При распространенных формах рака TGF-β индуцирует множество метаболических путей, которые приводят к росту, инвазии и метастазированию раковых клеток [20].
Мы показали, что TGF-β экспрессируется не только в ткани метастатически пораженного сальника, что согласуется с вышеприведенными данными, но и в ткани сальника, еще не пораженного злокачественным процессом, но находящегося в организме больных РЯ. Этот факт можно рассматривать двояко. С одной стороны, известно, что TGF-β действует как супрессор опухолей в нормальных эпителиальных клетках и на ранних стадиях опухолевого процесса [20], с другой — TGF-β индуцирует прогрессирование рака через эпителиально-мезенхимальный переход, который является важным этапом инвазии и метастазирования рака [11]. И нам ближе вторая точка зрения.
Заключение
Таким образом, результаты данного исследования свидетельствуют о том, что взаимодействие между VEGF-A, IGF-1 и TGF-β может служить регулятором метаболического состояния органов для вторичных опухолей, маркируя преметастатическую нишу и обеспечивая мезенхимально-эпителиальный переход циркулирующих опухолевых клеток. Несомненно, понимание тонких механизмов взаимодействия данных факторов в предопухолевых нишах приблизит фармакологов и онкологов к повышению эффективности лечения больных РЯ — заболевания с чрезвычайно высокой тропностью к имплантационному метастазированию.
Сведения об авторах:
Франциянц Елена Михайловна — д.б.н., профессор, заместитель генерального директора по науке, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0003-3618-6890.
Моисеенко Татьяна Ивановна — д.м.н., профессор, главный научный сотрудник отдела опухолей репродуктивной системы, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0003-4037-7649.
Якубова Дарья Юрьевна — аспирант отделения онкогинекологии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0001-8204-0855.
Черярина Наталья Дмитриевна — научный сотрудник лаборатории изучения патогенеза опухолей, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0002-3711-8155.
Меньшенина Анна Петровна — к.м.н., ведущий научный сотрудник отдела опухолей репродуктивной системы, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0002-7968-5078.
Вереникина Екатерина Владимировна — к.м.н., заведующая отделением онкогинекологии, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0002-1084-5176.
Адамян Мери Людвиковна — к.м.н., научный сотрудник отдела опухолей репродуктивной системы, ФГБУ «НМИЦ онкологии» Минздрава России, 344037, Россия, г. Ростов-на-Дону, 14-я линия, д. 63; ORCID iD 0000-0003-4188-3746.
Контактная информация: Меньшенина Анна Петровна, e-mail: anna.menshenina.00@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 15.05.2020, поступила после рецензирования 29.05.2020, принята в печать 11.06.2020.
About the authors:
Elena M. Frantsiyants — Dr. of Sci. (Biol.), Deputy Director General for Science, National Medical Research Centre for Oncology. 63, 14th Line, Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0003-3618-6890.
Tat’yana I. Moiseenko — Dr. of Sci. (Med.) Professor, Senior Researcher of the Division of Reproductive System Tumors, National Medical Research Centre for Oncology. 63, 14th Line, Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0003-4037-7649.
Dar’ya Yu. Yakubova — postgraduate student of the Department of Oncogynecology, National Medical Research Centre for Oncology. 63, 14th Line, Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0001-8204-0855.
Natal’ya D. Cheryarina — Researcher of the Laboratory of the Study of Tumor Pathogenesis, National Medical Research Centre for Oncology. 63, 14th Line, Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0002-3711-8155.
Anna P. Men’shenina — Cand. of Sci. (Med.), Leading Researcher of the Division of Reproductive System Tumors, National Medical Research Centre for Oncology. 63, 14th Line, Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0002-7968-5078.
Ekaterina V. Verenikina — Cand. of Sci. (Med.), Head of the Department of Oncogynecology, National Medical Research Centre for Oncology. 63, 14th Line, Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0002-1084-5176.
Meri L. Adamyan — Cand. of Sci. (Med.), Researcher of the Division of Reproductive System Tumors, National Medical Research Centre for Oncology. 63, 14th Line, Rostov-on-Don, 344037, Russian Federation; ORCID iD 0000-0003-4188-3746.
Contact information: Anna P. Men’shenina, e-mail: anna.menshenina.00@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.05.2020, revised 29.05.2020, accepted 11.06.2020.
2. Motohara T., Masuda K., Morotti M. et al. An evolving story of the metastatic voyage of ovarian cancer cells: cellular and molecular orchestration of the adipose-rich metastatic microenvironment. Oncogene. 2019;38(16):2885–2898. DOI: 10.1038/s41388-018-0637-x.
3. Farsinejad S., Cattabiani T., Muranen T., Iwanicki M. Ovarian Cancer Dissemination-A Cell Biologist’s Perspective. Cancers (Basel). 2019;11(12):1957. DOI: 10.3390/cancers11121957.
4. Mitra A.K., Zillhardt M., Hua Y. et al. MicroRNAs reprogram normal fibroblasts into cancer-associated fibroblasts in ovarian cancer. Cancer Discov. 2012;2:1100–1108. DOI: 10.1158/2159-8290.CD-12-0206.
5. Моисеенко Т.И., Кит О.И., Франциянц Е.М. и др. Показатели системы ростовых факторов при различных вариантах роста рака шейки матки и их биологический смысл. Известия высших учебных заведений. Северо-Кавказский регион. Естественные науки. 2017;3(195–2):83–89. [Moiseenko T.I., Kit O.I., Frantsiyants E.M. et al. Parameters of the system of growth factors in different growth patterns of cervical cancer and their biological meaning. Izvestiya vysshikh uchebnykh zavedeniy. Severo-Kavkazskiy region. Yestestvennyye nauki. 2017;3:83–89 (in Russ.)].
6. Кит О.И., Франциянц Е.М., Моисеенко Т.И. и др. Факторы роста семейства VEGF и FGF в сыворотке крови в динамике развития рака яичников. Современные проблемы науки и образования. 2017;1. (Электронный ресурс). URL: https://science-education.ru/ru/article/view?id=25898. Дата обращения 06.05.2020. [Kit O.I., Frantsiyants E.M., Moiseenko T.I. et al. Growth factors of VEGF and FGF 21 family in blood serum in the ovarian cancer dynamics. Sovremennyye problemy nauki i obrazovaniya. 2017;1. (Electronic recourse). URL: https://science-education.ru/ru/article/view?id=25898 Access date 06.05.2020 (in Russ.)].
7. Sopo M., Anttila M., Hämäläinen K. et al. Expression profiles of VEGF-A, VEGF-D and VEGFR1 are higher in distant metastases than in matched primary high grade epithelial ovarian cancer. BMC cancer. 2019;19(1):584. DOI: 10.1186/s12885-019-5757-3.
8. Lohela M., Bry M., Tammela T., Alitalo K. VEGFs and receptors involved in angiogenesis versus lymphangiogenesis. Curr Opin Cell Biol. 2009;21(2):154–165. DOI: 10.1016/j.ceb.2008.12.012.
9. Sallinen H., Heikura T., Koponen J. et al. Serum angiopoietin-2 and soluble VEGFR-2 levels predict malignancy of ovarian neoplasm and poor prognosis in epithelial ovarian cancer. BMC Cancer. 2014;14(1):696. DOI: 10.1186/1471-2407-14-696.
10. Zhao C., Wang Q., Wang B. et al. IGF-1 induces the epithelial-mesenchymal transition via Stat5 in hepatocellular carcinoma. Oncotarget. 2017;8(67):111922–111930. DOI: 10.18632/oncotarget.22952.
11. Al Ameri W., Ahmed I., Al-Dasim F.M. et al. Cell Type-Specific TGF-β Mediated EMT in 3D and 2D Models and Its Reversal by TGF-β Receptor Kinase Inhibitor in Ovarian Cancer Cell Lines. International journal of molecular sciences. 2019;20(14):3568. DOI: 10.3390/ijms20143568.
12. Kim S., Han Y., Kim S.I. et al. Tumor evolution and chemoresistance in ovarian cancer. NPJ Precis. Oncol. 2018;2:20. DOI: 10.1038/s41698-018-0063-0.
13. Berek J.S., Crum C., Friedlander M. Cancer of the ovary, fallopian tube, and peritoneum. Int. J. Gynaecol. Obs. 2012;119:S118–S129. DOI: 10.1016/S0020-7292(12)60025-3.
14. Ahmed N., Stenvers K.L. Getting to know ovarian cancer ascites: Opportunities for targeted therapy-based translational research. Front. Oncol. 2013;3:256. DOI: 10.3389/fonc.2013.00256.
15. Feng W., Dean D.C., Hornicek F.J. et al. Exosomes promote pre-metastatic niche formation in ovarian cancer. Mol Cancer. 2019;18(1):124. DOI: 10.1186/s12943-019-1049-4.
16. Liu Y., Cao X. Characteristics and significance of the pre-metastatic niche. Cancer Cell. 2016;30:668–681. DOI: 10.1016/j.ccell.2016.09.011.
17. Wang Q., Bian C. E., Peng H. et al. Association of circulating insulin-like growth factor 1 and insulin-like growth factor binding protein 3 with the risk of ovarian cancer: A systematic review and meta-analysis. Mol Clin Oncol. 2015;3(3):623–628. DOI: 10.3892/mco.2015.516.
18. Peeters P.H., Lukanova A., Allen N. et al. Serum IGF-I, its major binding protein (IGFBP-3) and epithelial ovarian cancer risk: the European Prospective Investigation into Cancer and Nutrition (EPIC) Endocr Relat Cancer. 2007;14:81–90. DOI: 10.1677/erc.1.01264.
19. Ishikura N., Yorozu K., Kurasawa M. et al. Sustained effect of continuous treatment with bevacizumab following bevacizumab in combination with chemotherapy in a human ovarian clear cell carcinoma xenograft model. Oncol Rep. 2019;42(3):1057–1065. DOI: 10.3892/or.2019.7211.
20. Derynck R., Muthusamy B.P., Saeteurn K.Y. Signaling pathway cooperation in TGF-β-induced epithelial–mesenchymal transition. Curr. Opin. Cell Biol. 2014;31:56–66. DOI: 10.1016/j.ceb.2014.09.001.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

