Зависимость между временем инстилляции антиглаукомных глазных капель и их эффективностью
Современная фармакотерапия глаукомы основана на использовании широкого круга гипотензивных препаратов различных групп. К сожалению, существующий арсенал препаратов пока не смог радикально решить многочисленные проблемы лечения глаукомы, поэтому поиск новых направлений ее лекарственной терапии продолжается. Внутриглазное давление (ВГД) и эффективность местных гипотензивных лекарственных препаратов в течение суток неодинаковы и подвержены ритмичным колебаниям. Благодаря методу 24-часового мониторинга ВГД в последние десятилетия получены новые данные о 24-часовой эффективности многих гипотензивных препаратов. Однако, несмотря на большое количество и объем выполненных исследований, однозначный ответ на вопрос об оптимальном времени инстилляции различных видов антиглаукомных капель не получен. Одним из интересных и многообещающих направлений современной фармакотерапии является хронотерапия — для достижения максимального эффекта прицельное назначение препарата в определенное время суток с учетом циркадных ритмов. В данном обзоре рассматриваются современные возможности применения индивидуализированного подхода в ежедневной практике лечения пациентов с глаукомой на основе хронофармакотерапии. Использование подобного индивидуализированного подхода в перспективе будет способствовать максимальному достижению целевого уровня ВГД и лучшему контролю глаукомы.
Ключевые слова: внутриглазное давление, 24-часовой мониторинг, суточные колебания внутриглазного давления, глаукома, фармакотерапия, хронотерапия.
Для цитирования: Гетманова А.М., Брежнев А.Ю., Газизова И.Р., Куроедов А.В., Онуфрийчук О.Н. Зависимость между временем инстилляции антиглаукомных глазных капель и их эффективностью. РМЖ. «Клиническая Офтальмология». 2020;20(2):85-91. DOI: 10.32364/2311-7729-2020-20-2-85-91.
Association between instillation time of glaucoma eye drops
and their efficacy
A.M. Getmanova1, A.Yu. Brezhnev2, I.R. Gazizova3, A.V. Kuroyedov4,5, O.N. Onufriichuk6
1Bryansk Regional Hospital, Bryansk, Russian Federation
2Kursk State Medical University, Kursk, Russian Federation
3Institute of Experimental Medicine of the Russian Academy of Sciences, St. Petersburg, Russian Federation
4P.V. Mandryka Military Clinical Hospital, Moscow, Russian Federation
5Pirogov Russian National Research Medical University, Moscow, Russian Federation
6G.I. Turner National Medical Research Center for Children’s Orthopedics and Trauma Surgery, Pushkin, Russian Federation
Modern pharmacotherapy for glaucoma includes a wide range of intraocular pressure (IOP)-lowering medications of various groups. Yet, current set of medications cannot address a myriad of challenges in glaucoma treatment. Therefore, the search for novel pharmacotherapies for glaucoma is underway. IOP and the efficacy of topical IOP-lowering medications fluctuate throughout the day being volatile items. In the past decade, 24-hour IOP monitoring has provided novel data on 24-hour efficacy of many IOP-lowering medications. However, despite a large number and volume of studies, optimal instillation period of various glaucoma eye drops is still unclear. An interesting and promising area of modern pharmacotherapy is chronotherapy that implies target prescription of a drug in specific daytime considering circadian rhythms to achieve maximum effect. This paper reviews current modalities of personalized chronopharmacotherapy and their potential application in r outine glaucoma practice. This personalized approach will help achieve target IOP and improve glaucoma control.
Keywords: intraocular pressure, 24-hour monitoring, diurnal IOP fluctuations, glaucoma, pharmacotherapy, chronotherapy.
For citation: Getmanova A.M., Brezhnev A.Yu., Gazizova I.R. et al. Association between instillation time of glaucoma eye drops and their efficacy. Russian Journal of Clinical Ophthalmology. 2020;20(2):85–91. DOI: 10.32364/2311-7729-2020-20-2-85-91.
Введение
Современная фармакотерапия глаукомы подразумевает использование широкого круга гипотензивных препаратов различных групп. Несмотря на тенденцию к ранней хирургии глаукомы, стремительное развитие микроинвазивных, дренажных и лазерных технологий, фармакотерапия по-прежнему остается широко востребованной во всех схемах лечения [1]. На рубеже XX–XXI вв. произошел прорыв в медикаментозном лечении глаукомы: появились аналоги простагландинов (АПГ) — латанопрост и другие препараты данной группы, местные формы ингибиторов карбоангидразы (ИКА), адреномиметики (АМ), которые в дополнение к ранее использовавшимся β-адреноблокаторам (ББ) и миотикам сформировали антиглаукомный кластер современной офтальмофармакологии [2]. Но, к сожалению, существующий арсенал препаратов пока не смог радикально решить многочисленные проблемы лечения глаукомы, и поиск новых направлений ее лекарственной терапии продолжается. В настоящее время несколько групп антиглаукомных лекарственных средств с качественно новыми механизмами действия находятся на стадии клинических исследований (агонисты рецепторов аденозина, агонисты простаноидных рецепторов, донаторы оксида азота, малые интерферирующие РНК-ингибиторы β2-адренергических рецепторов) [3]. В некоторых странах уже разрешены для клинического применения препараты с механизмом действия, основанным на ингибировании регуляторного фермента Rho-киназы, которые снижают офтальмотонус путем прямого действия на трабекулярный отток, однако их эффективность по снижению внутриглазного давления (ВГД) от исходного уровня составляет 25%, что уступает эффективности АПГ [4]. Таким образом, гипотензивное действие ожидаемых в ближайшей перспективе препаратов вряд ли превзойдет эффект уже имеющихся.
Еще одним направлением офтальмофармакологии, призванным повысить эффективность медикаментозного лечения глаукомы, стало создание различных вариантов фиксированных комбинаций (ФК). В настоящее время наиболее востребованными оказались сочетания АПГ и ББ, ББ и ИКА, ББ и АМ. ФК позволяют лучше снижать уровень ВГД и повышать приверженность пациентов лечению (комплаентность) [5]. Перспективы данного направления связывают с появлением новых комбинаций и увеличением количества компонентов (до 3 и более). Однако и здесь не приходится ожидать кардинального изменения ситуации, а значит, необходима оптимизация лечения в рамках существующего спектра лекарственных препаратов.
Хронотерапия
Одним из интересных и многообещающих направлений современной фармакотерапии является хронотерапия. Основная идея метода — прицельное назначение препарата в определенное время суток с учетом циркадных ритмов для достижения максимального эффекта. Циркадные ритмы играют важную роль в поддержании гомеостаза в организме человека. Они влияют на различные физиологические системы: от регуляции уровня глюкозы и инсулина в крови до выработки кортизола и мелатонина, изменения температуры тела и работы вегетативной нервной системы [6]. Сейчас хронотерапия активно применяется при лечении бронхиальной астмы, гипертонической болезни, язвенной болезни 12-перстной кишки, сахарного диабета, онкологических заболеваний [6]. Подобные циркадные ритмы влияют и на развитие глаукомы. Известно, что ВГД, глазное перфузионное давление и глазной кровоток изменяются согласно циркадным ритмам, а глаукома прогрессирует, даже несмотря на, казалось бы, хорошо контролируемые показатели офтальмотонуса [6]. Так, исследования, проведенные у пациентов с глаукомой, которые использовали местно ББ, и пациентов с гипертонической болезнью на фоне лечения пероральными ББ показали, что лечение у обеих групп хуже в ночное время [6]. Все эти данные ставят перед нами вопрос: возможна ли оптимизация медикаментозного лечения глаукомы с учетом временного фактора?
Хронотерапия может осуществляться двумя путями: 1) подбором времени воздействия, исходя из представлений о нормальном ритме функций и изменений, которые наступают в данной группе больных (групповая хронотерапия); 2) подбором времени воздействия на основе изучения ритмов конкретного больного (индивидуальная хронотерапия). Предполагается, что понимание зависимости фармакологического эффекта от временного состояния биосистемы позволяет отказаться от шаблонного назначения лекарственных веществ, повысить результативность лечения при одновременном снижении дозировок и выраженности побочных реакций [7].
Суточные колебания ВГД
С развитием новых технологий появляются новые данные, касающиеся колебаний уровня ВГД. Суточные колебания уровня ВГД при глаукоме впервые были описаны А. И. Масленниковым в журнале «Вестник офтальмологии» в 1905 г. [8].
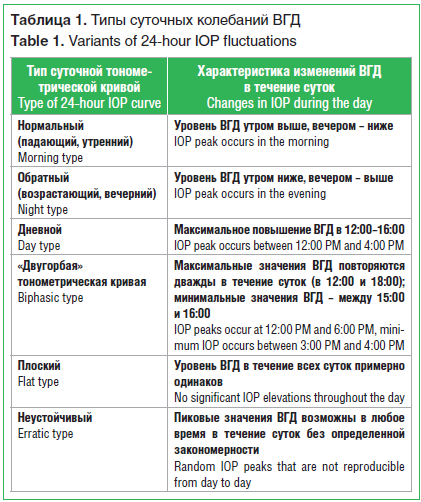
У большинства пациентов уровень ВГД в 10:00 имеет наибольшее среднее значение, однако это не является единственным вариантом нормы. Предложены различные классификации типичных суточных кривых, характерных как для здоровых лиц, так и для больных глаукомой (табл. 1) [9, 10].
Разработано несколько устройств для 24-часового контроля уровня ВГД. Первым доступным для обычного клинического использования подобным устройством была сенсорная контактная линза Triggerfish (Sensimed AG, Швейцария). Принцип ее работы основан на регистрации изменений кривизны роговицы на фоне колебаний ВГД [11].
Благодаря такому способу измерения офтальмотонуса к настоящему времени описан ряд специфических особенностей суточных кривых в зависимости от вида, стадии глаукомы. Использование устройств для круглосуточного мониторирования позволило по-новому взглянуть на некоторые аспекты оценки эффективности проводимого лечения, а именно рассматривать еще одну перспективу фармакотерапии — индивидуализированный подход.
Рядом исследований подтверждается невозможность выявления всех пиков ВГД в дневное время при однократном измерении. Так, в работе Y. Barkana et al. (2006) почти две трети пациентов имели пиковые значения офтальмотонуса во «внеофисное» время, в т. ч. в ночные часы, причем выявление этих показателей у трети пациентов привело к немедленной смене терапии [12].
При лечении глаукомы важно учитывать индивидуальный суточный тип ВГД. Под колебаниями (флуктуациями) уровня ВГД понимают разность между измерениями в течение суток или нескольких дней, недель, месяцев и даже лет. Суточные колебания офтальмотонуса измеряют в течение определенного дня или 24-часового цикла. Краткосрочными колебаниями называют разницу ВГД в период от нескольких дней до месяцев. Долгосрочные колебания описывают флуктуацию ВГД в течение нескольких месяцев и лет. В ряде исследований подчеркивается роль колебаний офтальмотонуса как независимого фактора риска прогрессирования разных типов глаукомы (глаукомы нормального давления, псевдоэксфолиативной глаукомы и первичной открытоугольной глаукомы) [5, 13–17].
Суточные колебания офтальмотонуса и роль краткосрочных и долгосрочных флуктуаций в прогрессировании глаукомы изучались в продольном ретроспективном когортном исследовании, проведенном в 2004–2009 гг. в Германии. В нем была показана значимая связь краткосрочного стандартного отклонения уровня ВГД (отношение рисков (ОР) 1,15; 95% доверительный интервал (ДИ) 1,07–1,23; p<0,0001), краткосрочного максимального уровня ВГД (ОР 1,05; 95% ДИ 1,02–1,07; р<0,0001) и долгосрочного максимального уровня ВГД (ОР 1,04; 95% ДИ 1,02–1,07; р<0,0001) с прогрессированием глаукомы по данным периметрии, но не выявлено связи прогрессирования с кратко- и долгосрочным средним уровнем ВГД [18].
Важно помнить, что и сами местные гипотензивные лекарственные препараты действуют неодинаково в течение суток. За последние десятилетия 24-часовой мониторинг ВГД позволил исследовать 24-часовую эффективность многих гипотензивных препаратов. Было показано, что АПГ и ФК значительно уменьшают суточные колебания ВГД. В опубликованном W.C. Stewart et al. (2008) метаанализе оценена 24-часовая эффективность снижения уровня ВГД при использовании латанопроста, травопроста, биматопроста, тимолола, бримонидина и дорзоламида. Всего проанализировано 864 24-часовых суточных кривых ВГД 386 пациентов в 11 исследованиях с 1966 по 2007 г. (табл. 2).
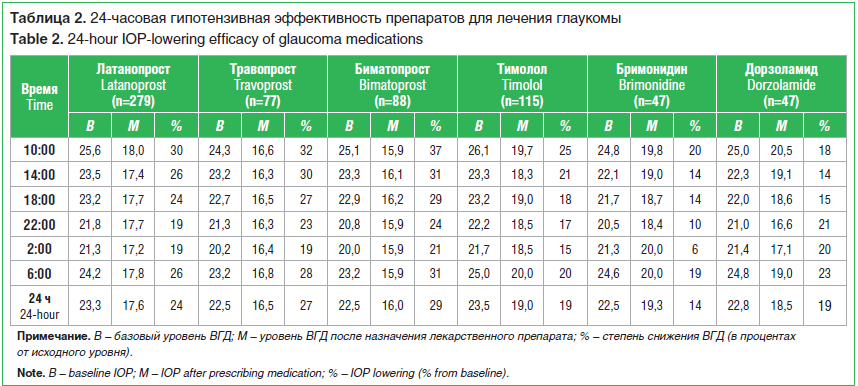
24-часовой контроль уровня ВГД показал разную эффективность препаратов в течение дня. Так, латанопрост снижал офтальмотонус на 30% в 10:00 с дальнейшей тенденцией к снижению гипотензивного эффекта в течение дня до 19%. Аналогичный результат показало использование травопроста. Тимолол поддерживал эффективность снижения ВГД на уровне 25% (утром) с постепенным снижением до 18–15% в вечернее и ночное время. Бримонидин продемонстрировал самое слабое 24-часовое снижение уровня ВГД (14%) и низкий контроль характеристик офтальмотонуса в вечернее и ночное время (от 10% до 6%), при лучшем контроле в утренние часы (19% и 20%). Дорзоламид понижал уровень ВГД на 18% утром, на 14–15% в дневное время и на 21–23% вечером [19].
С точки зрения хронофармакотерапии наибольший интерес вызывают препараты, назначаемые 1 р./сут, поскольку возникает вопрос о времени их назначения с позиций максимальной эффективности. В случае глаукомы это АПГ и ФК, куда они входят как один из компонентов. АПГ стали препаратами первого выбора благодаря своей доказанной высокой эффективности в снижении уровня ВГД от 31–33% при однократной ежедневной инстилляции, хорошему профилю безопасности и лучшим показателям комплаентности [20, 21]. В 2015 г. опубликованы результаты первого многоцентрового рандомизированного тройного слепого плацебо-контролируемого исследования влияния местной гипотензивной терапии АПГ на сохранение зрительных функций у пациентов с глаукомой: United Kingdom Glaucoma Treatment Study (UKGTS). Оценивали чувствительный критерий изменения данных стандартной автоматизированной периметрии вплоть до четвертой подряд периметрии, подтверждающей прогрессирование глаукомных дефектов поля зрения по сравнению с исходным уровнем на момент начала исследования, изменения слоя нервных волокон сетчатки и диска зрительного нерва по данным ОКТ, провели кластерный анализ в начале и в конце периода наблюдения. Достоверность результатов обеспечили частыми повторными обследованиями и достаточно большой выборкой (516 пациентов). Удалось выявить статистически значимые различия между группой латанопроста и группой плацебо уже через 1 год после начала исследования, а не только в конце 2-летнего периода наблюдения, что убедительно доказало более длительное сохранение зрения при инстилляциях латанопроста по сравнению с плацебо: ОР 0,44; 95% ДИ 0,28–0,69; p=0,0003 [22].
Первым препаратом группы АПГ, который появился в клинической практике в 1995 г., был латанопрост 0,005%, разработанный в Швеции группой ученых [23]. Именно вечерние инстилляции латанопроста в первых опубликованных работах (1995) показали хорошую эффективность снижения уровня ВГД, что и легло в основу инструкций по применению для большинства АПГ. Позже в 6-месячном рандомизированном многоцентровом исследовании с 3 параллельными группами было показано, что вечернее применение латанопроста статистически достоверно превосходит утреннее по среднему суточному снижению ВГД и составляет 31% и 27% соответственно [24].
Впрочем, последующие исследования, касающиеся этой группы препаратов, носили противоречивый характер. Так, в перекрестном исследовании А. Konstas et al. (2006) сравнивали 24-часовую эффективность латанопроста при утреннем и вечернем применении. Авторы пришли к выводу, что оба режима одинаково эффективно снижают уровень ВГД. При этом было отмечено, что в 6:00, т. е. в момент, когда уровень офтальмотонуса при глаукоме максимально повышается, оба режима одинаково эффективно понижали офтальмотонус. Опираясь на данные этих исследований, можно сделать вывод о том, что возможно для каждого пациента индивидуально выбирать время применения АПГ с учетом циркадных ритмов профиля ВГД [25].
По данным проведенного в 2010 г. метаанализа 30 исследований, включающих суммарно 1017 пациентов, установлено, что АПГ равномерно снижают ВГД в течение 24 ч и значимо одинаково эффективны при утренних и вечерних инстилляциях [26]. Изучение 2 групп пациентов (n=33), инстиллировавших травопрост в течение 8 нед. сначала утром, а затем вечером, с последующим 24-часовым контролем уровня ВГД (всего 4 измерения), статистически значимой разницы уровня офтальмотонуса не выявило. Однако при вечерних инстилляциях 24-часовые колебания уровня ВГД были значимо более стабильными (3,2±1,0 мм рт. ст.), чем при утренних (4,0±1,5 мм рт. ст.) (р<0,01) [27].
По данным проведенного в 2007 г. в США ретроспективного исследования 2 групп пациентов, инстиллировавших травопрост утром (n=18) или вечером (n=23) в течение 50 дней, общий показатель приверженности в обеих группах значимо не отличался (р=0,08). Однако пропущенных дней в утренней группе было 3,33±1,33, а в вечерней — 5,87±1,52 (p<0,001), то есть утренняя группа отличалась более высоким уровнем комплаентности [28]. Схожие результаты были представлены в работе О.А. Киселевой, А.М. Бессмертного и соавт. Исследование суточной эффективности травопроста не показало значительной разницы в уровне среднего ВГД за 24 ч при утреннем и вечернем назначении капель (p=0,33). Однако при использовании препарата вечером колебания уровня ВГД были достоверно меньше (p=0,002) относительно значений при утреннем приеме (3,0±1,2 и 3,8±1,7 мм рт. ст. соответственно) [29].
Основный механизм действия ББ — снижение выработки внутриглазной жидкости. Существуют циркадные ритмы ее выработки с тенденцией к уменьшению в ночное время, что коррелирует с более низким уровнем снижения ВГД при применении этой группы гипотензивных средств в ночное время и более выраженным гипотензивным эффектом в утренние часы [30]. Применяются ББ 2 р./сут, однако при этом они обладают рядом системных побочных эффектов (снижение частоты сердечных сокращений, риск бронхоспазма, увеличение инсулинорезистентности), что ограничивает их использование у определенной группы пациентов и нежелательно в ночное время. С целью увеличить продолжительность действия ББ и использовать их 1 р./сут, улучшая тем самым профиль безопасности, были разработаны гелевые формы тимолола для однократного введения. Пик действия таких форм достигается через 2–3 ч после применения. Исследования показали статистически значимое снижение уровня ВГД при однократном использовании препарата в утренние часы по сравнению с таковым при приеме в вечерние часы. Также проводилось многоцентровое исследование по сравнению тимолола 0,5% в виде геля при однократном использовании утром и тимолола 0,5% в виде стандартных капель (применение 2 р./сут). Уровень ВГД измерялся утром до инстилляции капель и геля, а затем через 2 ч. Были сделаны выводы, что применение гелевой формы утром было так же эффективно, как и применение стандартных капель 2 р./сут. L. Quaranta et al. (2013) в перекрестном исследовании зафиксировали одинаковую 24-часовую эффективность снижения уровня ВГД при применении тимолола 0,5% 2 р./сут и 0,1% тимолола (гелевая форма) утром [31].
ИКА согласно инструкции применяют 2–3 р./сут. По данным одних работ, они обладают сопоставимой ночной и дневной эффективностью при регулировании офтальмотонуса. По данным других исследований 24-часовой эффективности снижения уровня ВГД, дорзоламид более эффективен в ночное время [19]. Среднее снижение уровня ВГД при использовании ИКА происходит на 16% в дневное время и на 21% в ночное [24].
Препарат группы АМ бримонидин 0,2% уменьшает свой гипотензивный эффект ночью [19]. Снижение среднего 24-часового уровня ВГД при применении бримонидина (2 р./сут) составляет 14–19%. По данным некоторых исследований, минимальная эффективность приходится на поздний ночной и ранний утренний период, снижение ночной гипотензивной эффективности было сопоставимо с таковым при применении ББ [24].
Лечение с использованием ФК имеет ряд преимуществ. Они удобны в применении в связи с меньшей кратностью инстилляций и, следовательно, патологическим воздействием на эпителий роговицы и лучшими показателями комплаентности [5].
Рандомизированное двойное слепое исследование (n=195) в течение 12 нед. показало, что утреннее закапывание ФК латанопрост/тимолол (ФКЛТ) менее эффективно в снижении уровня ВГД, чем инстилляции латанопроста однократно вечером и тимолола 2 р./сут [32, 33]. Более позднее 12-недельное двойное слепое рандомизированное исследование тех же авторов (n=517) показало, что инстилляция ФКЛТ 1 раз вечером так же эффективно снижает офтальмотонус, как и совместное применение компонентов [34]. Результаты другого наблюдения: 37 ранее не получавших лечение пациентов разделили на 2 группы — одна получала вечером лечение латанопростом, другая — ФКЛТ. Через 8 нед. происходила смена режимов, было выявлено дополнительное снижение уровня ВГД на 1,5–2,9 мм рт. ст. при использовании ФКЛТ вечером [32]. В работе Д. Ловпаче показано, что на фоне применения ФКЛТ суточный профиль колебаний ВГД не отличался от физиологического и не зависел от исходного ВГД, однако при утренней инстилляции препарата суточная стабилизация была более убедительной [35].
В 3-месячном проспективном многоцентровом перекрестном исследовании (n=60) применение ФК биматопрост/тимолол (ФКБимТ), назначаемой в вечерние часы, позволило добиться снижения ВГД на 35,3% от исходного, в то время как использование инстилляций утром — на 33,8% (p=0,005) [36]. В 3-недельном двойном слепом рандомизированном исследовании А. Hommer et al. (2007) ФКБимТ сравнивали c применением биматопроста и тимолола или с монотерапией биматопростом (n=445). Утреннее применение ФКБимТ так же эффективно снижало уровень ВГД, как и сопутствующее лечение биматопростом вечером и тимололом 2 р./сут [37].
В 4-месячном исследовании у 32 пациентов определялась эффективность утреннего или вечернего применения ФК травопрост/тимолол (ФКТрТ). Было выявлено, что лучше снижение уровня ВГД происходит при утреннем использовании по сравнению с вечерним — 18,4 и 19,2 мм рт. ст. соответственно. Колебания уровня ВГД были менее выражены в первой группе — 3,8 и 5,1 мм рт. ст. соответственно [38]. В исследовании D.A. Hughes et al. (2005) средний уровень ВГД был достоверно на 1,0 мм рт. ст. ниже в 4 из 9 контрольных точек в группе, получавшей раздельные компоненты медикаментозной гипотензивной терапии ФКТрТ [39]. L. Quaranta et al. (2016) высказали предположение о том, что это может быть связано с тем, что ББ инстиллируют 2 р./сут, в то время как ФКТрТ используют 1 р./сут, и преимущественно утром [40]. Однако степень снижения уровня ВГД была выше в группе раздельного применения компонентов лишь к концу 1-го мес. наблюдения (7,7 и 8,7 мм рт. ст. соответственно), а к концу 12-го мес. эти показатели были практически идентичны (7,4 и 7,3 мм рт. ст. соответственно). Приверженность лечению была выше в группе ФКТрТ (60% и 43% соответственно) [41].
В проспективном плацебо-контролируемом исследовании с участием 2 групп пациентов, одна из которых в течение 3 мес. инстиллировала ФК тафлупрост/тимолол 0,5% утром (8:00), а другая — вечером (22:00), проводилось 24-часовое мониторирование уровня офтальмотонуса. По окончании каждого периода лечения тонометрами Гольдмана сидя (в 10:00, 14:00, 18:00, 22:00) и Перкинса лежа (в 2:00, 6:00) измерялся уровень ВГД. Результаты показали хорошее снижение среднего 24-часового ВГД в обеих группах (р<0,001). Однако вечерние инстилляции обеспечивали более низкие значения уровня ВГД в 4 временных точках между 6:00 и 18:00 и лучший профиль суточного ВГД (р<0,05) [42].
Заключение
Несмотря на большое количество и объем выполненных исследований, не получен однозначный ответ на вопрос об оптимальном времени инстилляции антиглаукомных капель. С учетом понимания, что уровень ВГД не является постоянным показателем, целью медикаментозной терапии глаукомы является минимизация суточных флуктуаций и стабильное снижение офтальмотонуса в течение 24 ч. Правильным решением, возможно, может стать индивидуализированный подход к лечению каждого пациента с учетом знания суточного профиля ВГД, возраста, скорости прогрессирования заболевания. Лечение должно выстраиваться так, чтобы целевой уровень ВГД определялся в том числе и на основе информации о 24-часовой эффективности препаратов. Все это может быть достигнуто путем улучшения фармакотерапии глаукомы с использованием индивидуализированного подхода с применением хронофармакотерапии в ежедневной практике лечения таких пациентов.
Сведения об авторах:
1Гетманова Анастасия Михайловна — врач-офтальмолог, ORCID iD 0000-0002-4900-6193;
2Брежнев Андрей Юрьевич — к.м.н., доцент кафедры офтальмологии, ORCID iD 0000-0002-5597-983X;
3Газизова Ильмира Рифовна — д.м.н., заведующая отделением, ORCID iD 0000-0003-4611-9931;
4,5Куроедов Александр Владимирович — д.м.н., профессор кафедры офтальмологии, начальник офтальмологического отделения, ORCID iD 0000-0001-9606-0566;
6Онуфрийчук Олег Николаевич — к.м.н., врач-офтальмолог, ORCID iD 0000-0001-6841-3547.
1ГАУЗ «Брянская областная больница № 1». 241033, Россия, г. Брянск, пр-т Станке Димитрова, д. 86.
2ФГБОУ ВО КГМУ Минздрава России. 305041, Россия, г. Курск, ул. Карла Маркса, д. 3.
3ФГБНУ «ИЭМ». 197376, Россия, г. Санкт-Петербург, ул. Академика Павлова, д. 12.
4ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России. 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А.
5ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
6ФГБУ «НИДОИ им. Г.И. Турнера» Минздрава России. 196603, Россия, г. Санкт-Петербург, г. Пушкин, ул. Парковая, д. 64–68.
Контактная информация: Гетманова Анастасия Михайловна, e-mail: anastasiagetmanova@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 18.03.2020.
About the authors:
1Anastasiya M. Getmanova — MD, ophthalmologist, ORCID iD 0000-0002-4900-6193;
2Andrey Yu. Brezhnev — MD, PhD, Associate Professor of the Department of Ophthalmology, ORCID iD 0000-0002-5597-983X;
3Ilmira R. Gazizova — MD, PhD, Head of the Department, ORCID iD 0000-0003-4611-9931;
4,5Aleksandr V. Kuroyedov — MD, PhD, Professor of the Department of Ophthalmology, Head of the Division of Ophthalmology, ORCID iD 0000-0001-9606-0566;
6Oleg N. Onufriichuk — MD, PhD, ophthalmologist, ORCID iD 0000-0001-6841-3547.
1Bryansk Regional Hospital. 86, Stanke Dimitrov av., Bryansk, 241033, Russian Federation.
2Kursk State Medical University. 3, Karl Marks str., Kursk, 305041, Russian Federation.
3Institute of Experimental Medicine of the Russian Academy of Sciences. 12, Academician Pavlov str., St. Petersburg, 197376, Russian Federation.
4P.V. Mandryka Military Clinical Hospital. 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation.
5Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117437, Russian Federation.
6G.I. Turner National Medical Research Center for Children’s Orthopedics and Trauma Surgery. 64–68, Parkovaya str., Pushkin, 196603, Russian Federation.
Contact information: Anastasiya M. Getmanova, e-mail: anastasiagetmanova@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 18.03.2020.
2. Офтальмология: Национальное руководство. М.: ГЭОТАР-Медиа; 2018.
3. Tanna A.P., Johnson M. Ophthalmology. 2018;125(11):1741–1756. DOI: 10.1016/j.ophtha.2018.04.040.
4. Петров С.Ю., Сафонова Д.М. Ингибиторы Rho-киназы — новые препараты местной гипотензивной терапии глаукомы. Национальный журнал глаукома. 2014;13(4):92–100.
5. Егоров Е.А., Астахов Ю.C., Еричев В.П. Национальное руководство по глаукоме. М.: ГЭОТАР-Медиа; 2015.
6. Wagh D.W. Chronobiology, Circadian Variations and Chronotherapy of Glaucoma. JChrDD. 2013;4(2–3):45–52.
7. Гуськова Т.А., Либерман С.С. Значение хронобиологии для фармакологических и токсикологических исследований. Фармакология и токсикология. 1987;50(4):111–118.
8. Масленников А.И. О суточных колебаниях внутриглазного давления при глаукоме. Вестник офтальмологии. 1905;3:237–263.
9. Устинова Е.И. Методы ранней диагностики глаукомы. М.: Медицина; 1966.
10. Mansouri K., Weinreb R.N., Medeiros F.A. Is 24-hour intraocular pressure monitoring necessary in glaucoma? Semin Ophthalmol. 2013;28(3):157–164. DOI: 10.3109/08820538.2013.771201.
11. Куроедов А.В., Брежнев А.Ю., Егоров Е.А. и др. Производные характеристики офтальмотонуса у пациентов с первичной открытоугольной глаукомой до и после оперативного лечения при круглосуточном мониторировании с применением современных технологий (пилотное исследование). РМЖ. Клиническая офтальмология. 2016;2:65–74. DOI: 10.21689/2311-7729-2016-16-2-65-74.
12. Брежнев А.Ю., Баранов В.И., Куроедов А.В. и др. Суточный мониторинг внутриглазного давления: возможности и перспективы. Национальный журнал глаукома. 2018;17(3):77–85. DOI: 10.25700/NJG.2018.03.09.
13. Брежнев А.Ю. Особенности медикаментозного лечения псевдоэксфолиативной глаукомы. РМЖ. Клиническая офтальмология. 2016;4:220–223. DOI: 10.21689/2311-7729-2016-16-4-220 223.
14. Kim J.H., Caprioli J. Intraocular Pressure Fluctuation: Is It Important? J Ophthalmic Vis Res. 2018;13(2):170–174. DOI: 10.4103/jovr.jovr_35_18.
15. Quaranta L., Katsanos A., Russo A., Riva I. 24-hour intraocular pressure and ocular perfusion pressure in glaucoma. Surv Ophthalmol. 2013;58(1):26–41. DOI: 10.1016/j.survophthal.2012.05.003.
16. Caprioli J., Coleman A.L. Intraocular pressure fluctuation a risk factor for visual field progression at low intraocular pressures in the advanced glaucoma intervention study. Ophthalmology. 2008;115(7):1123–1129. DOI: 10.1016/j.ophtha.2007.10.031.
17. Asrani S., Zeimer R., Wilensky J. et al. Large diurnal fluctuations in intraocular pressure are an independent risk factor in patients with glaucoma. J Glaucoma. 2000;9(2):134–142. DOI: 10.1097/00061198-200004000-00002
18. Matlach J., Bender S., König J. et al. Investigation of intraocular pressure fluctuation as a risk factor of glaucoma progression. Clin Ophthalmol. 2018;13:9–16. DOI: 10.2147/OPTH.S186526.
19. Stewart W.C., Konstas A.G., Nelson L.A. et al. Meta-analysis of 24-hour intraocular pressure studies evaluating the efficacy of glaucoma medicines. Ophthalmology. 2008;115:1117–1122. DOI: 10.1016/j.ophtha.2007.10.004.
20. Авдеев Р.В., Александров А.С., Бакунина Н.А. и др. Сопоставление режимов лечения больных первичной открытоугольной глаукомой с характеристиками прогрессирования заболевания. Часть 2. Эффективность инициальных режимов гипотензивного лечения. Национальный журнал глаукома. 2018;17(2):65–83.
21. Gazizova I., Avdeev R., Aleksandrov A. et al. Multicenter study of intraocular pressure level in patients mith moderate and advanced primary open-angle glaucoma on treatment. Invest Ophthalmol Vis Sci. 2016;57(12):6470. DOI: 10.17816/OV2015143-60.
22. Garway-Heath D.F., Crabb D.P., Bunce C. et al. Latanoprost for open-angle glaucoma (UKGTS): A randomised, multicentre, placebocontrolled trial. Lancet. 2015;385:1295–1304. DOI: 10.1016/S01406736(14)62111-5.
23. Астахов Ю.С., Нечипоренко П.А. Аналоги простагландинов: прошлое, настоящее и будущее. Офтальмологические ведомости. 2017;10(1):40–52. DOI: 10.17816/OV10140-52.
24. Konstas А., Quaranta L., Bozkurt B. et al. 24-h Efficacy of Glaucoma Treatment Options. Adv Ther. 2016;33:481–517. DOI:10.1007/s12325–016–0302–0.
25. Konstas A.G., Mikropoulos D., Kaltsos К. et al. 24-hour intraocular pressure control obtained with evening- versus morning-dosed travoprost in primary open-angle glaucoma. Ophthalmology. 2006;113(3):446–500. DOI: 10.1016/j.ophtha.2005.10.053.
26. Ford B.A, Gooi M., Carlsson A., Crichton A.C. Morning dosing of once-daily glaucoma medication is more convenient and may lead to greater adherence than evening dosing. J Glaucoma. 2013;22(1):1–4. DOI: 10.1097/IJG.0b013e31822e622f.
27. Riva I., Katsanos A., Floriani I. et al. Long-term 24-hour intraocular pressure control with travoprost monotherapy in patients with primary open-angle glaucoma. J Glaucoma. 2014;23(8):535–540. DOI: 10.1097/IJG.0000000000000073.
28. Kahook M.Y., Noecker R.J. Evaluation of adherence to morning versus evening glaucoma medication dosing regimens. Clin Ophthalmol. 2007;1(1):79–83.
29. Киселева О.А., Бессмертный А.М., Якубова Л.В. и др. Эффективность и безопасность препарата Травапресс у пациентов с первичной открытоугольной глаукомой. Вестник офтальмологии. 2019;135(1):67–73. DOI: 10.17116/oftalma201913501167.
30. Lee P.W., Doyle A., Stewart J.A. et al. Metaanalysis of timolol on diurnal and nighttime intraocular pressure and blood pressure. Eur J Ophthalmol. 2010;20(6):1035–1041. DOI: org/10.1177/112067211002000602.
31. Quaranta L., Katsanos A., Floriani I. et al. Circadian intraocular pressure and blood pressure reduction with timolol 0.5% solution and timogel 0.1% in patients with primary open-angle glaucoma. J Clin Pharmacol. 2012;52(10):1552–1557. DOI: 10.1177/0091270011420254.
32. Higginbotham E.J., Olander K.W., Kim E.E. et al. Fixed combination of latanoprost and timolol vs individual components for primary open-angle glaucoma or ocular hypertension. Arch Ophthalmol. 2010;28(2):165–172. DOI: 10.1001/archophthalmol.2009.384.
33. Diestelhorst M., Larsson L.I., European Latanoprost Fixed Combination Study Group A 12 week study comparing the fixed combination of latanoprost and timolol with the concomitant use of the individual components in patients with open angle glaucoma and ocular hypertension. Br J Ophthalmol. 2004;88(2):199–203. DOI: 10.1136/bjo.2003.018234.
34. Diestelhorst M., Larsson L.I. European-Canadian Latanoprost Fixed Combination Study Group A 12-week, randomized, double-masked, multicenter study of the fixed combination of latanoprost and timolol in the evening versus the individual components. Ophthalmology. 2006;113(1):70–76. DOI: 10.1016/j.ophtha.2005.06.027.
35. Ловпаче Дж.Н. Опыт применения фиксированной комбинации Дуопрост (Rompharm Company) у пациентов с развитой стадией ПОУГ. Российский офтальмологический журнал. 2015;9(2):83–87.
36. Konstas A.G., Holló G., Mikropoulos D. et al. Twenty-four-hour intraocular pressure control with bimatoprost and the bimatoprost/timolol fixed combination administered in the morning, or evening in exfoliative glaucoma. Br J Ophthalmol. 2010;94(2):209–213. DOI: 10.1136/bjo.2008.155317.
37. Hommer A. Ganfort Investigators Group I A double-masked, randomized, parallel comparison of a fixed combination of bimatoprost 0.03% / timolol 0.5% with non-fixed combination use in patients with glaucoma or ocular hypertension. Eur J Ophthalmol. 2007;17(1):53–62. DOI: 10.1177/112067210701700436.
38. Schuman J.S., Katz G.J., Lewis R.A. et al. Efficacy and safety of a fixed combination of travoprost 0.004%/timolol 0.5% ophthalmic solution once daily for open-angle glaucoma or ocular hypertension. Am J Ophthalmol. 2005;140(2):242–250. DOI: 10.1016/j.ajo.2005.02.058.
39. Hughes B.A., Bacharach J., Craven E.R. et al. A three-month, multicenter, double-masked study of the safety and efficacy of travoprost 0.004% / timolol 0.5% ophthalmic solution compared to travoprost 0.004% ophthalmic solution and timolol 0.5% dosed concomitantly in subjects with open angle glaucoma or ocular hypertension. J Glaucoma. 2005;14(5):392–399. DOI: 10.1097/01.ijg.0000176935.08392.14.
40. Quaranta L., Biagioli E., Riva I. et al. Prostaglandin analogs and timolol-fixed versus unfixed combinations or monotherapy for open-angle glaucoma: A systematic review and meta-analysis. J Ocul Pharmacol Ther. 2013;29(4):382–389. DOI: 10.1089/jop.2012.0186.
41. Нагорнова З.М., Куроедов А.В., Селезнев А.В. Сравнительный анализ эффективности и безопасности применения фиксированных комбинаций и их отдельных компонентов в лечении пациентов с первичной открытоугольной глаукомой. РМЖ. Клиническая офтальмология. 2019;19(1):13–19. DOI: 10.21689/2311-7729-2019-19-1-13-19.
42. Konstas A.G., Katsanos A., Athanasopoulos G.P. et al. Preservative-free tafluprost/timolol fixed combination: comparative 24-h efficacy administered morning or evening in open-angle glaucoma patients. Exp Opin Pharm. 2018;19(18):1981–1988. DOI: 10.1080/14656566.2018.1534958.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

