Результаты анализа сетчатки при сочетанной патологии миопии средней степени и возрастной макулярной дегенерации. Подходы к лечению
Цель исследования: оценка состояния сетчатки при сочетанной патологии: миопии средней степени и возрастной макулярной дегенерации (ВМД) разных стадий с помощью современных методов диагностики.
Материал и методы: обследовано 48 пациентов (96 глаз) с миопией средней степени и «сухой» формой ВМД. Проанализированы максимально корригированная острота зрения (МКОЗ); показатели светочувствительности сетчатки: MD (mean deviation) — среднее отклонение, отражающее среднее снижение светочувствительности, и PSD (pattern standard deviation) — паттерн стандартного отклонения, характеризующий выраженность локальных дефектов по данным компьютерной периметрии Humphrey; центральная толщина сетчатки (ЦТС); переднезадняя ось глаза (ПЗО); состояние макулярной зоны сетчатки по данным оптической когерентной томографии (ОКТ) в режиме β-сканирования и аутофлуоресценции (АФ).
Результаты исследования: выявлено, что при сочетанной патологии (миопия средней степени и «сухая» форма ВМД (категории AREDS 1, 2, 3)) у 54,2% (26 человек, 52 глаза) среднее значение МКОЗ было достоверно снижено и составило 0,8; показатели светочувствительности сетчатки также были достоверно снижены и составили: MD — 2,19 dB (р<0,001) PSD — 2,14 dB (р<0,001). Выявлено достоверное увеличение ПЗО до 25,11 мм (р<0,001); ЦТС статистически значимо не различалась и была равна 233 мкм (р=0,123). При сочетанной патологии органа зрения могут наблюдаться следующие морфологические изменения глазного дна: грубые дефекты и фокусы атрофии пигментного эпителия сетчатки, протяженные участки поражения линии сочленения наружных и внутренних сегментов, разнокалиберные друзы. По данным АФ выявлены следующие патологические паттерны: фокальная гипо- и гипераутофлуоресценция, гипераутофлюоресцентный участок по краю стафиломы, линейные гипоаутофлуоресцентные полосы, окруженные гипераутофлуоресценцией, ретикулярный паттерн, пятнистый паттерн, унифокальная и мультифокальные области географической атрофии.
Заключение: полученные результаты, свидетельствующие о потере поля зрения (MD, PSD) при ВМД в зависимости от стадии, данные ОКТ при ВМД совпадают с данными других авторов, однако нами проанализирована коморбидная форма (сочетание ВМД с миопией средней степени), сопоставлены морфологические и функциональные показатели с выявлением роли АФ.
Ключевые слова: миопия, возрастная макулярная дегенерация, оптическая когерентная томография, аутофлуоресценция.
Для цитирования: Мошетова Л.К., Алексеев И.Б., Воробьева И.В., Нам Ю.А. Результаты анализа сетчатки при сочетанной патологии миопии средней степени и возрастной макулярной дегенерации. Подходы к лечению. РМЖ. «Клиническая Офтальмология». 2022;22(2):91-98. DOI: 10.32364/2311-7729-2022-22-2-91-98.
L.K. Moshetova1, I.B. Alekseev1–3, I.V. Vorob’eva1,2, Yu.A. Nam3
1Russian Medical Academy of Continuous Professional Education, Moscow,
Russian Federation
2S.P. Botkin City Clinical Hospital, Moscow, Russian Federation
3Treatment Rehabilitation Center of the Ministry of Economic Development, Moscow,
Russian Federation
Aim: to assess retinal status in comorbid ocular disorders (moderate myopia and age-related macular degeneration/AMD of various stages) using modern diagnostic tools.
Patients and Methods: 48 patients (96 eyes) with moderate myopia and dry AMD were enrolled. Best-corrected visual acuity (BCVA), mean deviation/MD (characterizes mean reduction of sensitivity), pattern standard deviation/PSD (characterizes the severity of local visual field defects), central macular thickness (CMT), and axial length (AL) were measured. The macular zone was investigated by optical coherence tomography (OCT) using B scan and fundus autofluorescence (FAF) regimens.
Results: in moderate myopia associated with dry AMD (AREDS categories 1,2,3), a significant reduction in the mean BCVA (20/25) was detected in 54.2% (26 patients, 52 eyes). Retinal photosensitivity indices (MD and PSD) were also significantly reduced to 2.19 dB (р<0.001) and 2.14 dB (р<0.001), respectively. AL was significantly increased (25.11 mm, р<0.001). No significant differences in CMT values were revealed (233 mcm, p=0.123). In comorbid ocular disorders, severe defects and focuses of RPE atrophy, extensive areas of the IS/OS junction line damage, and drusen are seen among morphological abnormalities of the eye fundus. FAF identified certain pathological patterns, e.g., focal hypo- and hyperautofluorescence, hyperautofluorescent halo at the border of staphyloma, linear hypoautofluorescent bands surrounded with hyperautofluorescence, reticular pattern, patches, focal and multifocal areas of geographic atrophy.
Conclusion: our findings on visual field loss (MD, PSD) in AMD depending on stage and OCT findings in AMD are in line with the results of other authors. Meanwhile, we investigated a comorbid variant (AMD in association with moderate myopia), compared morphological and functional parameters, and addressed the relevance of FAF.
Keywords: myopia, age-related macular degeneration, optical coherence tomography, autofluorescence.
For citation: Moshetova L.K., Alekseev I.B., Vorob’eva I.V., Nam Yu.A. Retinal status in moderate myopia and age-related macular degeneration. Management strategies. Russian Journal of Clinical Ophthalmology. 2022;22(2):91–98 (in Russ.). DOI: 10.32364/2311-7729-2022-22-2-91-98.
Введение
В последнее десятилетие в мире отмечается неуклонный рост двух социально значимых заболеваний: возрастной макулярной дегенерации и миопии [1–5]. Одна из серьезных проблем здравоохранения — сочетанная патология: близорукость и возрастная макулярная дистрофия (ВМД). Во всем мире, по оценкам экспертов, 153 млн человек старше 5 лет уже имеют зрительные расстройства из-за некорригированной миопии и других аномалий рефракции, из них 8 млн — слепые [6]. Более 30 млн человек в мире, в том числе более 12 млн европейцев, потеряли зрение из-за ВМД [7]. Поиск связи между аномалиями рефракции и ВМД проводили и ранее. Так, в 1991 г. исследование Beaver Dam Eye Study [8] и норвежское исследование 2018 г. [9] показали, что исходная рефракция не имела связи с наличием ранней либо поздней стадий ВМД, однако в 2003 г. в Роттердамском исследовании [10] выявили, что усиление рефракции в сторону гиперметропии было связано c уже имеющейся или развивающейся ВМД. В свою очередь, исследования 2010 г. в Сингапуре [11] показали, что каждый миллиметр уменьшения переднезадней оси глаза (ПЗО) увеличивает шансы на развитие ВМД.
В случае с миопией изменения глазного дна и необратимое снижение зрения, как правило, связаны с развитием миопической макулопатии, особенно при увеличении ПЗО более 26,5 мм [12–15]. При миопии средней или высокой степени оценка стадии ВМД часто вызывает определенные диагностические сложности, поскольку изменения заднего полюса глаза при развитых или далеко зашедших стадиях обеих патологий имеют схожие характеристики и определить первопричину заболевания не всегда представляется возможным.
В настоящее время офтальмологическое сообщество широко использует в повседневной практике оптическую когерентную томографию (ОКТ) с аутофлуоресценцией (АФ) глазного дна, что позволяет выявить очаги атрофии или деструкции в слоях сетчатки и дифференцировать степень их выраженности [16–21]. С учетом того, что морфологические и функциональные характеристики органа зрения при коморбидной патологии (сочетание миопии средней степени с разными стадиями ВМД) недостаточно изучены, проведено данное исследование.
Цель исследования: оценка состояния сетчатки при сочетанной патологии: миопии средней степени и ВМД разных стадий с помощью современных методов диагностики.
Материал и методы
Обследовано 48 пациентов (96 глаз) с сочетанной глазной патологией — миопией средней степени и «сухой» формой ВМД. Средний возраст обследованных составил 55,5 года. Пациенты были разделены на 3 группы в зависимости от стадии ВМД согласно классификации AREDS. К категории AREDS 1 были отнесены 10 человек (20 глаз), к категории AREDS 2 — 25 человек (50 глаз), к категории AREDS 3 — 13 человек (26 глаз). Всем пациентам было проведено комплексное офтальмологическое обследование с оценкой максимально корригированной остроты зрения (МКОЗ), внутриглазного давления (ВГД), биомикроскопия с биомикроофтальмоскопией, а также компьютерная периметрия Humphrey (Carl Zeiss Meditec, Германия), ОКТ на приборе Spectralis HRA + OCT (Heidelberg Engineering, Германия), определяли ПЗО на приборе Ultrasonic A/B scanner and biometer UD 6000 (Tomey, Япония).
Критерии включения: наличие любых неэкссудативных изменений глазного дна, возраст пациентов старше 44 лет, миопия средней степени. Критерии исключения: последствия острой сосудистой патологии, диабетическая ретинопатия, отслойка сетчатки, травмы глаза в анамнезе, глаукома, воспалительные процессы глаз, непрозрачность оптических сред, ухудшающая ОКТ-визуализацию.
Статистический анализ выполнен с помощью специализированного программного обеспечения IBM SPSS Statistics 21. Для представления результатов использовался табличный процессор MS Office Excel 2010. Количественные признаки проверены на нормальность распределения с помощью критерия Колмогорова — С мирнова. В большинстве случаев распределение признаков во всей выборке и в подгруппах сравнения не подчинялось нормальному закону и для описания данных признаков использовались медиана, первый и третий квартиль (Me [Q1; Q3]), а для последующего сравнительного анализа были применены методы непараметрической статистики. При проверке статистических гипотез пороговый уровень значимости (р) принимался равным 0,05.
Результаты исследования
Биомикроскопия переднего отрезка глаза соответствовала возрастной норме: роговица имела признаки arcus senilis у 38,8% (17 человек, 31 глаз); радужка с признаками субатрофии — у 66,6% (31 человек, 62 глаза); пигментная кайма с признаками частичной деструкции — у 65,5% (30 человек, 59 глаз). У 79,3% пациентов выявлены начальные помутнения в ядерных и кортикальных слоях хрусталиков (36 человек, 69 глаз), у 92,4% (42 человека, 81 глаз) — деструкция стекловидного тела.
Клиническая картина глазного дна при биомикроофтальмоскопии выглядела следующим образом: у 82,3% пациентов (40 человек, 78 глаз) наблюдались миопические конусы различной величины и формы; расширение склерального кольца выявлено у 73,7% (35 человек, 70 глаз); стафиломы 3-го типа — у 39,5% (19 человек, 28 глаз). С учетом величин миопических конусов выделены некоторые перипапиллярные изменения, а именно: склеральное кольцо — у 20,7% (8 человек, 16 глаз), конусы малых размеров — у 48,2% (19 человек, 38 глаз), конусы средних размеров — у 31,1% (12 человек, 24 глаза). С учетом состояния макулярной зоны выделены 3 стадии изменений:
I стадия — отсутствие ареолярных рефлексов — у 85,3% обследованных (41 человек, 82 глаза), II стадия — макула имела пигментированный вид или «паркетный» тип — у 17,1% (16 глаз, 9 человек), III стадия — фовеа имела неравномерную пигментацию по типу ткани, «изъеденной молью», — у 37,1% (22 человека, 36 глаз).
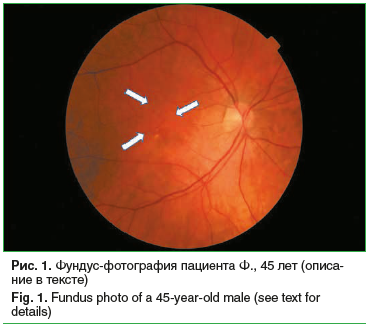
На рисунке 1 представлена фундус-фотография пациента с миопией средней степени и «сухой» формой ВМД, категория 2 AREDS: определяются «сухие» твердые друзы малого и среднего размера, дезорганизация пигментного эпителия сетчатки (ПЭС); указаны стрелками), на видимой периферии сетчатка имеет «паркетный» вид. МКОЗ – 0,7.
Анализ МКОЗ выявил, что в 45,8% случаев она была высокой и составила 0,9 у 27,0% (14 человек, 28 глаз) и 1,0 у 18,8% (8 человек, 16 глаз), у остальных пациентов МКОЗ была снижена. Среднее значение сферического эквивалента (SE) составило -4,76 [-5,46; -4,1] диоптрии (p<0,001).
Согласно нашим данным светочувствительность сетчатки достоверно ухудшается от AREDS 1 к AREDS 3 (см. таблицу). Показатель светочувствительности сетчатки PSD (pattern standard deviation) — паттерн стандартного отклонения, характеризующий выраженность локальных дефектов по данным компьютерной периметрии Humphrey, — также имел статистически значимые отклонения от нормы.
Анализ ПЗО выявил статистически значимое увеличение длины глаза у пациентов с миопией средней степени и различными категориями ВМД, среднее значение которого составило 25,11 мм.![Таблица. Показатели светочувствительности, ЦТС и ПЗО у обследованных пациентов (Me [Q1; Q3]) Table. Mean deviation, central macular thickness, and axial length in participants, Me [Q1; Q3] Таблица. Показатели светочувствительности, ЦТС и ПЗО у обследованных пациентов (Me [Q1; Q3]) Table. Mean deviation, central macular thickness, and axial length in participants, Me [Q1; Q3]](/upload/medialibrary/261/91-2.png)
Анализ центральной толщины сетчатки (ЦТС) статистически значимых различий у пациентов не выявил. При внутригрупповом сравнении достоверных различий также выявлено не было.
При ОКТ макулярной зоны сетчатки выявлены грубые дефекты ПЭС и фокусы атрофии ПЭС у 88,7% (43 человека, 85 глаз), протяженные участки поражения линии сочленения наружных и внутренних сегментов фоторецепторов с диффузной локализацией в 97,3% случаев (46 человек, 92 глаза).
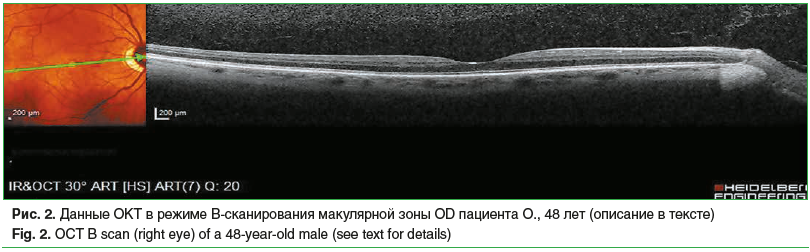
В группе пациентов с категорией 1 по AREDS (10 человек, 20 глаз — 22,7%) выявлены единичные мелкие «сухие» друзы и частичная альтерация сегментов фоторецепторов у 8,1% обследованных (4 человека, 8 глаз), у 12,4% (6 человек, 12 глаз) определялись окончатые дефекты ПЭС. На рисунке 2 представлеы данные ОКТ в режиме B-сканирования макулярной зоны правого глаза пациента с участками разрушения линии соединения наружных и внутренних сегментов фоторецепторов в макулярной зоне.
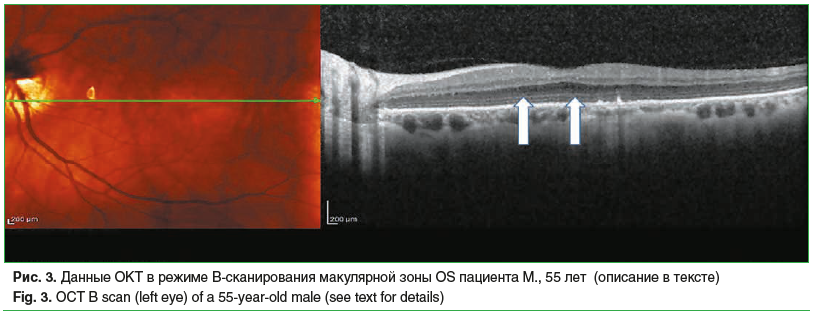
Категории AREDS 2 соответствовали 52,5% пациентов (25 человек, 50 глаз), у которых выявлены множественные друзы малых и средних размеров. У 35,3% больных (17 человек, 33 глаза) выявлены дефекты ПЭС, мелкие друзы и единичные друзы среднего размера, пигментный эпителий имел волнообразный вид. У 12,5% пациентов (8 человек, 15 глаз) выявлены участки разрушения линии соединения наружных и внутренних сегментов фоторецепторов. На рисунке 3 представлены данные ОКТ пациента с мелкими «сухими» друзами, единичными друзами среднего размера, волнообразным ходом ПЭС, альтерацией линии соединения наружных и внутренних сегментов фоторецепторов в макулярной зоне (обозначены стрелками).
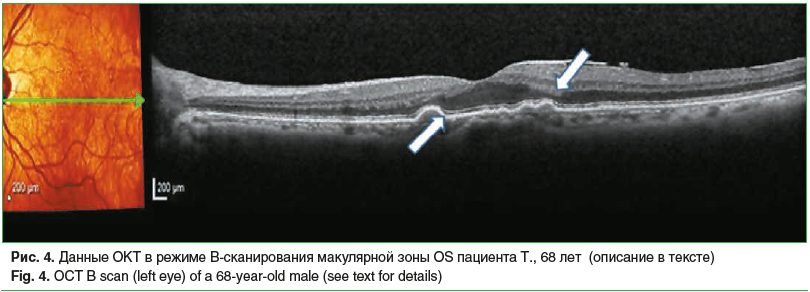
К категории AREDS 3 отнесены 25,2% пациентов (13 человек, 26 глаз). В 100% случаев у пациентов данной группы определялось множество друз среднего размера. У 5,3% (5 человек, 7 глаз) выявлена географическая атрофия, расположенная экстрафовеолярно. У 7,3% исследуемых (7 человек, 13 глаз) отмечены крупные мягкие друзы (диаметром ≥125 микрон) с волнистым видом пигментного эпителия, а также отмечались дефекты ПЭС и нарушение линии соединения наружных и внутренних сегментов фоторецепторов. На рисунке 4 представлены данные ОКТ пациента с друзами среднего размера, крупной друзой, дефектами ПЭС и слоя фоторецепторов в макулярной зоне (обозначены стрелками).
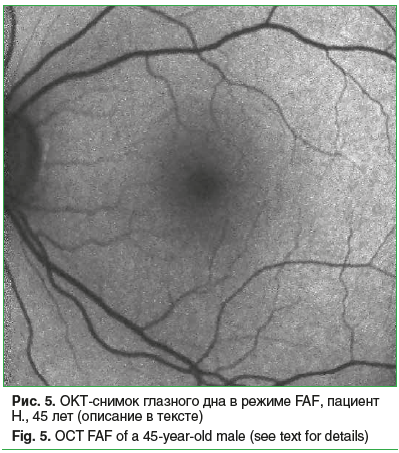
По данным аутофлюоресцентного анализа у 6% исследуемых (3 человека, 4 глаза) выявлена нормальная АФ, которая представляла собой однородный фон монотонно серого цвета с постепенным уменьшением градиента яркости во внутреннем отделе макулы по направлению к фовеа из-за маскирующего эффекта макулярного пигмента (рис. 5).
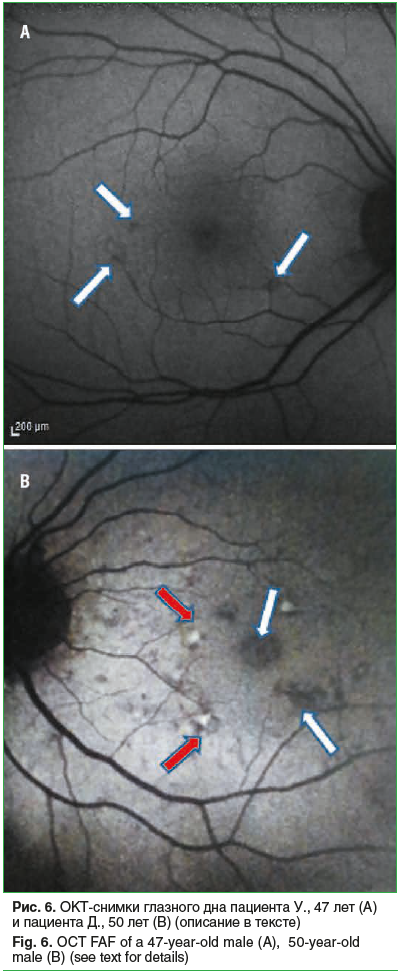
За счет экранирования АФ сосуды выглядели темными, а диск зрительного нерва имел черный цвет из-за отсутствия флуорофоров. Минимальные изменения по типу фокальной гипоаутофлуоресценции выявлены у 26,1% исследуемых (13 человек, 24 глаза), по типу фокальной гипераутофлуоресценции — у 15,2% (7 человек, 12 глаз) (рис. 6А). Данные паттерны АФ соответствовали дефектам в слое ПЭС и неоднородности рисунка пигментного эпителия; гипераутофлюоресцентный участок по краю стафиломы определялся у 37,4% (18 человек, 32 глаза) и соответствовал области перипапиллярной атрофии ПЭС. У 4,1% (2 человека, 2 глаза) выявлены линейные гипоаутофлуоресцентные полосы, окруженные гипераутофлуоресценцией, исходящей от верхней границы стафиломы. У 14,6% (7 человек, 11 глаз) выявлен ретикулярный паттерн, который выглядел как множественные фокусы гипоаутофлуоресценции с более яркой линейной АФ между ними (рис. 6А, красные стрелки), а пятнистый паттерн — у 9,1% (4 человека, 6 глаз) в виде нескольких крупных (>200 мкм в диаметре) участков гипераутофлуоресценции, соответствующей крупным мягким друзам (рис. 6B, белые стрелки).
У 11,5% обследованных (6 человек, 12 глаз) выявлялась унифокальная область географической атрофии (ГА), а у 17,5% (8 человек, 15 глаз) — мультифокальные области ГА. Такие изменения представляли собой четко очерченные участки депигментации с гипертрансмиссией в глубокие сосуды хориоидеи с выраженной гипоаутофлуоресценцией из-за отсутствия ПЭС, с парафовеальной локализацией в макуле и/или с распространением на области перипапиллярной атрофии. Новые очаги ГА имели более низкую интенсивность гипоаутофлуоресценции и выглядели светлее, а прилежащие к зоне атрофии участки имели выраженную интенсивность АФ.
Обсуждение
При анализе у пациентов с сочетанной патологией — миопией средней степени и «сухой» формой ВМД (категории AREDS 1, 2, 3) выявлены функциональные изменения в виде статистически значимого снижения МКОЗ до 0,8 у 54,2% пациентов, умеренного снижения показателей светочувствительности центрального поля зрения сетчатки. Также выявлено достоверное увеличение ПЗО. Центральная толщина сетчатки у пациентов с миопией средней степени претерпевала изменения в зависимости от стадии сопутствующей ВМД (AREDS 1, 2, 3), Ц dо изменения были статистически незначимы. Таким образом, полученные нами данные по снижению светочувствительности сетчатки при ВМД совпадали с результатами других авторов [27, 28] и зависели от стадии ВМД.
В нашем исследовании проанализирована коморбидная патология, сопоставлены морфологические и функциональные данные при миопии средней степени и «сухой» форме ВМД. Основные отличия проявлялись в следующем: изменения ПЭС и мембраны Бруха выявлены при разных стадиях ВМД, а при миопии средней степени чаще отмечали различные по размеру фокусы атрофии всех слоев сетчатки.
При сочетанной патологии глазного дна по данным ОКТ выявлены рЦ 0зличные морфологические изменения, а именно: грубые дефекты ПЭС и фокусы атрофии ПЭС, протяженные участки поражения линии сочленения наружных и внутренних сегментов фоторецепторов с диффузной локализацией. При этом увеличение количества друз разного размера зависело от стадии ВМД. Полученные результаты ОКТ при ВМД совпадают с данными других авторов [29]. Выявлено, что АФ играет ключевую роль в доклинической диагностике ранних стадий ВМД. Так, если у пациентов отсутствуют изменения на глазном дне при офтальмоскопии, то появление гипераутофлуоресценции является важнейшим признаком повышенного накопления липофусцина, что позволяет расценивать метод АФ в качестве метода ранней диагностики ВМД. Морфологические изменения в пигментном эпителии и мембране Бруха в виде искажения, неровности появляются позже.
Снижение активности антиоксидантной системы и истончение ПЭС являются основными причинами раннего развития и прогрессирования дегенеративных заболеваний сетчатки. Особая роль в осуществлении антиоксидантной защиты отводится каротиноидам из класса ксантофиллов — лютеину и зеаксантину. Установлено, что каротиноиды являются оптическим фильтром для синего цвета, таким образом, обеспечивая антиоксидантную защиту сетчатки, подавляя перекисное окисление длинноцепочечных полиненасыщенных жирных кислот. С учетом того, что ксантофиллы не синтезируются в организме, важным моментом является определение устойчивости к фотострессу в зависимости от их поступления в качестве пищевых добавок [23]. Результаты исследований AREDS 1 [30], AREDS 2 [24] и LUNA [31] подтвердили, что прием комбинации лютеин + зеаксантин приводил к снижению риска развития поздних стадий ВМД на 10%, а неоваскуляризации — на 11%. Прием лютеина и зеаксантина в составе формулы AREDS 2 снижал вероятность прогрессирования ВМД на 20%. Усовершенствованная формула AREDS 2 включает 500 мг витамина С, 400 МЕ (268 мг) витамина Е, 10 мг лютеина, 2 мг зеаксантина, 25 мг оксида цинка и 2 мг оксида меди. Яркими представителями нутрицевтиков, состав которых приближен к формуле AREDS 2, являются Окувайт Макс (включает 10 мг лютеина, 2 мг зеаксантина, 15 мг цинка, 180 мг витамина С, 30 мг витамина Е и 150 мг докозагексаеновой кислоты) и Окувайт Форте (включает 6 мг лютеина, 0,5 мг зеаксантина, 5 мг цинка, 120 мкг селена, 60 мг витамина С, 8,8 мг витамина Е), опыт применения которого в России составляет более 10 лет. Данные препараты имеют сбалансированную формулу каротиноидов, витаминов и минералов, их состав близок по значениям к рекомендуемому уровню суточного потребления витаминов и минерал ов согласно Единым санитарно-гигиеническим требованиям РФ. Окувайт Макс [32] назначается также пациентам с высоким риском развития «влажной» формы ВМД, в первую очередь для людей с затруднением при глотании капсул и таблеток (имеет удобную форму в виде порошка, не требующего растворения в воде). По данным исследования [32], включившего 5294 больных из 21 города, 89% пациентов с ВМД принимали этот препарат в качестве дополнительного источника лютеина.
Исследование Э.Н. Эскиной и соавт. [25] подтвердило, что применение антиоксидантного комплекса у пациентов с «сухой» формой ВМД способствует достоверному улучшению пространственно-частотной контрастной чувствительности, повышению остроты зрения, улучшению социальн ой адаптации пациентов с положительным эмоциональным состоянием и удовлетворенности своим зрением. Л.К. Мошетовой и соавт. [26] установлена эффективность терапии нутрицевтиками при сочетании диабетической ретинопатии и «сухой» формы ВМД (AREDS 1, 2, 3), что подтверждено достоверной положительной динамикой зрительных функций (МКОЗ, морфологическим уменьшением толщины сетчатки, увеличением светочувствительности макулы).
Заключение
Проведенное нами исследование продемонстрировало, что АФ при сочетанной патологии (миопия средней степени и «сухая» форма ВМД) позволяет диагностировать ранние доклинические изменения в пигментном эпителии сетчатки, слое фоторецепторов, слое нейроэпителия, которые являются предикторами развития сочетанной патологии глазного дна (гипераутофлуоресценция, гипоаутофлуоресценция, гипоаутофлуоресцентные полосы, ретикулярный паттерн, пятнистый паттерн, уни- и мультифокальные области ГА), а также является одним из наиболее широко используемых неинвазивных, визуализирующих и достоверных методов диагностики.
Прием нутрицевтиков с антиоксидантным и минерально-витаминным составом особенно эффективен в лечении ранних стадий ВМД, что позволяет предотвратить прогрессирование ВМД.
Сведения об авторах:
Мошетова Лариса Константиновна — д.м.н., профессор, академик РАН, заслуженный врач РФ, заведующая кафедрой офтальмологии, президент ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002-5899-2714.
Алексеев Игорь Борисович — д.м.н., профессор кафедры офтальмологии ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1; врач-офтальмолог ГБУЗ ГКБ им. С.П. Боткина; 125284, Россия, г. Москва, 2-й Боткинский пер., д. 5; врач-офтальмолог ФБУЗ ЛРЦ Минэкономразвития России; 119192, Россия, г. Москва, Ломоносовский пр-т, д. 43; ORCID iD 0000-0002-4506-4986.
Воробьева Ирина Витальевна — д.м.н., доцент кафедры офтальмологии ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1; врач-офтальмолог ГБУЗ ГКБ им. С.П. Боткина; 125284, Россия, г. Москва, 2-й Боткинский пер., д. 5; ORCID iD 0000-0003-2707-8417.
Нам Юлия Аркадьевна — врач-офтальмолог ФБУЗ ЛРЦ Минэкономразвития России; 119192, Россия, г. Москва, Ломоносовский пр-т, д. 43; ORCID iD 0000-0002-4353-8260.
Контактная информация: Нам Юлия Аркадьевна, e-mail: yuliyanam@rocketmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 13.02.2022.
Поступила после рецензирования 11.03.2022.
Принята в печать 05.04.2022.
About the authors:
Larisa K. Moshetova — Dr. Sc. (Med.), Professor, Full-Member of the Russian Academy of Sciences, Honored Doctor of Russian Federation, Head of the Department of Ophthalmology. President of the Russian Medical Academy of Continuous Professional Education, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0001-5081-414X.
Igor B. Alekseev — Dr. Sc. (Med.), professor of the Department of Ophthalmology, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ophthalmologist, S.P. Botkin City Clinical Hospital; 5, 2nd Botkinskiy pass., Moscow, 125284, Russian Federation; ophthalmologist, Treatment Rehabilitation Center of the Ministry of Economic Development; 43, Lomonovskiy av., Moscow, 119192, Russian Federation; ORCID iD 0000-0002-4506-4986.
Irina V. Vorobyeva — Dr. Sci. (Med.), associate professor of the Department of Ophthalmology, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ophthalmologist, S.P. Botkin City Clinical Hospital; 5, 2nd Botkinskiy pass., Moscow, 125284, Russian Federation; ORCID iD 0000-0003-2707-8417.
Yuliya A. Nam — ophthalmologist, Treatment Rehabilitation Center of the Ministry of Economic Development; 43, Lomonovskiy av., Moscow, 119192, Russian Federation; ORCID iD 0000-0002-4353-8260.
Contact information: Yuliya A. Nam, e-mail: yuliyanam@rocketmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 13.02.2022.
Revised 11.03.2022.
Accepted 05.04.2022.
2. Wong Y.-L., Sabanayagam C., Wong C.-W. et al. Six-year changes in myopic macular degeneration in adults of the Singapore Epidemiology of Eye Diseases study. Invest Ophthalmol Vis Sci. 2020;61(4):14. DOI: 10.1167/iovs.61.4.14.
3. Saw S.-M., Matsumura S., Hoang Q.V. Prevention and management of myopia and myopic pathology. Invest Ophthalmol Vis Sci. 2019;60:488–499. DOI: 10.1167/iovs.18-25221.
4. García-Layana A., Cabrera-López F., García-Arumí J. et al. Early and intermediate age-related macular degeneration: update and clinical review. Clin Interv Aging. 2017;12:1579–1587. DOI: 10.2147/CIA.S142685.
5. Будзинская М.В., Воробьева М.В., Киселева Т.Н. и др. Современные подходы к лечению и профилактике возрастной макулярной дегенерации. Клиническая офтальмология. 2007;8(2):78–82.
6. Resnikoff S., Pascolini D., Mariotti S.P., Pokharel G.P. Global magnitude of visual impairment caused by uncorrected refractive errors in 2004. Bull World Health Organ. 2008;86(1):63–70.
7. Шадричев Ф.Е. Возрастная макулярная дегенерация. Современная оптометрия. 2008;6:27–43.
8. Klein R., Klein B.E., Linton K.L. Prevalence of age-related maculopathy. The Beaver Dam Eye Study. Ophthalmology. 1992;99:933–943.
9. Hagen L.A., Gjelle J.V.B., Arnegard S. et al. Prevalence and possible factors of myopia in Norwegian adolescents. Sci Rep. 2018;8:13479. DOI: 10.1038/s41598-018-31790-y.
10. Van Leeuwen R., Klaver C.C.W., Vingerling J.R. et al. The Risk and Natural Course of Age-Related Maculopathy: Follow-up at 6½ Years in the Rotterdam Study. Arch Ophthalmol. 2003;121(4):519–526. DOI: 10.1001/archopht.121.4.519.
11. Lavanya R., Kawasaki R., Tay W.T. et al. Hyperopic refractive error and shorter axial length are associated with age-related macular degeneration: the Singapore Malay Eye Study. Invest Ophthalmol Vis Sci. 2010;51(12):6247–6252. DOI: 10.1167/iovs.10-5229.
12. Hayashi K., Ohno-Matsui K., Shimada N. Long-term pattern of progression of myopic maculopathy: a natural history study. Ophthalmology. 2009;117:1595–1601. DOI: 10.1016/j.ophtha.2009.11.003.
13. Аветисов С.Э., Будзинская М.В., Жабина О.А. и др. Анализ изменений центральной зоны глазного дна при миопии по данным флюоресцентной ангиографии и оптической когерентной томографии. Вестник офтальмологии. 2015;4:38–48.
14. Curtin В.J., Karlin D.B. Axial length measurements and fundus changes of the myopic eyes. Am J Ophthalmol. 1971;71:42–53.
15. Spaide R.F., Ohno-Matsui K., Lawrence Y.A. Pathologic Myopia. New York: Springer; 2014.
16. Waldstein S.M., Vogl W.D., Bogunovic H. et al. Characterization of Drusen and Hyperreflective Foci as Biomarkers for Disease Progression in Age-Related Macular Degeneration Using Artificial Intelligence in Optical Coherence Tomography. JAMA Ophthalmol. 2020;138(7):740–747. DOI: 10.1001/jamaophthalmol.2020.1376.
17. Ly A., Nivison-Smith L., Assaad N., Kalloniatis M. Fundus Autofluorescence in Age-related Macular Degeneration. Optom Vis Sci. 2017;94(2):246–259. DOI: 10.1097/OPX.0000000000000997.
18. Гндоян И.А., Петряевский А.В., Дятчина А.И. Аутофлюоресценция глазного дна в диагностике возрастной макулярной дегенерации. Вестник офтальмологии. 2020;136(5):136–141. DOI: 10.17116/oftalma2020136051136.
19. Li J., Zhao X., Chen S. et al. Patterns of Fundus Autofluorescence in Eyes with Myopic Atrophy Maculopathy: A Consecutive Case Series Study. Curr Eye Res. 2020;17:1–5. DOI: 10.1080/02713683.2020.1857780.
20. You Q.S., Peng X.Y., Xu L. et al. Myopic maculopathy imaged by optical coherence tomography: the beijing eye study. Ophthalmology. 2014;121(1):220–224. DOI: 10.1016/j.ophtha.2013.06.013.
21. Аветисов С.Э., Киселева Т.Н., Воробьева М.В. и др. Значение метода аутофлюоресценции в диагностике патологии глазного дна. Вестник офтальмологии. 2011;127(5):49–53.
22. Ishida T., Shinohara K., Tanaka Y. et al. Chorioretinal folds in eyes with myopic staphyloma. Am J Ophthalmol. 2015;160(3):608–613. DOI: 10.1016/j.ajo.2015.05.028.
23. Файзрахманов Р.Р., Будзинская М.В. Макулярные пигменты при дегенеративных процессах сетчатки. Вестник офтальмологии. 2018;134(5):135–140. DOI: 10.17116/oftalma2018134051135.
24. Lutein + zeaxanthin and omega-3 fatty acids for age-related macular degeneration:the Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA. 2013;309(19):2005–2015. DOI: 10.1001/jama.2013.4997.
25. Эскина Э.Н., Белогурова А.В., Гветадзе А.А., Сморчкова А.С. Применение офтальмонутрицевтика при «сухой» форме возрастной макулярной дегенерации. Вестник офтальмологии. 2020;136(4):86–92. DOI: 10.17116/oftalma202013604186.
26. Мошетова Л.К., Воробьева И.В., Алексеев И.Б., Михалева Л.Г. Результаты лечения антиоксидантными и ангиопротекторными препаратами пациентов с диабетической ретинопатией и возрастной макулярной дегенерацией при сахарном диабете 2 типа. Вестник офтальмологии. 2015;131(3):34–44. DOI: 10.17116/oftalma2015131334-44.
27. Acton J.H., Gibson J.M., Cubbidge R.P. Quantification of visual field loss in age-related macular degeneration. PLoS One. 2012;7(6):e39944. DOI: 10.1371/journal.pone.0039944.
28. Denniss J., Baggaley H.C., Brown G.M. et al. Properties of Visual Field Defects Around the Monocular Preferred Retinal Locus in Age-Related Macular Degeneration. Invest Ophthalmol Vis Sci. 2017;58(5):2652–2658. DOI: 10.1167/iovs.16-21086.
29. Bhende M., Shetty S., Parthasarathy M.K., Ramya S. Optical coherence tomography: A guide to interpretation of common macular diseases. Indian J Ophthalmol. 2018;66(1):20–35. DOI: 10.4103/ijo.IJO_902_17.
30. Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol. 2001;119(10):1417–1436. DOI: 10.1001/archopht.119.10.1417.
31. Trieschmann M., Beatty S., Nolan J.M. et al. Changes in macular pigment optical density and serum concentrations of its constituent carotenoids following supplemental lutein and zeaxanthin: the LUNA study. Exp Eye Res. 2007;84(4):718–728. DOI: 10.1016/j.exer.2006.12.010.
32. Нероев В.В. Российское наблюдательное эпидемиологическое неинтервенционное исследование пациентов с «влажной» формой возрастной макулярной дегенерации. Российский офтальмологический журнал. 2011;4(2):4–9.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.