Ретинобластома. Часть 1. Клинико-диагностические аспекты
DOI: 10.32364/2311-7729-2020-20-3-159-164
Ретинобластома относится к числу наиболее распространенных опухолей сетчатки глаза у детей раннего возраста. Средний возраст на момент первичной диагностики заболевания не превышает 1,5 года. Доказана связь развития опухоли с утратой или инактивацией обоих аллелей гена RВ1. Мутации в гене RВ1 приводят к полной инактивации экспрессии белка ретинобластомы, что в конечном итоге ведет к неконтролируемой пролиферации клетки и формированию клона опухолевых клеток. Существуют наследственные и спорадические формы заболевания. В статье подробно представлены клинико-эпидемиологические характеристики наследственных и спорадических форм, описаны основные клинические проявления, в частности один из первых и наиболее частых симптомов — лейкокория. Отдельный раздел посвящен особенностям гистологического строения злокачественной опухоли и ее доброкачественного предшественника. Существующие в настоящее время системы классификации интраокулярной ретинобластомы основаны на степени распространенности опухоли и необходимы для определения четких показаний к органосохраняющему лечению. В статье подробно освещены современные методики диагностики ретинобластомы. Офтальмоскопия является «золотым стандартом» и имеет свои особенности у детей раннего возраста. В статье также представлена информация о других основных методах визуализации опухоли, таких как ультразвуковые исследования, оптическая когерентная томография и магнитно-резонансная томография.
Ключевые слова: дети, ретинобластома, наследственность, ген ретинобластомы, патоморфология, лейкокория, офтальмоскопия, ультразвуковое исследование.
Для цитирования: Иванова С.В., Кулева С.А., Садовникова Н.Н., Комиссаров М.И., Чистякова М.Н., Хохлова А.В., Щеголева Н.А. Ретинобластома. Часть 1. Клинико-диагностические аспекты. РМЖ. «Клиническая Офтальмология». 2020;20(3):159-164. DOI: 10.32364/2311-7729-2020-20-3-159-164.
Retinoblastoma. Part 1. Clinical presentations and diagnostic tools
S.V. Ivanova1, S.A. Kuleva1, N.N. Sadovnikova2, M.I. Komissarov2, M.N. Chistyakova2,
A.V. Khokhlova1, N.A. Shchegoleva3
1N.N. Petrov National Medical Research Center of Oncology, St. Petersburg,
Russian Federation
2St. Petersburg State Pediatric Medical University, St. Petersburg, Russian Federation
3K.A. Rauchfuss St. Petersburg Children’s City Multidisciplinary Clinical Center of High Medical Technologies, St. Petersburg, Russian Federation
Retinoblastoma is one of the most common retinal tumors in young children. At the time of primary diagnosis, mean age is no more than 1.5 years. The association between tumor development and the loss of both alleles of RB1 gene is well-established. Mutations in the RB1 gene result in the complete inactivation of retinoblastoma protein expression and, therefore, uncontrolled cell proliferation and generation of tumor cell clone. There are two types of retinoblastoma, i.e., hereditary and sporadic. This paper describes in detail clinical epidemiological characteristics of hereditary and sporadic retinoblastoma and major clinical signs (in particular, one of the most early and common symptoms, leukocoria). Histology of malignant tumor and its benign precursor is addressed. Current classification systems of intraocular retinoblastoma are based on tumor extent being required to specify clear indications for organ preservation treatment. Modern diagnostic tools for retinoblastoma are discussed as well. Eye fundus examination is the gold standard but has some specifics in young children. Other important imaging techniques in retinoblastoma are sonography, optical coherence tomography, and magnetic resonance imaging.
Keywords: children, retinoblastoma, heredity, retinoblastoma gene, pathomorphology, leukocoria, ophthalmoscopy, sonography.
For citation: Ivanova S.V., Kuleva S.A., Sadovnikova N.N. et al. Retinoblastoma. Part 1. Clinical presentations and diagnostic tools. Russian Journal of Clinical Ophthalmology. 2020;20(3):159–164. DOI: 10.32364/2311-7729-2020-20-3-159-164.
Введение
Ретинобластома относится к числу наиболее распространенных неоплазий, поражающих орган зрения у детей раннего возраста. Тем не менее заболевание является относительно редким, встречающимся в среднем у одного из 15–18 тыс. новорожденных. Мальчики и девочки поражаются одинаково часто. 70% выявленных опухолей являются спорадическими; остальные 30% представлены наследственно обусловленной формой. Около 95% случаев ретинобластомы диагностируются до 5 лет. В Северной Америке были проанализированы 1452 случая ретинобластомы за период с 1973 по 2009 г. [1]. Средний возраст на момент первичной диагностики не превышал 1,5 года. У пациентов с двухсторонней ретинобластомой заболевание манифестировало раньше и диагностировалось, как правило, на первом году жизни (медиана 0,46 года). Это одно из крупнейших эпидемиологических исследований, представленных в зарубежной литературе. Точных сведений о заболеваемости ретинобластомой в России не существует, поскольку статистическая отчетность формируется на основании кодов МКБ-10, основанных на анатомической локализации поражения, что ведет к искусственному завышению показателей заболеваемости за счет включения других опухолей, поражающих орбиту (лимфомы, саркомы и проч.) [2].
Роль наследственности в заболеваемости ретинобластомой
Ген ретинобластомы RВ1, расположенный в проксимальном отделе длинного плеча хромосомы 13q14.1, является одним из первых открытых и наиболее изученных генов-онкосупрессоров [3]. Согласно «двухударной» гипотезе A.G. Knudson (1971 г.) существует единый механизм возникновения наследственной и спорадической форм ретинобластомы, связанный с утратой или инактивацией обоих аллелей гена RВ1 [4, 5]. В случае наличия герминальной мутации каждый ретинобласт гетерозиготного носителя уже имеет инактивированный аллель RВ1. Для развития ретинобластомы достаточно всего одной соматической мутации, затрагивающей оставшуюся копию гена. Переход гена из гетерозиготного в гомозиготное состояние приводит к инактивации обоих аллелей, что инициирует злокачественную трансформацию клетки [6]. Вероятность развития заболевания (пенетрантность) у носителей гена ретинобластомы составляет 90%. Мутации в гене RВ1 отличаются большим разнообразием — это могут быть точечные поломки, большие и малые делеции, сплайсинговые мутации и глубокие интронные варианты мутаций, в 52% случаев изменения в обоих аллелях гена идентичны [7, 8].
Конституциональные мутации de novo наиболее часто возникают в половой клетке, обычно мужской. Крайне редко возникает ситуация, когда конституциональная мутация в гене RВ1 происходит через некоторое время после зачатия в одной из нескольких клеток развивающегося эмбриона. В этом случае появляется мозаицизм, и если поражены половые клетки эмбриона, заболевание будет передаваться в поколении [9].
Мутации в гене RВ1 приводят к полной инактивации экспрессии белка ретинобластомы (pRb). Белок-супрессор опухолевого роста pRb является основным ингибитором клеточной пролиферации, регулирующим переход клеточного цикла в S-фазу путем блокировки точки контроля G1. Блокирование перехода G1/S осуществляется, главным образом, через взаимодействие с транскрипционным фактором 1 семейства E2F. В случае мутации белка pRb транскрипционный фактор E2F1 переходит в активное состояние, что в конечном итоге ведет к неконтролируемой пролиферации клетки и формированию клона опухолевых клеток.
Для наследственных форм ретинобластомы характерны ранняя манифестация, билатеральность и мультифокальность поражения, положительный семейный анамнез, а также обнаружение хромосомных и молекулярных аномалий гена ретинобластомы [10]. Заболевание может развиваться как одновременно в обоих глазах, так и метахронно. Наличие герминальной мутации в гене RВ1 способствует повышенному риску развития вторых опухолей: остеогенной саркомы, рака мочевого пузыря, легких, кожи и опухолей мозга на протяжении всей жизни излеченного от ретинобластомы пациента. Фактором, резко повышающим риск развития второй опухоли, является использование дистанционной лучевой терапии. Крайне редко (не более чем в 5% случаев всех наследственных форм) у больных развивается трилатеральная ретинобластома — сочетание двухсторонней ретинобластомы с морфологически идентичной опухолью мозга, наиболее часто локализующейся в шишковидной железе [11].
Спорадическая форма ретинобластомы диагностируется в 70–80% случаев и характеризуется манифестацией в старшем возрасте, унилатеральным и монофокальным характером поражения.
У незначительной доли пациентов (около 3%) развитие ретинобластомы не связано с мутацией в гене RВ1. В последние десятилетия появились работы, свидетельствующие о причастности к возникновению опухоли онкогена MYCN [12, 13]. Заболевание в таком случае характеризуется односторонним поражением и ранней манифестацией в первом полугодии жизни ребенка.
Патоморфология
По гистологической структуре ретинобластома представляет собой злокачественную нейроэктодермальную опухоль, развивающуюся из нервных клеток эмбриональной сетчатки. Опухоль состоит из недифференцированных нейробластических клеток — ретинобластов, которые характеризуются гиперхромными ядрами, скудной цитоплазмой, большим числом митозов. Строма в опухоли отсутствует. В зависимости от степени дифференциации опухолевых клеток различают ретинобластому (встречающуюся чаще) и ретиноцитому.
Согласно Международной классификации заболеваний в онкологии (International Classification of Diseases for Oncology) ретинобластоме присвоен морфологический код 9510/3, а ретиноцитоме — 9510/0 [14].
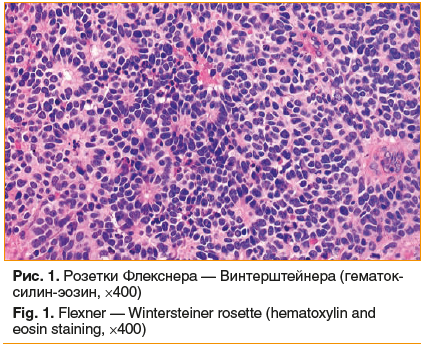
Ретиноцитома — весьма редкое, одно- или двухстороннее доброкачественное новообразование сетчатки. Ткань опухоли состоит из дифференцированных клеток, из которых образуются истинные розетки Флекснера — Винтерштейнера (рис. 1). Классическая розетка Флекснера — Винтерштейнера представляет собой округлый кластер клеток, сгруппированных вокруг центрального просвета, содержащего мелкие цитоплазматические отростки окружающих клеток. Существует возможность злокачественного перерождения ретиноцитомы, в связи с чем пациенты с этим заболеванием подлежат тщательному динамическому наблюдению.
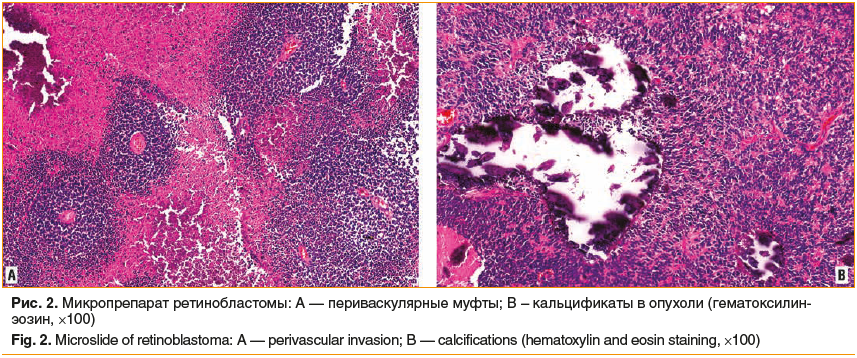
Ретинобластома состоит из мелких низкодифференцированных клеток. Различают два типа роста опухоли — эндофитный, или стелящийся, и экзофитный. При эндофитном росте происходит проминирование образования в стекловидное тело, нередко с формированием витреальных отсевов. При экзофитном росте чаще возникает отслойка сетчатки с накоплением субретинальной жидкости, появлением субретинальных отсевов. При распространении опухоли в сосудистую оболочку глазного яблока резко возрастает вероятность гематогенного метастазирования.
В растущей опухоли развиваются новообразованные сосуды. Опухолевые клетки пролиферируют вокруг них, формируя так называемые периваскулярные муфты (рис. 2A). В связи с недостаточным кровоснабжением опухоль рано подвергается некрозу, очаги которого являются источником рассеивания отдельных клеток и целых конгломератов. В очагах некроза откладываются соли кальция, образуя характерные для опухоли кальцификаты (рис. 2В).
Клиническая картина
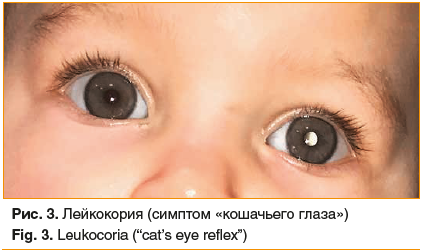
Первый и наиболее характерный клинический признак заболевания — лейкокория, проявляющаяся феноменом беловато-желтого свечения зрачка вследствие отражения света от поверхности проминирующей в стекловидное тело опухоли. Этот симптом родители нередко замечают самостоятельно, в том числе на фотографиях ребенка
(рис. 3). Другими частыми проявлениями заболевания являются косоглазие, ослабление прямой реакции на свет, раздражение глазного яблока, гифема и др., которые врач может заметить при первичном осмотре ребенка. При прогрессирующей отслойке сетчатки зрение снижается вплоть до слепоты, однако выявить этот симптом у ребенка раннего возраста при банальном осмотре педиатру достаточно сложно. Косвенным проявлением потери зрения на глазу с ретинобластомой служат нарушение поведения ребенка, появление «неуклюжести», немотивированные падения, столкновения с преградой, негативная реакция при попытке закрыть здоровый глаз.
По мере роста и распространения опухоли глаз реагирует воспалительным процессом (увеит, иридоциклит). При отеке орбитальной клетчатки и/или распространении в орбиту развивается экзофтальм. При прорастании трабекулярного аппарата и нарушении оттока из глаза внутриглазной жидкости развивается вторичная глаукома, клиническим проявлением которой может стать появление болевого синдрома и (у маленьких детей) буфтальма.
Системы классификации ретинобластомы
По мере расширения представлений о диагностике и лечении ретинобластомы исторически происходила эволюция подходов к классификации этого заболевания.
Прежде всего, стоит определить понятие «интраокулярная ретинобластома» — патологический процесс, ограниченный в пределах глазного яблока, когда посредством всех доступных методов визуализации доказано отсутствие распространения процесса за пределы склеры.
В 1963 г. А.B. Reese и R.M. Ellsworth предложили классификацию интраокулярной ретинобластомы [15]. Она использовалась вплоть до 2005 г. и имела большое практическое значение в период, когда для лечения широко применялась дистанционная лучевая терапия.
С появлением новых методов лечения в 2005 г. была разработана Международная классификация интраокулярной ретинобластомы (International Intraocular Retinoblastoma Classification — IIRC), которая позволила оценивать прогноз заболевания при применении системной полихимиотерапии и определять четкие показания для проведения органосохраняющего лечения [16]. Согласно классификации пораженные глаза распределяются на клинические группы, которым присваивается буквенная аббревиатура от A до Е (табл. 1). Позднее C.L. Shields et al. (2006 г.) предложили модификацию IIRC, согласно которой в случае поражения опухолью более половины глазного яблока пациент стратифицируется в клиническую группу Е [17]. Таким образом, на настоящий момент в мире одновременно используются как минимум два варианта IIRC, что затрудняет интерпретацию результатов лечения интраокулярной ретинобластомы у разных авторов и не позволяет провести корректное сравнение различных клинических исследований.
![Таблица 1. Международная классификация интраокуляр- ной ретинобластомы IIRC [16] Table 1. International Intraocular Retinoblastoma Classification (IIRC) [16] Таблица 1. Международная классификация интраокуляр- ной ретинобластомы IIRC [16] Table 1. International Intraocular Retinoblastoma Classification (IIRC) [16]](/upload/medialibrary/e3f/159-4.png)
В 2006 г. группой экспертов, принимавших участие в разработке IIRC, также была предложена унифицированная международная система стадирования экстраокулярной ретинобластомы (International Retinoblastoma Staging System — IRSS), основанная на оценке радикальности выполненной энуклеации и диссеминации опухолевого процесса [18].
Говоря о различных системах стадирования и классификации ретинобластомы, нельзя не упомянуть о международной системе TNM (tumor, node, metastasis), которая в 2017 г. подверглась пересмотру Американским объединенным комитетом по раку (American Joint Committee on Cancer — AJCC). В ходе работы над 8-й редакцией AJCC применительно к ретинобластоме в классификацию TNM было введено определение наследственного характера заболевания, обозначенное буквой «H» (heritable trait — наследственный характер) [19].
Диагностика ретинобластомы
Офтальмоскопия признана «золотым стандартом» в диагностике ретинобластомы [20]. Особенностью офтальмоскопии у детей является исследование в условиях максимального медикаментозного мидриаза и медикаментозного сна, фотофиксация осуществляется на ретинальной педиатрической камере (рис. 4).
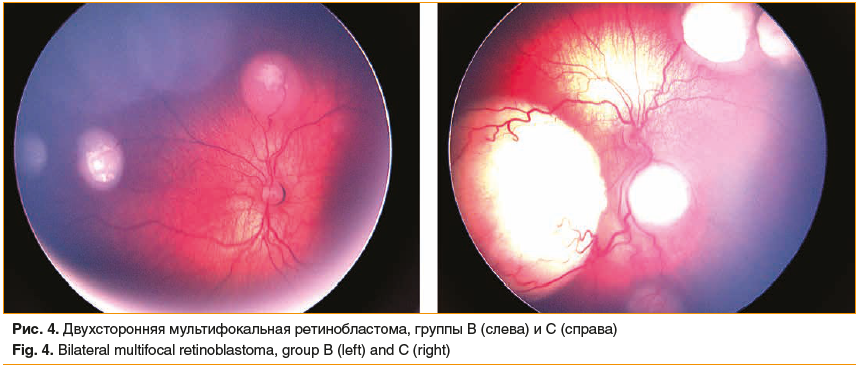
Данный метод визуализации позволяет дифференцировать ретинобластому от других поражений сетчатки (болезнь Коатса, ретролентальная фибродисплазия, эндофтальмит, гамартома сетчатки и проч.), картировать опухолевые узлы и отсевы, определять степень тяжести поражения глаза и, соответственно, клиническую группу, мониторировать ответ на лечение. Факторами, снижающими диагностическую ценность офтальмоскопии, являются кровоизлияние в стекловидное тело, массивная отслойка сетчатки и непрозрачность сред, нередко обусловленная крупными облаковидными интравитреальными отсевами.
Ультразвуковое исследование глаз также входит в стандарты обязательного офтальмологического обследования при ретинобластоме. Одним из наиболее информативных методов является В-сканирование глазного яблока, позволяющее благодаря визуализации плюс-ткани в различном положении глаза отличить ретинобластому от гемофтальма, эндофтальмита, отслойки сетчатки, ретролентальной фиброплазии, фиброза стекловидного тела и другой патологии органа зрения [20]. Выявление классических кальцификатов в опухоли, без сомнения, подтверждает диагноз ретинобластомы (рис. 5).
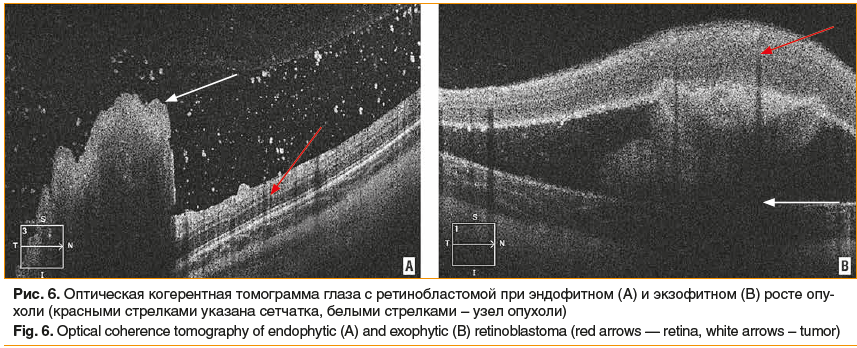
Оптическая когерентная томография позволяет четко визуализировать взаимоотношение опухоли с сетчаткой и хориоидеей, дифференцировать экзо- и эндофитный рост ретинобластомы, дать метрическую характеристику очагам опухоли (рис. 6) [20].
Ультразвуковая биомикроскопия позволяет особенно тщательно оценить передние отделы сетчатки глаза, цилиарную область и передний сегмент [21]. При анализе более чем 100 глаз этот метод не показал ни одного ложноположительного или ложноотрицательного результата, что подтверждает его высокую диагностическую значимость при первичной диагностике и последующем динамическом наблюдении за пациентами [22].
Магнитно-резонансная томография (МРТ) орбит и головного мозга доказала свои преимущества перед компьютерной томографией в оценке распространения опухоли за пределы глазного яблока, инвазии зрительного нерва, поражения вещества головного мозга (метастазы или трилатеральная ретинобластома), она позволяет достаточно точно осуществить стадирование процесса [23, 24]. МРТ-исследование с контрастированием является обязательным методом как на этапе первичной диагностики, так и в процессе динамического наблюдения за пациентами с ретинобластомой.
Заключение
Ретинобластому можно с уверенностью отнести к разряду неоплазий, диагностика которых возможна на ранних стадиях. Несмотря на редкость этого заболевания, практически каждый детский офтальмолог в своей практической работе хотя бы однажды встречает такого пациента. При этом именно офтальмолог играет ключевую роль в установлении диагноза и, что крайне важно, определяет клиническую группу по классификации IIRC. Современные стратегии ранней диагностики опухоли направлены на обеспечение возможности применения органосохраняющих методик в ее лечении, что позволяет сохранить не только жизнь, но и глазное яблоко и зрение у ребенка.
Таким образом, именно содружественная работа детских офтальмологов, детских онкологов и лучевых диагностов является залогом успеха в излечении маленьких пациентов.
Сведения об авторах:
1Иванова Светлана Вячеславовна — к.м.н., детский онколог отделения химиотерапии и комбинированного лечения злокачественных опухолей у детей, ORCID iD 0000-0002-0585-0907;
1Кулева Светлана Александровна — д.м.н., заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, ORCID iD 0000-0003-0390-8498;
2Садовникова Наталья Николаевна — к.м.н., заведующая офтальмологическим отделением, ORCID iD 0000-0002-5943-1046;
2Комиссаров Михаил Игоревич — к.м.н., заведующий отделением рентгенохирургических методов лечения, ORCID iD 0000-0003-4788-7561;
2Чистякова Маргарита Николаевна — врач-офтальмолог офтальмологического отделения, ORCID iD 0000-0001-7410-3650;
1Хохлова Анна Валерьевна — врач-патологоанатом патологоанатомического отделения с прозектурой, ORCID iD 0000-0002-0551-804X;
3Щеголева Наталья Адольфовна — главный внештатный детский хирург, заместитель главного врача по хирургии, ORCID iD 0000-0003-3672-7319.
1ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. 197758, Россия, г. Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68.
2ФГБОУ ВО СПбГПМУ Минздрава России. 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2.
3СПб ГБУЗ «ДГМКЦ ВМТ им. К.А. Раухфуса». 191036, г. Санкт-Петербург, Лиговский пр., д. 8, лит. А.
Контактная информация: Иванова Светлана Вячеславовна, e-mail: tabalinadoc@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 10.01.2020.
About the authors:
1Svetlana V. Ivanova — MD, PhD, pediatric oncologist of the Department of Chemotherapy and Combined Treatment of Malignant Tumors in Children, ORCID iD 0000-0002-0585-0907;
1Svetlana A. Kuleva — MD, PhD, Head of the Department of Chemotherapy and Combined Treatment of Malignant Tumors in Children, ORCID iD 0000-0003-0390-8498;
2Natal’ya N. Sadovnikova — MD, PhD, Head of Ophthalmological Department, ORCID iD 0000-0002-5943-1046;
2Mikhail I. Komissarov — MD, PhD, Head of the Department of Interventional Radiology Procedures, ORCID iD 0000-0003-4788-7561;
2Margarita N. Chstyakova — MD, ophthalmologist of Ophthalmological Department, ORCID iD 0000-0001-7410-3650;
1Anna V. Khokhlova — MD, pathologist of Pathoanatomic Department with Prosection, ORCID iD 0000-0002-0551-804X;
3Natal’ya A. Shchegoleva — MD, Chief Visiting Pediatric Surgeon, Deputy Head Doctor for Surgery, ORCID iD 0000-0003-3672-7319.
1N.N. Petrov National Medical Research Center of Oncology. 68, Leningradskaya str., Pesochnyy Village, St. Petersburg, 197758, Russian Federation.
2St. Petersburg State Pediatric Medical University. 2, Litovskaya str., St. Petersburg, 194100, Russian Federation.
3K.A. Rauchfuss St. Petersburg Children’s City Multidisciplinary Clinical Center of High Medical Technologies. 8A, Ligovskiy av., St. Petersburg, 191036, Russian Fede-
ration.
Contact information: Svetlana V. Ivanova, e-mail: tabalinadoc@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 10.01.2020.
2. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). МНИОИ им. П.А. Герцена, филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. [Kaprin A.D., Starinsky V.V., Petrova G.V. Malignant neoplasms in Russia in 2017 (morbidity and mortality). FGBU “NMITS Radiology” MNIOI named after P.A. Herzen, 2018 (in Russ.)].
3. Soliman S.E., Racher H., Zhang C. et al. Genetics and Molecular Diagnostics in Retinoblastoma — An Update. Asia Pac J Ophthalmol (Phila). 2017;6(2):197–207. DOI: 10.22608/APO.201711.
4. Berger A.H., Knudson A.G., Pandolfi P.P. A continuum model for tumour suppression. Nature. 2011;476(7359):163–169. DOI: 10.1038/nature10275.
5. Berry J.L., Polski A., Cavenee W.K. et al. The RB1 Story: Characterization and Cloning of the First Tumor Suppressor Gene. Genes. 2019;10(11):879. DOI: 10.3390/genes10110879.
6. Dimaras H., Kimani K., Dimba E.A. et al. Retinoblastoma. Lancet. 2012;379(9824):1436–1446. DOI: 10.1016/S0140-6736 (11) 61137-9.
7. Li W.L., Buckley J., Sanchez-Lara P.A. et al. A Rapid and Sensitive Next-Generation Sequencing Method to Detect RB1 Mutations Improves Care for Retinoblastoma Patients and Their Families. J Mol Diagn. 2016;18(4):480–493. DOI: 10.1016/j.jmoldx.2016.02.006.
8. Price E.A., Price K., Kolkiewicz K. et al. Spectrum of RB1 mutations identified in 403 retinoblastoma patients. J Med Genet. 2014;51(3):208–214. DOI: 10.1136/jmedgenet-2013-101821.
9. Rushlow D., Piovesan B., Zhang K. et al. Detection of mosaic RB1 mutations in families with retinoblastoma. Hum Mutat. 2009;30:842–851. DOI: 10.1002/humu.20940.
10. Dimaras H., Corson T.W., Cobrinik D. et al. Retinoblastoma. Nat Rev Dis Primers. 2015;1:15021. DOI:10.1038/nrdp.2015.21.
11. De Jong M.C., Kors W.A., de Graaf P. et al. Trilateral retinoblastoma: a systematic review and meta-analysis. Lancet Oncol. 2014;15(10):1157–1167. DOI: 10.1016/S1470-2045 (14) 70336-5.
12. Rushlow D.E., Mol B.M., Kennett J.Y. et al. Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies. Lancet Oncol. 2013;14(4):327–334. DOI: 10.1016/S1470-2045 (13) 70045-7.
13. Schwermer M., Hiber M., Dreesmann S. et al. Comprehensive characterization of RB1 mutant and MYCN amplified retinoblastoma cell lines. Exp Cell Res. 2019;375(2):92–99. DOI: 10.1016/j.yexcr.2018.12.018.
14. Grossniklaus H.E., Eberhart C.G., Kivelä T.T. WHO Classification of Tumours of the Eye. 4th Edition. Lyon: International Agency for Research on Cancer, 2018.
15. Reese A.B., Ellsworth R.M. The evaluation and current concept of retinoblastoma therapy. Trans Am Acad Ophthalmol-Otolaryngol. 1963:164–172. PMID: 13973597.
16. Murphree L.A. Intraocular retinoblastoma: the case for a new group classification. Ophthalmol Clin North Am. 2005;18(1):41–53. DOI: 10.1016/j.ohc.2004.11.003.
17. Shields C.L., Mashayekhi A., Au A.K. et al. The International Classification of Retinoblastoma predicts chemoreduction success. Ophthalmol. 2006;113(12):2276–2280. DOI: 10.1016/j.ophtha.2006.06.018.
18. Chantada G., Doz F., Antoneli C.B. et al. A proposal for an international retinoblastoma staging system. Pediatr. Blood Cancer. 2006;47:801–805. DOI: 10.1002/pbc.20606.
19. Amin M.B., Edge S.B., Greene F.L. et al. AJCC Cancer Staging Manual. 8th ed. NY: Springer; 2017:819–831. DOI: 10.1007/978-3-319-40618-3.
20. Кулева С.А., Иванова С.В., Садовникова Н.Н. и др. Ретинобластома: клиника, диагностика и лечение: учебно-методическое пособие для обучающихся в системе высшего и дополнительного профессионального образования. СПб.; 2019. [Kuleva S.A., Ivanova S.V., Sadovnikova N.N. et al. Retinoblastoma: clinical features, diagnosis and treatment. SPb.; 2019 (in Russ.)].
21. Moulin A.P., Gaillard M.C., Balmer A., Munier F.L. Ultrasound biomicroscopy evaluation of anterior extension in retinoblastoma: a clinicopathological study. Br J Ophthalmol. 2012;96(3):337–340. DOI: 10.1136/bjophthalmol-2011-300051.
22. Vasquez L.M., Giuliari G.P., Halliday W. et al. Ultrasound biomicroscopy in the management of retinoblastoma. Eye (Lond.). 2011;25(2):141–147. DOI: 10.1038/eye.2010.193.
23. De Jong M.C., de Graaf P., Noij D.P. et al. European Retinoblastoma Imaging Collaboration (ERIC). Diagnostic performance of magnetic resonance imaging and computed tomography for advanced retinoblastoma: a systematic review and meta-analysis. Ophthalmology. 2013;121(5):1109–1118. DOI: 10.1016/j.ophtha.2013.11.021.
24. De Graaf P., Göricke S., Rodjan F. et al. European Retinoblastoma Imaging Collaboration (ERIC). Guidelines for imaging retinoblastoma: imaging principles and MRI standardization. Pediatric radiology. 2011;42(1):2–14. DOI: 10.1007/s00247-011-2201-5.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
