Первые результаты применения ингибитора васкулогенеза бролуцизумаба (Визкью®) при хориоидальной неоваскуляризации у пациентов с возрастной макулярной дегенерацией
DOI: 10.32364/2311-7729-2022-22-4-228-233
Цель исследования: провести анализ непосредственной клинической эффективности применения бролуцизумаба при хориоидальной неоваскуляризации (ХНВ) у пациентов с возрастной макулярной дегенерацией (ВМД).
Материал и методы: проведена клиническая оценка эффективности применения препарата бролуцизумаб у 25 пациентов (25 глаз) с неоваскулярной ВМД. Динамический мониторинг осуществлялся с использованием оптической когерентной томографии: оценивали локализацию и площадь неоваскулярного комплекса, плотность и толщину новообразованных сосудов (режим ангиографии). Выполнялись 3 инъекции бролуцизумаба (в дозе 6,0 мг / 0,05 мл) 1 раз в месяц. Срок наблюдения составил 4 мес.
Результаты исследования: средний возраст пациентов составил 68±5 лет. После 1-й инъекции бролуцизумаба наблюдалось статистически значимое снижение средних показателей центральной толщины сетчатки (ЦТС) и объема макулы (ОМ) относительно исходных. К 4 мес. наблюдения отмечено статистически значимое увеличение максимальной корригированной остроты зрения (МКОЗ) в сравнении с исходным с 0,3 (0,2; 0,45) до 0,6 (0,4; 0,6) (p<0,001). У всех пациентов после выполнения 3 инъекций были достигнуты минимальные значения показателя ЦТС с 298 (284; 302) мкм до 268 (263; 270) мкм и снижение ОМ с 10,4 (9,5; 10,7) мм3 до 8,8 (8,7; 9,3) мм3 (p<0,001). У 22 из 25 пациентов через 1 мес. регистрировалось прилегание нейро- и пигментного эпителия с полной резорбцией субретинальной жидкости, у 3 пациентов — после 3 интравитреальных инъекций бролуцизумаба, при этом наличия субретинальной жидкости у них не зарегистрировано. Субъективно все пациенты отмечали улучшение качества и контрастности центрального зрения после лечения.
Заключение: после каждой инъекции бролуцизумаба отмечалась прогрессирующая статистически значимая редукция показателей макулярной области — ЦТС и ОМ в сочетании с повышением средних значений МКОЗ.
Ключевые слова: эндотелиальный сосудистый фактор роста, анти-VEGF, бролуцизумаб, возрастная макулярная дегенерация, неоваскулярная возрастная макулярная дегенерация, влажная форма возрастной макулярной дегенерации, эффективность лечения.
Для цитирования: Жайворонок Н.С., Коленко О.В., Данилова Л.П., Сорокин Е.Л. Первые результаты применения ингибитора васкулогенеза бролуцизумаба (Визкью®) при хориоидальной неоваскуляризации у пациентов с возрастной макулярной дегенерацией. РМЖ. «Клиническая Офтальмология». 2022;22(4):228-233. DOI: 10.32364/2311-7729-2022-22-4-228-233.
N.S. Zhayvoronok1, O.V. Kolenko1–3, L.P. Danilova1,2, E.L. Sorokin1,3
1Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution, Khabarovsk, Russian Federation
2Institute of Advanced Training of Healthcare Specialists, Khabarovsk, Russian Federation
3Far Eastern State Medical University, Khabarovsk, Russian Federation
Aim: to assess the clinical efficacy of brolucizumab for choroidal neovascularization (CNV) in patients with age-related macular degeneration (AMD).
Patients and Methods: clinical assessment of the efficacy of brolucizumab was performed in 25 patients (25 eyes) with neovascular AMD. The dynamic monitoring included optical coherence tomography to assess the localization and area of the neovascular complex, as well as the density and thickness of the new blood vessels (OCT-angiography). Three injections of brolucizumab (in a dose of 6 mg/0.05 mL) were performed once a month. The follow-up period was 4 months.
Results: the mean age of patients was 68±5 years. After the first injection of brolucizumab, there was a statistically significant decrease in the mean values of central retinal thickness (CRT) and macular volume (MV) vs the baseline values. By month 4, a statistically significant increase in the best corrected visual acuity (BCVA) vs. that at the baseline was achieved: from 0.3 (0.2; 0.45) to 0.6 (0.4; 0.6) (p<0,001). In all patients after three injections the minimal values of CRT were reported: they decreased from 298 (284; 302) to 268 (263; 270) µm. Also, MV reduced from 10.4 (9.5; 10.7) to 8.8 (8.7; 9.3) mm3 (p<0,001). After one month in 22 of 25 patients and after three intravitreal injections of brolucizumab in 3 patients an adhesion of the neuro- and pigment epithelium was recorded with the complete resorption of the subretinal fluid, and the subretinal fluid was not found. Subjectively, all patients noted an improvement in the quality and contrast sensitivity of central vision after treatment.
Conclusions: after each injection of brolucizumab, there was a statistically significant progressive reduction in macular parameters, CRT and MV, coupled with an increase in mean BCVA values.
Keywords: vascular endothelial growth factor, anti-VEGF, brolucizumab, age-related macular degeneration, neovascular age-related macular degeneration, wet age-related macular degeneration, treatment efficacy.
For citation: Zhayvoronok N.S., Kolenko O.V., Danilova L.P., Sorokin E.L. The initial results of using brolucizumab (Beovu®), an angiogenesis inhibitor, for choroidal neovascularization in patients with age-related macular degeneration. Russian Journal of Clinical Ophthalmology. 2022;22(4):228–233 (in Russ.). DOI: 10.32364/2311-7729-2022-22-4-228-233.
Введение
Одной из ведущих причин потери центрального зрения и инвалидности по зрению у взрослого населения развитых стран является возрастная макулярная дегенерация (ВМД) [1, 2]. Необходимо отметить, что более 80% случаев потери зрения при ВМД отмечаются в результате формирования хориоидальной неоваскуляризации (ХНВ) и ее последствий, а именно: экссудации, ретинальных геморрагий и дисциформных рубцов [3, 4]. В настоящее время доказана ведущая роль нарушений регуляции эндотелиального сосудистого фактора роста (vascular endothelial growth factor, VEGF) в патогенезе неоваскулярной ВМД (нВМД) [5, 6].
Современные успехи в лечении нВМД обусловлены, прежде всего, активным использованием лекарственных средств, подавляющих неоангиогенез. Первым препаратом, зарегистрированным в 2008 г. в РФ для анти-VEGF-терапии нВМД, был ранибизумаб [6–8]. Данный препарат является антигенсвязывающим Fab-фрагментом гуманизированного рекомбинантного моноклонального антитела, воздействующего на все изоформы VEGF-A. Низкая молекулярная масса ранибизумаба, составляющая 48 кДа, обеспечивает его хорошее проникновение через ретинальные слои для взаимодействия с рецепторами VEGF новообразованных сосудов [9].
Но с наработкой клинического опыта оказалось, что у ряда пациентов имеется резистентность или тахифилаксия к данному препарату. Причем их доля в общей совокупности пациентов с нВМД достаточно высока: от 10% до 50% [10–13].
Позже был разработан другой препарат для лечения нВМД — афлиберцепт с молекулярной массой 97 кДа. Он был зарегистрирован в РФ в 2016 г. Афлиберцепт представляет собой полностью человеческий гибридный белок — «рецептор-ловушку», специально разработанный для антиангиогенной терапии [14–16]. Его молекула состоит из VEGF-связывающих доменов VEGFR1 и VEGFR2, соединенных с Fc-фрагментом человеческого иммуноглобулина G. Преимуществом афлиберцепта в сравнении с ранибизумабом является его способность образовывать очень стабильную инертную связку с иммунными комплексами VEGF-A, характеризующуюся высокой аффинностью, строго в соотношении 1:1 [14, 15]. Кроме того, афлиберцепт обладает возможностью связывания плацентарного фактора роста (PIGF), играющего важную роль в патогенезе формирования неоваскуляризации [17–19].
Однако, несмотря на все преимущества афлиберцепта, при его использовании были выявлены отдельные случаи формирования хориоретинальной атрофии [20–22]. В связи с этим поиски наиболее эффективного и безопасного метода лечения нВМД по-прежнему остаются актуальными.
Новым ингибитором ангиогенеза стал недавно появившийся в клинической практике препарат бролуцизумаб (Визкью®, Novartis Pharma AG, Швейцария). Структурной основой бролуцизумаба является гуманизированный одноцепочечный фрагмент антитела с намного меньшей молекулярной массой (~26 кДа) в сравнении как с ранибизумабом, так и с афлиберцептом. Эти свойства позволяют ему успешно ингибировать связывание VEGF-A с рецепторами VEGFR1 и VEGFR2. По данным мультицентровых исследований HAWK и HARRIER, клиническая эффективность бролуцизумаба при достижении редукции интраретинальной и субретинальной жидкости оказалась значительно выше таковой у афлиберцепта (до 30% и более) [23].
В РФ бролуцизумаб был зарегистрирован для применения при нВМД в ноябре 2020 г. В Хабаровском филиале ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России мы стали использовать бролуцизумаб при лечении нВМД с декабря 2021 г. В связи с единичными российскими публикациями об использования бролуцизумаба при нВМД [24] мы сочли целесообразным представить свои первые результаты применения данного препарата.
Цель исследования: провести анализ непосредственной клинической эффективности применения препарата бролуцизумаб (Визкью®) при ХНВ у пациентов с ВМД.
Материал и методы
В исследовании приняли участие 25 пациентов (25 глаз) с нВМД. Среди них было 13 женщин, 12 мужчин. Критериями включения в исследование явились: наличие активной ХНВ, отсутствие какой-либо проводимой ранее антиангиогенной терапии. Критерии невключения: наличие в анамнезе ранее проводимой антиангио-генной терапии.
Исследование проводилось в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki — Ethical Principles for Medical Research Involving Human Subjects, 2013). Перед выполнением исследования у всех пациентов получено письменное информированное согласие.
Всем пациентам помимо стандартных методов исследования выполнялась оптическая когерентная томография (ОКТ) на приборе RS-3000 Advance2 (NIDEK, Япония). В режиме ангиографии (ангио-ОКТ) выяснялась локализация и площадь неоваскулярного комплекса, плотность и толщина новообразованных сосудов, разветвленность и перфузируемость субретинальной неоваскулярной мембраны, оценивалась их динамика после лечения. Кроме того, проводилась оценка светочувствительности сетчатки с помощью микропериметрии Maia (CenterVue, Италия).
Всем пациентам выполнялись интраокулярные инъекции Визкью® по стандартной загрузочной схеме — 3 ежемесячные инъекции. Все они выполнялись одним хирургом в условиях стерильной операционной в соответствии с инструкцией по медицинскому применению лекарственного средства (в дозе 6,0 мг / 0,05 мл).
Критерием эффективности лечения считалась положительная динамика следующих показателей: МКОЗ, ЦТС в мкм, объем макулы (ОМ) в мм3. Диагностическое обследование проводили исходно и после каждой из 3 инъекций бролуцизумаба. Срок наблюдения составил 4 мес.
Статистическая обработка данных выполнялась с использованием программы статистического анализа R версии 4.1.2. Нормальность распределений проверялась критерием Шапиро — Уилка. Нормально распределенные данные представлены в виде M±σ, где M — среднее значение, σ — стандартное отклонение. Данные, отличные от нормальных, представлены в виде Me (Q25; Q75), где Me — медиана, Q25, Q75 — 25-й и 75-й квантили соответственно. Для сравнения количественных показателей использовался модифицированный критерий суммы рангов Уилкоксона. Корректировка p-значений на множественные сравнения осуществлялась функцией p.adjust по методу Холма. Отличия считались значимыми при p<0,001.
Результаты исследования
Средний возраст пациентов составил 68±5 лет (от 58 до 74 лет). При офтальмоскопии в 15 глазах исходно парафовеолярно определялись типичные офтальмоскопические признаки неоваскулярной ВМД: субретинальный серо-зеленый очаг ХНВ, множественные «твердые» друзы, ретинальные единичные множественные геморрагии. На снимках ОКТ определялось наличие объемного гиперрефлективного веретенообразного участка над уровнем пигментного эпителия (рис. 1). По данным ангио-ОКТ, во всех 15 глазах имела место петлевидная сосудистая сеть различной интенсивности в зоне, соответствующей на снимке веретенообразному участку.
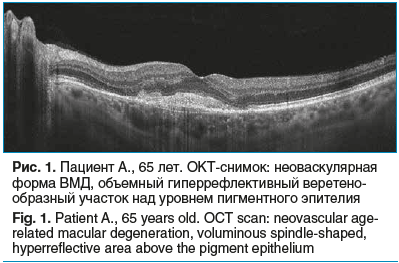
Кроме того, в 5 глазах в макулярной зоне определялась экссудативная отслойка нейроэпителия площадью от 1,5 до 2 диаметров диска зрительного нерва с неоднородным гиперрефлективным содержимым. По данным ангио-ОКТ, в этих 5 глазах наблюдалась петлевидная сосудистая сеть с многочисленными ответвлениями.
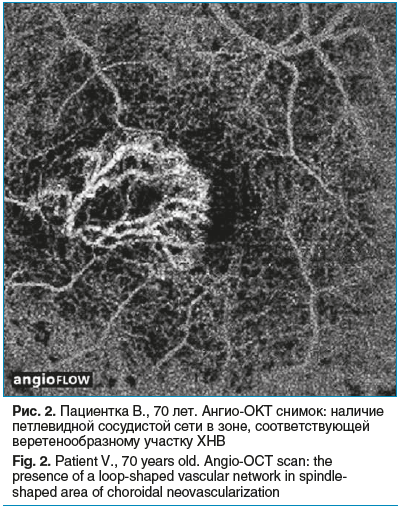
Еще у 5 пациентов при офтальмоскопии визуализировалась субретинальная геморрагия в макулярной области, друзы и атрофия пигментного эпителия. Согласно данным ОКТ в них определялась отслойка пигментного эпителия с гиперрефлективным содержимым. Ангио-ОКТ позволила выявить наличие петлевидной сосудистой сети в зоне, которая соответствует на снимке ОКТ веретенообразному участку (рис. 2).
Исходные показатели и их динамика на фоне лечения представлены в таблице.
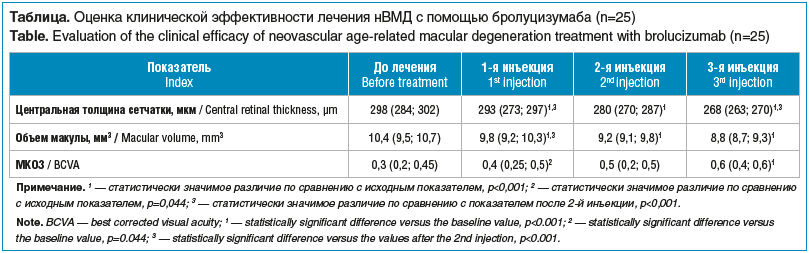
Как видно из таблицы, после 1-й инъекции бролуцизумаба наблюдалось статистически значимое снижение средних показателей ЦТС и ОМ относительно исходных данных (p<0,001). При этом наблюдалось повышение МКОЗ. После каждой инъекции регистрировали уменьшение ЦТС и ОМ и повышение МКОЗ. После 3-й инъекции исследуемого препарата отмечали статистически значимое снижение ЦТС и ОМ и повышение МКОЗ по сравнению с исходными показателями (p<0,001).
Лишь у 1 пациентки 72 лет с нВМД после 1-й инъекции произошло снижение МКОЗ с 0,1 до 0,05. При этом отмечено умеренное увеличение показателя ЦТС с 294 до 300 мкм. После 2-й инъекции данные значения показателя ЦТС сохранялись на прежнем уровне и составляли 300 мкм. Лишь после 3-й инъекции бролуцизумаба произошло снижение показателя ЦТС до 270 мкм. При этом отмечено повышение МКОЗ с 0,05 до 0,2.
Компьютерная микропериметрия макулярной зоны у всех пациентов до проведения курсов лечения регистрировала снижение световой чувствительности в среднем на 10 дБ. На фоне анти-VEGF-терапии изменения световой чувствительности были незначительны и колебались в среднем на 2,5 дБ, что не являлось статистически значимым для оценки результатов лечения и планирования дальнейшей тактики.
Уже через 1 мес. после 1-й инъекции у 22 из 25 пациентов регистрировалось прилегание нейро- и пигментного эпителия с полной резорбцией субретинальной жидкости. У 3 пациентов полная редукция отслойки нейро- или пигментного эпителия произошла только после 3 ежемесячных интравитреальных инъекций исследуемого препарата, при этом субретинальная жидкость у них не регистрировалась.
Субъективно все пациенты отмечали улучшение качества и контрастности центрального зрения в оперированных глазах.
Обсуждение
Проблема эффективного лечения неоваскулярной формы ВМД является одной из наиболее актуальных в клинической офтальмологии. Это обусловлено высокой степенью снижения зрительных функций и распространенностью данной патологии. В клинической практике широко применяются препараты, относящиеся к фармакологической группе ингибиторов VEGF, — ранибизумаб, афлиберцепт. Новый препарат Визкью® представляет собой инновационную молекулу с уникальным строением, специально разработанную для лучшего контроля нВМД [23]. Данный препарат превосходит афлиберцепт и ранибизумаб в достижении стабильного контроля активности нВМД на протяжении 2 лет [23, 25]. Согласно данным многоцентровых исследований использование этого препарата позволяет устойчиво контролировать заболевание при более длительных интервалах между инъекциями, что потенциально повышает комплаентность пациента [26].
В приведенном исследовании на небольшом клиническом материале мы проследили динамику изменений основных показателей, характеризующих нВМД, — ЦТС, ОМ, МКОЗ при стандартном загрузочном введении бролуцизумаба (3 последовательные инъекции). Практически во всех случаях после каждой инъекции отмечалось постепенное статистически значимое улучшение исследуемых показателей. При этом значения МКОЗ обнаруживали четкую тенденцию к повышению. Полученные нами данные полностью согласуются с аналогичными данными зарубежных авторов [25, 27].
В проведенном нами исследовании не отмечено каких-либо воспалительных реакций глаз. По данным исследований, их частота в реальной клинической практике может составлять около 2,4% [28]. Ограничениями нашего исследования являются небольшое число включенных случаев и короткий срок наблюдения, однако все пациенты получили обследование с помощью методов мультимодальной диагностики, и мы можем рассчитывать, что ни один, даже самый легкий, случай внутриглазного воспаления не был пропущен.
Выводы
Клинические результаты проведения 3 стандартных загрузочных инъекций нового препарата Визкью® при лечении нВМД показали, что после каждой инъекции отмечалась прогрессирующая статистически значимая редукция основных морфометрических показателей макулярной области — ЦТС и ОМ. Это сочеталось с повышением средних значений МКОЗ к 4-му месяцу наблюдения.
Для более глубоких заключений о степени эффективности данного препарата требуются долгосрочные наблюдения на большом клиническом материале. Однако уже сейчас предварительные данные позволяют говорить о хорошей эффективности данного препарата.
Сведения об авторах:
Жайворонок Наталья Сергеевна — врач-офтальмолог отделения комплексно-реабилитационного лечения Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; ORCID iD 0000-0001-5515-4099.
Коленко Олег Владимирович — д.м.н., директор Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; заведующий кафедрой офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения»; 680000, Россия, г. Хабаровск, ул. Краснодарская, д. 9; профессор кафедры общей и клинической хирургии ФГБОУ ВО ДВГМУ Минздрава России; 680000, Россия, г. Хабаровск, ул. Муравьева-Амурского, д. 35; ORCID iD 0000-0001-7501-5571.
Данилова Любовь Петровна — заведующая отделением комплексно-реабилитационного лечения, врач-офтальмолог Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; ассистент кафедры офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения»; 680000, Россия, г. Хабаровск, ул. Краснодарская, д. 9; ORCID iD 0000-0003-0665-1755.
Сорокин Евгений Леонидович — д.м.н., профессор, заместитель директора по научной работе Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; профессор кафедры общей и клинической хирургии ФГБОУ ВО ДВГМУ Минздрава России; 680000, Россия, г. Хабаровск, ул. Муравьева-Амурского, д. 35; ORCID iD 0000‑0002-2028-1140.
Контактная информация: Жайворонок Наталья Сергеевна, e-mail: naukakhvmntk@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 22.08.2022.
Поступила после рецензирования 14.09.2022.
Принята в печать 07.10.2022.
About the authors:
Natal’ya S. Zhayvoronok — ophthalmologist of the Department of Complex Rehabilitation Treatment, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; ORCID iD 0000-0001-5515-4099.
Oleg V. Kolenko — Dr. Sc. (Med.), Director, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; Head of the Department of Ophthalmology, Institute of Advanced Training of Healthcare Specialists; 9, Krasnodarskaya str., Khabarovsk, 680000, Russian Federation; Professor of the Department of General and Clinical Surgery, Far Eastern State Medical University; 35, Murav’ev-Amurskiy str., Khabarovsk, 680000, Russian Federation; ORCID iD 0000-0001-7501-5571.
Lyubov’ P. Danilova — Head of the Department of Complex Rehabilitation Treatment, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; assistant of the Department of Ophthalmology, Institute of Advanced Training of Healthcare Specialists; 9, Krasnodarskaya str., Khabarovsk, 680000, Russian Federation; ORCID iD 0000-0003-0665-1755.
Evgeniy L. Sorokin — Dr. Sc. (Med.), Professor, Deputy Director for Research, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; Professor of the Department of General and Clinical Surgery, Far Eastern State Medical University; 35, Murav’ev-Amurskiy str., Khabarovsk, 680000, Russian Federation; ORCID iD 0000‑0002-2028-1140. Contact information: Natal’ya S. Zhayvoronok, e-mail: naukakhvmntk@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 22.08.2022.
Revised 14.09.2022.
Accepted 07.10.2022.
2. Stahl A. Anti-angiogenic therapy in ophthalmology. Germany: Springer; 2016.
3. Бикбов М.М., Файзрахманов Р.Р., Ярмухаметова А.Л. Возрастная макулярная дегенерация. М.: Апрель; 2013.
4. Ferris F.L. 3rd, Fine S.L., Hyman L. Age-related macular degeneration and blindness due to neovascular maculopathy. Arch Ophthalmol. 1984;102(11):1640–1642. DOI: 10.1001/archopht.1984.01040031330019.
5. Das A., Friberg T. Therapy for ocular angiogenesis: principles and practice. USA, Philadelphia: LWW; 2011.
6. Коротких С.А., Бобыкин Е.В., Назарова Н.С., Мелехина Е.Е. Антиангиогенная терапия неоваскулярных заболеваний макулярной области (отдаленные результаты). Вестник офтальмологии. 2016;132(1):76–84. DOI: 10.17116/oftalma2016132176-84.
7. Jacob J., Brie H., Leys A. et al. Six-year outcomes in neovascular age-related macular degeneration with ranibizumab. Int J Ophthalmol. 2017;10(1):81–90. DOI: 10.18240/ijo.2017.01.14.
8. Rofagha S., Bhisitkul R.B., Boyer D.S. et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: a multicenter cohort study (SEVEN UP). Ophthalmology. 2013;120(11):2292–2299. DOI: 10.1016/j.ophtha.2013.03.046.
9. Presta L.G., Chen H., O’Connor S.J. et al. Humanization of an anti-vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders. Cancer Res. 1997;57(20):4593–4599. PMID: 9377574.
10. Будзинская М.В., Плюхова А.А., Сорокин П.А. Резистентность к анти-VEGF-терапии при экссудативной возрастной макулярной дегенерации. Вестник офтальмологии. 2017;133(4):103–108.
11. Фокин В.П., Балалин А.С., Чайковская С.М. Микропериметрия и оптическая когерентная томография в морфофункциональном анализе сетчатки у пациентов с влажной макулодистрофией. Современные технологии в офтальмологии. 2019;(1):310–314. DOI: 10.25276/2312-4911-2019-1-310-314.
12. Donati S., Cattaneo J., Bianchi M. et al. Clinical efficacy of aflibercept in non-responsive to ranibizumab choroidal neovascular lesions in AMD. Invest Ophthalmol Vis Sci. 2015;56(7):4585.
13. Queguiner F., Bezirganyan K., Courjaret J.C. et al. Impact of switching from ranibizumab to aflibercept on the number of intravitreous injection and follow up visit in wet AMD: results of real life ELU study. Int J Ophthalmol. 2020;13(2):252–256. DOI: 10.18240/ijo.2020.02.08.
14. Ohr M., Kaiser P.K. Intravitreal aflibercept injection for neovascular (wet) age-related macular degeneration. Expert Opin Pharmacother. 2012;13(4):585–591. DOI: 10.1517/14656566.2012.658368.
15. Sophie R., Akhtar A., Sepah Y.J. et al. Aflibercept: a potent vascular endothelial growth factor antagonist for neovascular age-related macular degeneration and other retinal vascular diseases. Biol Ther. 2012;2(1):3. DOI: 10.1007/s13554-012-0003-4.
16. Semeraro F., Morescalchi F., Duse S. et al. Aflibercept in wet AMD: specific role and optimal use. Drug Des Devel Ther. 2013;(7):711–722. DOI: 10.2147/DDDT.S40215.
17. Papadopoulos N., Martin J., Ruan Q. et al. Binding and neutralization of vascular endothelial growth factor (VEGF) and related ligands by VEGF Trap, ranibizumab and bevacizumab. Angiogenesis. 2012;15(2):171–185. DOI: 10.1007/s10456-011-9249-6.
18. Li X., Lee C., Tang Z. et al. VEGF-B: a survival, or an angiogenic factor? Cell Adh Migr. 2009;3(4):322–327. DOI: 10.4161/cam.3.4.9459.
19. Rakic J.M., Lambert V., Devy L. et al. Placental growth factor, a member of the VEGF family, contributes to the development of choroidal neovascularization. Invest Ophthalmol Vis Sci. 2003;44(7):3186–3193. DOI: 10.1167/iovs.02-1092.
20. Koizumi H., Yamamoto A., Ogasawara M. et al. Macular atrophy after aflibercept therapy for neovascular age-related macular degeneration: outcomes of Japanese multicenter study. Jpn J Ophthalmol. 2020;64(4):338–345. DOI: 10.1007/s10384-020-00745-0.
21. Sayanagi K., Uematsu S., Hara C. et al. Effect of intravitreal injection of aflibercept or ranibizumab on chorioretinal atrophy in myopic choroidal neovascularization. Graefes Arch Clin Exp Ophthalmol. 2019;257(4):749–757. DOI: 10.1007/s00417-018-04214-w.
22. Жайворонок Н.С., Егоров В.В., Смолякова Г.П. и др. Первый клинический опыт применения афлиберцепта в лечении пациентов с неоваскулярной возрастной макулярной дегенерацией, резистентной к ранибизумабу. Современные технологии в офтальмологии. 2018;2:144–147.
23. Dugel P.U., Singh R.P., Koh A. et al. HAWK and HARRIER: Ninety-six-week outcomes from the phase 3 trials of brolucizumab for neovascular age-related macular degeneration. Ophthalmology. 2021;128(1):89–99. DOI: 10.1016/j.ophtha.2020.06.028.
24. Куликов А.Н., Мальцев Д.С., Малафеева А.Ю. и др. Первый опыт применения бролуцизумаба в лечении неоваскулярной возрастной макулярной дегенерации. РМЖ. Клиническая офтальмология. 2022;22(2):108–115. DOI: 10.32364/2311-7729-2022-22-2-108-115.
25. Singer M., Albini T.A., Seres A. et al. Clinical characteristics and outcomes of eyes with intraocular inflammation after brolucizumab: post hoc analysis of HAWK and HARRIER. Ophthalmol Retina. 2022;6(2):97–108. DOI: 10.1016/j.oret.2021.05.003.
26. Tadayoni R., Sararols L., Weissgerber G. et al. Brolucizumab: a newly developed anti-VEGF molecule for the treatment of neovascular age-related macular degeneration. Ophthalmologica. 2021;244(2):93–101. DOI: 10.1159/000513048.
27. Agostini H., Mulyukov Z., Tsilimbaris M. et al. Comparison of the efficacy of brolucizumab with natural disease progression in wet AMD using clinical data from the phase III HAWK and HARRIER trials and modelled placebo data. Curr Eye Res. 2020;45(10):1298–1301. DOI: 10.1080/02713683.2020.1731832.
28. Khanani A.M., Zarbin M.A., Barakat M.R. et al. Safety outcomes of brolucizumab in neovascular age-related macular degeneration: results from the IRIS registry and KOMODO healthcare map. JAMA Ophthalmol. 2022;140(1):20–28. DOI: 10.1001/jamaophthalmol.2021.4585.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
