«Ландшафт» глаукомы в России, странах СНГ и Восточной Европы: что поменялось за 15 лет? Результаты многоцентрового международного исследования
Цель исследования: изучить динамику и характер изменений клинико-эпидемиологической характеристики, подходов к диагностике и лечению ПОУГ в Российской Федерации и ряде стран ближнего и дальнего зарубежья в период 2005–2020 гг.
Материал и методы: в итоговый протокол ретроспективного научно-клинического многоцентрового международного исследования были включены данные 289 пациентов с ПОУГ из 7 государств (Россия, Беларусь, Сербия, Молдова, Кыргызстан, Словакия, Словения). Проанализированы используемые методы диагностики ПОУГ, клинико-демографические характеристики пациентов (пол, возраст, место проживания) и характеристики глаукомного процесса (возраст начала, продолжительность заболевания и его стадии, уровни офтальмотонуса, гипотензивный режим, применявшиеся лазерные и хирургические вмешательства). Все пациенты были разделены на 4 группы в зависимости от времени постановки первичного диагноза: 2004–2005 гг., 2009–2010 гг., 2014–2015 гг., 2019–2020 гг.
Результаты исследования: тонометрия по Маклакову и Гольдману на протяжении 15 лет остается «золотым стандартом» измерения внутриглазного давления (ВГД) (95% случаев). Доля пневмотонометрии выросла с 40% в 2005 г. до 60% в 2020 г. Около трети клиник по-прежнему используют в качестве вспомогательного метода электронную тонографию. Базовым методом диагностики и динамического сопровождения ПОУГ является автоматическая статическая периметрия (более 95% случаев). Мануальная кинетическая периметрия (периметрия по Ферстеру) применяется менее чем в 10% случаев. Во всех клиниках и во всех случаях диагностики глаукомы используется офтальмоскопия (прямая и бинокулярная). Спектр инструментальных технологий визуализации включает оптическую когерентную томографию (ОКТ), гейдельбергскую ретинальную томографию (HRT) и сканирующую лазерную поляриметрию. В настоящее время ОКТ используется в 90% клиник. Установлено, что стандартом первичной диагностики ПОУГ в 2005 г. был набор из тонометрии по Маклакову/Гольдману, офтальмоскопии, кинетической периметрии. В 2020 г. этот список включает тонометрию по Маклакову/Гольдману, пневмотонометрию в качестве дополнения, автоматическую статическую периметрию, офтальмоскопию и ОКТ. Доля впервые выявленной ПОУГ в начальной стадии выросла за 15 лет в 2 раза (с 20% в 2005 г. до 38% в 2020 г.). Средний возраст пациентов на этапе первичной постановки диагноза ПОУГ составил в 2005 г. 62 (52; 67) года, в 2020 г. — 65 (50; 70) лет соответственно (р=0,694). Доля аналогов простагландинов в медикаментозной терапии выросла за 15 лет на 20%, на столько же уменьшилась доля β-блокаторов, использование холиномиметиков практически прекратилось. Общее количество лазерных антиглаукомных операций возросло, на первый план в течение последнего десятилетия вышла селективная лазерная трабекулопластика, доля же аргон-лазерной трабекулопластики уменьшилась на 10%. Частота первичной антиглаукомной хирургии (трабекулэктомия) продолжает падать.
Заключение: за период 2005–2020 гг. выявлено постепенное и последовательное внедрение в рутинную практику высокотехнологичных методов диагностики (автоматическая статическая периметрия и ОКТ), установлена четкая тенденция объективизации получаемых данных. Эволюция фармацевтического «ландшафта» лечения заболевания сопровождается увеличением доли более эффективных и безопасных лекарственных препаратов (аналоги простагландинов) и уменьшением роли β-блокаторов в качестве препаратов выбора в стартовой терапии. С 2005 по 2010 г. неуклонно падает доля антиглаукомной хирургии как стартовой стратегии лечения ПОУГ.
Ключевые слова: глаукома, внутриглазное давление, тонометрия, периметрия, оптическая когерентная томография, трабекулэктомия.
Для цитирования: Брежнев А.Ю., Егоров Е.А., Еричев В.П., Куроедов А.В., Завадский П.Ч., Bozic M., Воронова Н.Н., Джумова М.Ф., Иванова Н.В., Имшенецкая Т.А., Каменских Т.Г., Лебедев О.И., Марченко Л.Н., Онищенко А.Л., Собянин Н.А., Экгардт В.Ф. «Ландшафт» глаукомы в России, странах СНГ и Восточной Европы: что поменялось за 15 лет? Результаты многоцентрового международного исследования. РМЖ. «Клиническая Офтальмология». 2023;23(2):73-79. DOI: 10.32364/2311-7729-2023-23-2-73-79.
A.Yu. Brezhnev1, E.A. Egorov2, V.P. Erichev3, A.V. Kuroedov2,4, P.Ch. Zavadsky5, M. Bozic6, N.N. Voronova7, M.F. Dzhumova8, N.V. Ivanova7, T.A. Imshenetskaya9, T.G. Kamenskikh10, O.I. Lebedev11, L.N. Marchenko8, A.L. Onishchenko12, N.A. Sobyanin13, V.F. Ekgardt14
1Kursk State Medical University, Kursk, Russian Federation
2Pirogov Russian National Research Medical University, Moscow, Russian Federation
3Krasnov Research Institute of Eye Diseases, Moscow, Russian Federation
4P.V. Mandryka Military Clinical Hospital, Moscow, Russian Federation
5LLC "Ophthalmological Center of Karelia", Petrozavodsk, Russian Federation
6University Eye Clinic, University of Belgrade, Belgrade, Serbia
7V.I. Vernadsky Crimean Federal University, Simferopol, Russian Federation
8Belarusian State Medical University, Minsk, Belarus
9Belarusian Medical Academy of Post-Diploma Education, Minsk, Belarus
10V.I. Razumovskiy Saratov State Medical University, Saratov, Russian Federation
11Omsk State Medical University, Omsk, Russian Federation
12Novokuznetsk State Institute for Advanced medical Education — Branch of Russian Medical Academy of Continuous Professional Education, Novokuznetsk, Russian Federation
13F.Kh. Gral City Clinical Hospital No. 2, Perm, Russian Federation
14South Ural State Medical University, Chelyabinsk, Russian Federation
Aim: to assess the changes in clinical and epidemiological characteristics, diagnostic and treatment options of primary open-angle glaucoma (POAG) in the Russian Federation and multiple near- and far-abroad countries over the period of 2005–2020.
Patients and Methods: the final protocol of this retrospective multi-center research and clinical study included 289 patients with POAG from 7 states (Russia, Belarus, Serbia, Moldova, Kyrgyzstan, Slovakia, and Slovenia). The authors analyzed the methods used for establishing POAP diagnosis, clinical and demographic patient characteristics (gender, age and place of residence), as well as the process of glaucoma development (age of onset, disease duration and stages, intraocular pressure, ocular hypotensive medications, and the used laser and surgical procedures). All patients were divided into four groups depending on the time of making the initial diagnosis: 2004–2005, 2009–2010, 2014–2015, 2019–2020.
Results: tonometry with Maklakov and Goldmann tonometers is still considered the gold standard for measuring intraocular pressure (IOP) (95% of cases). The percentage of pneumotonometry increased from 40% in 2005 to 60% in 2020. Approximately a third of clinics are still using electronic tonography as a supplementary method. Static automated perimetry is a basic tool for diagnosis and follow-up of patients with POAG (more than 95% of cases). Manual kinetic perimetry (Foerster's perimetry) is used in less than 10% of cases. Ophthalmoscopy (direct and binocular) was involved in the diagnostic process in all clinics and in all cases.
The range of instrumental visualization technologies includes optical coherence tomography (OCT), Heidelberg Retina Tomography (HRT), and scanning laser polarimetry. Currently, OCT is utilized in 90% of clinics. It was found out that in 2005 the standard of initial POAG diagnosis encompassed a set of Maklakov/Goldmann tonometry, ophthalmoscopy and kinetic perimetry. In 2020, this list includes Maklakov/Goldmann tonometry, pneumotonometry as a supplemental tool, static automated perimetry, ophthalmoscopy and OCT. The percentage of newly diagnosed POAG at the early stage has increased twofold over the past 15 years (from 20% in 2005 to 38% in 2020). The mean age of patients at the time of initial POAG diagnosis in 2005 was 62 (52; 67) years, in 2020 — 65 (50; 70) years, respectively (р=0.694). The proportion of prostaglandins in medication therapy increased by 20% over the past 15 years, while the proportion of beta-blockers reduced by the same percentage. The use of cholinomimetic drugs was almost discontinued. The total number of glaucoma laser surgeries has grown, and in the last decade the top priority has been given to selective laser trabeculoplasty, while the share of argon laser trabeculoplasty has decreased by 10%. The rate of primary glaucoma surgeries (trabeculectomy) keeps going down.
Conclusion: a gradual and consistent implementation of high-tech diagnostic methods (static automated perimetry and OCT) in the routine practice occurred over 2005–2020. Also, there was a clear trend in more extensive use of objective data. The evolution of pharmaceutical "landscape" in the disease management is associated with an increasing proportion of more effective and safe drugs (prostaglandin analogues) and a diminishing role of beta-blockers as drugs of choice for starting therapy. The share of glaucoma surgeries as a starting strategy of POAG management was running down steadily from 2005 to 2010.
Keywords: glaucoma, intraocular pressure, tonometry, perimetry, optical coherence tomography, trabeculectomy. For citation: Brezhnev A.Yu., Egorov E.A., Erichev V.P. et al. Glaucoma "landscape" in Russia, CIS and Eastern European countries: what has changed over 15 years? Russian Journal of Clinical Ophthalmology. 2023;23(2):73–79 (in Russ.). DOI: 10.32364/2311-7729-2023-23-2-73-79.
Введение
Окружающая нас реальность стремительно трансформируется. Изменения, которые носят глобальный характер и скорость которых неуклонно возрастает, не могли не отразиться на частностях, касающихся в том числе медицины, офтальмологии, глаукоматологии. Ускоряющиеся темпы развития современной науки привели к совершенствованию старых и возникновению оригинальных технологий диагностики, направлений медикаментозного и хирургического лечения многих офтальмологических заболеваний, в том числе и первичной открытоугольной глаукомы (ПОУГ).
В течение многих лет стандартный алгоритм лечения ПОУГ практически не менялся и включал возможность применения максимально длительной медикаментозной терапии до тех пор, пока процесс не заходил достаточно далеко, чтобы рассматривать вопрос о хирургическом вмешательстве.
Однако в последние десятилетия данная стратегия была существенно пересмотрена. Это связано с появлением современного диагностического оборудования, разработкой новых классов антиглаукомных препаратов, активным внедрением лазерных методик и оперативных вмешательств, в том числе с использованием имплантируемых устройств [1–5]. Параллельно изменяются клинико-демографические показатели, возрастает средняя продолжительность жизни, что отражается на эпидемиологии возраст-ассоциированных заболеваний [6, 7].
Несмотря на происходящие процессы, глаукома на протяжении последних десятилетий продолжает оставаться одной из ведущих причин необратимой слепоты и слабовидения в мире [8]. Ожидается увеличение числа таких пациентов в ближайшие 20 лет [9]. В этой связи очевидно, что далеко не все новаторства в области глаукоматологии достигают своей основной цели, и требуется их критическая оценка и переосмысление для выработки новых и более эффективных мер борьбы с ПОУГ. Представляется актуальным проанализировать те трансформации, которые касаются глаукомного процесса и сопровождающих его организационных и иных моментов, которые произошли в течение последних 15 лет.
Цель исследования: изучить динамику и характер изменений клинико-эпидемиологической характеристики, подходов к диагностике и лечению ПОУГ в Российской Федерации и ряде стран ближнего и дальнего зарубежья в период 2005–2020 гг.
Материал и методы
Проведено ретроспективное когортное научно-клиническое комбинированное многоцентровое международное исследование, в котором приняли участие 26 офтальмологов из 7 государств (Россия, Беларусь, Сербия, Молдова, Кыргызстан, Словакия, Словения), представляющих 20 офтальмологических клиник и центров.
Ретроспективный анализ проведен за период 2004–2020 гг. Предметом исследования выступили пациенты с разными стадиями ПОУГ, разделенные на 4 группы в зависимости от времени постановки первичного диагноза: 1-я — в 2004–2005 гг.; 2-я — в 2009–2010 гг.; 3-я — в 2014–2015 гг.; 4-я — в 2019–2020 гг.
В ходе исследования изучались такие показатели, как используемые методы диагностики ПОУГ, клинико-демографические характеристики пациентов (пол, возраст, место проживания) и характеристики глаукомного процесса (возраст начала, продолжительность заболевания и его стадии, уровни офтальмотонуса, гипотензивный режим, применявшиеся лазерные и хирургические вмешательства).
Критерии включения: продолжительность заболевания ПОУГ более 6 мес. с момента верификации диагноза; возраст на момент диагностирования ПОУГ от 40 до 85 лет; клиническая рефракция не более±6,0 дптр и астигматизм степенью не более±3,0 дптр.
Критерии исключения: выраженные помутнения оптических сред, затрудняющие использование морфометрических или периметрических методов исследования или приводящие к неправильной трактовке их результатов; пациенты с любыми иными заболеваниями сетчатки (например, «сухая» форма возрастной макулярной дегенерации (ВМД), начиная со II стадии по классификации AREDS (2001), состояния после сосудистых окклюзий и осложнений диабетической ретинопатии, «влажная» форма ВМД, в том числе на фоне интравитреальных инъекций препаратами — ингибиторами ангиогенеза, и др.); пациенты с травмами и заболеваниями органа зрения в анамнезе, затрудняющими проведение тонометрии; пациенты после проведенной интракапсулярной экстракции катаракты, «классической» экстракапсулярной экстракции катаракты или факоэмульсификации, прошедших с осложнениями (например, частичная потеря стекловидного тела); пациенты с любой формой отслойки сетчатки (оперированная или неоперированная); пациенты с общими (системными) заболеваниями, требующими гормональной терапии.
В итоговый протокол исследования были включены данные 289 пациентов (1-я группа — 65 человек, 2-я группа — 83 человека, 3-я группа — 72 человека, 4-я группа — 69 человек). Относительная равномерность распределения пациентов между изучаемыми временными промежутками позволила получить статистически значимые результаты. Мужчины составили 44%, женщины — 56%. В большинстве случаев были представлены пациенты, проживающие в городах с населением более 50 тыс. человек.
Статистический анализ полученных данных осуществляли с использованием программы Statistica 10.0 (StatSoft Inc., США). Параметры, имеющие распределение, отличное от нормального, представлены в формате Мe (Q1; Q3), где Мe — медиана, Q1 и Q3 — квартили. Для проверки равенства медиан нескольких выборок применяли H-критерий Краскела — Уоллиса; при отличном от нормального распределении параметров для сравнения нескольких независимых выборок — для попарного сравнения двух независимых выборок — Z-аппроксимация U-критерия Манна — Уитни, для повторных внутригрупповых сравнений — Z-аппроксимация T-критерия Уилкоксона. Статистическую значимость различий двух или нескольких относительных показателей (частот, долей) оценивали с использованием критерия согласия Пирсона (χ2). Критический уровень значимости при проверке статистических гипотез принят равным <0,05.
Результаты и обсуждение
Блок "Диагностика"
Основными направлениями диагностического поиска при глаукоме по-прежнему остаются тонометрия, периметрия и исследование глазного дна.
ТонометрияНа рисунке 1 представлен спектр и динамика использования различных методов измерения офтальмотонуса за изучаемый период. Тонометрия по Маклакову для России и стран постсоветского пространства и тонометрия по Гольдману для стран Восточной Европы и Азии, принявших участие в исследовании, остается «золотым стандартом».
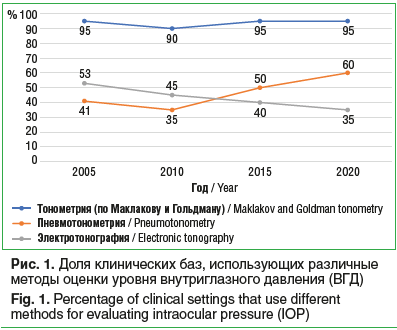
Доля клинических баз, использующих эти методы, составляет в сумме около 95%. Этот показатель остается стабильным на протяжении всего периода наблюдения. Обращает на себя внимание любопытный аспект, связанный с увеличением доли пневмотонометрии в диагностике и динамическом наблюдении пациентов с ПОУГ (с 40% в 2005 г. до 60% в 2020 г.). С одной стороны, это свидетельствует о дополнительном оснащении поликлинического звена современным оборудованием, с другой — вызывает вопросы в части корректного сопровождения глаукомного процесса с учетом потенциальных погрешностей и недостатков пневмотонометрии при ее использовании у глаукомных пациентов [10]. Тонометрия с регистрацией параметров роговичного гистерезиса начала использоваться в клинической практике с 2010 г., однако среди представленных офтальмологических центров лишь два были оснащены данным оборудованием. Любопытно, что около трети лечебных учреждений, принявших участие в исследовании, по-прежнему используют в качестве вспомогательного метода на этапе первичной диагностики ПОУГ электронную тонографию. Впрочем, за 15 лет ее доля уменьшилась с 53 до 35%.
ПериметрияПрактически во всех клиниках автоматическая статическая периметрия является базовым методом для диагностики и динамического сопровождения глаукомного процесса, составляя более 95% случаев (рис. 2). При этом еще 15 лет назад этот показатель составлял немногим больше 40%. Мануальная кинетическая периметрия (периметрия по Ферстеру), использовавшаяся 15 лет назад в 2/3 случаев, сейчас востребована лишь у 1 пациента из 10, и этот метод постепенно переходит в разряд «исторических». Впрочем, существуют ситуации, когда он по-прежнему используется в рутинной практике. В этой связи респонденты упоминают ситуации, связанные преимущественно с возраст-ассоциированными и когнитивными проблемами у пациентов, затрудняющими использование компьютерных технологий. Кампиметрические исследования в диагностике ПОУГ были упомянуты лишь одним исследователем.
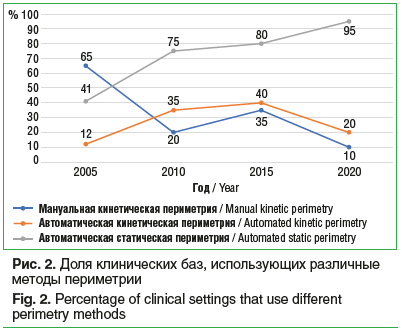
Офтальмоскопия (прямая и бинокулярная) используется в настоящее время во всех клиниках и во всех случаях диагностики глаукомы. Спектр инструментальных технологий визуализации, отмеченных исследователями, включал оптическую когерентную томографию (ОКТ), гейдельбергскую ретинальную томографию (HRT) и сканирующую лазерную поляриметрию. В 2005 г. на долю ОКТ приходилось до 24% всех случаев диагностики, HRT использовалась у 18% пациентов, сканирующая лазерная поляриметрия ограничивалась единичными случаями. Спустя 15 лет «конкурентную борьбу» выиграла технология ОКТ, ставшая «золотым стандартом» и применяемая в качестве критерия диагностики и динамического наблюдения в 90% клиник. Остальные методики в сумме не превышают 5% тестов.
В целом, оценивая произошедшие в диагностическом алгоритме изменения, следует отметить, что стандартом первичной диагностики ПОУГ в 2005 г. был набор из тонометрии по Маклакову/Гольдману (в зависимости от страны), офтальмоскопии, кинетической периметрии. С 2020 г. этот список включает тонометрию по Маклакову/Гольдману, пневмотонометрию в качестве дополнения, автоматическую статическую периметрию, офтальмоскопию и ОКТ.
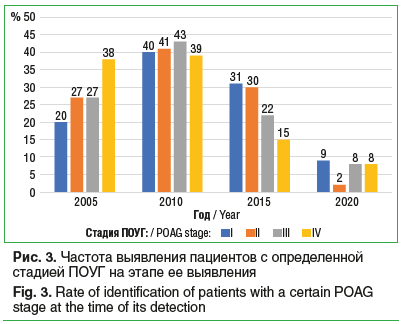
Блок «Клинический портрет пациента»Безусловно положительным трендом следует считать рост числа случаев выявления ранних стадий глаукомы. В принявших участие в исследовании клиниках доля впервые выявленной ПОУГ в начальной стадии выросла за 15 лет практически вдвое (с 20% в 2005 г. до 38% в 2020 г.). Доля впервые выявленной терминальной глаукомы остается стабильной, составляя 8–9% (рис. 3).
Не нашел подтверждения нередко декларируемый тезис о «помолодении» глаукомы. В нашем исследовании возраст пациентов на этапе первичной постановки диагноза ПОУГ составил в 2005 г. 62 (52; 67) года, в 2010 г. — 64 (53; 68) года, в 2015 г. — 66 (60; 73) лет и в 2020 г. — 65 (50; 70) лет (р=0,694).
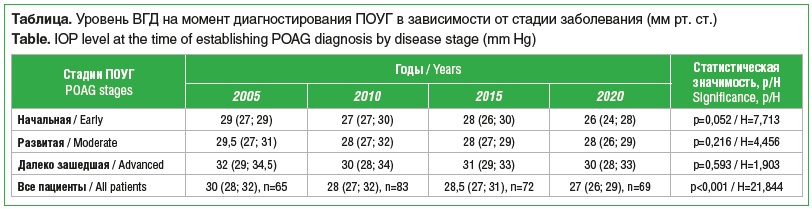
Еще один проанализированный параметр — уровень ВГД на этапе первичной постановки диагноза глаукомы. Сейчас ПОУГ диагностируется на уровне ВГД примерно на 3 мм рт. ст. ниже, чем 15 лет назад (см. таблицу). Возможно, это объясняется возросшей долей начальных стадий впервые выявленной глаукомы, при которых уровень ВГД исходно ниже.
Не установлено изменений по другим клинико-демографическим характеристикам.
Блок «Лечение»Существенные изменения претерпели за изучаемый период времени спектр и соотношение используемых в лечении ПОУГ лекарственных препаратов для местного использования. За 15 лет доля аналогов простагландинов выросла на 20%, примерно столько же потеряли β-блокаторы. Ингибиторы карбоангидразы и α-адреномиметики в целом сохраняют свои позиции. Использование холиномиметиков в качестве препаратов лечения ПОУГ практически прекратилось (рис. 4). Очевидно, что данный тренд определяется сравнительной гипотензивной эффективностью и профилем безопасности имеющихся в нашем арсенале антиглаукомных препаратов и имеет общемировой характер [11–13].
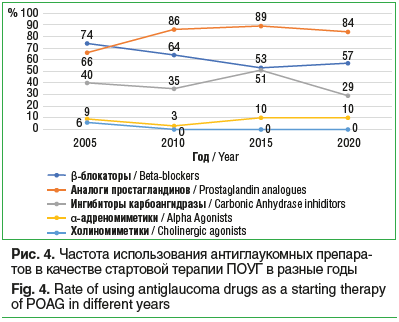
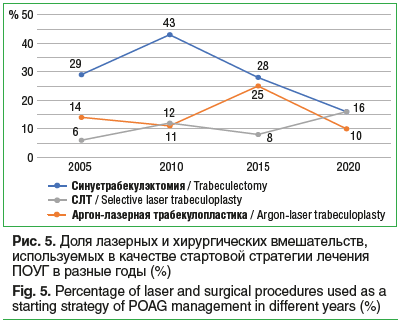
Общее количество лазерных антиглаукомных операций несколько возросло. Структура этой группы претерпела изменения: на первый план в течение последнего десятилетия вышла селективная лазерная трабекулопластика (СЛТ), доля же аргон-лазерной трабекулопластики уменьшилась на 10%. Это соотносится с общемировыми тенденциями, получившими развитие после появления технологии СЛТ в 2001 г. и накопления данных об эффективности, безопасности и расширения показаний к применению данной технологии в последние годы [14–16]. Очевиден тренд, касающийся доли первичной антиглаукомной хирургии (трабекулэктомия и пр.) — этот показатель в течение последнего десятилетия продолжает неуклонно падать (рис. 5). Начало процесса падения совпадает с активной экспансией аналогов простагландинов и разнообразных фиксированных комбинаций на фармацевтическом рынке и подтверждает данные литературы из других регионов мира [17–21].
Уровень ВГД на этапе стартового лечения за прошедшие годы практически не изменился, однако несколько эффективнее стала гипотензивная терапия начальной стадии глаукомы. Это можно объяснить более правильным выбором стратегии лечения при наличии новых эффективных препаратов, появившихся в арсенале офтальмологов в последние 15 лет.
Заключение
Несмотря на относительно короткий промежуток времени, в рамках которого осуществлялся анализ «ландшафта» глаукомы (2005–2020 гг.), выявлен целый ряд тенденций, характеризующих изменения, сопутствующие сопровождению глаукомного процесса у пациентов в России и странах ближнего и дальнего зарубежья. В первую очередь это постепенное и последовательное внедрение в рутинную практику высокотехнологичных методов диагностики (автоматическая статическая периметрия и ОКТ), тенденция к объективизации получаемых данных. Это, в свою очередь, обусловливает расширение спектра возможностей ранней диагностики начальных стадий ПОУГ и уход от «тонометрической» зависимости. Эволюция фармацевтического «ландшафта» сопровождается увеличением доли более эффективных и безопасных лекарственных препаратов (аналоги простагландинов) и уменьшением роли β-блокаторов в качестве препаратов выбора в стартовой терапии. Спектр лазерных технологий за изучаемый период не изменился, но очевидна тенденция к преимущественному использованию СЛТ. Наконец, с 2005–2010 гг. неуклонно падает доля антиглаукомной хирургии как стартовой стратегии лечения ПОУГ.
Благодарность
Авторы благодарят коллективы врачей и отдельных специалистов, принимавших участие в формировании первичной базы данных: Cvenkel B. (Любляна, Словения), Ferková S.L. (Братислава, Словакия), Praženicová M. (Братислава, Словакия), Иманбаева С.С. (Бишкек, Кыргыстан, Marjanović I. (Белград, Сербия), Поступаев А.В., Поступаева Н.В. (оба — Хабаровск, Россия), Хуснитдинов И.И. (Уфа, Россия), Черных В.В., Чехова Т.А. (оба — Новосибирск, Россия), Чистякова С.В. (Симферополь, Россия).
Cведения об авторах:
Брежнев Андрей Юрьевич — к.м.н., доцент кафедры офтальмологии ФГБОУ ВО КГМУ Минздрава России; 305041, Россия, г. Курск, ул. К. Маркса, д. 3; ORCID iD 0000-0002-5597-983X.
Егоров Евгений Алексеевич — д.м.н., профессор, заведующий кафедрой офтальмологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-6495-7173.
Еричев Валерий Петрович — д.м.н., профессор, руководитель научного направления института ФГБНУ «НИИГБ им. М.М. Краснова»; 119021, Россия, г. Москва, ул. Россолимо, д. 11 А, Б; ORCID iD 0000-0001-6842-71643.
Куроедов Александр Владимирович — д.м.н., профессор кафедры офтальмологии РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; начальник офтальмологического центра ФКУ «ЦВКГ им. П.В. Мандрыка»; 107014, Россия, г. Москва, ул. Большая Оленья, д. 8а; ORCID iD 0000-0001-9606-0566.
Завадский Павел Чеславович — к.м.н., главный врач ООО «Офтальмологический центр Карелии»; 185035, Россия, г. Петрозаводск, наб. Варкауса, д. 1б; ORCID iD 0000-0002-6159-1620.
Maria Bozic — д.м.н., профессор, заведующая кафедрой офтальмологии Университетской глазной клиники, Университет Белграда; 11000, Сербия, г. Белград, ул. Пастерова, д. 2; ORCID iD 0000-0002-0367-5906.
Воронова Наталья Николаевна — ассистент кафедры офтальмологии Института «Медицинская академия им. С.И. Георгиевского» ФГАОУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0003-4851-3801.
Джумова Марина Федоровна — к.м.н., доцент кафедры глазных болезней Белорусского государственного медицинского университета; 220083, Беларусь, г. Минск, пр-т Дзержинского, д. 83; ORCID iD 0000-0003-2182-3113.
Иванова Нанули Викторовна — д.м.н., профессор, заведующая кафедрой офтальмологии Института «Медицинская академия им. С.И. Георгиевского» ФГАОУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0002-5092-8961.
Имшенецкая Татьяна Александровна — д.м.н., профессор, заведующая кафедрой офтальмологии БелМАПО; 220013, Беларусь, г. Минск, ул. П. Бровки, д. 3, к. 3; ORCID iD 0000-0002-9353-8664.
Каменских Татьяна Григорьевна — д.м.н., профессор, заведующая кафедрой глазных болезней ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России; 410012, Россия, г. Саратов, ул. Большая Казачья, д. 112; ORCID iD 0000-0001-8709-5599.
Лебедев Олег Иванович — д.м.н., профессор, заведующий кафедрой офтальмологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-8190-4121.
Марченко Людмила Николаевна — д.м.н., профессор, заведующая кафедрой глазных болезней Белорусского государственного медицинского университета; 220083, Беларусь, г. Минск, пр-т Дзержинского, д. 83; ORCID iD 0000-0002-1838-1572.
Онищенко Александр Леонидович — д.м.н., профессор, заведующий кафедрой офтальмологии НГИУВ — филиала ФГБОУ ДПО РМАНПО Минздрава России; 654005, Россия, г. Новокузнецк, пр-т Строителей, д. 5; ORCID iD 0000-0002-1549-5742.
Собянин Николай Александрович — к.м.н., заведующий офтальмологическим отделением ГБУЗ ГКБ № 2 им. Ф.Х. Граля; 614068, Россия, г. Пермь, ул. Пермская, д. 230; ORCID iD 0000-0003-1015-5201.
Экгардт Валерий Федорович — д.м.н., профессор, заведующий кафедрой глазных болезней ФГБОУ ВО ЮУГМУ Минздрава России; 454092, Россия, г. Челябинск, ул. Воровского, д. 64; ORCID iD 0000-0002-3372-8044.
Контактная информация: Брежнев Андрей Юрьевич, e-mail: drbrezhnev@hotmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.12.2022.
Поступила после рецензирования 16.01.2023.
Принята в печать 08.02.2023.
About the authors:
Andrey Yu. Brezhnev — C. Sc. (Med.), associate professor of the Department of Ophthalmology, Kursk State Medical University; 3, K. Marks str., Kursk, 305041, Russian Federation; ORCID iD 0000-0002-5597-983X.
Evgeniy A. Egorov — Dr. Sc. (Med.), Professor, Head of the department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-6495-7173.
Valery P. Erichev — Dr. Sc. (Med.), Professor, Head of the Research Field, Krasnov Research Institute of Eye Diseases; 11A, B, Rossolimo str., Moscow, 119021, Russian Federation; ORCID iD 0000-0001-6842-71643.
Aleksandr V. Kuroedov — Dr. Sc. (Med.), Professor of the Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; Head of the Ophthalmology Center, P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0000-0001-9606-0566.
Pavel Ch. Zavadsky — C. Sc. (Med.), Chief Physician, LLC "Ophthalmological Center of Karelia"; 16, Varkaus quay, Petrozavodsk, 185035, Russian Federation; ORCID iD 0000-0002-6159-1620.
Maria Bozic — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, University Eye Clinic, University of Belgrade; 2, Pasterov str., Belgrade, 11000, Serbia; ORCID iD 0000-0002-0367-5906.
Natalia N. Voronova — assistant of the Department of Ophthalmology of the S.I. Georgievsky Medical Academy, V.I. Vernadsky Crimean Federal University; 5/7, Lenin blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0003-4851-3801.
Marina F. Dzhumova — C. Sc. (Med.), associate professor of the Department of Eye Diseases, Belarusian State Medical University; 83, Dzerzhinsky av., Minsk, 220083, Belarus; ORCID iD 0000-0003-2182-3113.
Nanuli V. Ivanova — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, of the S.I. Georgievsky Medical Academy, V.I. Vernadsky Crimean Federal University; 5/7, Lenin blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0002-5092-8961.
Tatyana A. Imshenetskaya — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, Belarusian Medical Academy of Post-Diploma Education; 3 build. 3, P. Brovki str., Minsk, 220013, Belarus; ORCID iD 0000-0002-9353-8664.
Tatyana G. Kamenskikh — Dr. Sc. (Med.), Professor, Head of the Department of Eye Diseases, V.I. Razumovskiy Saratov State Medical University; 112, Bolshaya Kazach'ya str., Saratov, 410012, Russian Federation; ORCID iD 0000-0001-8709-5599.
Oleg I. Lebedev — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-8190-4121.
Ludmila N. Marchenko — Dr. Sc. (Med.), Professor, Head of the Department of Eye Diseases, Belarusian State Medical University; 83, Dzerzhinsky av., Minsk, 220083, Belarus; ORCID iD 0000-0002-1838-1572.
Aleksandr L. Onishchenko — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, Novokuznetsk State Institute for Advanced medical Education — Branch of Russian Medical Academy of Continuous Professional Education; 5, Stroiteley av., Novokuznetsk, 654005, Russian Federation; ORCID iD 0000-0002-1549-5742.
Nikolay A. Sobyanin — C. Sc. (Med.), head of the Ophthalmological Department, F.Kh. Gral City Clinical Hospital No. 2; 230, Permskaya str., Perm, 614068, Russian Federation; ORCID iD 0000-0003-1015-5201.
Valery F. Ekgardt — Dr. Sc. (Med.), Professor, Head of the Department of Eye Diseases, South Ural State Medical University; 64, Vorovsky str., Chelyabinsk, 454092, Russian Federation; ORCID iD 0000-0002-3372-8044.
Contact information: Andrey Yu. Brezhnev, e-mail: drbrezhnev@hotmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 15.12.2022.
Revised 16.01.2023.
Accepted 08.02.2023.
2. Авдеев Р.В., Александров А.С., Бакунина Н.А. и др. Сопоставление режимов лечения больных первичной открытоугольной глаукомой с характеристиками прогрессирования заболевания. Часть 1. Состояние показателей офтальмотонуса. Национальный журнал глаукома. 2018;17(1):14–29. DOI: 10.25700/NJG.2018.01.02. [Avdeev R.V., Alexandrov A.S., Bakunina N.A. et al. Comparison of treatment regimens for patients with primary open-angle glaucoma with signs of disease progression. Part 1. IOP levels. National Journal glaucoma. 2018;17(1):14–29 (in Russ.)]. DOI: 10.25700/NJG.2018.01.02.
3. Jonas J.B., Aung T., Bourne R.R. et al. Glaucoma. Lancet. 2017;390:2183–2193. DOI: 10.1016/S0140-6736(17)31469-1.
4. Sheybani A., Scott R., Samuelson T.W. et al. Open-angle glaucoma: burden of illness, current therapies, and the management of nocturnal IOP variation. Ophthalmol Ther. 2020;9:1–14. DOI: 10.1007/s40123-019-00222-z17.
5. Whitson J.T. Glaucoma: a review of adjunctive therapy and new management strategies. Expert Opin Pharmacother. 2007;8:3237–3249. DOI: 10.1517/14656566.8.18.3237.
6. Куроедов А.В., Мовсисян А.Б., Егоров Е.А. и др. Профиль пациентов с первичной открытоугольной глаукомой в Российской Федерации (предварительные результаты многоцентрового популяционного исследования). Часть 1. Национальный журнал глаукома. 2021;20(1):3–15. DOI: 10.25700/NJG.2021.01.01. [Kuroyedov A.V., Movsisyan A.B., Egorov E.A. et al. The profile of patients with primary open-angle glaucoma in the Russian Federation (preliminary results of a multicenter population-based study). Part 1. National Journal glaucoma. 2021;20(1):3–15 (in Russ.)]. DOI: 10.25700/NJG.2021.01.01.
7. Куроедов А.В., Мовсисян А.Б., Егоров Е.А. и др. Профиль пациентов с первичной открытоугольной глаукомой в Российской Федерации (предварительные результаты многоцентрового популяционного исследования). Часть 2. Национальный журнал глаукома. 2021;20(2):31–42. DOI: 10.25700/2078-4104-2021-20-2-31-42. [Kuroyedov A.V., Movsisyan A.B., Egorov E.A. et al. The profile of patients with primary open-angle glaucoma in the Russian Federation (preliminary results of a multicenter population-based study). Part 2. National Journal glaucoma. 2021;20(2):31–42 (in Russ.)]. DOI: 10.25700/2078-4104-2021-20-2-31-42.
8. Vaajanen A., Purola P., Ojamo M. et al. Changes in incidence and severity of visual impairment due to glaucoma during 40 years - a register-based study in Finland. Acta Ophthalmol. 2022;100(5):534–540. DOI: 10.1111/aos.15030.
9. Tham Y.C., Li X., Wong T.Y. et al. Global prevalence of glaucoma and projections of glaucoma burden through 2040. Ophthalmology. 2014;121(11):2081–2090. DOI: 10.1016/j.ophtha.2014.05.013.
10. Егоров Е.А., Петров С.Ю., Городничий В.В. и др. Тонометрическое внутриглазное давление у взрослого населения: популяционное исследование. Национальный журнал глаукома. 2020;19(2):39–50. DOI: 10.25700/NJG.2020.02.05. [Egorov E.A., Petrov S.Yu., Gorodnichy V.V. et al. Tonometric intraocular pressure in adult population: a population study. National Journal glaucoma. 2020;19(2):39–50 (in Russ.)]. DOI: 10.25700/NJG.2020.02.05.
11. Imperato J.S., Zou K.H., Li J.Z., Hassan T.A. Clinical Practice Management of Primary Open-Angle Glaucoma in the United States: An Analysis of Real-World Evidence. Patient Prefer Adherence. 2022;16:2213–2227. DOI: 10.2147/PPA.S367443.
12. Hogg H.D.J., Connor A. 10-year trends in English primary care glaucoma prescribing. Eye (Lond). 2020;34(1):192–196. DOI: 10.1038/s41433-019-0656-z.
13. Bro T., Wickström K., Lindén C. The future is old - Patients with topical ocular hypotensive treatment in the Nordic region between 2008 and 2017 with projections for 2040. Acta Ophthalmol. 2021;99(8):e1442–e1448. DOI: 10.1111/aos.14848.
14. Leahy K.E., White A.J.R. Selective laser trabeculoplasty: current perspectives. Clin Ophthalmol. 2015;9:833–841. DOI: 10.2147/OPTH.S53490.
15. Gazzard G., Konstantakopoulou E., Garway-Heath D. et al. Selective laser trabeculoplasty versus eye drops for first-line treatment of ocular hypertension and glaucoma (LiGHT): a multicentre randomised controlled trial. Lancet. 2019;393(10180):1505–1516. DOI: 10.1016/S0140-6736(18)32213-X.
16. Garg A., Vickerstaff V., Nathwani N. et al. Efficacy of repeat selective laser trabeculoplasty in medication-naïve open-angle glaucoma and ocular hypertension during the LiGHT trial. Ophthalmology. 2020;127:467–476. DOI: 10.1016/j.ophtha.2019.10.023.
17. Rachmiel R., Trope G.E., Chipman M.L. et al. Effect of medical therapy on glaucoma filtration surgery rates in Ontario. Arch Ophthalmol. 2006;124(10):1472–1477. DOI: 10.1001/archopht.124.10.1472.
18. Van der Valk R., Schouten J.S., Webers C.A. et al. The impact of a nationwide introduction of new drugs and a treatment protocol for glaucoma on the number of glaucoma surgeries. J Glaucoma. 2005;14(3):239–242. DOI: 10.1097/01.ijg.0000159121.11371.5f.
19. Walland M.J. Glaucoma treatment in Australia: changing patterns of therapy 1994-2003. Clin Exp Ophthalmol. 2004;32(6):590–596. DOI: 10.1111/j.1442-9071.2004.00908.x.
20. Murphy C., Ogston S., Cobb C., MacEwen C. Recent trends in glaucoma surgery in Scotland, England and Wales. Br J Ophthalmol. 2015;99(3):308–312. DOI: 10.1136/bjophthalmol-2013-304465.
21. Luebke J., Boehringer D., Anton A. et al. Trends in Surgical Glaucoma Treatment in Germany Between 2006 and 2018. Clin Epidemiol. 2021;13:581–592. DOI: 10.2147/CLEP.S310542.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
