Сравнительная оценка эффективности однократного и курсового применения аутологичной трансплантации мезенхимальных стволовых клеток в терапии рассеянного склероза
Рубрика:
Неврология
Цель исследования: провести сравнительную оценку эффективности однократной и курсовой аутологичной трансплантации мезенхимальных стволовых клеток (АуТМСК) у пациентов с рассеянным склерозом (РС), а также изучить отдаленные результаты лечения.
Материал и методы: в статье изложены результаты проспективного открытого лонгитюдного одноцентрового исследования, в котором 19 пациентам с РС проводилась однократная (n=12) либо повторная/курсовая (n=7) АуТМСК. В группу сравнения вошли 12 пациентов с РС, получавшие симптоматическую терапию. Для оценки эффективности АуТМСК использовались: шкала выраженности инвалидизации EDSS, МРТ головного мозга с введением парамагнетика, оптическая когерентная томография. Период мониторинга составил 2 года.
Результаты исследования: у пациентов с РС, которым проводилась АуТМСК (n=19), статистически значимого различия в выраженности инвалидизации за период наблюдения не отмечено (критерий Вилкоксона T=1,7, p=0,090). В группе больных, получавших симптоматическую терапию, отмечено нарастание неврологического дефицита (Т=2,67, p=0,008). У пациентов, перенесших АуТМСК, количество активных очагов демиелинизации было достоверно меньше (χ2=7,2, p=0,0073), чем у пациентов группы сравнения.
После повторной трансплантации наблюдали снижение инвалидизации (Т=2,02, p=0,04). Среди больных, прошедших однократную АуТМСК, значимых изменений показателей шкалы EDSS не отмечено (T=0,37, p=0,710). Толщина слоя нервных волокон сетчатки (СНВС) после курсовой АуТМСК статистически значимо нарастала (T=2,37, p=0,017). Оптимальный временной интервал для курсовых введений МСК с учетом продолжительности их антипролиферативного действия составил 9–12 мес. Полученные результаты указывают на клиническую эффективность АуТМСК и обоснованность повторных реинфузий МСК.
Выводы: АуТМСК у пациентов с РC позволяет достичь стабилизации либо положительной динамики неврологического статуса, нейровизуализационных данных, а также увеличения толщины СНВС в течение 2 лет после трансплантации. Курсовая АуТМСК является более эффективной, чем однократная. Повторная реинфузия МСК должна проводиться через 9–12 мес. после их первого введения.
Ключевые слова: рассеянный склероз, аутологичная трансплантация, мезенхимальные стволовые клетки.
Материал и методы: в статье изложены результаты проспективного открытого лонгитюдного одноцентрового исследования, в котором 19 пациентам с РС проводилась однократная (n=12) либо повторная/курсовая (n=7) АуТМСК. В группу сравнения вошли 12 пациентов с РС, получавшие симптоматическую терапию. Для оценки эффективности АуТМСК использовались: шкала выраженности инвалидизации EDSS, МРТ головного мозга с введением парамагнетика, оптическая когерентная томография. Период мониторинга составил 2 года.
Результаты исследования: у пациентов с РС, которым проводилась АуТМСК (n=19), статистически значимого различия в выраженности инвалидизации за период наблюдения не отмечено (критерий Вилкоксона T=1,7, p=0,090). В группе больных, получавших симптоматическую терапию, отмечено нарастание неврологического дефицита (Т=2,67, p=0,008). У пациентов, перенесших АуТМСК, количество активных очагов демиелинизации было достоверно меньше (χ2=7,2, p=0,0073), чем у пациентов группы сравнения.
После повторной трансплантации наблюдали снижение инвалидизации (Т=2,02, p=0,04). Среди больных, прошедших однократную АуТМСК, значимых изменений показателей шкалы EDSS не отмечено (T=0,37, p=0,710). Толщина слоя нервных волокон сетчатки (СНВС) после курсовой АуТМСК статистически значимо нарастала (T=2,37, p=0,017). Оптимальный временной интервал для курсовых введений МСК с учетом продолжительности их антипролиферативного действия составил 9–12 мес. Полученные результаты указывают на клиническую эффективность АуТМСК и обоснованность повторных реинфузий МСК.
Выводы: АуТМСК у пациентов с РC позволяет достичь стабилизации либо положительной динамики неврологического статуса, нейровизуализационных данных, а также увеличения толщины СНВС в течение 2 лет после трансплантации. Курсовая АуТМСК является более эффективной, чем однократная. Повторная реинфузия МСК должна проводиться через 9–12 мес. после их первого введения.
Ключевые слова: рассеянный склероз, аутологичная трансплантация, мезенхимальные стволовые клетки.
A.S. Fedulov1, A.V. Borisov1, M.M. Zafranskaya2, S.I. Krivenko3, L.N. Marchenko1, T.V. Kachan1, Yu.V. Moskovskikh1, D.B. Nizhegorodova2
1Belarusian State Medical University, Minsk
2Belarusian Medical Academy of Postgraduate Education, Minsk
3Minsk Scientific and Practical Center of Surgery, Transplantology and Hematology
Aim: to conduct a comparative effectiveness evaluation of a single and repeated autologous mesenchymal stem cells transplantation (AMSCT) and to study AMSCT long-term results in patients with multiple sclerosis (MS).
Patients and Methods: the article presents the results of the prospective, open, longitudinal, single-center study which included 19 patients underwent single (n=12) or repeated (course) AMSCT (n=7). The control group included 12 patients with MS receiving symptomatic therapy. To following tools were used for the AMSCT effectiveness evaluation: expanded disability status scale (EDSS), brain MRI with gadolinium enhancement, optical coherent tomography (OCT). The monitoring period was 2 years.
Results: statistically significant differences in EDSS weren’t observed (T=1.7, p=0.090) among patients with MS who underwent AMSCT. An increase in the neurological deficit was observed (Т=2.67, p=0.008) in the control group receiving symptomatic treatment. The number of active demyelination foci was significantly less in the group underwent AMSCT (χ2=7.2, p=0.0073), in comparison to the control group. After repeated transplantation, there was a decrease in disability (T=2.02, p=0.04). Single AMSCT doesn’t significantly change the EDSS indicators in patients (T=0.37, p=0.710). The retinal nerve fiber layer (RNFL) thickness statistically significantly increased after repeated AMSCT (T=2.37, p=0.017). The optimal time interval for repeated AMSCT is 9–12 month considering their antiproliferative ability. Obtained results indicated AMSCT clinical efficacy and MSC reinfusion relevancy.
Conclusion: AMSCT in patients with MS allows to achieve stabilization or positive dynamics in neurological status, decrease activity in MRI and increase the RNFL thickness within 2 years after transplantation. Repeated AMSCT is more effective than a single one. MSC reinfusion should be carried out in 9–12 months after their first injection.
Keywords: multiple sclerosis, autologous transplantation, mesenchymal stem cells.
For citation: Fedulov A.S., Borisov A.V., Zafranskaya M.M. et al. Comparative effectiveness evaluation of autologous mesenchymal stem cells transplantation in terms of a single and repeated application in the multiple sclerosis treatment. RMJ. Medical Review. 2019;4(II):54–58.
1Belarusian State Medical University, Minsk
2Belarusian Medical Academy of Postgraduate Education, Minsk
3Minsk Scientific and Practical Center of Surgery, Transplantology and Hematology
Aim: to conduct a comparative effectiveness evaluation of a single and repeated autologous mesenchymal stem cells transplantation (AMSCT) and to study AMSCT long-term results in patients with multiple sclerosis (MS).
Patients and Methods: the article presents the results of the prospective, open, longitudinal, single-center study which included 19 patients underwent single (n=12) or repeated (course) AMSCT (n=7). The control group included 12 patients with MS receiving symptomatic therapy. To following tools were used for the AMSCT effectiveness evaluation: expanded disability status scale (EDSS), brain MRI with gadolinium enhancement, optical coherent tomography (OCT). The monitoring period was 2 years.
Results: statistically significant differences in EDSS weren’t observed (T=1.7, p=0.090) among patients with MS who underwent AMSCT. An increase in the neurological deficit was observed (Т=2.67, p=0.008) in the control group receiving symptomatic treatment. The number of active demyelination foci was significantly less in the group underwent AMSCT (χ2=7.2, p=0.0073), in comparison to the control group. After repeated transplantation, there was a decrease in disability (T=2.02, p=0.04). Single AMSCT doesn’t significantly change the EDSS indicators in patients (T=0.37, p=0.710). The retinal nerve fiber layer (RNFL) thickness statistically significantly increased after repeated AMSCT (T=2.37, p=0.017). The optimal time interval for repeated AMSCT is 9–12 month considering their antiproliferative ability. Obtained results indicated AMSCT clinical efficacy and MSC reinfusion relevancy.
Conclusion: AMSCT in patients with MS allows to achieve stabilization or positive dynamics in neurological status, decrease activity in MRI and increase the RNFL thickness within 2 years after transplantation. Repeated AMSCT is more effective than a single one. MSC reinfusion should be carried out in 9–12 months after their first injection.
Keywords: multiple sclerosis, autologous transplantation, mesenchymal stem cells.
For citation: Fedulov A.S., Borisov A.V., Zafranskaya M.M. et al. Comparative effectiveness evaluation of autologous mesenchymal stem cells transplantation in terms of a single and repeated application in the multiple sclerosis treatment. RMJ. Medical Review. 2019;4(II):54–58.
В статье представлены результаты исследования, посвященного сравнительной оценке эффективности однократной и курсовой аутологичной трансплантации мезенхимальных стволовых клеток у пациентов с рассеянным склерозом, а также изучению отдаленных результатов лечения.
Введение
Рассеянный склероз (РС) представляет собой мультифакторное аутоиммунное хроническое заболевание центральной нервной системы (ЦНС), проявляющееся многоочаговой неврологической симптоматикой и имеющее в типичных случаях на ранних стадиях ремиттирующий характер течения [1]. РС занимает 5-е место среди неврологических заболеваний и наиболее часто встречается у лиц молодого, трудоспособного возраста [2]. В специальной литературе в настоящее время накопилось определенное количество публикаций, в которых исследуется эффективность аутологичной трансплантации мезенхимальных стволовых клеток (АуТМСК) при данном заболевании [3–5]. Терапевтический потенциал мезенхимальных стволовых клеток (МСК) при РС заключается в эффектах иммуномодуляции и нейропротекции [6–10].Однако остается невыясненным ряд вопросов, касающихся применения АуТМСК. В связи с тем что время жизни МСК в организме ограничено несколькими неделями, актуально изучение отдаленных результатов их использования при РС, эффективности повторных (курсовых) реинфузий МСК и временных интервалов, через которые они должны проводиться.
Цель исследования — провести сравнительную оценку эффективности и изучить отдаленные результаты однократной и курсовой АуТМСК у пациентов с РС.
Материал и методы
Дизайн: проспективное открытое одноцентровое лонгитюдное исследование.Критерии включения: верифицированный на основании критериев McDonald et al. в редакции 2010 г. диагноз
РС [11]; рецидивирующе-ремиттирующая клиническая форма заболевания; возраст 18–45 лет; продолжительность заболевания от 1 года до 10 лет; нарастание выраженности инвалидизации за последний год >1 балла по расширенной шкале оценки степени инвалидизации EDSS (Expanded Disability Status Scale).
Однократную либо повторную АуТМСК проводили 19 пациентам с рецидивирующе-ремиттирующим РС (РРРС). Период от забора МСК до трансплантации составлял 22,8+3,3 (M+σ) дня. Количество клеточных пассажей — от 2 до 3. Подготовленные и паспортизированные в соответствии с локальным нормативным регламентом ГУ «Минский научно-практический центр хирургии, трансплантологии и гематологии» аутологичные МСК вводили внутривенно в дозе 1,0×106/кг массы тела. Повторную трансплантацию осуществляли через 9 мес. после первой. В группу сравнения рекрутировано 13 больных РС, которым проводили симптоматическую терапию, а при экзацербациях использовали глюкокортикостероиды. Эффективность однократной и повторной АуТМСК оценивали через 9 мес. соответственно после выполнения процедуры. Период наблюдения пациентов при оценке отдаленных результатов АуТМСК составил 2 года. Клинико-демографическая характеристика больных представлена в таблице 1.
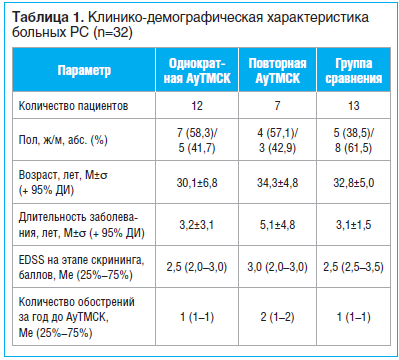
Для определения выраженности инвалидизации больных РС использовали шкалу EDSS с оценкой неврологического статуса по функциональным системам.
Нейровизуализационное исследование пациентов осуществляли с помощью аппарата Philips Intera 1.0Т (Голландия) в стандартизованных последовательностях МРТ (T1-взвешенное изображение с внутривенным усилением, T2-взвешенное изображение в режиме FLAIR — Fluid attenuation inversion recovery). Для внутривенного усиления вводили парамагнетик гадодиамид в дозе 20–40 мл (в зависимости от массы тела).
Для проведения оптической когерентной томографии (ОКТ) заднего отрезка глазного яблока использовался оптический когерентный томограф Stratus OCT, модель 3000, фирмы Carl Zeis Meditec c источником света — суперлюминесцентным диодом и длиной волны 820 nm. При этом оценивали следующие показатели: толщину слоя нервных волокон сетчатки (СНВС), полный макулярный объем, площадь диска зрительного нерва, объем и площадь нейроретинального ободка, объем и площадь экскавации.
Статистическую обработку данных выполняли с использованием стандартного пакета программы Statistica 10.0 (StatSoftInc., США). Определение достоверных различий между сравниваемыми группами осуществляли непараметрическими методами: U-критерий Манна — Уитни (две независимые группы); T-критерий Вилкоксона (одна группа до и после лечения); критерий соответствия хи-квадрат (χ2). Во всех случаях различия считались значимыми при вероятности ошибки р<0,05.
Результаты исследования
Результаты однократной и повторной АуТМСК у больных РС
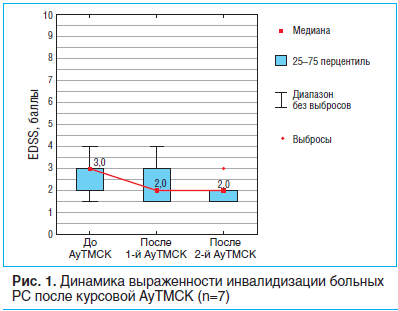
На этапе скрининга выраженность инвалидизации у групп пациентов с однократной и повторной АуТМСК существенно не отличалась (U= -0,75, p=0,450). При оценке неврологического статуса у пациентов с РС, которым проводили АуТМСК (n=19), через 9 мес. после трансплантации установлено, что статистически значимого различия в отношении данного показателя за указанный период наблюдения также не определялось (T=1,7, p=0,090).Спустя 9 мес. после реинфузии МСК выраженность инвалидизации по шкале EDSS в группе пациентов, проходивших однократную АуТМСК (n=12), существенно не изменилась (T=0,37, p=0,710). Среди больных РC, которым проводили повторную АуТМСК (n=7), выраженность инвалидизации по шкале EDSS после первой реинфузии аутологичных МСК также достоверно не отличалась от таковой на этапе скрининга (р=0,11). Вместе с тем повторное введение МСК привело к статистически значимому снижению данного показателя в этой группе (Т=2,02, p=0,04) (рис. 1).
Оценка выраженности инвалидизации по шкале EDSS на этапе скрининга не выявила достоверных различий между пациентами, которым была выполнена АуТМСК, и пациентами группы сравнения (U= -1,004, p=0,310). Анализ неврологического статуса пациентов, получавших симптоматическое лечение, за период мониторинга установил нарастание количества баллов по шкале EDSS (T=2,5, p=0,010).
Спустя 9 мес. после трансплантации больные, прошедшие АуТМСК, имели менее выраженный неврологический дефицит, чем пациенты, которым трансплантация не выполнялась (U= -3,36, p=0,0008). Причем различие в выраженности инвалидизации было статистически значимо как между группой сравнения и пациентами, которым выполняли однократную АуТМСК (U= -2,73, p=0,006), так и между группой сравнения и пациентами после повторной трансплантации (U= -2,85, p=0,004).
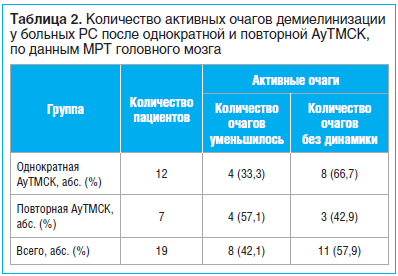
Количество активных очагов демиелинизации на этапе скрининга у пациентов основной группы и группы сравнения было сопоставимым и составляло 0–2 очага, накапливающих парамагнетик. После АуТМСК статистически значимых различий по данному параметру между группами пациентов, которым проводилась однократная и повторная трансплантация, не определялось (p=0,376). В то же время снижение числа активных очагов чаще отмечалось после курсовой реинфузии МСК по сравнению с однократной: соответственно 57,1 и 33,3% (табл. 2).
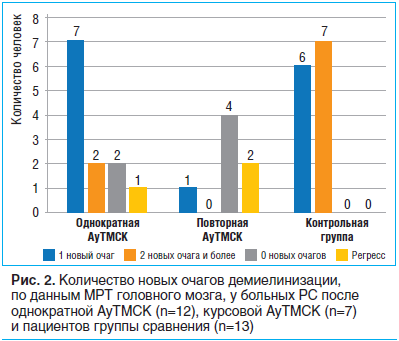
После однократной трансплантации аутологичных МСК у большинства пациентов с РС новые очаги демиелинизации не визуализировались либо отмечалось не более 1 такого очага — 83,3%. Среди больных РС, которым выполнялась повторная трансплантация, в 71,4% случаев имелось не более 1 нового очага, в 28,6% — регресс 1 или нескольких таких очагов. В то же время в группе сравнения после 9 мес. наблюдения у 53,8% пациентов появилось более 2 новых очагов демиелинизации (рис. 2).
Среди параметров ОКТ наиболее значимым оказалась толщина СНВС. У пациентов с РС, прошедших АуТМСК, установлено статистически значимое увеличение толщины СНВС (T=2,85, p=0,004). Сравнение динамики данного показателя у пациентов с однократной и повторной трансплантацией выявило, что более значительное его нарастание наблюдалось в группе с курсовой АуТМСК (рис. 3). Достоверное увеличение толщины СНВС было установлено в группе с повторной трансплантацией (T=2,37, p=0,017), в то время как у больных РС с однократной АуТМСК этот показатель существенно не изменился по сравнению с предтрансплантационным уровнем (T=1,21, p=0,230).
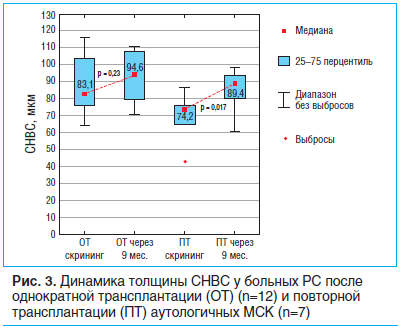
Отдаленные последствия АуТМСК у больных РС
Среднее значение EDSS на этапе скрининга в группе больных после однократной трансплантации составляло 2,5 (2,0–3,0) балла, после повторной реинфузии МСК — 3,0 (2,0–3,0), в группе сравнения — 2,5 (2,5–3,5) балла. За 2-летний период наблюдения среди пациентов, проходивших АуТМСК, среднее значение EDSS увеличилось на 0,25 балла. В то же время статистически значимого нарастания неврологического дефицита за указанный период времени в этой группе не выявлено (Т=1,47, p=0,14). У пациентов, получавших симптоматическое лечение, отмечалось более значительное, чем в исследуемых группах, нарастание среднего значения EDSS на 1 балл, выраженность инвалидизации по EDSS достоверно увеличилась (Т=2,67, p=0,008) до 3,75 (3,5–4,5) балла (рис. 4).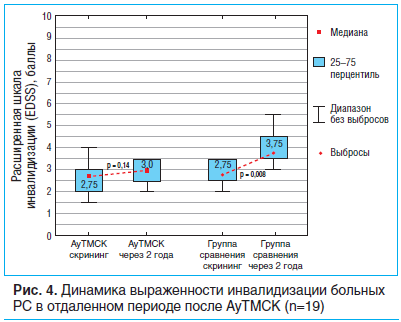
В группе сравнения относительный риск нарастания выраженности инвалидизации более чем на 0,5 балла по шкале EDSS в 1,83 раза (95% ДИ 0,92–3,82) превосходил таковой у пациентов после АуТМСК. Абсолютное снижение риска ухудшения неврологического статуса в условиях применения АуТМСК составило 41,7% (95% ДИ 4,8–78,6%).
В результате нейровизуализации были получены следующие данные. В группе пациентов с РС, которым выполнялась АуТМСК, количество активных очагов демиелинизации было достоверно меньше (χ2=7,2, p=0,0073), чем в группе сравнения. Относительный риск возникновения активных очагов после проведения АуТМСК по сравнению с таковым при лечении по традиционным протоколам равен 0,25 (95% ДИ 0,064–0,974). Относительный шанс возникновения активных очагов после АуТМСК составил 0,63 (95% ДИ 0,006–0,644) от шансов появления таких очагов при применении симптоматической терапии. Абсолютное увеличение пользы (АУП) у пациентов исследуемой группы — 60,0% (95% ДИ 22,7–97,3%) по сравнению с больными группы сравнения. Число пациентов, которых необходимо подвергнуть лечению с использованием АуТМСК для предотвращения одного дополнительного случая возникновения активных очагов демиелинизации, составляет
2 (95% ДИ 1–4).
Технология трансплантации аутологичных МСК характеризовалась хорошей переносимостью и безопасностью. Введение трансплантата МСК не сопровождалось побочными реакциями. Осложнений в раннем и позднем посттрансплантационных периодах, а также в отдаленном периоде после АуТМСК за время наблюдения не отмечено.
Таким образом, в группе пациентов, проходивших однократную или повторную АуТМСК, имела место стабилизация либо положительная динамика неврологического статуса, в отличие от группы сравнения, где наблюдалось увеличение инвалидизации (p<0,05). У пациентов, которым осуществляли реинфузию аутологичных МСК, отмечалось снижение количества активных и новых очагов демиелинизации, а также увеличение толщины СНВС. В группе больных, получавших симптоматическое лечение, напротив, имели место увеличение числа таких очагов и снижение толщины СНВС (p<0,05).
Сопоставление результатов однократной и повторной АуТМСК выявило более высокую эффективность курсовой реинфузии МСК. Это выразилось в снижении уровня инвалидизации у пациентов с РС после повторной трансплантации (Т=2,02, p=0,04), в то время как у больных, прошедших однократную АуТМСК, значимых изменений шкалы EDSS не отмечено (T=0,37, p=0,710). У пациентов, которым проводилась повторная реинфузия аутологичных МСК, имело место более значительное снижение количества очагов, накапливающих парамагнетик (гадодиамид), чем у пациентов с однократной АуТМСК: соответственно 57,1 и 33,3%. Кроме того, повторная реинфузия аутологичных МСК уменьшала частоту появления новых очагов демиелинизации. Толщина СНВС после курсовой АуТМСК статистически значимо нарастала (T=2,37, p=0,017), вместе с тем в группе пациентов, которым она проводилась однократно, наблюдалась стабилизация данного параметра (T=1,21, p=0,230). Вышеуказанные результаты, а также тот факт, что антипролиферативное действие МСК (т. е. их способность снижать уровень пролиферации активированных Т-лимфоцитов на специфические антигены, согласно данным иммунологических исследований) в полной мере развивается к 9–12-му мес. после их введения [12], позволяют рассматривать этот временной интервал как оптимальный для осуществления повторных реинфузий.
Отдаленные последствия АуТМСК указывают на достаточно длительный эффект реинфузии аутологичных МСК. Это проявляется в отсутствии статистически значимого нарастания выраженности инвалидизации за 2-летний период мониторинга (Т=1,47, p=0,14). Кроме того, оценка ряда параметров доказательной медицины также свидетельствует о продолжительном эффекте АуТМСК. Так, абсолютное снижение риска ухудшения неврологического статуса при применении АуТМСК за указанный период наблюдения составило 41,7% (95% ДИ 4,8–78,6%), относительный риск возникновения активных очагов после проведения трансплантации по сравнению с таковым после симптоматической терапии оказался равен 0,250 (95% ДИ 0,064–0,974); АУП у пациентов, прошедших реинфузию МСК, относительно группы сравнения составило 60,0% (95% ДИ 22,7–97,3%).
М.М. Одинак и соавт. вводили аутологичные МСК 8 пациентам с РС путем внутривенной инфузии в дозе 2,0×106/кг массы тела повторно с интервалом 30 дней на протяжении 4–8 мес. Через 12 мес. после АуТМСК у 6 (75,0%) из 8 больных отмечалось снижение выраженности инвалидизации по EDSS (на 0,5–1,0 балла) c полным отсутствием признаков прогрессирования заболевания [13]. Таким образом, результаты данного исследования также свидетельствуют о стабилизации либо снижении неврологического дефицита при применении повторной АуТМСК.
В исследовании А. Uccelli et al. АуТМСК была выполнена 15 пациентам с РС, а также 19 пациентам с боковым амиотрофическим склерозом [14]. МСК в количестве 2,5×106/кг массы тела были трансплантированы интратекально (n=34) и внутривенно (n=14). Причем в 9 случаях они маркировались суперпарамагнетиком (оксидом железа). Максимальный посттрансплантационный период составил 25 мес.
Среднее значение выраженности неврологического дефицита по шкале EDSS после АуТМСК снизилось с 6,7 до 5,9 балла. Признаков клинической или нейрорадиологической активности заболевания не обнаружено. МРТ головного и спинного мозга с использованием парамагнетика выявила наличие МСК в головном мозге (преимущественно в перивентрикулярных отделах), нервных корешках и спинном мозге.
Таким образом, исследование продемонстрировало эффективность АуТМСК у пациентов с РС, а также доказало способность МСК мигрировать в ЦНС. Вместе с тем интратекальное введение МСК не показало своих преимуществ в клинической эффективности по сравнению с внутривенной реинфузией. Кроме того, из пациентов, которые получали МСК интратекально, у 21 отмечались побочные явления в виде преходящей лихорадки, у 15 пациентов — головная боль, в то время как внутривенное введение МСК не приводило к подобного рода побочным эффектам.
В открытом сравнительном исследовании, в котором 24 пациентам с РС (10 — с РРРС, 14 — с вторично-прогредиентным РС) проводили реинфузию аутологичных МСК в средней дозе 1,9×106/кг с последующим наблюдением в течение 2 лет, были получены следующие результаты [15]. После трансплантации не отмечено активных либо новых очагов демиелинизации, по данным МРТ. За время наблюдения у 18 (75%) пациентов не было рецидивов, 3 (12,5%) пациента имели 1 обострение, а 3 (12,5%) пациента — 2 рецидива. За исключением одного случая экзацербация отмечалась только у пациентов с РРРС.
Следовательно, результаты этого исследования согласуются с нашими данными в отношении подавления активности процесса демиелинизации после реинфузии МСК в течение длительного периода наблюдения (2 года). В то же время неожиданным и требующим дополнительного анализа является лучший результат АуТМСК при вторично-прогредиентном РС по сравнению с таковым при РРРС.
Таким образом, результаты исследования свидетельствуют о том, что АуТМСК представляет собой безопасный и эффективный метод лечения РС. Продолжительность терапевтического действия МСК достигала 2 лет. Полученные результаты указывают на клиническую эффективность АуТМСК и целесообразность использования курсового введения аутологичных МСК пациентам с РС.
Выводы
АуТМСК у пациентов с РС позволяет достичь стабилизации либо положительной динамики неврологического статуса, нейровизуализационных данных, а также увеличения толщины СНВС в течение 2 лет после трансплантации.Курсовая трансплантация аутологичных МСК является более эффективной, чем однократная. Повторная реинфузия МСК должна проводиться через 9–12 мес. после их первого введения.
Внутривенный способ введения МСК позволяет достичь системного эффекта от введения МСК и при этом избегнуть побочных действий.
Для проведения клеточной терапии РС аутологичные МСК должны использоваться в дозе 1×106/кг веса и более.
Литература
1. Muraro P.A., Martin R., Mancardi G.L. et al. Autologous haematopoietic stem cell transplantation for treatment of multiple sclerosis. Nature Reviews Neurology. 2017;13:391–405.
2. Figueroa F.E., Carrian F., Villanueva S., Khoury M. Mesenchymal stem cell treatment for autoimmune diseases: a critical review. Biol. Res. 2012;45(3):269–277.
3. Cohen J.A. Mesenchymal stem cell transplantation in multiple sclerosis. J Neurol Sci. 2013;333(1–2):43–49.
4. Darlington P.J., Boivin M.N., Bar-Or A. Harnessing the therapeutic potential of mesenchymal stem cells in multiple sclerosis. Expert Rev. Neurother. 2011;11(9):1295–1303.
5. Payne N., Sun G., McDonald C. et al. Distinct immunomodulatory and migratory mechanisms underpin the therapeutic potential of human mesenchymal stem cells in autoimmune demyelination. Cell. Transplant. 2013;22(8):1409–1425.
6. Федулов А.С., Борисов А.В., Московских Ю.В. и др. Аутологичная трансплантация мезенхимальных стволовых клеток как метод модификации клинического течения рассеянного склероза. Неврология и нейрохирургия. Восточная Европа. 2016;4:516–522. [Fedulov A.S., Borisov A.V., Moskovskikh Yu.V. et al. Autologous transplantation of mesenchymal stem cells as a method of modifying the clinical course of multiple sclerosis. Neurology and neurosurgery. Eastern Europe. 2016;4:516–522 (in Russ.)].
7. Федулов А.С., Борисов А.В., Зафранская М.М. и др. Применение аутологичной трансплантации мезенхимальных стволовых клеток при рецидивирующе-ремиттирующей форме рассеянного склероза. Неврология и нейрохирургия. Восточная Европа. 2017;2:297–307. [Fedulov A.S., Borisov A.V., Zafranskaya M.M. et al. The use of autologous transplantation of mesenchymal stem cells in the relapsing-remitting form of multiple sclerosis. Neurology and neurosurgery. Eastern Europe. 2017;2:297–307 (in Russ.)].
8. Cipriani P., Carubbi F., Liakouli V. et al. Stem cells in autoimmune diseases: Implications for pathogenesis and future trends in therapy. Autoimmun. Rev. 2013;12(7):709–716.
9. Ren G., Chen X., Dong F. et al. Concise review: mesenchymal stem cells and translational medicine: emerging issues. Stem Cells Transl. Med. 2012;1(1):51–58.
10. Freedman M.S., Uccelli A. Neurorepair with mesenchymal stem cells: hope or hype? Lancet Neurol. 2012;11(2):123–125.
11. Polman C.H., Reingold S.C., Banwell B. et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Mult Scler. 2013;19(5):515–519.
12. Зафранская М.М. Мезенхимальные стволовые клетки: иммуномодулирующие свойства и обоснование их применения для клеточной иммунотерапии рассеянного склероза: дис. … д-ра мед. наук: Минск, 2016. [Zafranskaya M.M. Mesenchymal stem cells: immunomodulating properties and the rationale for their use for cellular immunotherapy for multiple sclerosis: thesis. Minsk. 2016 (in Russ.)].
13. Одинак М.М., Бисага Г.Н., Тыренко В.В. и др. Трансплантация мезенхимальных стволовых клеток при рассеянном склерозе. Журнал неврологии и психиатрии им. С.С. Корсакова. Рассеянный склероз. 2011;2:72–76. [Odinak M.M., Bisaga G.N., Tyrenko V.V. et al. Transplantation of mesenchymal stem cells in multiple sclerosis. J Neurol and Psych after SS. Korsakov. Multiple sclerosis. 2011;2:72–76 (in Russ.)].
14. Uccelli A., Laroni A., Freedman M.S. Mesenchymal stem cells as treatment for MS — progress to date. Mult. Scler. 2013;19(5):515–519.
15. Cohen J., Imrey P., Planchon S. et al. Pilot trial of intravenous autologous culture-expanded mesenchymal stem cell transplantation in multiple sclerosis. Mult. Scler. 2017;24(4):501–511.
2. Figueroa F.E., Carrian F., Villanueva S., Khoury M. Mesenchymal stem cell treatment for autoimmune diseases: a critical review. Biol. Res. 2012;45(3):269–277.
3. Cohen J.A. Mesenchymal stem cell transplantation in multiple sclerosis. J Neurol Sci. 2013;333(1–2):43–49.
4. Darlington P.J., Boivin M.N., Bar-Or A. Harnessing the therapeutic potential of mesenchymal stem cells in multiple sclerosis. Expert Rev. Neurother. 2011;11(9):1295–1303.
5. Payne N., Sun G., McDonald C. et al. Distinct immunomodulatory and migratory mechanisms underpin the therapeutic potential of human mesenchymal stem cells in autoimmune demyelination. Cell. Transplant. 2013;22(8):1409–1425.
6. Федулов А.С., Борисов А.В., Московских Ю.В. и др. Аутологичная трансплантация мезенхимальных стволовых клеток как метод модификации клинического течения рассеянного склероза. Неврология и нейрохирургия. Восточная Европа. 2016;4:516–522. [Fedulov A.S., Borisov A.V., Moskovskikh Yu.V. et al. Autologous transplantation of mesenchymal stem cells as a method of modifying the clinical course of multiple sclerosis. Neurology and neurosurgery. Eastern Europe. 2016;4:516–522 (in Russ.)].
7. Федулов А.С., Борисов А.В., Зафранская М.М. и др. Применение аутологичной трансплантации мезенхимальных стволовых клеток при рецидивирующе-ремиттирующей форме рассеянного склероза. Неврология и нейрохирургия. Восточная Европа. 2017;2:297–307. [Fedulov A.S., Borisov A.V., Zafranskaya M.M. et al. The use of autologous transplantation of mesenchymal stem cells in the relapsing-remitting form of multiple sclerosis. Neurology and neurosurgery. Eastern Europe. 2017;2:297–307 (in Russ.)].
8. Cipriani P., Carubbi F., Liakouli V. et al. Stem cells in autoimmune diseases: Implications for pathogenesis and future trends in therapy. Autoimmun. Rev. 2013;12(7):709–716.
9. Ren G., Chen X., Dong F. et al. Concise review: mesenchymal stem cells and translational medicine: emerging issues. Stem Cells Transl. Med. 2012;1(1):51–58.
10. Freedman M.S., Uccelli A. Neurorepair with mesenchymal stem cells: hope or hype? Lancet Neurol. 2012;11(2):123–125.
11. Polman C.H., Reingold S.C., Banwell B. et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Mult Scler. 2013;19(5):515–519.
12. Зафранская М.М. Мезенхимальные стволовые клетки: иммуномодулирующие свойства и обоснование их применения для клеточной иммунотерапии рассеянного склероза: дис. … д-ра мед. наук: Минск, 2016. [Zafranskaya M.M. Mesenchymal stem cells: immunomodulating properties and the rationale for their use for cellular immunotherapy for multiple sclerosis: thesis. Minsk. 2016 (in Russ.)].
13. Одинак М.М., Бисага Г.Н., Тыренко В.В. и др. Трансплантация мезенхимальных стволовых клеток при рассеянном склерозе. Журнал неврологии и психиатрии им. С.С. Корсакова. Рассеянный склероз. 2011;2:72–76. [Odinak M.M., Bisaga G.N., Tyrenko V.V. et al. Transplantation of mesenchymal stem cells in multiple sclerosis. J Neurol and Psych after SS. Korsakov. Multiple sclerosis. 2011;2:72–76 (in Russ.)].
14. Uccelli A., Laroni A., Freedman M.S. Mesenchymal stem cells as treatment for MS — progress to date. Mult. Scler. 2013;19(5):515–519.
15. Cohen J., Imrey P., Planchon S. et al. Pilot trial of intravenous autologous culture-expanded mesenchymal stem cell transplantation in multiple sclerosis. Mult. Scler. 2017;24(4):501–511.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
