Когнитивные нарушения у больных, перенесших COVID-19
В настоящее время врачи всех специальностей как в России, так и во всем мире имеют дело не только с новой коронавирусной инфекцией, но и с последствиями COVID-19 — так называемым постковидным синдромом (ПКС). Проявления ПКС разнообразны, характеризуются симптоматикой со стороны различных систем организма, но особо важными являются неврологические расстройства: когнитивные нарушения, астенические, вегетативные и тревожные расстрой ства, приводящие к снижению показателей качества жизни пациентов и замедлению темпов выздоровления. Наиболее выраженные неврологические нарушения отмечаются у пациентов старше 50 лет, имеющих исходно сопутствующую сердечно-сосудистую патологию. Широкая распространенность ПКС, его значительное воздействие на повседневную жизнь пациентов требуют поиска адекватных терапевтических подходов. Несомненный интерес представляет применение пептидных препаратов, обладающих нейропротективным и нейрорепаративным эффектами. Приводятся собственные результаты первого опыта применения отечественного препарата Целлекс (полипептиды из головного мозга свиней) для лечения пациентов с болезнью малых артерий и ПКС с когнитивными нарушениями. Отмечен положительный эффект терапии в виде уменьшения выраженности когнитивных нарушений, тяжести тревожного и астенического синдромов, а также хорошая переносимость и отсутствие существенных побочных эффектов.
Ключевые слова: COVID-19, постковидный синдром, когнитивные нарушения, астенический синдром, болезнь мелких артерий, хроническая ишемия головного мозга, лечение.
Для цитирования: Камчатнов П.Р., Черемин Р.А., Скипетрова Л.А., Абусуева Б.А., Пышкина Л.И., Ханмурзаева С.А. Когнитивные нарушения у больных, перенесших COVID-19. РМЖ. Медицинское обозрение. 2022;30(4):33-37.
Cognitive disorders in patients after COVID-19
P.R. Kamchatnov1, R.A. Cheremin2, L.A. Skipetrova2, B.A. Abusueva3, L.I. Pyshkina1, S.A. Khanmurzayeva3
1Pirogov Russian National Research Medical University, Moscow
2Center for Speech Disorders and Neurorehabilitation, Moscow
3Dagestan State Medical University, Makhachkala
Nowadays, doctors of all specialties in Russia and worldwide are dealing not only with a new coronavirus infection but also with the COVID-19 comorbidities, the so-called post-covid syndrome (PCS). PCS manifestations are diverse and characterized by symptoms from various body systems, and neurological disorders are particularly important: cognitive disorders, asthenic, vegetative, and anxiety disorders, leading to a decrease in the patients’ life quality and a slowdown in the recovery rate. The most significant neurological disorders are observed in patients over 50 years with initially concomitant cardiovascular pathology. The wide prevalence of PCS, its significant impact on the patients’ life requires the search for adequate therapeutic methods. Of undoubted interest is the use of peptide preparations with neuroprotective and neuropreparative effects. The authors present their data f rom the first experience of using the domestic drug, Cellex (pig brain polypeptides), to treat patients with small vessel disease and PCS with cognitive disorder. Therapy positive effect was noted as a decrease in the severity of cognitive disorder, anxiety and asthenic syndromes. Adding that, there was a good tolerability and the absence of severe side effects.
Keywords: COVID-19, post-covid syndrome, cognitive impairment, asthenic syndrome, small vessel disease, chronic cerebral ischemia, treatment.
For citation: Kamchatnov P.R., Cheremin R.A., Skipetrova L.A. et al. Cognitive disorders in patients after COVID-19. RMJ. 2022;4:33–37.
Введение
Широкое распространение COVID–19, высокая частота нарушения здоровья после острого периода заболевания требуют изучения состояния пациентов после перенесенной инфекции, вызванной вирусом SARS-CoV-2. Понятие постковидного синдрома (ПКС) было введено для характеристики симптомокомплекса, развивающегося во время или непосредственно после COVID-19 и продолжающегося на протяжении более 12 нед., которое не может быть удовлетворительным образом объяснено иными альтернативными диагнозами [1]. В последующем с целью разграничения длительно протекающего COVID-19 и ПКС был предложен термин "PASC" (англ. post-acute sequelae of SARS-CoV-2 infection — постострые последствия COVID-19) [2]. В 2021 г. для определения данного состояния Всемирная организация здравоохранения предложила следующее определение: «Состояние после COVID-19 развивается у лиц с анамнезом вероятной или подтвержденной инфекции, вызванной вирусом SARS-CoV-2, как правило, в течение 3 мес. от момента дебюта COVID-19 и характеризуется наличием симптомов на протяжении не менее 2 мес., а также невозможностью их объяснения альтернативным диагнозом. К числу распространенных симптомов относятся утомляемость, одышка, когнитивная дисфункция, а также ряд других проявлений, которые, как правило, приводят к нарушениям и ограничениям повседневной деятельности. Может отмечаться появление симптомов вслед за периодом выздоровления после острой инфекции COVID-19 либо персистенция симптомов с момента первоначально перенесенной болезни. Кроме того, может иметь место периодическое возникновение или рецидивирование симптомов с течением времени» [3].
Проявления ПКС разнообразны, характеризуются симптоматикой со стороны различных систем организма, но особо важными являются неврологические (нейропсихические) расстройства: когнитивные нарушения, астенические, вегетативные, и тревожные расстройства, приводящие к снижению показателей качества жизни пациентов и замедлению темпов выздоровления [4]. Различные проявления ПКС имеют место у большинства больных, перенесших COVID-19: у трети пациентов наблюдается повышенная утомляемость, у пятой части — когнитивные нарушения [5]. Указанные расстройства могут наблюдаться у пациентов с различной тяжестью течения основного заболевания.
В результате исследования [6] установлена связь темпа и полноты регресса нейропсихических проявлений в течение 6 мес. от начала COVID-19, с одной стороны, и исходной тяжести COVID-19 — с другой. Также отмечено, что 70–90% пациентов, получавших амбулаторное лечение по поводу COVID-19 (тяжесть состояния не требовала госпитализации), через 3 мес. практически полностью избавляются от основных симптомов заболевания [7]. Стойкая симптоматика на протяжении 6 мес. и более от начала лечения в стационаре существенно выше у пожилых больных, госпитализированных по поводу внебольничной пневмонии, а также при пребывании в стационаре более 3 нед.
После завершения острой фазы COVID-19 последующее течение заболевания и динамика его клинических проявлений различаются. Изменения психического и физического компонентов здоровья тесно связаны друг с другом, тогда как когнитивные нарушения в значительной степени независимы от иных проявлений ПКС. Можно предположить различие механизмов формирования проявлений ПКС, что обеспечит стратификацию пациентов и проведение персонифицированных реабилитационных мероприятий.
Механизмы формирования ПКС
Результаты экспериментальных и клинических исследований [8–11] позволили уточнить многие механизмы формирования ПКС. Так, при проведении позитронно-эмиссионной томографии (ПЭТ) головного мозга с 18F-фосфодездоксиглюкозой (18FФДГ) больным, у которых при проведении магнитно-резонансной томографии (МРТ) головного мозга (в том числе с контрастным усилением) отсутствовали признаки структурных изменений, были обнаружены зоны гипометаболизма в коре (поясная извилина) [8]. Нейропсихологическое обследование позволило выявить у этих пациентов снижение памяти и способности к запоминанию, а также некоторые другие нейрокогнитивные нарушения. В последующем у больных с ПКС при проведении ПЭТ с 18FФДГ обнаружено двустороннее снижение метаболизма в области орбитальной коры (обонятельная извилина), височной доле (миндалевидное тело и гиппокамп), продолговатом мозге и мозжечке с обеих сторон при отсутствии структурных поражений мозгового вещества. Функциональные изменения сопровождались соответствующими когнитивными нарушениями [9].
Предпринимались попытки поиска свидетельств непосредственного воздействия вируса SARS-CoV-2 на вещество головного мозга. Результаты такого рода исследований [10, 11], в которые были включены пациенты с различной тяжестью заболевания, не позволили установить наличие вируса в ткани мозга или цереброспинальной жидкости (ЦСЖ) и косвенных признаков вирусной инфекции. Выявленное повышение уровня нейроспецифических белков в ЦСЖ пациентов с COVID-19 может свидетельствовать о повреждении клеток головного мозга, хотя и не позволяет судить о характере патологического процесса. Вместе с тем полученные данные могут свидетельствовать о том, что перенесенный COVID-19 способен инициировать механизмы отсроченного повреждения мозгового вещества, в том числе нейродегенеративного характера.
Применение препарата Целлекс
Не вызывает сомнения тот факт, что наиболее тяжелое течение COVID-19 имеет место у больных с сопутствующими заболеваниями, наличием факторов сердечно-сосудистого риска, а также с различными формами цереброваскулярной патологии, в частности с хронической ишемией головного мозга (ХИМ). Острое системное инфекционное заболевание, системная воспалительная реакция, гипоксия, эндотелиальная дисфункция, активация нейродегенеративных процессов и другие факторы способны вызывать ухудшение течения цереброваскулярного заболевания [12, 13].
Имеющиеся на сегодняшний день рекомендации по лечению пациентов с ПКС носят преимущественно эмпирический характер, что требует поиска аргументированных подходов к лечению.
Несомненный интерес представляет возможность применения нейротрофических и нейропротективных полипептидных лекарственных средств. Одним из таких препаратов является Целлекс, который изготовлен из эмбриональной ткани головного мозга свиней, что исключает риск пЦ 5редачи вируса коровьего бешенства. Состав препарата включает большое количество белков и пептидов (фактор роста нервов, глиальный нейротрофический, тромбоцитарный ростовой и инсулиноподобный ростовой факторы, нейротрофины 3, 4, 5 и др.), оказывающих трофическое и регуляторное действие. Он стимулирует дифференцировку и миграцию прогениторных нервных и глиальных клеток, активирует процессы ангиогенеза, синаптогенеза, спрутинга. Являясь индуктором процессов нейропластичности в ЦНС, данный препарат обеспечивает реализацию процессов морфологической и функциональной репарации поврежденной нервной ткани [14, 15].
Результаты клинических исследований [16, 17] показали, что применение Целлекса у пациентов с острым ишемическим инсультом сопровождается более быстрым и полным восстановлением нарушенных двигательных и речевых функций, при этом раннее начало лечения было связано с более значимым клиническим эффектом. Также была продемонстрирована эффективность данного препарата у пациентов с ХИМ / дисциркуляторной энцефалопатией, у которых имели место эпизоды острой церебральной ишемии (ишемический инсульт с полностью обратимым неврологическим дефицитом, транзиторные ишемический атаки (ТИА), асимптомные инфаркты головного мозга) [18].
Собственный опыт
В настоящее время проводится исследование Cell-CA/2021, посвященное изучению влияния препарата Целлекс на выраженность когнитивных и аффективных нарушений у пациентов с болезнью мелких сосудов (БМС). В результате анализа материала было установлено, что часть пациентов перенесла COVID-19 умеренной степени тяжести, с которым было связ e0но ухудшение состояния в виде нарастания нарушений памяти, внимания, снижения настроения, повышенной тревожности, расстройств сна. Указанные жалобы, продолжающиеся на протяжении не менее 3 мес., наряду с имеющимися соматическими расстройствами позволили диагностировать у этих больных сочетание ПКС и БМС с когнитивными и эмоциональными нарушениями. С учетом данных о связи перенесенного COVID-19 и когнитивных нарушений были проанализированы результаты воздействия препарата Целлекс на их состояние.
Критерии включения в исследование: возраст от 45 до 75 лет, перенесенный верифицированный COVID-19, субъективное ухудшение состояния после перенесенного COVID-19, нейровизуализационные признаки БМС, соответствующие критериям STRIVE, синдром мягких когнитивных нарушений, готовность пациента к соблюдению требований протокола. Критерии невключения: возраст моложе 45 лет или старше 75 лет, значения по шкале МоСА менее 24 баллов, значимые проявления депрессии (значения по шкале HАDS >18 баллов), значимые проявления тревоги (значения по шкале HАDS >18 баллов), эпилепсия, перенесенные органические поражения головного мозга со стойкими остаточными явлениями, прием полипептидных, аминокислотных комплексов и ноотропных препаратов, помимо Целлекса, непереносимость препарата.
Обследование включало исследование неврологического и соматического статуса, оценку выраженности когнитивных нарушений (опросник МоСА и батарея лобной дисфункции), астении (опросник MFI-20, раздельно оценивалась выраженность физической и психической астении), тревоги и депрессии (опросник HADS). Обследование проводилось до начала лечения, через 10 дней (после окончания первого курса введения Целлекса) и через 6 нед. (после окончания второго курса введения Целлекса больным 2-й группы).
Полуколичественная оценка выраженности изменений головного мозга проводилась на основании результатов МРТ (томограф Siemens Аchieva, 1,5 Тл) и включала оценку гиперинтенсивности сигнала от белого вещества, расширения периваскулярных пространств, количества перенесенных лакунарных инфарктов.
Статистический анализ включал описание количественных показателей с использованием количества наблюдений (n), среднего значения (M), среднего отклонения (m), медианы (Me), межквартильного размаха (Q1; Q3). Оценка достоверности отличий проводилась при помощи критерия Манна — Уитни, за достоверные принимали отличия при p<0,05.
Все пациенты, перенесшие COVID-19, были разделены на 3 группы: 1-ю группу составили 19 пациентов, которые получили Целлекс (10 подкожных инъекций по 0,1 мг), 2-ю группу — 20 пациентов, которые с интервалом в 1 мес. получили 2 курса по 10 подкожных инъекций в дозе 0,1 мг, 3-ю группу (контроля) — 16 пациентов, не получавших препарат. Группы были сопоставимы между собой по основным демографическим показателям, исходной выраженности неврологического дефицита и соматического состояния.
У больных 1-й группы на 2-м визите наблюдалось статистически значимое увеличение балла по опроснику МоСА (на 10%, p<0,05), а на 3-м визите указанный показатель возвращался практически к исходному уровню. У пациентов 2-й группы на 2-м визите также наблюдалось значимое увеличение данного показателя (на 13%, p<0,05), а на 3-м визите его значения увеличивались еще на 13% (p<0,05), превышая соответствующие значения у больных 1-й группы на 3-м визите (p<0,05). У больных 3-й группы статистически значимых изменений показателя по опроснику МоСА на протяжении периода исследования отмечено не было; различия по сравнению с 1-й и 2-й группами на 1-м и 2-м визитах отсутствовали (см. таблицу).
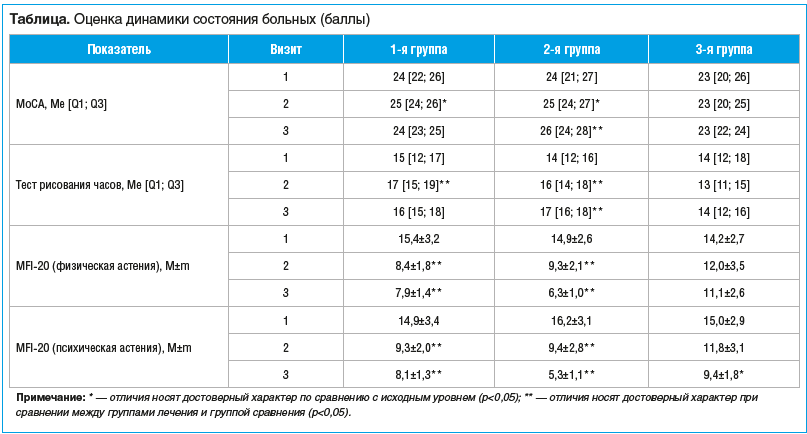
Оценка выполнения тестов батареи лобной дисфункции показала, что у пациентов 1-й группы на 2-м визите наблюдалось увеличение показателя в среднем на 15% (p<0,05), а на 3-м визите его значения несколько снижались, хотя и превышали начальный уровень (p>0,05). У больных 2-й группы начальные значения рассматриваемого показателя оказались незначительно ниже, чем в 1-й группе (p>0,05). На 2-м визите наблюдалось увеличение показателя на 16% (p<0,05), а на 3-м визите — дальнейшее увеличение, отличия носили достоверный характер по сравнению с исходными значениями и с 1-й группой (p<0,05). В группе контроля минимальные показатели были отмечены на 2-м визите, они оказались статистически значимо ниже, чем в 1-й и 2-й группах (p<0,05). На 3-м визите значения в 3-й группе несколько возрастали (отличия не носили статистически значимого характера по сравнению с исходным уровнем, p>0,05) и оказались существенно ниже, чем во 2-й группе (p<0,05). На 3-м визите существенных отличий от 1-й группы не было установлено.
Исходные показатели выраженности физической астении существенным образом не отличались у пациентов всех 3 групп. У больных 1-й группы на 2-м визите наблюдалось значимое уменьшение показателя — на 50% (p<0,05), а на 3-м — еще на 15% (p<0,05). У пациентов 2-й группы на 2-м визите также имело место уменьшение показателя на 40% (p<0,05), в последующем данный показатель уменьшился еще на 25% (p<0,05). Значение выраженности физической астении у пациентов 3-й группы несколько уменьшалось на 2-м и 3-м визитах по сравнению с исходным уровнем, однако отличия не носили достоверного характера.
Исходные показатели выраженности психической астении не отличались у пациентов 3 групп. У больных 1-й группы на 2-м визите имело место снижение указанного показателя на 40% (p<0,05), в последующем, на 3-м визите, значения несколько уменьшались (на 20% по сравнению с исходным уровнем, отличия не носили достоверного характера) и оказались несколько ниже, чем в 3-й группе. У больных 2-й группы на 2-м визите также имело место снижение показателя на 38% (p<0,05), на 3-м визите значения данного показателя уменьшались еще на 50% и оказались значительно ниже по сравнению как с исходным уровнем, так и с двумя другими группами (p<0,05). Выраженность психической астении у пациентов 3-й группы незначительно снижалась ко 2-му визиту, только на 3-м визите отмечались статистически значимые отличия по сравнению с исходным уровнем.
При оценке выраженности явлений депрессии установлено, что у больных 1-й группы на 2-м визите наблюдалась тенденция к уменьшению данного показателя (p>0,05). На 3-м визите значения по шкале депрессии не отличались от предыдущего показателя. У пациентов 2-й группы, несмотря на более высокие исходные значения по шкале HADS по сравнению с больными 1-й группы (p>0,05), на 2-м визите наблюдалась тенденция к уменьшению показателя, которая не носила значимого характера. При обследовании на 3-м визите имело место дальнейшее уменьшение значений по опроснику депрессии HADS (p<0,05). Значения данного показателя на 3-м визите существенно не отличались между двумя группами. Выраженность депрессивных проявлений у больных 3-й группы на протяжении всего периода наблюдения была неизменной.
Выраженность тревожных расстройств у больных всех 3 групп не различалась на момент включения в исследование, в последующем отсутствовала существенная динамика указанного показателя.
Таким образом, результаты проведенного исследования свидетельствуют о том, что у пациентов с БМС с когнитивными нарушениями после COVID-19 на фоне применения препарата Целлекс выявлено существенное улучшение когнитивных функций, заключающееся увеличении показателей выполнения тестов опросника МоСА и батареи лобной дисфункции. Достоверное уменьшение выраженности депрессивных нарушений достигнуто после повторного курса введения препарата. Выраженность тревожного расстройства на фоне приема препарата Целлекс оставалась неизменной. Лечение сопровождалось значительным уменьшением выраженности eaак психической, так и физической астении. Отмечена хорошая переносимость лечения и отсутствие нежелательных явлений при применении препарата.
Заключение
Постковидные неврологические нарушения приводят к существенному снижению качества повседневной жизни у большого количества пациентов, в том числе у больных трудоспособного возраста. Не до конца понятны механизмы формирования изменений со стороны нервной системы при нов eeй коронавирусной инфекции. Имеющиеся на сегодняшний день рекомендации по лечению пациентов с ПКС носят преимущественно эмпирический характер, что требует поиска аргументированных подходов к лечению. Несомненный интерес представляет применение нейротрофических и нейропротективных полипептидных лекарственных средств. Полученные результаты проведенного нами исследования дают основание рассматривать применение препарата Целлекс при лечении пациентов с когнитивными нарушениями, обусловленными ХИМ, в качестве перспективного метода лечения.
Благодарность
Редакция благодарит компанию АО «Фарм-Синтез» за оказанную помощь в технической редактуре настоящей публикации.
2. Fauci Introduces New Acronym for Long COVID at White House Briefing (Electronic recorse.) URL: https://www.medscape.com/viewarticle/946419 (access date: 20.01.2022).
3. Клиническое определение случая состояния после COVID-19 методом Дельфийского консенсуса 6 октября 2021 г. (Электронный ресурс.) URL: WHO/2019-nCoV/Post_COVID-19_condition/Clinical_case_definition/2021.1 (дата обращения: 15.01.2022). [Clinical case determination of the condition after COVID-19 by the Delphic consensus method on October 6, 2021. (Electronic recourse.) URL: WHO/2019-nCoV/Post_COVID-19_condition/Clinical_case_definition/2021.1 (access date: 15.01.2022) (in Russ.)].
4. Ceban F., Ling S., Lui L.M.W. et al. Fatigue and cognitive impairment in Post-COVID-19 Syndrome: A systematic review and meta-analysis. Brain Behav Immun. 2021;101:93–135. DOI: 10.1016/j.bbi.2021.12.020.
5. Frontera J.A., Lewis A., Melmed K. et al. Prevalence and Predictors of Prolonged Cognitive and Psychological Symptoms Following COVID-19 in the United States. Front Aging Neurosci. 2021;13:690383. DOI: 10.3389/fnagi.2021.690383.
6. Wyrwich K.W., Yu H., Sato R., Powers J.H. Observational longitudinal study of symptom burden and time for recovery from community-acquired pneumonia reported by older adults surveyed nationwide using the CAP Burden of Illness Questionnaire. Patient Relat Outcome Meas. 2015;6:215–223. DOI: 10.2147/PROM.S85779.
7. Evans R.A., McAuley H., Harrison E.M. et al. PHOSP-COVID Collaborative Group. Physical, cognitive, and mental health impacts of COVID-19 after hospitalisation (PHOSP-COVID): a UK multicentre, prospective cohort study. Lancet Respir Med. 2021;9(11):1275–1287. DOI: 10.1016/S2213-2600(21)00383-0.
8. Hugon J., Msika E.F., Queneau M. et al. Long COVID: cognitive complaints (brain fog) and dysfunction of the cingulate cortex. J Neurol. 2022;269:44–46. DOI: 10.1007/s00415-021-10655-x.
9. Guedj E., Campion J.Y., Dudouet P. et al. 18F-FDG brain PET hypometabolism in patients with long COVID. Eur J Nucl Med Mol Imaging. 2021;48(9):2823–2833. DOI: 10.1007/s00259-021-05215-4.
10. Kanberg N., Simrén J., Edén A. et al. Neurochemical signs of astrocytic and neuronal injury in acute COVID-19 normalizes during long-term follow-up. EBioMedicine. 2021;70:103512. DOI: 10.1016/j.ebiom.2021.103512.
11. Edén A., Simrén J., Price R.W. et al. Neurochemical biomarkers to study CNS effects of COVID-19: A narrative review and synthesis. J Neurochem. 2021;159(1):61–77. DOI: 10.1111/jnc.15459.
12. Захаров В.В. Постковидный синдром глазами невролога. Поведенческая неврология. 2021;2:14–22. [Zakharov V.V. Postcovid syndrome through the eyes of a neurologist. Behavioral neurology. 2021;2:14–22 (in Russ.)]. DOI: 10.46393/2712-9675_2021_2_14_22.
13. Камчатнов П.Р., Соловьева Э.Ю., Хасанова Д.Р., Фатеева В.В. Астенические и когнитивные нарушения у пациентов, перенесших COVID-19. РМЖ. Медицинское обозрение. 2021;5(10):636–641. [Kamchatnov P.R., Solov’eva E.Yu., Khasanova D.R., Fateeva V.V. Asthenic and cognitive disorders after the COVID-19 infection. Russian Medical Inquiry. 2021;5(10):636–641 (in Russ.)]. DOI: 10.32364/2587-6821-2021-5-10-636-641.
14. Романова Г.А., Шакова Ф.М., Барсков И.В. Функциональные и морфологические повреждения при фокальной ишемии префронтальной коры головного мозга крыс; коррекция с помощью препарата целлекс. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;5:34–39. [Romanova G.A., Shakova F.M., Barskov I.V. Functional and morphological injuries in focal ischemia of the prefrontal cortex of rats; correction with the help of the drug cellex. Zhurnal Nevrologii I Psikhiatrii imeni S.S. Korsakova. 2011;5:34–39 (in Russ.)].
15. Корсунская Л.Л., Власенко С.В., Давыдова А.А. и др. Изучение влияния препарата целлекс на регенераторные процессы в ткани головного мозга при моделировании паренхиматозного кровоизлияния у животных. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;7:73–77. [Korsunskaya L.L., Vlasenko S.V., Davydova A.A. et al. The effect of cellex on regenerative processes in cerebral parenchymal hemorrhage under experimental condition. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2018;7:73–77 (in Russ.)]. DOI: 10.17116/jnevro20181187173.
16. Камчатнов П.Р., Измайлов И.А., Умарова Х.Я., Соколов М.А. Результаты применения Целлекса у больных ишемическим инсультом. Фарматека. 2015;19:52–57. [Kamchatnov P.R., Izmailov I.A., Umarova H.Ya., Sokolov M.A. Results of the use of Cellex in patients with ischemic stroke. Pharmateca. 2015;19:52–57 (in Russ.)].
17. Коваленко А.В., Сафронова М.Н. Влияние целлекса на восстановление когнитивных и речевых нарушений в остром периоде инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;115(1):40–44. [Kovalenko A.V., Safronova M.N. The effect of cellex on cognitive and speech impairments in the acute stage of stroke. Zhurnal Nevrologii I Psikhiatrii imeni S.S. Korsakova. 2015;115(1):40–44 (in Russ.)]. DOI: 10.17116/jnevro20151151140-44.
18. Абусуева Б.А., Евзельман М.А, Камчатнов П.Р., Умарова Х.Я. Применение препарата Целлекс у пациентов с хронической ишемией головного мозга и умеренными когнитивными нарушениями. Нервные болезни. 2016;2:29–34. [Abusueva B.A., Evzelman M.A., Kamchatnov P.R., Umarova H.Ya. The use of the drug Cellex in patients with chronic cerebral ischemia and moderate cognitive impairment. Nervous diseases. 2016;2:29–34 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
