Хондрогард® (хондроитина сульфат) в терапии пациентов с остеоартритом и коморбидными заболеваниями
Распространенность коморбидной патологии стала одной из важнейших проблем клинической медицины. Коморбидность нельзя рассматривать как сосуществование разных нозологических единиц у одного пациента, поскольку многие патогенетические и патофизиологические процессы этих заболеваний взаимосвязаны и часто взаимно отягощают течение друг друга. Во многих проведенных исследованиях подтверждена эффективность и безопасность назначения инъекционной формы хондроитина сульфата (ХС) у пациентов с остеоартритом (ОА) и коморбидными заболеваниями, сопровождающимися кардиоваскулярным риском, атеросклерозом, заболеваниями легких (включая рак легких) и желудочно-кишечного тракта, заболеваниями почек, сахарным диабетом 2 типа, саркопенией. ХС оказывает выраженное системное противовоспалительное действие (подавляя активность провоспалительных цитокинов), ингибирует сигнальный каскад ядерного фактора κB, осуществляющий биологические эффекты фактора некроза опухоли α, запуская сложную иерархию изменений в протеоме и активности соответствующих молекулярных каскадов. ХС обладает онкопротективным эффектом, подавляя инвазию метастазов при разных формах рака. Полученные данные позволяют применять ХС (Хондрогард®) у широкого круга пациентов с ОА и коморбидностью.
Ключевые слова: остеоартрит, коморбидные заболевания, хондроитина сульфат, Хондрогард, саркопения, атеросклероз, сердечно-сосудистые заболевания, заболевания легких, заболевания почек, сахарный диабет.
Для цитирования: Шавловская О.А., Громова О.А., Романов И.Д., Бокова И.А. Хондрогард® (хондроитина сульфат) в терапии пациентов с остеоартритом и коморбидными заболеваниями. РМЖ. Медицинское обозрение. 2023;31(3):26-30.
Введение
На сегодняшний день распространенность коморбидной патологии стала одной из важнейших проблем клинической медицины. Коморбидность нельзя рассматривать как сосуществование разных нозологических единиц у одного пациента, поскольку многие патогенетические и патофизиологические процессы этих заболеваний взаимосвязаны и часто взаимно отягощают течение друг друга [1].
Самое распространенное в мире заболевание суставов — остеоартрит (ОА). ОА характеризуется деградацией экстрацеллюлярного матрикса, возникающей при микро- и макроповреждениях, которые запускают патологические адаптивные реакции [2]. В популяции пациентов с ОА самой уязвимой является группа лиц пожилого и старческого возраста, имеющая наибольшее количество коморбидных заболеваний. Отмечена высокая коморбидность ОА и сердечно-сосудистых заболеваний (ССЗ), таких как артериальная гипертензия (АГ), атеросклероз, ишемическая болезнь сердца (ИБС), хроническая болезнь почек (ХБП) [3].
Хроническая боль в суставах способствует уменьшению функциональной активности сустава, что впоследствии ведет к иммобилизации пациента, а снижение повседневной физической активности из-за болевого синдрома опосредованно приводит к функциональным нарушениям и декомпенсации ССЗ. На фоне ОА тяжесть течения коморбидных заболеваний: ССЗ, сахарного диабета 2 типа (СД2), хронической обструктивной болезни легких (ХОБЛ), старческой астении (саркопения) усугубляется [4].
Основные задачи терапии ОА заключаются в уменьшении боли, сохранении хрящевого матрикса, безопасности применения лекарственных препаратов (ЛП) у лиц с коморбидными заболеваниями, минимизации нежелательных явлений (НЯ). ЛП, применяемый в терапии ОА, должен оказывать выраженное обезболивающее действие, сопоставимое с эффектом нестероидных противовоспалительных препаратов (НПВП), но обладать при этом более безопасным профилем. Одним из перспективных на сегодняшний день направлений терапии ОА является назначение ЛП, обладающих модифицирующим действием на симптом, структуру хряща и саму болезнь. К таким ЛП относится хондроитина сульфат (ХС), имеющий доказанный уровень достоверности и убедительности рекомендаций применения (1А)1. Доказано, что фармацевтический стандартизированный ХС оказывает выраженное противовоспалительное и структурно-модифицирующее действие, способствуя репарации эндогенного ХС в составе хряща и в синовиальной жидкости.
Безопасность ХС в терапии пациентов с кардиоваскулярными рисками и атеросклерозом
Коморбидность ОА и ССЗ является наиболее частой и типичной полиморбидностью пациентов старших возрастных групп. К факторам риска развития сердечно-сосудистых событий относятся [5]: повышенный индекс массы тела (ИМТ), СД2, АГ, гиперхолестеринемия, прием НПВП.
В прогрессировании атеросклероза основная роль отводится патологическим процессам в клетках эндотелия и моноцитах, а именно в передаче сигналов через каскад ядерного фактора κB (NF-κB) [6]. Известно, что ХС проявляет выраженное противовоспалительное действие посредством блокирования сигнального каскада NF-κB и ингибирования эффектов фактора некроза опухоли α (ФНО-α), что крайне важно в терапии ОА. В последние годы были проведены исследования, указывающие на перспективность изучения при атерогенном коморбидном фоне на клеточных культурах молекулы ХС.
Пациенты с ОА, получавшие высокие дозы ХС, имеют более низкую частоту ИБС, однако механизм этого положительного эффекта ХС оставался неясным. P. Melgar-Lesmes et al. [7] на экспериментальных моделях (мыши с ожирением) показали, как лечение ХС влияет на формирование атероматозных бляшек посредством взаимодействия с эндотелиальными клетками и моноцитами. При лечении мышей с ожирением было выявлено, что на фоне назначения ХС расширение покрытия пенистых клеток в атероматозных бляшках артериальных бифуркаций уменьшилось на 62,5%, концентрации интерлейкина 1β (ИЛ-1β) и ФНО-α в сыворотке крови упали на 70 и 82% соответственно, а отдельных хемокинов — на 25–35%. В культуре коронарных эндотелиальных клеток и моноцитов, стимулированных ФНО-α, на фоне использования ХС отмечено снижение секреции провоспалительных цитокинов (р<0,01). Выявлено, что ХС подавлял в эндотелиальных клетках активацию сигнального пути ФНО-α на 36%, NF-κB — на 33%, а также снижал миграцию активированных моноцитов к воспаленным эндотелиальным клеткам в трансвеллах (р<0,001). Авторы заключили, что проведенное исследование свидетельствует о роли ХС в активации провоспалительных путей, которые являются общими для ожирения и атерогенеза.
В сравнительном исследовании с участием пациентов с гонартрозом (ГА) и коксартрозом (КА), рентгенологически I–III ст. по J. Kellgren и J. Lawrence (n=80; средний возраст 50,62±8,9 года), c реактивным синовитом и коморбидными заболеваниями (ИБС, АГ) в 75% случаев, проводилась оценка клинической эффективности применения комбинации накожного и надвенного лазерного облучения крови (НЛОК) в сочетании с в/м введением ХС (Хондрогард®) [8]. Согласно дизайну исследования 1-я группа получала (n=39) в/м Хондрогард® (2 мес.) + НПВП (3–5 сут) + НЛОК (10 ежедневных процедур на курс, 2 курса в течение 6 мес.), 2-я группа (n=20) — Хондрогард® + НПВП (10 сут) + физиотерапия, 3-я группа (n=21) — НПВП (3–5 сут). Хондрогард® в/м вводили по общепринятой схеме: первые три инъекции в дозе 1 мл (100 мг) через день (ч/д), начиная с 4-го дня — в дозе 2 мл (200 мг), курсом № 30. Анализировали значения артериального давления (АД): систолического (САД), диастолического (ДАД) и пульсового (ПАД), проводился суточный мониторинг АД, анализ частоты сердечных сокращений (ЧСС) и приступов загрудинных болей. Динамику показателей оценивали до и после лечения на 8–10-е, 28–30-е сутки и через 6 мес. В ходе исследования было установлено, что у пациентов из 1-й группы САД снизилось с 160,8±6,9 до 130,4±3,4 мм рт. ст., ДАД — с 98,9±2,6 до 86,3±5,4 мм рт. ст., ПАД — с 62,2±3,44 до 4,8±3,6 мм рт. ст.; уменьшилась ЧСС (p<0,05); уменьшились приступы загрудинных болей, что было отмечено на 5–8-е сутки (p<0,05). Во 2-й группе отмечалась положительная, но недостоверная динамика указанных параметров (p>0,05), а у пациентов 3-й группы установлено ухудшение всех указанных параметров. Авторы заключили, что наиболее эффективной схемой терапии ОА у пациентов с кардиоваскулярной патологией является комбинация «НЛОК + Хондрогард® + НПВП», в сравнении с комбинацией «Хондрогард® + НПВП» или только НПВП. При использовании указанной схемы терапии были отмечены существенное снижение выраженности болевого синдрома и нормализация показателей АД и ЧСС. Таким образом, можно заключить, что терапия препаратом Хондрогард® и НПВП оказывает выраженное воздействие на суставной болевой синдром, но в более поздние сроки (отсроченно).
Эффективность и безопасность назначения ХС (Хондрогард®) в терапии пациентов с ОА, неспецифическими болями в нижней части спины (БНЧС) и высоким кардиоваскулярным риском (уровень АД ≤139/89 мм рт. ст.) продемонстрированы в одном из сравнительных исследований [9]. Пациенты, вошедшие в исследование, были разделены на 2 группы: в основной группе (n=63; средний возраст 64,5 года) назначен Хондрогард® в/м ч/д, по схеме: первые три инъекции — по 1 мл (100 мг/мл), начиная с 4-й инъекции — по 2 мл (200 мг) № 30; в группе контроля (n=63; средний возраст 65 лет) пациенты получали только базовую терапию. В ходе исследования изменения показателей плазменного звена гемостаза и скорости клубочковой фильтрации зафиксированы не были. У пациентов основной группы выявлено снижение боли более чем на 62% [9]. Таким образом, в исследовании была продемонстрирована высокая безопасность в/м введения ХС у пациентов с БНЧС и высоким кардиоваскулярным риском. Результаты данного исследования позволяют рекомендовать ХС пациентам с коморбидными заболеваниями, сопровождающимися повышением АД, заболеваниями почек, имеющих риск развития тромбообразования.
В двухмесячном проспективном исследовании пациентов (n=70; средний возраст 62,0±6,46 года) с ОА коленных суставов II ст. (80%) и III ст. (20%), имевших сопутствующие заболевания (АГ (100%), СД2 (20%), ИБС (5,7%), заболевания желудочно-кишечного тракта (ЖКТ) (2,7%), ИМТ 31,9±5,9 кг/м2), назначался ХС (Хондрогард®) по общепринятой схеме [10]. Первые инъекции пациентам проведены в условиях стационара. В течение 2 мес. было выполнено 30 инъекций. Снижение дозы НПВП через 1 мес. от начала терапии отмечено в 58,5% случаев, отмена НПВП через 2 мес. — в 46%. Пациенты вели дневник, записывая показатели АД (утро/вечер), терапию АГ, больные с СД2 — уровень глюкозы. В качестве показателей безопасности оценивали частоту и характер НЯ. Ни у одного из пациентов с АГ на фоне применения ХС не отмечено повышения АД, у больных СД2 гликемия оставалась на прежнем уровне до конца лечения. Эффективность терапии была высоко оценена и пациентом, и врачом в 94,3% случаев. Авторы сделали вывод, что в/м применение препарата Хондрогард® может быть рекомендовано для курсового приема при ОА коленных суставов у пациентов с коморбидностью [10].
Пациенты, нуждающиеся в проведении стентирования коронарных артерий, нередко страдают ОА, эти состояния часто являются коморбидными. В одной из научно-исследовательских работ приведено обоснование использования ХС для профилактики рестеноза (осложнения кардиоваскулярного стентирования) [11]. Активация рецептора гиалуронана CD44 в стентированных коронарных артериях человека ассоциирована с патофизиологией рестеноза. Как следствие, в области стента происходит стимуляция роста неоинтимы, инфильтрация макрофагами области неоинтимы, гиперпролиферация гладкомышечных клеток (ГМК) и накопление протеогликана версикана. Рецептор CD44 является таргетным белком для молекул ХС. Взаимодействуя с рецептором CD44, ХС способствует инактивации провоспалительного белка NF-κB и препятствует избыточной пролиферации ГМК в просвете стента, тормозя рестеноз. Применение ХС, таким образом, способствует снижению системного воспаления и торможению неоваскуляризации [11].
Безопасность применения ХС при заболеваниях ЖКТ
В одном из экспериментальных исследований оценена гастропротекторная активность ХС в отношении язв желудка, вызванных этанолом [12]. На животной модели (крысы) этанол-индуцированной язвы желудка изучали гастропротекторный эффект ХС. Показано, что ХС обладает выраженной гастропротекторной активностью, степень ингибирования язвы у него достигала 35–45%, что аналогично таковому у омепразола (41%). Полученные результаты демонстрируют перспективы назначения ЛП на основе ХС у пациентов с ОА, имеющих коморбидную патологию ЖКТ.
В систематическом обзоре, включавшем в анализ 2319 научных статей, оценивали влияние ХС на функцию печени [13]. Было установлено, что фармацевтические субстанции ХС, имеющие высокую степень очистки, обладают гепатопротекторным эффектом, проявляющимся даже при лекарственных интоксикациях (парацетамол, метотрексат). Отмечено, что стандартизированные формы ХС уменьшают выраженность хронического воспаления, оказывают влияние на обмен веществ в печени. Кроме того, ЛП на основе ХС проявляют противоопухолевые эффекты. Результаты проведенного анализа свидетельствуют о благоприятном профиле ЛП на основе фармацевтических стандартизированных форм ХС, которые имеют высокую степень безопасности в отношении влияния на функцию печени [13].
В одном из исследований пациентам (n=81) с эрозивным эзофагитом (ЭЭ) A, B, С степеней согласно Лос-Анджелесской эндоскопической классификации (1994 г.) проведен сравнительный анализ эффективности и безопасности назначения ХС [14]. До и после терапии клинически оценивали выраженность симптомов гастроэзофагеальной рефлюксной болезни (ГЭРБ) и проводили эзофагогастродуоденоскопию. Методом рандомизации пациентов разделили на 2 группы: 1-я (n=41; средний возраст 45 лет) получала ингибитор протонной помпы (ИПП), 2-я (n=40; средний возраст 45,5 года) — ИПП + ХС. Курс терапии составил 4 нед. После проведенной терапии в 1-й группе улучшение эндоскопической картины (как минимум на 1 уровень по Лос-Анджелесской классификации) отмечено в 85% случаев, во 2-й группе — в 100% случаев (p<0,009). В группе комбинированной терапии (ИПП + ХС) отмечена меньшая частота возникновения (p<0,01) и выраженности (p<0,01) изжоги, отрыжки воздухом (p=0,014), а также существенно уменьшилась потребность в терапии антацидами «по требованию». Таким образом, добавление к терапии ИПП ХС продемонстрировало клиническую и эндоскопическую эффективность терапии в отношении эрозивной ГЭРБ. Данный факт позволяет рекомендовать ЛП, содержащие ХС, в комбинированной терапии ЭЭ при недостаточной эффективности классической кислотосупрессивной терапии ГЭРБ [14].
Безопасность ХС у больных с легочной и почечной патологией
При анализе материалов фундаментальных и клинических исследований, включавшем в себя 1273 публикации, была дана оценка влияния ХС на функцию легких, патофизиологические процессы в легочной ткани [15]. Было отмечено, что на экспериментальных моделях (индуцированное повреждение легких и эмфизема у хомяков) сульфатированные ХС-полисахариды ингибируют эластазу лейкоцитов, оказывая противовоспалительное действие. В исследованиях с участием мужчин и женщин (n=217) в возрасте 50–75 лет применение ХС (800–1200 мг/сут) приводило к достоверному снижению (на 27%) уровня простагландина PGE-M в моче, повышение уровня которого является одним из биомаркеров — предвестников развития карциномы легких. Анализ результатов фундаментальных исследований позволил установить механизмы опосредованного влияния ХС на патологические процессы в легочной ткани. Воздействуя на определенные молекулярные каскады, ХС способствует подавлению опухолевых процессов в легочной ткани, вызывая апоптоз опухолевых клеток, и фиброзных изменений в легких, также, стабилизируя тучные клетки, способствует уменьшению проявлений аллергических реакций при бронхиальной астме. Применение ХС у пациентов с ОА и коморбидными заболеваниями легких может снижать риск развития воспалительных процессов, уменьшить проявления аллергических реакций, ингибировать начальные изменения при фибротических и опухолевых заболеваниях легких [15].
Проведен анализ текстов 2093 публикаций о влиянии ХС на функцию органов мочевыделительной системы (почек, мочевого пузыря) [16]. Установлено, что патологический метаболизм эндогенных гликозаминогликанов и нарушения функции почек взаимосвязаны. Гломерулонефрит характеризуется хроническими мезангиальными и/или мембранозными изменениями, при которых отмечается низкий уровень сульфатирования ХС почти у всех пациентов, тогда как в группах контроля — менее чем в 50% случаев. В экспериментальных исследованиях на культурах клеток уротелия было установлено, что ХС улучшает барьерную функцию клеток, поврежденных нефротоксикантом протамином. В другом эксперименте продемонстрировано, что ХС дозозависимо ингибирует кристаллизацию оксалата кальция, у крыс с гипероксалурией прием ХС предотвращает камнеобразование в почках. При выраженном болевом синдроме на фоне интерстициального цистита экзогенный ХС препятствует повреждению клеток мочевого пузыря, ингибируя каскад NF-kB. В проанализированных исследованиях указывается на протективное действие ХС на функцию почек, мочевого пузыря.
Безопасность ХС у пациентов старших возрастных групп с саркопенией, онкологическими заболеваниями
В возрастной группе старше 65 лет саркопения может рассматриваться как коморбидное заболевание, которое является фактором риска прогрессирования ССЗ (хронической сердечной недостаточности), существенно затрудняющего проведение реабилитационных мероприятий. В одном из систематических анализов, который включал 31 992 статьи, дано уточнение относительно взаимодействия коморбидных ОА состояний, таких как саркопения и остеопороз, с целью обоснования назначения ХС у данной группы пациентов. В патогенезе саркопении основную роль играет нарушение синтеза мышечного белка, усиленный апоптоз миоцитов и системное воспаление. Было показано, что молекулы ХС, взаимодействуя с рецептором CD44, инактивируют провоспалительный фактор NF-κB, активность которого повышена при атрофии мышц, наблюдаемой при саркопении. Мышечные стволовые клетки, стимулируя рецептор CD44, усиливают регенерацию мышц у пациентов с ОА и саркопенией. Таким образом, высокоочищенные препараты на основе ХС целесообразно использовать для замедления прогрессирования саркопении [17].
Систематический анализ 5129 публикаций фундаментальных и клинических исследований противоопухолевых эффектов ХС выявил, что ХС проявляет схожие механизмы противоопухолевого действия, снижая хроническое воспаление (ингибирование каскада ФНО/NF-κB) [18]. Молекулы ХС обладают способностью стимулировать апоптоз опухолевых клеток, подавлять экспрессию фактора роста эндотелия сосудов и активность матриксных металлопротеиназ. ХС тормозит процесс метастазирования, способствуя инкапсуляции опухолевых образований. По результатам метаанализа был сделан вывод, что ХС может быть рекомендован для долговременной профилактики опухолевых заболеваний [18].
Противоопухолевый эффект ХС продемонстрирован на примере предотвращения прогрессирования рака молочной железы, так как ХС может препятствовать образованию инвазивных выпячиваний и миграции клеток [19]. Кроме того, показано отрицательное воздействие ХС на регуляцию прометастатического гена внеклеточного матрикса Col1a1, который является регулируемым геном-мишенью в клетках рака молочной железы. Подавление экспрессии гена Col1a1 имитирует эффекты лечения ХС. Онкопротективный эффект ХС выражается в ингибировании инвазивных выпячиваний при метастазировании, имеет дозозависимый характер (т. е. зависит от концентрации ХС-4 и -6, составлявших 5 мкг/мл, 20 мкг/мл, 100 мкг/мл).
Заключение
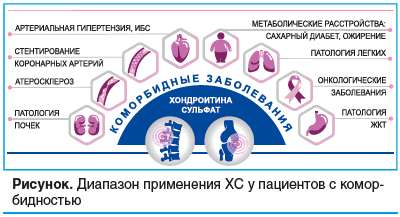
Во многих проведенных исследованиях подтверждена эффективность и безопасность назначения ХС у пациентов с ОА и коморбидными заболеваниями с кардиоваскулярным риском (АГ, ИБС), атеросклерозом, заболеваниями легких (включая рак легких) и ЖКТ (эрозивный эзофагит, патология печени и др.), заболеваниями почек (включая ХБП) и СД2, саркопенией (см. рисунок). Результаты крупномасштабных клинических исследований указывают на перспективность использования ХС для долговременной профилактики опухолевых заболеваний. ХС оказывает выраженное системное противовоспалительное действие (подавляя активность провоспалительных цитокинов), ингибирует сигнальный каскад NF-κB, осуществляющий биологические эффекты ФНО-α, запуская сложную иерархию изменений в протеоме и влияя на активность соответствующих молекулярных каскадов. Полученные данные позволяют применять препарат Хондрогард® у широкого круга пациентов с ОА и коморбидностью.
1 Клинические рекомендации МЗ РФ «Хроническая боль у пациентов пожилого и старческого возраста». 2020. (Электронный ресурс.) URL: https://cr.rosminzdrav.ru/#!/recomend/1033 (дата обращения: 20.04.2023).
2. Алексеева Л.И., Таскина Е.А., Кашеварова Н.Г. Остеоартрит: эпидемиология, классификация, факторы риска и прогрессирования, клиника, диагностика, лечение. Современная ревматология. 2019;13(2):9–21. [Alekseeva L.I., Taskina E.A., Kashevarova N.G. Osteoarthritis: epidemiology, classification, risk factors, and progression, clinical presentation, diagnosis, and treatment. Sovremennaya Revmatologiya. 2019;13(2):9–21 (in Russ.)]. DOI: 10.14412/1996-7012-2019-2-9-21.
3. Шавловская О.А., Бокова И.А., Сарвилина И.В. и др. Хондроитина сульфат в терапии остеоартрита у пациентов с коморбидными сердечно-сосудистыми заболеваниями: артериальной гипертензией, атеросклерозом, ишемической болезнью сердца. Неврология, нейропсихиатрия, психосоматика. 2021;13(3):113–118. [Shavlovskaya O.A., Bokova I.A., Sarvilina I.V. et al. Chondroitin sulfate in osteoarthritis treatment in patients with comorbid cardiovascular diseases: hypertension, atherosclerosis, coronary heart disease. Neurology, Neuropsychiatry, Psychosomatics. 2021;13(3):113–118 (in Russ.)]. DOI: 10.14412/2074-2711-2021-3-113-118.
4. Алексеева Л.И., Наумов А.В. Ведение остеоартрита с коморбидностью в общей врачебной практике (клинические рекомендации). Доктор.Ру. 2017;5(134):51–69. [Alekseyeva L.I., Naumov A.V. Management of Comorbid Osteoarthritis: Clinical Recommendations for General Practitioners. Doctor.Ru. 2017;5(134):51–69 (in Russ.)].
5. Наумов А.В. Сердечно-сосудистая коморбидность остеоартрита: клиническое значение и стратегии терапии. Российский журнал гериатрической медицины. 2021;2(6):231–236. [Naumov A.V. Cardiovascular comorbidity of osteoarthritis: clinical significance and therapy strategies. Russian Journal of Geriatric Medicine. 2021;2(6):231–236 (in Russ.)]. DOI: 10.37586/2686-8636-2-2021-231-236.
6. Лила А.М., Торшин И.Ю., Громова О.А. Стоит ли переосмыслить полученный полвека назад положительный опыт применения хондроитин сульфатов при атеросклерозе? ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020;13(2):184–191. [Lila A.M., Torshin I.Yu., Gromova O.A. Is it worthwhile rethinking the positive experience of the last 50 years of using chondroitin sulfates against atherosclerosis? FARMAKOEKONOMIKA. Sovremennaya farmakoekonomika i farmakoepidemiologiya. 2020;13(2):184–191 (in Russ.)]. DOI: 10.17749/2070-4909/farmakoekonomika.2020.043.
7. Melgar-Lesmes P., Garcia-Polite F., Del-Rey-Puech P. et al. Treatment with chondroitin sulfate to modulate inflammation and atherogenesis in obesity. Atherosclerosis. 2016;245:82–87. DOI: 10.1016/j.atherosclerosis.2015.12.016.
8. Васильева Л.В., Евстратова Е.Ф., Никитин А.В. и др. Дифференцированный подход в лечении больных остеоартрозом с кардиоваскулярной патологией. Российский кардиологический журнал. 2016;2(130):84–89. [Vasil’eva L.V., Evstratova E.F., Nikitin A.V. et al. Differentiated approach to treatment of osteoarthrosis in cardiovascular pathology. Russ J Cardio. 2016;2(130):84–89 (in Russ.)]. DOI: 10.15829/1560-4071-2016-2-84-89.
9. Золотовская И.А., Давыдкин И.Л., Повереннова И.Е. Терапия неспецифической боли в нижней части спины у пациентов с высоким кардиоваскулярным риском. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019;119(8):18–23. [Zolotovskaya I.A., Davydkin I.L., Poverennova I.E. Therapy of nonspecific lower back pain in patients with high cardiovascular risk. Zhurnal Nevrologii i Psikhiatrii im. S.S. Korsakova. 2019;119(8):18–23 (in Russ.)]. DOI: 10.17116/jnevro201911908118.
10. Шарапова Е.П., Кашеварова Н.Г., Таскина Е.А. и др. Исследование эффективности, переносимости и безопасности препарата Хондрогард у пациентов с остеоартрозом коленных суставов и коморбидностью. Фарматека. 2017;7(340):46–51. [Sharapova E.P., Kashevarova N.G., Naskina E.A. et al. Evaluation of the efficacy, tolerability and safety of chondrogard in patients with osteoarthrosis of the knee and comorbidity. Farmateka. 2017;7(340):46–51 (in Russ.)].
11. Громова О.А., Торшин И.Ю., Лила А.М. и др. Профилактика рестеноза у пациентов после чрескожного коронарного вмешательства: возможный патогенетический подход. РМЖ. 2019;8(I):33–40. [Gromova O.A., Torshin I.Yu., Lila A.M. et al. Prevention of restenosis in patients after percutaneous coronary intervention: possible pathogenetic approach. RMJ. 2019;8(I):33–40 (in Russ.)].
12. Wang K., Bai F., Zhou X. et al. Characterization of chondroitin sulfates isolated from large hybrid sturgeon cartilage and their gastroprotective activity against ethanol-induced gastric ulcers. Food Chem. 2021;363:130436. DOI: 10.1016/j.foodchem.2021.130436.
13. Торшин И.Ю., Лила А.М., Громова О.А. Гепатопротекторные эффекты хондроитина сульфата и глюкозамина сульфата. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021;14(4):537–547. [Torshin I.Yu., Lila A.M., Gromova O.A. Hepatoprotective effects of chondroitin sulfate and glucosamine sulfate. FARMAKOEKONOMIKA. Sovremennaya farmakoekonomika i farmakoepidemiologiya. 2021;14(4):537–547 (in Russ.)]. DOI: 10.17749/2070-4909/farmakoekonomika.2021.112.
14. Бакулина Н.В., Тихонов C.В., Топалова Ю.Г. и др. Эзофагопротективная терапия у пациентов с эрозивным эзофагитом. Терапевтический архив. 2022;94(8):985–991. [Bakulina N.V., Tikhonov S.V., Topalova Yu.G. et al. Esophagoprotective therapy in patients with erosive esophagitis. Terapevticheskii Arkhiv. 2022;94(8):985–991 (in Russ.)]. DOI: 10.26442/00403660.2022.08.201828.
15. Торшин И.Ю., Громова О.А., Чучалин А.Г. Перспективы применения хондропротекторов для лечения легочной патологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021;14(4):563–579. [Torshin I.Yu., Gromova O.A., Chuchalin A.G. Prospects of using chondroprotectors for the treatment of pulmonary pathology. FARMAKOEKONOMIKA. Sovremennaya farmakoekonomika i farmakoepidemiologiya. 2021;14(4):563–579 (in Russ)]. DOI: 10.17749/2070-4909/farmakoekonomika.2021.113.
16. Торшин И.Ю., Лила А.М., Лиманова О.А., Громова О.А. Перспективы применения хондроитина сульфата и глюкозамина сульфата при остеоартрите в сочетании с патологией почек и мочевыделительной системы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020;13(1):23–34. [Torshin I.Yu., Lila A.М., Limanova O.A., Gromova O.A. Prospects for the use of chondroitin sulfate and glucosamine sulfate with osteoarthritis associated with pathology of the kidneys and urinary system. FARMAKOEKONOMIKA. Sovremennaya farmakoekonomika i farmakoepidemiologiya. 2020;13(1):23–34 (in Russ.)]. DOI: 10.17749/2070-4909.2020.13.1.23-34.
17. Громова О.А., Торшин И.Ю., Лила А.М. и др. Молекулярные механизмы миопротективного действия хондроитина сульфата и глюкозамина сульфата при саркопении. Неврология, нейропсихиатрия, психосоматика. 2019;11(1):117–124. [Gromova O.A., Torshin I.Yu., Lila A.M. et al. Molecular mechanisms of myoprotective action of chondroitin sulfate and glucosamine sulfate in sarcopenia. Neurology, Neuropsychiatry, Psychosomatics. 2019;11(1):117–124 (in Russ.)]. DOI: 10.14412/2074-2711-2019-1-117-124.
18. Громова О.А., Торшин И.Ю., Лила А.М. и др. Систематический анализ исследований противоопухолевых эффектов хондропротекторов глюкозамина сульфата и хондроитина сульфата. РМЖ. Медицинское обозрение. 2019;4(I):4–10. [Gromova O.A., Torshin I.Yu., Lila A.M. et al. Systematic study review on antitumor effects of glucosamine and chondroitin sulfate cartilage protectors. RMJ. Medical Review. 2019;4(I):4–10 (in Russ.)].
19. Wills C.M., Klüppel M. Chondroitin sulfate-E is negative regulator of a pro-tumorigenic Wrt/beta-Collagen 1 axis in breast cancer cells. PLoS One. 2014;9(8):e103966. DOI: 10.1371/journal.pone.0103966.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
