Эффективность неденатурированного и гидролизованного коллагена II типа в терапии болевого синдрома
DOI: 10.32364/2587-6821-2022-6-10-571-575
Коллагены играют важную структурную роль и вносят вклад в механические свойства, организацию и форму тканей. При заболеваниях опорно-двигательного аппарата (ОДА) существенно уменьшается количество коллагена II типа в межклеточном матриксе хряща. Деградация и уменьшение количества коллагена II типа ассоциируются с остеоартритом (ОА). Сегодня в терапии ОА для перорального и парентерального применения широко используются SYSADOA (Symptomatic Slow Acting Drugs for Osteoarthritis) — симптоматические препараты замедленного действия в терапии остеоартрита. В последнее время стало уделяться повышенное внимание к новым подходам в терапии ОА на основе новой перспективной молекулы коллагена II типа: неденатурированного (НК-II) и гидролизованного (ГлК-II) коллагена. НК-II — это нативный коллаген (фибриллярный белок с молекулярной массой 300 кДа), тогда как ГлК-II представляет собой полипептиды (молекулярная масса 2–9 кДа). В статье описаны молекулярные механизмы действия НК-II и ГлК-II, обозначены основные различия между ними. Разный механизм действия описанных видов коллагена обусловливает их клиническое применение: НК-II назначается в основном при заболеваниях ОДА, в частности ОА, а ГлК-II преимущественно используется в косметологии, а также при заболеваниях ОДА. Представлены результаты исследований, продемонстрировавших безопасность и эффективность лекарственных препаратов и БАД, содержащих НК-II и ГлК-II, в купировании болевого синдрома при ОА.
Ключевые слова: неденатурированный коллаген II типа, нативный коллаген, гидролизованный коллаген, пептиды коллагена, SYSADOA, болевой синдром, остеоартрит.
Для цитирования: Шавловская О.А., Бокова И.А., Романов И.Д., Шавловский Н.И. Эффективность неденатурированного и гидролизованного коллагена II типа в терапии болевого синдрома. РМЖ. Медицинское обозрение. 2022;6(10):571-575. DOI: 10.32364/2587-6821-2022-6-10-571-575.
O.A. Shavlovskaya1, I.A. Bokova2, I.D. Romanov3, N.I. Shavlovsky4
1International University of Rehabilitation Medicine, Moscow, Russian Federation
2I.M. Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russian Federation
3MD Clinic LLC, Moscow, Russian Federation
4Russian Medical Academy of Continuous Professional Education; Moscow, Russian Federation
Collagens play an important structural role and contribute to the mechanical properties, organization and shape of tissues. In musculoskeletal system diseases (MSD), the amount of type II collagen in the cartilage extracellular matrix significantly decreases. Degradation and reduction of type II collagen are associated with osteoarthritis (OA). At present, SYSADOA (Symptomatic Slow Acting Drugs for Osteoarthritis) are widely used in the treatment of OA for oral and parenteral use. Besides, increased attention has been paid to the new treatment methods for OA based on a new promising type II collagen molecule: undenatured (UC-II) and hydrolyzed (HC-II) collagen. UC-II is a native collagen (fibrillar protein with a molecular weight of 300 kDa), whereas HC-II is a polypeptide (molecular weight of 2–9 kDa). The article describes the molecular mechanisms of action of UC-II and HC-II, and identifies the main differences between them. The diverse mechanism of action of the described collagen types determines their clinical use: UC-II is prescribed mainly in MSD, in particular OA, and HC-II is mainly used in cosmetology, as well as in MSD. The article also presents the study results demonstrating the safety and efficacy of drugs and dietary supplements containing UC-II and HC-II in relieving pain syndrome during OA.
Keywords: undenatured type II collagen native collagen, hydrolyzed collagen, collagen peptides, SYSADOA, pain syndrome, osteoarthritis.
For citation: Shavlovskaya O.A., Bokova I.A., Romanov I.D., Shavlovsky N.I. Efficacy of undenatured and hydrolyzed type II collagen in the treatment of pain syndrome. Russian Medical Inquiry. 2022;6(10):571–575 (in Russ.). DOI: 10.32364/2587-6821-2022-6-10-571-575.
Введение
Коллагены играют важную структурную роль и вносят вклад в механические свойства, организацию и форму тканей. Коллаген — это фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий ее прочность и эластичность. Семейство коллагенов включает 28 типов, которые содержат по меньшей мере один домен с тройной спиралью [1]. Коллагены откладываются во внеклеточном матриксе, где большинство из них образуют супрамолекулярные сборки. У взрослых людей более 90% коллагена хрящевого матрикса представлено коллагеном II типа, который является основным структурным компонентом межклеточного матрикса хряща [2]. При заболеваниях опорно-двигательного аппарата (ОДА) в межклеточном матриксе хряща существенно уменьшается количество коллагена II типа [3]. Основой суставного хряща является гиалиновая хрящевая ткань, состоящая из хондроцитов, имеющих тканеспецифические антигены, которые индуцируют выработку антител у пациентов с остеоартритом (ОА). Именно деградация и уменьшение количества коллагена II типа ассоциируются с ОА.
Сегодня в терапии ОА для перорального и парентерального применения широко используются симптоматические лекарственные средства замедленного действия (СЛСЗД, SYSADOA — Symptomatic Slow Acting Drugs for Osteoarthritis), или хондропротекторы, такие как фармацевтически стандартизированные хондроитина сульфат (ХС) и глюкозамина сульфат (ГС), гиалуроновая кислота для внутрисуставного введения, имеющие наивысший уровень убедительности рекомендаций (А) и достоверности доказательств (1), которые могут эффективно влиять на симптомы при длительном (до 6 мес.) курсе лечения, проявляя низкую токсичность [4]. Наряду с указанными лекарственными препаратами (ЛП) также назначаются и другие средства из этой категории (биоактивный концентрат мелкой морской рыбы, гликозаминогликан-пептидный комплекс, неомыляемые соединения авокадо и сои, диацереин), которые имеют недостаточный уровень убедительности рекомендаций и достоверности доказательств.
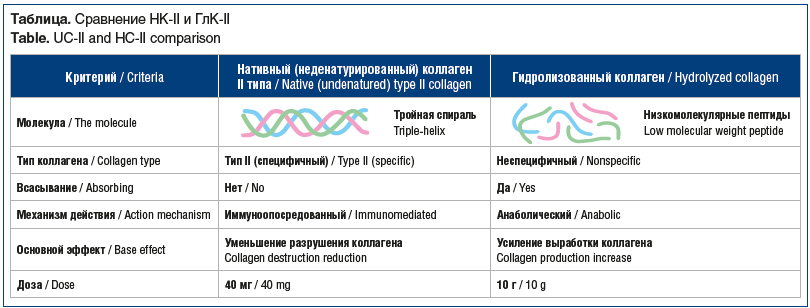
В последнее время стало уделяться повышенное внимание новым подходам к терапии ОА, в частности препаратам, в основе которых лежит новая перспективная молекула коллагена II типа: неденатурированный, или нативный, коллаген (НК-II); денатурированный (гидролизованный) коллаген (ГлК-II), или пептиды коллагена. Коллаген способствует значимому уменьшению боли в суставах при проведении коротких (в течение недель) и средних (в течение месяцев) курсов лечения. Молекулярная масса НК-II высокая (300 кДа), ГлК-II — низкая (2–9 кДа) [5].
Молекулярные механизмы действия НК-II
Имеющиеся в литературе данные о молекулярных механизмах действия коллагенов II типа, в том числе НК-II, систематизированы посредством современных методов анализа больших объемов данных [6]. Действие стандартизированных экстрактов НК-II связано с модуляцией механизмов врожденного и приобретенного иммунитета, снижением активности провоспалительных цитокинов и простагландинов. Эпитопы нативного коллагена в структуре НК-II способствуют уменьшению активности аутоиммунных реакций, стимулирующих деградацию хряща. Взаимодействуя с дискоидиновыми рецепторами (Receptor Tyrosine Kinases, DDR1 и DDR2) [2, 7], НК-II ускоряет реконструкцию соединительной ткани хряща и тормозит провоспалительные эффекты эндогенных коллагенов.
Систематический анализ данных выявил, что молекулярная фармакология предполагает три механизма действия НК-II [6]:
При поступлении per os трехмерные эпитопы полипептидов НК-II воздействуют на Т- и В-лимфоциты в пейеровых бляшках тонкого кишечника, начинается выработка антител, которые образуют защитный слой вокруг волокон коллагена разрушающегося хряща, препятствуя избыточной продукции провоспалительных цитокинов Т-лимфоцитами, не сенсибилизированными к НК-II.
НК-II частично гидролизуется под действием ферментов желудочно-кишечного тракта, вследствие чего образуются полипептидные фрагменты, которые, взаимодействуя с DDR на поверхности хондроцитов, способствуют ускорению регенерации хрящевой ткани.
Полипептидные фрагменты НК-II могут блокировать аутоантитела, которые ускоряют гибель хондроцитов и деградацию хрящевой ткани, что способствует торможению деградации ткани хряща.
Молекулярные механизмы действия ГлК-II
Гидролизованный коллаген, или пептиды коллагена, — это группа пептидов с низкой молекулярной массой (в среднем 3–6 кДа), которые могут быть получены ферментативным действием в кислых или щелочных средах при определенной температуре инкубации [8]. Биодоступность ГлК-II in vitro демонстрирует высокие показатели абсорбции из-за его низкой молекулярной массы [9]. Гидролизованный коллаген содержит 8 из 9 незаменимых аминокислот, включая глицин (33%), пролин, гидроксипролин (22%) в триплексной спирали, которая образована тремя α-цепями [10]. Эти аминокислоты играют важную роль в формировании скелетных разновидностей соединительной ткани, а их дефицит может быть причиной болей в суставах, хрупкости ногтей, ломкости волос. Аминокислотный состав гидролизованного коллагена соответствует аминокислотному составу матрикса хрящевой ткани. Применение гидролизата коллагена стимулирует анаболические процессы в межклеточном веществе хрящевой ткани, приводящие к активизации регенерации и стабильности суставного хряща [11]. Топическое применение порошков коллагена способствует регенерации кожи и заживлению ран [12]: ускоряется переход от экссудативной фазы воспаления к пролиферативной, быстрее происходит эпителизация [13].
Согласно имеющимся данным действие пептидов коллагена опосредовано тремя различными механизмами: прямым воздействием на фибробласты, М2-подобные макрофаги и механизмами, связанными с оральной толерантностью [9].
Различия между НК-II и ГлК-II
Структура коллагена очень стабильна из-за внутримолекулярных водородных связей между глицином в соседних цепях. Молекула коллагена образуется из тройной спиральной области и двух негелевых областей на обоих концах спиральной структуры с молекулярной массой около 300 кДа, длиной 280 нм и диаметром 1,4 нм. Гидролизат коллагена представляет собой обрывки белковых нитей, которые представлены отдельными аминокислотами, дипептидами и трипептидами.
Молекулярная масса неденатурированного коллагена высокая (300 кДа), гидролизата коллагена — существенно ниже (2–9 кДа, в среднем 6 кДа) [5]. Полипептиды гидролизата коллагена легко всасываются, обладают анаболическим эффектом, ускоряют биосинтез коллагена и увеличивают синтез внеклеточного матрикса хондроцитами, улучшают минерализацию костей за счет дифференциации и пролиферации остеобластов.
Таким образом, молекула неденатурированного коллагена содержит нативный коллаген (фибриллярный белок), тогда как денатурированный коллаген представляет собой полипептиды. ГлК-II легко всасывается из-за низкой молекулярной массы [14, 15], тогда как НК-II не всасывается при приеме per os. Основной эффект НК-II — уменьшение деструкции коллагена, тогда как ГлК-II повышает синтез коллагена. Механизм действия НК-II — иммуноопосредованный, ГлК-II — анаболический (см. таблицу). Механизм действия разных видов коллагена (неденатурированного и денатурированного) обусловливает их клиническое применение: НК-II назначается в основном при заболеваниях ОДА [16, 17], в частности ОА; основная область применения ГлК-II — косметология, при инволюционных процессах в коже [18, 19], назначается также и при заболеваниях ОДА [20, 21].
Терапевтическая эффективность коллагена
Нативный коллаген II является основной частью коллагеновых фибрилл гиалинового хряща суставов, он также присутствует в пульпозном ядре межпозвонкового диска. НК-II, полученный из хряща куриной грудины, назначается при ОА коленного сустава [22]. Показано, что добавление коллагеновых пептидов способствует восстановлению соединительной ткани и уменьшает боль за счет увеличения выработки коллагена [23].
Метаанализ рандомизированных плацебо-контролируемых исследований подтвердил эффективность приема НК-II при ОА. Отмечено статистически значимое снижение показателей по шкале WOMAC, в том числе по подшкале «скованность суставов», уменьшение выраженности боли по ВАШ [16].
В ряде исследований дана сравнительная оценка эффективности коллагена и анальгетиков (ацетаминофена). Сравнивались результаты симптоматического лечения пациентов с ОА коленного сустава (n=20; средний возраст 57,7 года) НК-II (10 мг/сут, курс 3 мес.) в сочетании с ацетаминофеном (1500 мг/сут) и лечения только ацетаминофеном (n=19; средний возраст 58,8 года). Прием НК-II был статистически значимо ассоциирован с заметным снижением боли в суставах по ВАШ, уменьшением выраженности дисфункции суставов по WOMAC и улучшением качества жизни по шкале SF-36, чего не наблюдалось в группе контроля [24].
В рандомизированном контролируемом исследовании [25] клиническая эффективность НК-II оценена у 60 пациентов в возрасте 40–75 лет с ОА II–III стадии. Пациенты первой группы (n=30) получали ацетаминофен (1500 мг/сут), второй (n=30) — НК-II (10 мг/сут) в течение 3 мес. Более выраженное статистически значимое снижение ночной боли и боли в покое отмечено в группе НК-II. В обеих группах отмечено улучшение показателей при подъеме по лестнице, при ходьбе по ровной поверхности. Положительная динамика по показателям ВАШ и WOMAC на 30% в обеих группах позволила сделать вывод о сопоставимой эффективности препаратов.
В большинство ЛП наряду с коллагеном включен комплекс лекарственных трав (босвеллия, куркумин и др.) или других хорошо изученных SYSADOA (ХС, ГС, гиалуроновая кислота). В сравнительном многоцентровом рандомизированном исследовании [17] с участием 191 пациента в возрасте от 40 до 75 лет с ОА коленных суставов (крепитация, наросты на костях, припухлость суставов и т. д.) наблюдались три группы: первая группа получала НК-II (40 мг/с), вторая — глюкозамина гидрохлорид (1500 мг) + ХС (1200 мг), третья — плацебо. Курс лечения составил 180 дней. В группе НК-II в сравнении с группой плацебо получено статистически значимое снижение показателей по шкале WOMAC, включая существенное достоверное уменьшение баллов по подшкалам WOMAC «боль», «скованность» и «физическая функция». Показатели безопасности в группах не различались [17].
В работе [20] показана эффективность БАД (ГлК + босвеллия + куркумин + гиалуроновая кислота + пиперин) у пациентов (n=30; средний возраст 54,4 года) с ОА коленного и тазобедренного суставов, болями в нижней части спины, с невыраженным болевым синдромом (4–5 баллов по численно-рейтинговой шкале). БАД назначалась per os в комплексе с физическими упражнениями в течение 30 дней. Терапевтический эффект проявлялся в уменьшении выраженности болевого синдрома более чем на 50% (в среднем на 77,2%), на 7–10-й день от начала приема пациенты сообщали об ощущении гибкости и «эластичности» в суставах. За период наблюдения нежелательных явлений (НЯ) не наблюдалось.
В пилотном исследовании [26] продемонстрировано влияние перорального препарата, содержащего гиалуроновую кислоту, ХС, ГлК-II и гидролизованный кератин, на характеристики синовиальной жидкости и клинические показатели у 30 пациентов (средний возраст 63,1 года) с ОА коленного сустава. Изменения в синовиальной жидкости оценивали путем измерения индексов местного воспаления, уровня цитокинов IL-1β, -8, -6, -10 и GM-CSF. В группе пациентов, получавших пероральную добавку, наблюдалось статистически значимое улучшение клинических показателей по WOMAC, шкале Лекена, ВАШ боли, тогда как в контрольной группе существенных изменений обнаружено не было.
В наблюдательном открытом многоцентровом клиническом исследовании REDART [27] дана оценка эффективности пищевой добавки, содержащей гидролизованный желатин, ХС, ГС, ГлК-II и экстракты лекарственных растений, относительно уменьшения боли и улучшения функциональных возможностей у пациентов (n=130) с ОА коленного и тазобедренного суставов в течение 6 мес. В ходе исследования получено статистически значимое уменьшение выраженности боли, положительная динамика по WOMAC и шкале Лекена. НЯ не наблюдалось. Сделан вывод, что лечение пищевой добавкой значительно уменьшает боль и улучшает двигательную функцию у пациентов с ОА.
В экспериментальном исследовании [28] по внутрисуставному введению бычьего ГлК-II (массой менее 3 кДа) пациентам с ОА коленного сустава было показано, что используемый внутрисуставно ГлК-II способен индуцировать хондроциты вырабатывать гиалиновый хрящ, нормализовать репаративную функцию, препятствовать образованию фиброзной ткани. НЯ при внутрисуставном использовании ГлК-II не выявлено.
Заключение
Экспериментальные и клинические исследования подтверждают эффективность использования стандартизированных субстанций НК-II для ускорения регенерации хряща и уменьшения боли при ОА и субклинической дисфункции суставов. Проанализированные результаты исследований являются чрезвычайно многообещающими и подчеркивают необходимость проведения дальнейших контролируемых проспективных исследований для изучения всех положительных эффектов ЛП, содержащих коллаген, для лечения ОА.
Сведения об авторах:
Шавловская Ольга Александровна — д.м.н., профессор кафедры восстановительной медицины и реабилитации АНО ВО «МУВМ»; 105062, Россия, г. Москва, Фурманный пер., д. 8, стр. 2; ORCID iD 0000-0003-3726-0730.
Бокова Ирина Анатольевна — к.м.н., доцент кафедры восстановительной медицины, реабилитации и курортологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России; 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-1640-1605.
Романов Игорь Дмитриевич — врач-невролог, руководитель по научной и консультативной неврологической помощи ООО «МД Клиник»; 111674, Россия, г. Москва, ул. Дмитриевского, д. 11; ORCID iD 0000-0002-0756-7961.
Шавловский Никита Игоревич — ординатор 1-го года кафедры неврологии с курсом рефлексологии и мануальной терапии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2; ORCID iD 0000-0002-8673-3146.
Контактная информация: Шавловская Ольга Александровна, e-mail: shavlovskaya@1msmu.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.08.2022.
Поступила после рецензирования 05.09.2022.
Принята в печать 28.09.2022.
About the authors:
Olga A. Shavlovskaya — Dr. Sc. (Med.), Professor of the Department of Restorative Medicine and Rehabilitation, International University of Rehabilitation Medicine; 8/2, Furmanny lane, Moscow, 105062, Russian Federation; ORCID iD 0000-0003-3726-0730.
Irina A. Bokova — C. Sc. (Med.), Associate Professor of the Department of Restorative Medicine, Rehabilitation and Balneology, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8/2, Trubetskaya, Moscow, 119991, Russian Federation; ORCID iD 0000-0002-1640-1605.
Igor D. Romanov — neurologist, Head of Scientific and Advisory Neurological Care, MD Clinic LLC; 11, Dmitrievsky str., Moscow, 111674, Russian Federation; ORCID iD 0000-0002-0756-7961.
Nikita I. Shavlovsky — 1st year resident of the Department of Neurology with a Faculty of Reflexology and Manual Therapy, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-8673-3146.
Contact information: Olga A. Shavlovskaya, e-mail: shavlovskaya@1msmu.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 11.08.2022.
Revised 05.09.2022.
Accepted 28.09.2022.
2. Elango J., Hou C., Bao B. et al. The Molecular interaction of collagen with cell receptors for biological function. Polymers (Basel). 2022;14(5):876. DOI: 10.3390/polym14050876.
3. Myllyharju J., Kivirikko K.I. Collagens and collagen-related diseases. Annals of Medicine. 2001;33(1):7–21. DOI: 10.3109/07853890109002055.
4. Шавловская О.А. Место препаратов SYSADOA в лечении дегенеративно-дистрофических заболеваний суставов в неврологической практике с позиции доказательной медицины. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022;122(3):30–37. DOI: 10.17116/jnevro202212203130. [Shavlovskaya O.A. SYSADOA place in degenerative-dystrophic joints diseases treatment of neurological practice from the standpoint of evidence-based medicine. S.S. Korsakov Journal of Neurology and Psychiatry. 2022;122(3):30–37. (in Russ.)]. DOI: 10.17116/jnevro202212203130.
5. Harris R.B., Fonseca F.L.A., Sharp M.H., Ottinger C.R. Functional characterization of undenatured type II collagen supplements: Are they interchangeable? J Diet Suppl. 2021;116. DOI: 10.1080/19390211.2021.1931621.
6. Громова О.А., Торшин И.Ю., Лила А.М., Шавловская О.А. О перспективах использования неденатурированного коллагена II типа в терапии остеоартрита и других заболеваний суставов. Современная ревматология. 2022;16(4):111–116. DOI: 10.14412/1996-7012-2022-4-111-116. [Gromova O.A., Torshin I.Yu., Lila A.M., Shavlovskaya O.A. On the prospects for the use of undenatured type II collagen in the treatment of osteoarthritis and other joint diseases. Modern Rheumatology Journal. 2022;16(4):111–116 (in Russ.)]. DOI: 10.14412/1996-7012-2022-4-111-116.7. Elango J., Sanchez C., de Val J.E.M.S. et al. Cross-talk between primary osteocytes and bone marrow macrophages for osteoclastogenesis upon collagen treatment. Sci Rep. 2018;8(1):5318. DOI: 10.1038/s41598-018-23532-x.
8. Николаева Т.И., Шеховцов П.В. Гидролизаты коллагена в профилактике и лечении заболеваний суставов. Фундаментальные исследования. 2014;12(3):524–528. [Nikolaeva T.I., Shekhovtsov P.V. Hydrolysates of collagen concerning prevention and healing joint diseases. Fundamental research. 2014;12(3):524–528 (in Russ.)].
9. Barati M., Jabbari M., Navekar R. et al. Collagen supplementation for skin health: A mechanistic systematic review. J Cosmet Dermatol. 2020;19(11):2820–2829. DOI: 10.1111/jocd.13435.
10. Kirchner M., Deng H., Xu Y. Heterogeneity in proline hydroxylation of fibrillar collagens observed by mass spectrometry. PLoS ONE. 2021;16(8): e0250544. DOI: 10.1371/journal.pone.0250544.
11. Тябут Т.Д., Кундер Е.В., Буглова А.Е., Руденко Е.В. Возможности применения комплексных природных препаратов у пациентов с остеоартритом (Фредулекс). Рецепт. 2021;24(1):78–89. DOI: 10.34883/PI.2021.24.1.007. [Tyabut T., Kundzer A., Buhlova A., Rudenka A. Possibilities of using complex natural medicines in patients with osteoarthritis (Fredulex). Recipe. 2021;24(1):78–89 (in Russ.)]. DOI: 10.34883/PI.2021.24.1.007.
12. Wang H. A Review of the effects of collagen treatment in clinical studies. Polymers (Basel). 2021;13(22):3868. DOI: 10.3390/polym13223868.
13. Stupin V., Manturova N., Silina E. et al. The Effect of Inflammation on the Healing Process of Acute Skin Wounds Under the Treatment of Wounds with Injections in Rats. J Exp Pharmacol. 2020;12:409–422. DOI: 10.2147/JEP.S275791.
14. Leon-Lopez A., Perez-Marroquin X.A., Campos-Lozada G. et al. Characterization of whey-based fermented beverages supplemented with hydrolyzed collagen: antioxidant activity and bioavailability. Foods. 2020;9(8):1106. DOI: 10.3390/foods9081106.
15. León-López A., Morales-Peñaloza A., Martínez-Juárez V.M. et al. Hydrolyzed collagen-sources and applications. Molecules. 2019;24(22):4031. DOI: 10.3390/molecules2422403.
16. Garcia-Coronado J.M., Martinez-Olvera L., Elizondo-Omana R.E. et al. Effect of collagen supplementation on osteoarthritis symptoms: a meta-analysis of randomized placebo-controlled trials. Int Orthop. 2019;43(3):531–538. DOI: 10.1007/s00264-018-4211-5.
17. Lugo J.P., Saiyed Z.M., Lane N.E. Efficacy and tolerability of an undenatured type II collagen supplement in modulating knee osteoarthritis symptoms: a multicenter randomized, double-blind, placebo-controlled study. Nutr J. 2016;15:14. DOI: 10.1186/s12937-016-0130-8.
18. Aguirre-Cruz G., León-López A., Cruz-Gómez V. et al. Collagen hydrolysates for skin protection: oral administration and topical formulation. Antioxidants (Basel). 2020;9(2):181. DOI: 10.3390/antiox9020181.
19. Schwartz S.R., Hammon K.A., Gafner A. et al. Novel hydrolyzed chicken sternal cartilage extract improves facial epidermis and connective tissue in healthy adult females: a randomized, double-blind, placebo-controlled trial. Altern Ther Health Med. 2019;25(5):12–29. PMID: 31221944.
20. Шавловская О.А. Оценка эффективности и безопасности комплексного воздействия физических нагрузок с БАД Картилокс при болевом синдроме. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2022;99(4):20–28. DOI: 10.17116/kurort20229904120. [Shavlovskaya O.A. Complex effects of physical exertion with dietary supplements Cartilox in pain syndrome effectiveness and safety evaluation. Problems of balneology, physiotherapy and exercise therapy. 2022;99(4):20–28 (in Russ.)]. DOI: 10.17116/kurort20229904120.
21. Volpi P., Zini R., Erschbaumer F. et al. Effectiveness of a novel hydrolyzed collagen formulation in treating patients with symptomatic knee osteoarthritis: a multicentric retrospective clinical study. Int Orthop. 2021;45(2):375–380. DOI: 10.1007/s00264-020-04616-8.
22. Selistre L., Goncalves G., Vasilceac F. The relationship between urinary C-Telopeptide fragments of type II collagen, knee joint load, pain, and physical function in individuals with medial knee osteoarthritis. Braz J Phys Ther. 2021;25(1):62–69. DOI: 10.1016/j.bjpt.2020.02.002.
23. Kviatkovsky S.A., Hickner R.C., Ormsbee M.J. Collagen peptide supplementation for pain and function: is it effective? Curr Opin Clin Nutr Metab Care. 2022;25(6):401–406. DOI: 10.1097/MCO.0000000000000870.
24. Bakilan F., Armagan O., Ozgen M. et al. Effects of native type II collagen treatment on knee osteoarthritis: a randomized controlled trial. Eurasian J Med. 2016;48(2):95–101. DOI: 10.5152/eurasianjmed.2015.15030.
25. Yatish R., Naveenkumar L., Bilagi A., Joshi D. Evaluation of clinical efficacy of undenatured type II collagen in the treatment of osteoarthritis of knee. A randomized controlled study. International Journal of Orthopaedics Sciences. 2020;6(2):497–500. DOI: 10.22271/ortho.2020.v6.i2h.2089.
26. Oliviero F., Ramonda R., Hoxha A. et al. Effect of an oral preparation containing hyaluronic acid, chondroitin sulfate, hydrolyzed collagen type II and hydrolyzed keratin on synovial fluid features and clinical indices in knee osteoarthritis. A pilot study. Reumatismo. 2020;72(3):125–130. DOI: 10.4081/reumatismo.2020.1272.
27. Puigdellivol J., Comellas Berenger C., Perez Fernandez M.A. et al. Effectiveness of a dietary supplement containing hydrolyzed collagen, chondroitin sulfate, and glucosamine in pain reduction and functional capacity in osteoarthritis patients. J Diet Suppl. 2019;16(4):379–389. DOI: 10.1080/19390211.2018.1461726.
28. De Luca P., Colombini A., Carimati G. et al. Intra-articular injection of hydrolyzed collagen to treat symptoms of knee osteoarthritis. A functional in vitro investigation and a pilot retrospective clinical study. J Clin Med. 2019;8(7):975. DOI: 10.3390/jcm8070975.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
