α-Глицерофосфохолин в восстановлении ментальных способностей после церебральных ишемических атак. Итальянское многоцентровое клиническое исследование (реферат)
Рубрика:
Неврология
Цель исследования: исследовать клиническую эффективность и переносимость α-глицерофосфохолина (α-GPC),
лекарственного препарата, способного обеспечить высокие уровни холина в нервных клетках головного мозга и защиту их стенок.
Материал и методы: в ходе клинического открытого многоцентрового исследования с участием 2044 пациентов, недавно перенесших инсульты или транзиторные ишемические атаки, препарат α-GPC вводили внутримышечно в течение 28 дней после атаки в суточной дозе 1000 мг и перорально в дозе 400 мг 3 р./сут в течение следующих 5 мес. после первого этапа исследования.
Оценка эффективности психического выздоровления производилась с помощью шкалы Мэтью (MS) во время внутримышечного введения лекарственного препарата, а также с использованием Краткой шкалы оценки психического статуса (MMST), Рейтинговой шкалы Кричтона (CRS) и Шкалы глобального ухудшения когнитивных функций (GDS) в течение последующего периода перорального приема препарата.
Результаты исследования: средний показатель по MS существенно повысился на 15,9 пункта за 28 дней (p<0,001) — с 58,7 до 74,6. В конце 5-месячного перорального приема значение CRS значительно уменьшилось — на 4,3 пункта, с 20,2 до 15,9 (p<0,001); средний показатель по MMST существенно повысился (p<0,001) — с 21 до 24,3 в конце исследования, достигнув оценки «норма» на 3-м мес. исследования. Оценка по GDS в конце исследования соответствовала значению «отсутствие снижения когнитивной способности» или «забывчивость» у 71% пациентов. Жалобы на возникновение неблагоприятных явлений отмечены у 44 пациентов (2,14%); в случаях с 14 пациентами (0,7%) исследователь предпочел досрочно прекратить терапию.Наиболее частыми жалобами были изжога (0,7%), тошнота/рвота (0,5%), бессонница/состояние возбуждения (0,4%) и головная боль (0,2%).
Выводы: исследование подтверждает терапевтическую роль препарата α-GPC в когнитивном восстановлении пациентов с острым инсультом или ТИА, а низкий процент возникновения неблагоприятных явлений подтверждает превосходную переносимость данного препарата.
Ключевые слова: острое церебральное ишемическое событие, ТИА, инсульт, нарушения памяти, деменция, психическое состояние, альфа-глицерофосфохолин (α-GPC).
лекарственного препарата, способного обеспечить высокие уровни холина в нервных клетках головного мозга и защиту их стенок.
Материал и методы: в ходе клинического открытого многоцентрового исследования с участием 2044 пациентов, недавно перенесших инсульты или транзиторные ишемические атаки, препарат α-GPC вводили внутримышечно в течение 28 дней после атаки в суточной дозе 1000 мг и перорально в дозе 400 мг 3 р./сут в течение следующих 5 мес. после первого этапа исследования.
Оценка эффективности психического выздоровления производилась с помощью шкалы Мэтью (MS) во время внутримышечного введения лекарственного препарата, а также с использованием Краткой шкалы оценки психического статуса (MMST), Рейтинговой шкалы Кричтона (CRS) и Шкалы глобального ухудшения когнитивных функций (GDS) в течение последующего периода перорального приема препарата.
Результаты исследования: средний показатель по MS существенно повысился на 15,9 пункта за 28 дней (p<0,001) — с 58,7 до 74,6. В конце 5-месячного перорального приема значение CRS значительно уменьшилось — на 4,3 пункта, с 20,2 до 15,9 (p<0,001); средний показатель по MMST существенно повысился (p<0,001) — с 21 до 24,3 в конце исследования, достигнув оценки «норма» на 3-м мес. исследования. Оценка по GDS в конце исследования соответствовала значению «отсутствие снижения когнитивной способности» или «забывчивость» у 71% пациентов. Жалобы на возникновение неблагоприятных явлений отмечены у 44 пациентов (2,14%); в случаях с 14 пациентами (0,7%) исследователь предпочел досрочно прекратить терапию.Наиболее частыми жалобами были изжога (0,7%), тошнота/рвота (0,5%), бессонница/состояние возбуждения (0,4%) и головная боль (0,2%).
Выводы: исследование подтверждает терапевтическую роль препарата α-GPC в когнитивном восстановлении пациентов с острым инсультом или ТИА, а низкий процент возникновения неблагоприятных явлений подтверждает превосходную переносимость данного препарата.
Ключевые слова: острое церебральное ишемическое событие, ТИА, инсульт, нарушения памяти, деменция, психическое состояние, альфа-глицерофосфохолин (α-GPC).
G. Barbagallo Sangiorgi, M. Barbagallo, M. Giordano, M. Meli, R. Panzarasa
Institute of Internal Medicine and Geriatrics University of Palermo, Italy
Aim: to investigate clinical efficacy and the tolerability of α-glycerophosphocholine (α-GPC), a drug able to provide high levels of choline for the nervous cells of the brain and to protect their cell walls.
Patients and Methods: in a clinical open multicenter trial on 2044 patients suffering from recent stroke or transient ischemic attacks were include. α-GPC was administered after the attack at the daily dose of 1000 mg im for 28 days and orally at the dose of 400 mg tid during the following 5 months after the first phase. The evaluation of the efficacy on the psychic recovery was done by the Mathew Scale (MS) during the period of im drug administration, and using the Mini Mental State Test (MMST), the Crichton Rating Scale (CRS), and the Global Deterioration Scale (GDS) during the following period of oral administration.
Results: the MS mean increased 15.9 points in 28 days in a statistically significant way (p<0.001) from 58.7 to 74.6. At the end of the 5 month oral administration, the CRS mean significantly decreased 4.3 points, from 20.2 to 15.9 (p<0.001); the MMST mean significantly increased (p<0.001) from 21 to 24.3 at the end of the trial, reaching the “normality’’ score at the 3rd month assessment. The GDS score at the end of the trial corresponded to “no cognitive decline” or “forgetfulness” in 71% of the patients. Adverse events were complained of by 44 patients (2.14%); in 14(0.7%) the investigator preferred to discontinue therapy. The most frequent complaints were heartburn (0.7%), nausea-vomit (0.5%), insomnia-excitation (0.4%), and headache (0.2%).
Conclusion: the trial confirms the therapeutic role of α-GPC on the cognitive recovery of patients with acute stroke or TIA, and the low percentage of adverse events confirms its excellent tolerability.
Key words: acute cerebral ischemic event, TIA, stroke, dementia, mental state, α-glycerophosphocholine (α-GPC).
For citation: Barbagallo Sangiorgi G., Barbagallo M., Giordano M. et al. α-Glycerophosphocholine in the mental recovery of cerebral ischemic attacks. An Italian multicenter clinical trial (report) // RMJ. Medical Review. 2018. № 11. P. 15–20.
Представлены результаты итальянского многоцентрового клинического исследования, посвященного роли α-глицерофосфохолина в восстановлении ментальных способностей после церебральных ишемических атак.
Введение
У пациентов, перенесших острое церебральное ишемическое событие (ТИА, p-ТИА, инсульт), может развиться синдром, характеризующийся чувствительно-двигательным и, зачастую, когнитивным расстройством в зависимости от типа окклюзии и индивидуальной ответной реакции [1, 2].Как правило, второй причиной деменции считается цереброваскулярное расстройство, при этом случаи инсульта составляют 20–25% [3]. Термин «деменция» подразумевает изменение с течением времени психического состояния от одного уровня психического функционирования до более низкого. Причины повышенного риска развития деменции после инсульта все еще не вполне понятны: поражение различных областей мозга, каждая из которых отвечает за конкретные когнитивные функции, может привести к деменции только при наличии дополнительных факторов, или многофакторный механизм заболевания может быть обусловлен синергическим эффектом нескольких зон поражений. Проведены клинические испытания множества лекарственных препаратов для оценки возможности функционального восстановления пациентов.
К таким препаратам относится альфа-глицерофосфохолин (α-GPC) из группы доноров холина. Результы фармакокинетических и фармакологических исследований препарата показали, что у животных он влияет на интегративную нейронную функцию [4] и дозозависимо улучшает память и повышает способность к обучению [5, 6]. Проникая через гематоэнцефалический барьер, α-GPC непосредственно увеличивает синтез и высвобождение ацетилхолина и, являясь предшественником мембранных фосфолипидов, улучшает функции нейронных мембран [7–9].
В клинических исследованиях у здоровых волонтеров α-GPC помог предотвратить развитие нарушений памяти, вызываемое введением скополамина [10]. Кроме того, в ходе открытых и контролируемых клинических исследований [11–14] у значительного количества пациентов наблюдалось хорошее терапевтическое действие данного препарата на течение деменции, независимо от ее этиологии [15].
Целью настоящего исследования является оценка эффективности и переносимости α-GPC в устранении нейропсихических симптомов после острого инсульта.
Материал и методы
Дизайн экспериментов
Настоящее исследование представляло собой открытое многоцентровое неконтролируемое исследование с участием 176 лечебных центров терапевтического, гериатрического и неврологического профиля в Италии.Исследование проводили в два этапа общей продолжительностью 6 мес.: в ходе первой части исследования (в течение 28 дней, в основном стационарно) α-GPC вводили пациентам парентерально в дозе 1000 мг/сут, а в ходе второй части исследования (начиная с 29-го дня по 6-й мес. включительно) α-GPC назначали перорально в дозе 1200 мг/сут по 400 мг 3 р./сут.
Клиническое обследование проводили во время первого приема (исходный уровень), в конце первой части исследования (через 1 мес.) и через 3 и 6 мес.
В таблице 1 представлены параметры клинической оценки и время контроля.
Первая часть исследования (исходный уровень, 28-й день): клиническая оценка включала в себя сбор анамнеза пациента (только на исходном уровне), физикальное и неврологическое обследование, контроль артериального давления и сердечного ритма, показатели шкалы Мэтью и анализ крови.
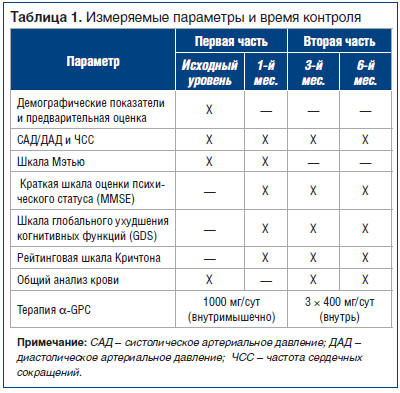
Вторая часть (28-й день, или второй исходный уровень, 3-й мес., 6-й мес.): клиническая оценка включала в себя физикальное и неврологическое обследование, показатели Краткой шкалы оценки психического статуса, Рейтинговой шкалы Кричтона и Шкалы глобального ухудшения когнитивных функций, контроль артериального давления и сердечного ритма, анализ крови.
Экспериментальный образец
В группу были включены 2058 пациентов в возрасте 45–85 лет, перенесшие в течение предыдущих 10 дней церебральные ишемические атаки (инсульт или ТИА).Критериями исключения из исследования были: показатель шкалы Мэтью <35 на исходном уровне исследования или расстройства сознания, исключающие возможность коммуникации, необходимой для оценки по протоколу; терапия психотропными или ноотропными препаратами; короткая ожидаемая продолжительность жизни; психические и неврологические заболевания в анамнезе; тяжелые заболевания почек, печени или сердца и новообразования. Кроме того, из исследования исключали пациентов с геморрагическим инфарктом, травмой головы, внутримозговым или субарахноидальным кровоизлиянием, а также алкоголизмом и/или наркоманией.
Сопутствующая терапия
Лечение инсульта проводили традиционным методом; сопутствующую терапию другими препаратами, влияющими на мозг, исключили. Терапию, которая требовалась пациентам по поводу других заболеваний, на протяжении 6 мес. исследования не изменяли. Анксиолитики короткого действия назначали в дозах, которые в течение 30 дней были полностью стабилизированы, данные заносили в карты пациентов.Прекращение лечения и побочные действия
Исследователи могли в любое время прекратить лечение с обязательной отметкой об этом в карте пациента, особенно если причиной такого прекращения явилось возникновение побочного действия, отмеченного самим пациентом или обнаруженного исследователем, которое можно было связать с приемом исследуемого препарата.Статистический анализ
Данные исследования выражали в виде значения ± стандартное отклонение (SD). Статистический анализ проводился Службой медицинской статистики (Кастелланца, провинция Варесе, Италия); для анализа непрерывных переменных использовали параметрические тесты, а для оценки эффективности препарата — непараметрические тесты (критерий Фридмана, квадратичное отклонение χ2).Результаты
Демографические характеристики
В общей сложности для исследования отобрали 2058 пациентов с ишемическими атаками. Критериям включения/исключения не соответствовали 14 пациентов, которых не учитывали в статистическом анализе. Причины исключения: возрастные ограничения (2 пациента), расхождение диагноза (2 пациента), неприемлемая доза препарата (1 пациент) и низкие показатели шкалы Мэтью (9 пациентов). Характеристики остальных 2044 пациентов представлены в таблице 2.
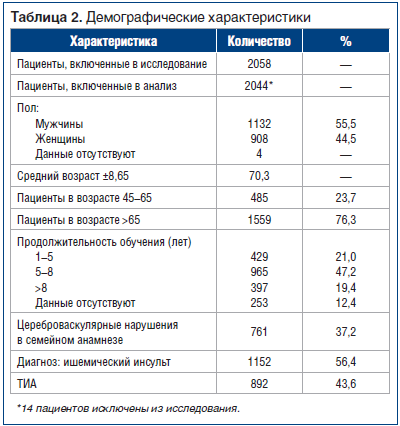
В исследовании приняли участие мужчины и женщины (55,5 и 44,5%соответственно). Средний возраст составил 70,3 года (485 пациентов (23,7%) в возрасте 45–65 лет; 1559 пациентов (76,3%) в возрасте 66–85 лет). Около 50% пациентов имели среднее образование с продолжительностью обучения 5–8 лет, примерно по 20% имели начальное или высшее образование. 1152 пациента (56,4%) перенесли ишемический инсульт и 892 (43,9%) — ТИА. Прекратили участие в исследовании 73 пациента (3,55%), 41 пациент умер (1,99%), нежелательные явления наблюдались у 14 пациентов (0,68%).
Большинство пациентов, включенных в исследование, имели сопутствующие заболевания, как показано в таблице 3. Фактически у 1781 пациента (87,1%) имелись сопутствующие заболевания, связанные в основном с сердечно-сосудистой системой (72,4%) и метаболическими нарушениями (31,5%).
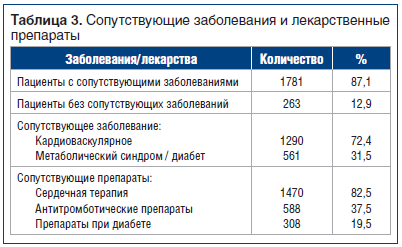
Помимо этого, 78,3% пациентов получали сопутствующую терапию, которая в большинстве случаев (82,5%) была представлена лекарственными препаратами для лечения сердечно-сосудистых заболеваний.
Первая часть исследования (дни 1–28)
Для оценки эффективности препарата α-GPC, который вводили внутримышечно (в/м) в течение первой части исследования (28 дней) в основном в больнице, использовали шкалу Мэтью; данная шкала имеет разметки от 0 (клиническая смерть) до 100 (пациент в совершенном сознании) [16]. В исследование включали пациентов с минимальным баллом 35 по шкале Мэтью, что соответствует уровню сознания, достаточному для проведения психометрических тестов.Изменения и средние значения оценки по этой шкале на исходном уровне и на 28-й день лечения отражены на рисунке 1 и в таблице 4. Среднее значение по шкале Мэтью увеличилось с 58,7 до 74,6, что соответствует 15,9 пункта (p<0,001).
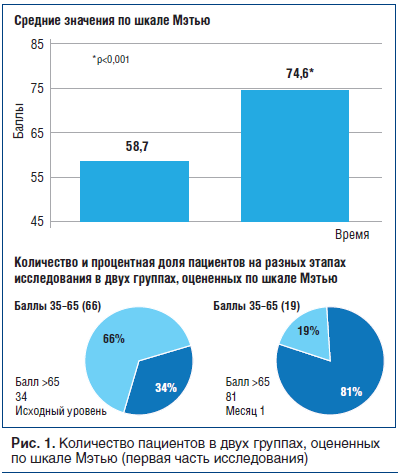
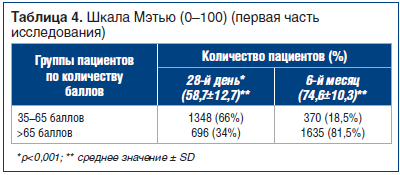
По принципу, использованному ранее в исследованиях Гельмерсом [17, 18], пациентов разделили на две группы: «с большей степенью ухудшения» (35–65 баллов) и «с меньшей степенью ухудшения» (>65 баллов). К концу первого этапа исследования улучшение состояния было отмечено у высокой процентной доли пациентов, которые перешли в категорию «с меньшей степенью ухудшения». Изменения эти были статистически значимыми (р<0,001).
Вторая часть исследования (дни 29–180)
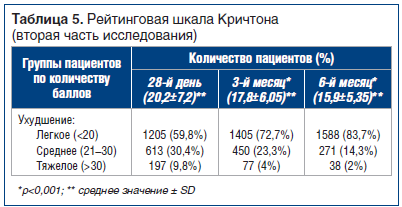
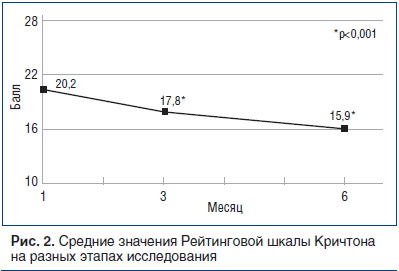
Для оценки эффективности препарата α-GPC во второй части исследования, в ходе которого пациенты принимали 400 мг перорально 3 р./сут (в основном амбулаторно), использовали Рейтинговую шкалу Кричтона (CRS) и Краткую шкалу оценки психического статуса (MMST). Оценку проводили в день изменения способа приема препарата (28-й день), а также на 3-й и 6-й мес. За «норму» принимали от 1 до 10 баллов по Рейтинговой шкале Кричтона [19], «легкое ухудшение» — 11–20 баллов, «умеренное ухудшение» — 21–30 баллов, «тяжелое ухудшение» — >30 баллов.Изменения среднего значения оценки пациентов в период между 28-м днем и последним визитом показаны в таблице 5 и на рисунке 2: значительное снижение (улучшение) — на 4,3 пункта, от 20,2 до 15,9. На рисунке 2 показано количество пациентов с баллом, соответствующим «легкому ухудшению»: их количество растет со временем, увеличиваясь с 72,7% на 3-м мес. до 83,7% на последнем визите (6-й мес.).
Когнитивные функции оценивали по Краткой шкале оценки психического статуса, где баллы от 0 до 23 обычно рассматривают как «аномальное ухудшение», а балл >23 — как «норму» [20]. Средние значения оценки со временем увеличились, показав повышение на 3-м мес. на 2,2 пункта (p<0,001) — выше балла, соответствующего норме, и на 1,1 пункта на 6-м мес. — до 24,3. Тенденция изменения средних значений представлена в таблице 6 и на рисунке 3.
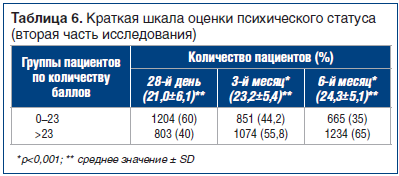
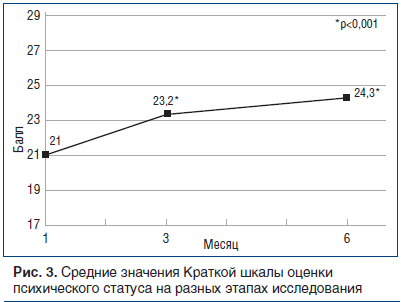
Кроме того, на рисунке 3 показан процент пациентов, у которых оценка изменилась с аномальной на нормальную: оценка повышается со временем — от 40% на 28-й день до 55,8% на 3-м мес. и до 65% на 6-м мес.
Степень глобального ухудшения оценивали с помощью Шкалы глобального ухудшения когнитивных функций (GDS) [21], где значение 0 означает норму, а 7 — тяжелое ухудшение. В таблице 7 и на рисунке 4 показаны тенденции изменения средних значений GDS. Средние значения уменьшились с 2,72 в начале второго этапа исследования до 2,16 в конце испытания; разница между средними баллами была статистически значимой (p<0,01).

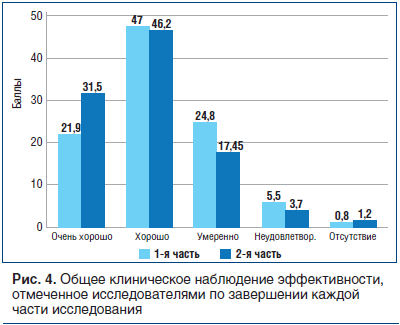
В конце каждой части испытания исследователей просили изложить их субъективные мнения об общей клинической эффективности и переносимости препарата α-GPC. На рисунке 4 представлены в процентном отношении мнения исследователей по завершении каждой части испытания.
68,9% (в первой части исследования) и 77,6% (во второй части) исследователей отметили эффективность как «очень хорошую»/«хорошую»; 24,8% (в первой части) и 17,5% (во второй части) – как «умеренную», а 6,3% (в первой части) и 4,9% (во второй части) — как «неудовлетворительную»/«отсутствие».
Системную переносимость препарата оценивали путем контроля артериального давления, частоты сердечных сокращений и анализа крови (общий анализ крови и исследование функции почек, печени).
Кроме того, пациентов наблюдали на предмет возникновения побочных эффектов, которые регистрировались при каждом контрольном визите. В ходе исследования каких-либо аномальных значений в анализах крови и других исследованиях не наблюдалось.
Выводы
Результаты исследования большей части пациентов с диагнозом острых церебральных ишемических атак подтверждают эффективное действие препарата α-GPC при восстановлении умственных способностей после инсульта.По завершении первой части исследования (в конце 1-го мес. парентеральной терапии препаратом α-GPC) отмечены очень хорошие результаты как по переносимости, так и по эффективности: по шкале Мэтью зарегистрирован средний балл, эквивалентный менее выраженному ухудшению неврологического состояния (>65), отмечена хорошая переносимость: 34 случая осложнений (1,66%) и 10 случаев выхода пациентов из исследования (0,49%).
В течение следующих 5 мес. пероральной терапии улучшение сохранялось, а дальнейшее улучшение когнитивных функций статистически оценивалось по Краткой шкале оценки психического статуса, поведенческих функций — по Рейтинговой шкале Кричтона и медицинских показаний, связанных со снижением когнитивных функций, — по Шкале глобального ухудшения когнитивных функций.
Отмечена очень хорошая переносимость и во второй части исследования: 17 случаев осложнений (0,33%) и 4 случая выхода пациентов из исследования (0,2%).
Эти данные подтверждают эффективность и терапевтическую роль препарата α-GPC в улучшении когнитивных функций у большей части пациентов с острыми цереброваскулярными атаками (инсульт и/или ТИА): крайне редкие случаи возникновения побочных явлений подтверждают, что прием α-GPC в течение длительного периода после возникновения инсульта является
безопасным.
Реферат подготовлен по материалам статьи:
Barbagallo Sangiorgi G., Barbagallo M., Giordano M. α-Glycerophosphocholine in the mental recovery of cerebral ischemic attacks. An Italian multicenter clinical trial // Ann N Y Acad Sci. 1994. Vol. 30. № 717. P. 253–269.
Литература
1. Loeb C. La diagnosi di attacco ischemic-transitorio: una diagnosi facile? // Aggiornamento del medico.1986. Vol. 10(2). P. 86–89.
2. Stazi C.F., Carpinte RI F., Stazi F. Ictus cerebrale: dall’etiologia alla terapia // Clin. Ter. 1986. Vol. 18. P. 433–447.
3. Tatemichi T.K., Foulkesj М.А., Mohrj Р. et al. Dementia in stroke survivors in the stroke data bank cohort // Stroke. 1990. Vol. 21(6). P. 858–866.
4. Schetiini G., Ventrat С., Floriom Т. et al. Molecular mechanisms mediating the effect of a-glycerylphosphorylcholine, a new cognition-enhancing drug, on behavioral and biochemical parameters in young and aged rats // Pharmacol. Biochem. Behavior. 1992. Vol. 43. P. 139–151.
5. Govoni S., Lopezf С., Baitaini F. et al. Effetti di alfa-GFC sul comportamento di evitamento passivo del ratto e sui livelli di acetilcolina // Basi Raz. Ter. 1990. Vol. 20(1). P. 55–60.
6. Drago F., Nardov L., Freni V. et al. Effetti comportamentali di a-GFC in modelli di invecchiamento cerebrale patologico // Basi Raz. Ter. 1990.Vol. 20(1). P. 65–48.
7. Spano P.F., Trabucch М. Farmacocinetica e metabolismo di 14c colina alfoscerato nel ratto // Basi Raz. Ter. 1990. Vol. 20(1).
8. Missale C., Sigala S., Spano P.F. Effetto modulatore di a-GFC sulla trasmissione colinergica nell’ippocampo di ratto // Basi Raz. Ter. 1990. Vol. 10(1). P. 13–15.
9. Amenta F., Bronzettmi Е., Delvalle М. et al. Neuroanatomia dell’invecchiamento cerebrale nell’animale da esperimento: effetto del trattamento con a-GFC // Basi Raz. Ter. 1990. Vol. 20(1). P. 31–38.
10. Canal N., Franceschi М., Alberon М. et al. Effetto di a-GFC sulla amnesia causata da scopolamina // Basi Raz. Ter. 1990. Vol. 20(1). P. 75–78.
11. Moglia A., Bergonzoli S., De Moliner Р. Effetto di a-GFC nel modificare il brain mapping in pazienti con Age Associated Memory Impairment (AAMI) // Basi Raz. Ter. 1990. Vol. 20(1). P. 83–89.
12. Bassi S., Albizzatri M.G., Piolti L., Frattola L. Esperienza clinica con colina alfoscerato in pazienti affetti da demenza degenerativa primaria e multiinfartuale. Gnosis. 1990. Vol. 5. P. 55–62.
13. Di Perrir G., Coppolal A., Ambrosioa L.А. et al. A multicentre trial to evaluate the efficacy and tolerability of a-glycerylphosphoryohcline versus cytidine diphosphocholine in patients with vascular dementia // J. Int. Med. Res. 1991. Vol. 19. P. 330–341.
14. Frattola L., Pioltis R., Bassi M. et al. Multicenter clinical comparison of the effects of choline alphoscerate and cytidine diphosphocholine in the treatment of multiinfarct dementia // Curr. Ther. Res. 1991. Vol. 49(4). P. 683–693.
15. Bant A., Panzarassa R., Borra D. et al. Choline alphoscerate in elderly patients with cognitive decline due to dementing illness. New trends // Clin. Neuropharmacol. 1991. Vol. 5(3/4). P. 1–35.
16. Mathew N.T., Meyer J.S., Rivera V.M. et al. Double blind evaluation of glycerol therapy in acute cerebral infarction // Lancet. 1972. Vol. 23. P. 77–91.
17. Gelmersh J.K., Gorter C.J., De Weerdt J. et al. A controlled trial of nimodipine in acute ischemic stroke // N. Engl. J. Med. 1988. Vol. 318(4). P. 203–207.
18. Gelmersh J.K., Gorter C., De Weerdt J. et al. Assessment of intraobserver variability in a Dutch multicenter study on acute ischemic stroke // Stroke. 1988. Vol. 19(6). Р. 709–711.
19. Guy W. ECDEU Assessment Manual for Psychopharmacology. Revised 1976. Department of Health, Education and Welfare Publication (ADM) P. 76338.
20. Folstein M.F. The Mini Mental State Examination. In Assessment in Geriatric Psychopharmacology. T. Crook, S. Ferris, R. Barbus, Eds. Mark Powley Ass., Inc. 1983. New Canaan, Conn.
21. Reisberg B., Ferrism S.H., De Leon J., Crook Т. The Global Deterioration Scale (GDS). An instrument for the assessment of primary degenerative dementia (PDD) // Am. J. Psych. 1982. Vol. 139. P. 1136–1139.
2. Stazi C.F., Carpinte RI F., Stazi F. Ictus cerebrale: dall’etiologia alla terapia // Clin. Ter. 1986. Vol. 18. P. 433–447.
3. Tatemichi T.K., Foulkesj М.А., Mohrj Р. et al. Dementia in stroke survivors in the stroke data bank cohort // Stroke. 1990. Vol. 21(6). P. 858–866.
4. Schetiini G., Ventrat С., Floriom Т. et al. Molecular mechanisms mediating the effect of a-glycerylphosphorylcholine, a new cognition-enhancing drug, on behavioral and biochemical parameters in young and aged rats // Pharmacol. Biochem. Behavior. 1992. Vol. 43. P. 139–151.
5. Govoni S., Lopezf С., Baitaini F. et al. Effetti di alfa-GFC sul comportamento di evitamento passivo del ratto e sui livelli di acetilcolina // Basi Raz. Ter. 1990. Vol. 20(1). P. 55–60.
6. Drago F., Nardov L., Freni V. et al. Effetti comportamentali di a-GFC in modelli di invecchiamento cerebrale patologico // Basi Raz. Ter. 1990.Vol. 20(1). P. 65–48.
7. Spano P.F., Trabucch М. Farmacocinetica e metabolismo di 14c colina alfoscerato nel ratto // Basi Raz. Ter. 1990. Vol. 20(1).
8. Missale C., Sigala S., Spano P.F. Effetto modulatore di a-GFC sulla trasmissione colinergica nell’ippocampo di ratto // Basi Raz. Ter. 1990. Vol. 10(1). P. 13–15.
9. Amenta F., Bronzettmi Е., Delvalle М. et al. Neuroanatomia dell’invecchiamento cerebrale nell’animale da esperimento: effetto del trattamento con a-GFC // Basi Raz. Ter. 1990. Vol. 20(1). P. 31–38.
10. Canal N., Franceschi М., Alberon М. et al. Effetto di a-GFC sulla amnesia causata da scopolamina // Basi Raz. Ter. 1990. Vol. 20(1). P. 75–78.
11. Moglia A., Bergonzoli S., De Moliner Р. Effetto di a-GFC nel modificare il brain mapping in pazienti con Age Associated Memory Impairment (AAMI) // Basi Raz. Ter. 1990. Vol. 20(1). P. 83–89.
12. Bassi S., Albizzatri M.G., Piolti L., Frattola L. Esperienza clinica con colina alfoscerato in pazienti affetti da demenza degenerativa primaria e multiinfartuale. Gnosis. 1990. Vol. 5. P. 55–62.
13. Di Perrir G., Coppolal A., Ambrosioa L.А. et al. A multicentre trial to evaluate the efficacy and tolerability of a-glycerylphosphoryohcline versus cytidine diphosphocholine in patients with vascular dementia // J. Int. Med. Res. 1991. Vol. 19. P. 330–341.
14. Frattola L., Pioltis R., Bassi M. et al. Multicenter clinical comparison of the effects of choline alphoscerate and cytidine diphosphocholine in the treatment of multiinfarct dementia // Curr. Ther. Res. 1991. Vol. 49(4). P. 683–693.
15. Bant A., Panzarassa R., Borra D. et al. Choline alphoscerate in elderly patients with cognitive decline due to dementing illness. New trends // Clin. Neuropharmacol. 1991. Vol. 5(3/4). P. 1–35.
16. Mathew N.T., Meyer J.S., Rivera V.M. et al. Double blind evaluation of glycerol therapy in acute cerebral infarction // Lancet. 1972. Vol. 23. P. 77–91.
17. Gelmersh J.K., Gorter C.J., De Weerdt J. et al. A controlled trial of nimodipine in acute ischemic stroke // N. Engl. J. Med. 1988. Vol. 318(4). P. 203–207.
18. Gelmersh J.K., Gorter C., De Weerdt J. et al. Assessment of intraobserver variability in a Dutch multicenter study on acute ischemic stroke // Stroke. 1988. Vol. 19(6). Р. 709–711.
19. Guy W. ECDEU Assessment Manual for Psychopharmacology. Revised 1976. Department of Health, Education and Welfare Publication (ADM) P. 76338.
20. Folstein M.F. The Mini Mental State Examination. In Assessment in Geriatric Psychopharmacology. T. Crook, S. Ferris, R. Barbus, Eds. Mark Powley Ass., Inc. 1983. New Canaan, Conn.
21. Reisberg B., Ferrism S.H., De Leon J., Crook Т. The Global Deterioration Scale (GDS). An instrument for the assessment of primary degenerative dementia (PDD) // Am. J. Psych. 1982. Vol. 139. P. 1136–1139.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
