Опыт применения системного препарата пиримидинового ряда в комплексной терапии трофических язв нижних конечностей
Нарушения трофики являются частым спутником многих заболеваний и могут возникать из-за патологии микроциркуляторного русла, особенностей нервной регуляции, гипоксии, воспалительного процесса, органной недостаточности, а также обменных нарушений и злокачественного перерождения тканей. При лечении трофических язв применяют как методы, направленные на ликвидацию основного этиологического фактора и удаление нежизнеспособных тканей, так и средства, предотвращающие развитие осложнений и улучшающие регенерацию тканей. Работа выполнена на клинических базах Приволжского исследовательского медицинского университета. В качестве пилотного исследования представлены клинические примеры комплексной терапии длительно существующих трофических дефектов двух больных сахарным диабетом со стажем заболевания более 5 лет и одной пациентки с гангренозной пиодермией. Во всех случаях на фоне присоединения к комплексной терапии препарата пиримидинового ряда гидроксиэтилдиметилдигидропиримидина (таблетки, 250 мг) регистрировалась отчетливая положительная динамика в виде уменьшения воспалительного процесса, закрытия язвенного дефекта, эпителизации. Полиэтиологичные язвы могут сохраняться длительное время на фоне многокомпонентной терапии и даже прогрессировать. Препарат гидроксиэтилдиметилдигидропиримидина обладает комплексным действием, позволяющим достичь лучшего клинического эффекта за счет купирования воспалительного процесса, улучшения микроциркуляции и стимуляции регенерации тканей вне зависимости от этиологии язвенного дефекта и комбинации препаратов, применяемых параллельно. С учетом механизма действия препарата он может быть рекомендован к использованию специалистами различного профиля.
Ключевые слова: трофические язвы, язвенный дефект, гидроксиэтилдиметилдигидропиримидин, препарат пиримидинового ряда, нарушения трофики, регенерация тканей.
Для цитирования: Петрова К.С., Немирова С.В., Карпенко А.А., Пройдакова Е.В., Щенникова Н.К. Опыт применения системного препарата пиримидинового ряда в комплексной терапии трофических язв нижних конечностей. РМЖ. Медицинское обозрение. 2022;30(7):36-41.
Case history of a systemic pyrimidine derivative in the complex therapy of trophic ulcers of the lower extremities
K.S. Petrova1, S.V. Nemirova1, A.A. Karpenko1, E.V. Proydakova2, N.K. Schennikova1
1Volga Research Medical University, Nizhny Novgorod
2Lobachevsky State University of Nizhny Novgorod, Nizhny Novgorod
Trophic disturbances are a common companion of many diseases and can occur due to the pathology of the microcirculatory bed, neural regulation patterns, hypoxia, inflammatory process, organ failure, as well as metabolic disorders and malignant tissue degeneration. In the treatment of trophic ulcers, both methods aimed at eliminating the main etiological factor and removing non-viable tissues are used, as well as means that prevent the development of complications and improve tissue regeneration. The work was performed at the clinical bases of the Volga Research Medical University. Clinical examples of complex therapy aimed at persistent trophic defects of two diabetic patients with more than 5 years of disease course and one patient with pyoderma gangrenosum are presented in a pilot study. In all cases, during the prescription of the pyrimidine series of hydroxyethyl-dimethyl-dihydropyrimidine in the complex therapy (in tablets, 250 mg), a distinct positive tendency was recorded in t he form of a decrease in the inflammatory process, closure of the ulcerative defect, and epithelialization. Polyetiological ulcers can persist for a long time even during the multicomponent therapy with probability of progression. The preparation of hydroxyethyl-dimethyl-dihydropyrimidine has a complex effect that allows achieving a better clinical effect by the treatment of the inflammatory process, improving microcirculation and stimulating tissue regeneration, regardless of the ulcerative defect etiology and a combination of drugs used concomitantly. Given the drug mechanism of action, it can be recommended for use by specialists of various profiles.
Keywords: trophic ulcers, ulcerative defect, hydroxyethyl-dimethyl-dihydropyrimidine, pyrimidine derivative, trophic disturbances, tissue regeneration.
For citation: Petrova K.S., Nemirova S.V., Karpenko A.A. et al. Case history of a systemic pyrimidine derivative in the complex therapy of trophic ulcers of the lower extremities. RMJ. 2022;7:36–41.
Введение
Нарушения трофики являются частым спутником многих заболеваний и могут возникать из-за патологии микроциркуляторного русла, особенностей нервной регуляции, гипоксии, воспалительного процесса, органной недостаточности, а также обменных нарушений и злокачественного перерождения тканей. В литературе описаны самые разнообразные по этиологии эрозии и трофические язвы (ТЯ) различной локализации, распространенности и глубины поражения. Отмечается высокая частота трофических нарушений при венозной недостаточности — 0,7–4% язвенных поражений нижних конечностей [1]. В современной классификации хронических заболеваний вен СЕАР нашла отражение склонность венозных ТЯ к рецидивированию, маркированная C6r [2]. В обзоре J. Hafner et al. [3] дается информация о ТЯ, ассоциированных непосредственно с артериальной недостаточностью, и поражениях кожи, обусловленных синдромом Мортарелла. E. Shavit et al. [4] называют причиной трофических нарушений васкулиты разной этиологии. Также более высокому риску формирования ТЯ подвержены пациенты с нейротрофическими расстройствами [5]. Особенно часто ригидные к терапии и длительно незаживающие дефекты формируются при сахарном диабете: 19–34% пациентов могут иметь признаки диабетической стопы и ТЯ [6]. Большую нишу в формировании трофических дефектов кожи занимают дерматозы различной этиологии, в частности красный плоский лишай, невротические экскориации, бактериальные и вирусные инфекции кожи, чесотка, панникулиты, липоидный некробиоз и гангренозная пиодермия. Также к этиологическим факторам ТЯ относят аутоиммунные заболевания и паранеопластические процессы, в частности базальноклеточный и плоскоклеточный рак кожи [7].
Классификации распространенных заболеваний нередко относят трофические нарушения к одной из стадий общего процесса, демонстрируя их высокую встречаемость при прогрессировании заболевания, как, например, при хронической артериальной недостаточности, сахарном диабете и синдроме Рейно [8, 9]. Особенности локализации и морфологии ТЯ являются важным дифференциально-диагностическим признаком, тем более при наличии сочетанной патологии.
При лечении ТЯ применяют как методы, направленные на ликвидацию основного этиологического фактора [10] и удаление нежизнеспособных тканей, например, создание локального отрицательного давления [11], так и средства, предотвращающие развитие осложнений и улучшающие регенерацию тканей. В их числе назначают атравматические повязки, подобранные в зависимости от стадии процесса, системные и топические антибактериальные (АБ) препараты, ангио- и нейропротекторы, глюкокортикостероиды (ГКС) и нестероидные противовоспалительные средства, серебросодержащие и эпителизирующие препараты [12]. В сложных случаях, особенно при обширных и длительно существующих дефектах, в комплекс лечения включают дермопластику или пересадку культуры клеток. Множество способов лечения ТЯ косвенно свидетельствует как о полиэтиологичности патологического процесса, так и об отсутствии идеального метода устранения дефекта тканей.
Следует отметить, что при огромном многообразии топических эпителизирующих и ранозаживляющих средств, в том числе входящих в состав атравматических повязок, выбор системных препаратов, способствующих регенерации тканей вне зависимости от характера патологического процесса, крайне ограничен.
Системные препараты пиримидинового ряда, в частности гидроксиэтилдиметилдигидропиримидин в лекарственной форме «таблетки», относятся к средствам, стимулирующим процессы репаративной регенерации, и десятилетиями успешно применяются в комплексной терапии ТЯ, ожогов и гнойно-деструктивных воспалительных процессов различного генеза [13]. Механизмы действия этого препарата разнообразны и связаны с повышением фагоцитарной активности Т-лимфоцитов и неспецифической резистентности организма, стимуляцией эритро- и лейкопоэза, клеточных и гуморальных факторов защиты, противовоспалительным и антимикробным действием, а также нормализацией соотношения между содержанием фибриногена в крови и ее фибринолитической активностью. Последний эффект этого препарата способствует улучшению регионарной микроциркуляции, предупреждая формирование тромбозов на уровне мелких сосудов [14]. Суммарное действие гидроксиэтилдиметилдигидропиримидина в лекарственной форме «таблетки» (Ксимедон) таково, что он стимулирует заживление трофических дефектов и ран, оказывая противомикробный и противовоспалительный эффект.
Клинические наблюдения
Пациентка К., 69 лет, обратилась в клинику в связи с наличием длительно незаживающей ТЯ правой голени. Трофические нарушения появились более года назад, через сутки после долгого переезда, спровоцировавшего выраженное усиление отека нижних конечностей. В анамнезе — рецидивирующий тромбоз вен нижних конечностей, рецидивирующая тромбоэмболия легочных артерий, имплантация кава-фильтра. Ранее, 4 года назад, формировались язвы правой и левой голеней, но на фоне терапии в течение месяца эпителизировались. У пациентки были выявлены ишемическая болезнь сердца (II функциональный класс), гипертоническая болезнь 2-й степени, II стадия, риск 4, декомпенсированный сахарный диабет 2 типа с признаками диабетической микроангио- и полинейропатии, посттромботическая болезнь (ПТБ) обеих нижних конечностей, отечно-болевая форма. Постоянно проводилась гипотензивная, сахароснижающая и антикоагулянтная терапия, применялись нитраты и статины. С момента появления язвы осуществлялась ее санация 3% раствором перекиси водорода с последующим нанесением йодо- или серебросодержащих мазей, топических АБ-средств. Большое количество препаратов и их сочетание привели к формированию дерматита и выраженного воспалительного процесса с экземой и болевым синдромом, несколько уменьшившимся при использовании атравматических повязок. Неоднократно назначались курсы препаратов тиоктовой кислоты, депротеинизированный гемодериват крови телят.
На момент осмотра на нижних конечностях визуализировались телеангиоэктазии, ретикулярные и незначительно варикозно-измененные вены (вторичный варикоз на фоне ПТБ), отек голеней, больше справа (+3 см от уровня лодыжек), в области медиальной лодыжки — дефект кожных покровов 3,4×4,2 см с налетом фибрина и обильным отделяемым. Ткани вокруг язвы отечны, гиперемированы, экзематозно изменены. Пульсация на магистральных артериях определялась, имелись парестезии в виде чувства покалывания стоп, иногда — их онемения, жжения или снижения чувствительности; движения в суставах — в полном объеме, безболезненные; поперечное плоскостопие 1–2-й степени.
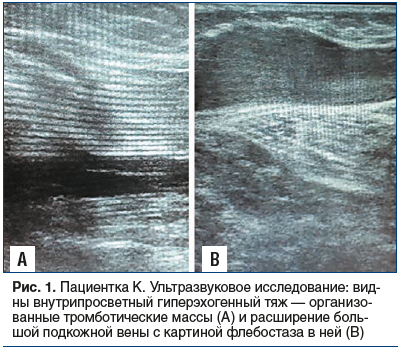
В ходе ультразвукового исследования выявлены симптомы ПТБ с наличием частичной реканализации ранее тромбированных вен с формированием внутрипросветных гиперэхогенных тяжей (рис. 1A), клапанной недостаточностью и вторичным варикозным расширением подкожных вен (рис. 1B).
Признаков очередного рецидива тромбоза выявлено не было. В общем анализе крови патологии не выявлено, нормокоагуляция, сахар крови 7,01 ммоль/л, гликированный гемоглобин 6,0%, креатинин 6,8 мкмоль/л.
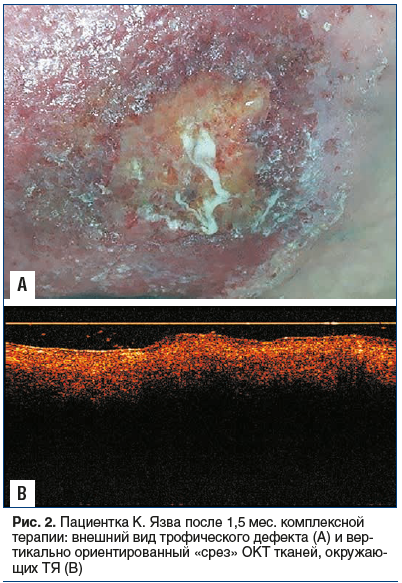
Пациентке были рекомендованы диосминсодержащие препараты, комбинированное топическое средство, содержащее анестетик и антибиотик, ношение компрессионного противоязвенного (двойного) трикотажа с надеванием наружного гольфа при нагрузке. На фоне терапии отмечены купирование болевого синдрома, отека и очищение язвы, однако ее размеры в течение 1,5 мес. практически не сокращались, на дне язвы имелись единичные вялые грануляции, сохранялось перифокальное воспаление с экзематозными изменениями, краевая эпителизация была незначительной (рис. 2А). При неинвазивной оптической когерентной томографии (ОКТ) тканей, окружающих ТЯ, также выявлялись признаки выраженного воспалительного процесса (рис. 2В).
На фоне продолжения указанной терапии пациентке был назначен курсовой прием гидроксиэтилдиметилдигидропиримидина в дозе 500 мг 3 р/сут курсом 2 нед.
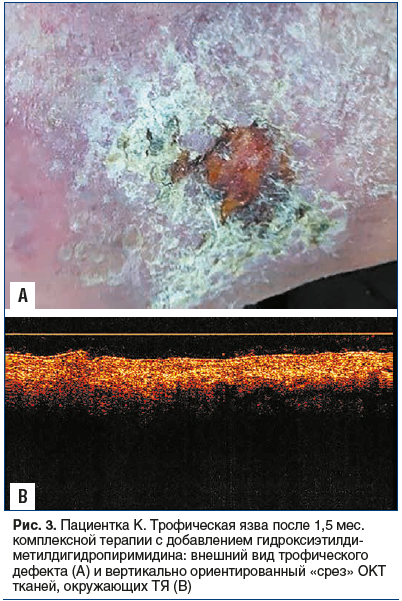
В ходе наблюдения отмечено постепенное купирование воспаления, появление активных грануляций с прогрессирующим нарастанием скорости эпителизации или «заживления под корочкой», сохраняющимся и после отмены препарата, несмотря на возрастание физической нагрузки и колебания уровня гликемии на фоне стресса (рис. 3А). При ОКТ тканей, окружающих ТЯ, отмечено значимое снижение выраженности оптических признаков воспаления (рис. 3В).
Пациентка И., 65 лет, обратилась в клинику по поводу длительно незаживающего язвенного дефекта кожи правой голени, появившегося около года назад после травмы голени. Со слов пациентки, образованию язвенных дефектов предшествовало появление пузырей. В анамнезе — сахарный диабет 2 типа, компенсированный за счет сахароснижающих препаратов, гипертоническая болезнь 2-й степени, II стадия, риск 4. Ранее возникали мелкие язвенные дефекты в области левой голени, которые постепенно эпителизировались самостоятельно. Консультирована сосудистым хирургом, патология вен нижних конечностей не выявлена. Неоднократно обращалась к дерматологу с жалобами на уплотнение кожи голеней. Установлен диагноз «липодерматосклероз».
Пациентка выполняла назначения врача, соблюдая диету с пониженным содержанием углеводов и принимая сахароснижающие и гипотензивные препараты. Наружно на язвенные дефекты самостоятельно накладывала топические АБ-средства и применяла облучение красным светом — без видимого положительного эффекта. Размеры язвенного дефекта увеличились за счет использования травматических повязок и трения обувью.
На момент первичного осмотра кожа обеих голеней была уплотнена, с трудом собиралась в складку, поверхность кожи — блестящая, отмечалось отсутствие придатков кожи. На задней поверхности нижней трети левой голени визуализировался очаг эритемы застойного фиолетово-розового цвета с относительно четкими границами размером около 15 см. В центре эритемы локализовались 2 сливающихся язвенных дефекта неправильной формы с ровными краями, дно которых было покрыто некротическими массами и гнойным налетом желтоватого цвета.
По данным ультразвукового исследования патологии вен нижних конечностей не выявлено. Общий анализ крови без патологии. Сахар крови 11,0 ммоль/л.
Пациентке проведена коррекция уровня гликемии, назначены системные АБ-препараты, средства, улучшающие микроциркуляцию, топические АБ- и эпителизирующие препараты в сочетании с диметилсульфоксидом (ДМСО) на кожу вокруг язвенных дефектов.
При повторном обращении пациентки через 3 мес. отмечено, что в течение этого времени площадь язвенных дефектов продолжала увеличиваться, в центре элементов формировались новые некротические наслоения, вокруг элементов появились признаки мокнутия и болезненные ощущения (рис. 4).
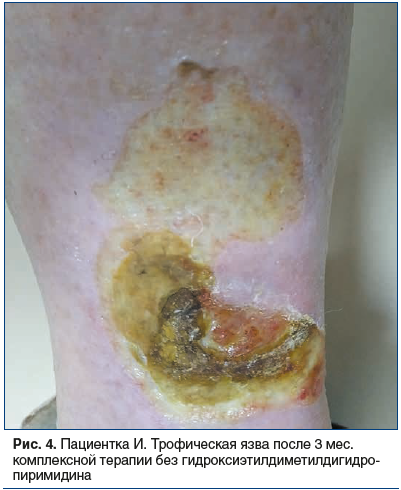
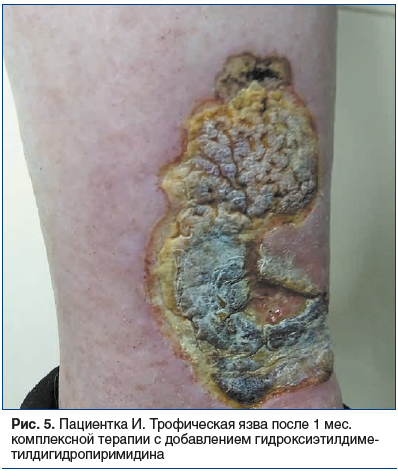
На фоне повторного курса указанной терапии пациентке был дополнительно назначен препарат гидроксиэтилдиметилдигидропиримидина в дозе 500 мг 2 р/сут в течение 4 нед. Отмечена положительная динамика: прекращение образования влажных некротических масс в области дна язвенных дефектов с формированием стабильной сухой корочки на поверхности очагов, начальные явления эпителизации (рис. 5), значительное снижение интенсивности болезненных ощущений.
Пациентка Н., 27 лет, обратилась к врачу с жалобами на наличие язвенных дефектов голени и выраженные болезненные ощущения. Дефекты появились 8 мес. назад на месте травмы кожи (натерла джинсами). Наличие хронических заболеваний отрицает. В анамнезе значительное повышение (в 2 раза) уровня тромбоцитов в общем анализе крови.
По поводу язвенных дефектов неоднократно консультирована хирургом, назначена стандартная терапия (системная АБ-терапия, местное применение левомеколя) — без эффекта. Язвенные дефекты продолжали увеличиваться по площади, болезненность в очагах усиливалась.
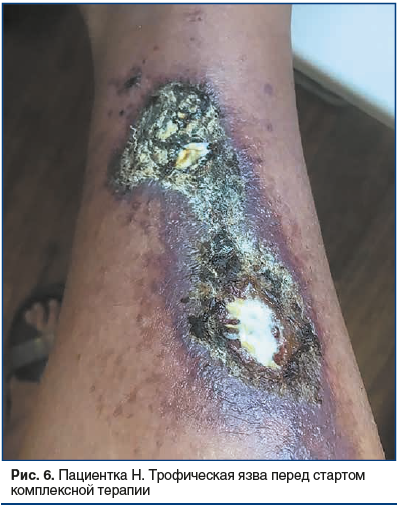
На момент первичного осмотра: трофические нарушения локализованы в области внутренней поверхности правой голени, где имеется очаг разлитой инфильтрированной эритемы застойного фиолетово-синюшного цвета с относительно четкими границами, размером около 20 см. По периферии центрального очага располагаются множественные мелкие участки эритемы округлой формы до 0,5 см. В центре очага расположены 2 крупных язвенных дефекта размером около 5 см, имеющих тенденцию к слиянию, покрытые слоистыми гнойно-геморрагическими корками коричневого цвета, в центре элементов располагаются гнойно-некротические массы желтоватого цвета (рис. 6).
По данным УЗИ патологии периферических сосудов не выявлено. В общем анализе крови: снижение уровня гемоглобина до 109 г/л и эритроцитов до 3,6×1012/л, нормальный уровень тромбоцитов и лейкоцитов без отклонений в лейкоцитарной формуле.
На основании данных анамнеза и клинического обследования заподозрена гангренозная пиодермия и рекомендован курс системных ГКС и АБ-препаратов широкого спектра действия, топические комбинированные ГКС и АБ-средства, топические препараты ДМСО, кератолитические средства с целью удаления роговых наслоений и корок, препятствующих эпителизации дефектов, а также топические эмоленты на кожу обеих голеней.
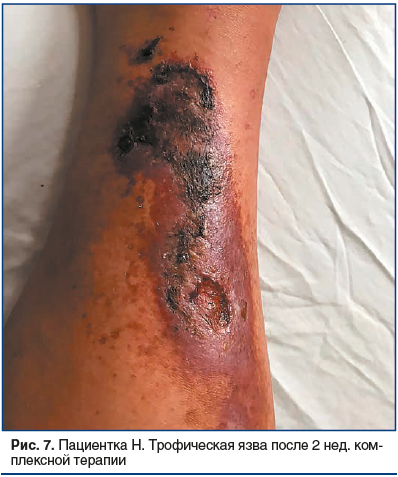
На фоне проведенной терапии через 2 нед. при очередном осмотре отмечалась положительная динамика с частичным очищением язвенных дефектов от корок и некротических масс, снижением выраженности воспалительных изменений в очаге (рис. 7).
Пациентке рекомендовано продолжение проводимой терапии с присоединением курса гидроксиэтилдиметилдигидропиримидина в дозе 500 мг 2 р/сут в течение 4 нед.
При очередных осмотрах через 2 и 4 нед. клинически отмечалось уменьшение глубины ТЯ, эпителизация мелких язвенных дефектов «под корочкой», формирование над язвенными дефектами стабильной сухой корки без признаков бактериального инфицирования (рис. 8).
Таким образом, во всех случаях на фоне присоединения к комплексной терапии препарата пиримидинового ряда гидроксиэтилдиметилдигидропиримидина регистрировалась отчетливая положительная динамика.
Обсуждение
Лечение ТЯ, несомненно, зависит от основной патологии, вызвавшей нарушение микроциркуляции и обмена веществ в области поражения. Так, некоторые методы нормализации гемодинамики, оптимальные при выраженной флебогипертензии [15], в частности ношение компрессионного трикотажа 3-го класса компрессии, противопоказаны при артериальной недостаточности c развитием язвенных дефектов. Терапия системного васкулита может включать ГКС [16], применения которых стараются избегать при ПТБ. Однако все ТЯ связаны с нарушением регенерации тканей и имеют высокий риск инфицирования, что обусловливает включение в комплекс терапии соответствующих препаратов. Множественность факторов, провоцирующих образование язвенных дефектов у одного пациента, а также одномоментное присутствие нескольких механизмов их образования нередко становятся причиной полипрагмазии и назначения нескольких препаратов, вступающих в нежелательные лекарственные взаимодействия, формирования клинических проявлений дерматита, еще больше усугубляющего трофические нарушения, что способствует прогрессированию ТЯ.
Представленные клинические примеры со сложными, ригидными к терапии ТЯ показали, что традиционная многокомпонентная терапия, несмотря на имеющийся положительный эффект, не всегда способствует прекращению роста и эпителизации язвенных дефектов.
Особенностью гидроксиэтилдиметилдигидропиримидина является комплексное воздействие, нивелирующее одновременно несколько элементов патогенеза развития ТЯ, в том числе воспалительный процесс, вне зависимости от исходной этиологии язвообразования. Несомненные преимущества гидроксиэтилдиметилдигидропиримидина в благоприятном профиле безопасности даже при совместном назначении с другими средствами, быстром появлении клинического эффекта с отчетливой регенерацией тканей вне зависимости от причин возникновения и патогенеза ТЯ, будь то диабетическая ангио- и нейропатия или ПТБ с прогрессирующей флебогипертензией на фоне диабетической микроангиопатии и ангиита.
Так как указанные группы пациентов могут попадать в поле зрения врачей разных специальностей, важна осведомленность клиницистов о многолетнем позитивном опыте применения препарата пиримидинового ряда при ТЯ самой разной этиологии, а также в лечении ожоговых и раневых дефектов [13].
Заключение
Длительно существующие, полиэтиологичные язвы могут сохраняться длительное время даже на фоне многокомпонентной терапии и прогрессировать. Препарат гидроксиэтилдиметилдигидропиримидина (Ксимедон) обладает комплексным действием, позволяющим достичь лучшего клинического эффекта за счет купирования воспалительного процесса, улучшения микроциркуляции и стимуляции регенерации тканей вне зависимости от этиологии язвенного дефекта и комбинации препаратов, применяемых параллельно. С учетом механизма действия препарата и его универсальности он может быть рекомендован к использованию специалистами различного профиля.
2. Lurie F., Passman M., Meisner M. et al. The 2020 update of the CEAP classification system and reporting standards. J Vasc Surg Venous Lymphat Disord. 2020;8(3):342–352. DOI: 10.1016/j.jvsv.2019.12.075.
3. Hafner J., Buset C., Anzengruber F. et al. Ulcus cruris: Die häufigen, makrovaskulären Ursachen [Leg ulcers (ulcus cruris): The frequent macrovascular causes]. Ther Umsch. 2018;75(8):506–514 (in German.). DOI: 10.1024/0040-5930/a001032.
4. Shavit E., Alavi A., Sibbald R.G. Vasculitis-What Do We Have to Know? A Review of Literature. Int J Low Extrem Wounds. 2018;17(4):218–226. DOI: 10.1177/1534734618804982.
5. American Diabetes Association. 11. Microvascular Complications and Foot Care: Standards of Medical Care in Diabetes-2019. Diabetes Care. 2019;42(Suppl 1):S124–S138. DOI: 10.2337/dc19-S011.
6. Armstrong D.G., Boulton A.J.M., Bus S.A. Diabetic Foot Ulcers and Their Recurrence. N Engl J Med. 2017;376(24):2367–2375. DOI: 10.1056/NEJMra1615439.
7. Shah M., Sachdeva M., Gefri A., Jfri A. Paraneoplastic pyoderma gangrenosum in solid organ malignancy: a literature review. Int J Dermatol. 2020;59(2):154–158. DOI: 10.1111/ijd.14637.
8. Lavery L.A., Oz O.K., Bhavan K., Wukich D.K. Diabetic Foot Syndrome in the Twenty-First Century. Clin Podiatr Med Surg. 2019;36(3):355–359. DOI: 10.1016/j.cpm.2019.02.002.
9. Haque A., Hughes M. Raynaud’s phenomenon. Clin Med (Lond). 2020;20(6):580–587. DOI: 10.7861/clinmed.2020-0754.
10. Marston W.A., Crowner J., Kouri A., Kalbaugh C.A. Incidence of venous leg ulcer healing and recurrence after treatment with endovenous laser ablation. J Vasc Surg Venous Lymphat Disord. 2017;5(4):525–532. DOI: 10.1016/j.jvsv.2017.02.007.
11. Liu S., He C.Z., Cai Y.T. et al. Evaluation of negative-pressure wound therapy for patients with diabetic foot ulcers: systematic review and meta-analysis. Ther Clin Risk Manag. 2017;13:533–544. DOI: 10.2147/TCRM.S131193.
12. N Amirrah I., Mohd Razip Wee M.F., Tabata Y. et al. Antibacterial-Integrated Collagen Wound Dressing for Diabetes-Related Foot Ulcers: An Evidence-Based Review of Clinical Studies. Polymers (Basel). 2020;12(9):2168. DOI: 10.3390/polym12092168. Полный список литературы Вы можете найти на сайте http://www.rmj.ru 13. Бесчастнов В.В., Измайлов С.Г., Ботяков А.А. и др. Антиоксидантная активность пиримидиновых производных при местном лечении гнойных ран мягких тканей (в эксперименте). Современные технологии в медицине. 2011;3:21–26. [Beschastnov V.V., Izmaylov S.G., Botyakov A.A. et al. Antioxidant activity of pyrimidine derivatives in local treatment of septic wounds of soft tissues (in an experiment). Sovremennyye tekhnologii v meditsine. 2011;3:21–26 (in Russ.)].
14. Доброквашин С.В., Измайлов А.Г., Шакирова Д.Х., Василькин Д.А. Применение препарата ксимедон в хирургической практике (Практические рекомендации). Казань, 2017. [Dobrokvashin S.V., Izmaylov A.G., Shakirova D.Kh., Vasil’kin D.A. The use of the drug xymedon in surgical practice (Practical recommendations). Kazan’, 2017 (in Russ.)].
15. Senet P., Monfort J.B., Debure C. Quelle compression veineuse utiliser en 2016 pour un ulcère de jambe ? [Compression therapy: Choosing the right option for leg ulcers in 2016]. J Mal Vasc. 2016;41(5):347–350 (in French.). DOI: 10.1016/j.jmv.2016.07.007.
16. Turska M., Parada-Turska J. [Cutaneous polyarteritis nodosa]. Wiad Lek. 2018;71(1 pt 1):73–77 (in Polish.).

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.