Энтеральное питание в периоперационной нутритивной поддержке и реабилитации при хирургическом лечении онкологических заболеваний
DOI: 10.32364/2587-6821-2021-5-3-137-144
Цель исследования: оценить эффективность периоперационной коррекции метаболических нарушений и полноту обеспечения энергопластических потребностей у онкологических больных при включении в состав программы нутритивной поддержки стандартных и специализированных стерилизованных смесей для энтерального питания.
Материал и методы: проведен анализ клинической эффективности энтерального питания в периоперационном периоде у онкологических больных с применением жидких стерилизованных смесей линии Нутриэн. Проанализированы результаты лечения 89 пациентов с новообразованиями ЖКТ, находившихся на лечении в хирургическом отделении и ОРИТ ФГБУ «ГВКГ им. Н.Н. Бурденко», ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ». До и после оперативного вмешательства проводилась персонифицированная метаболически направленная нутритивная поддержка. Оценивалась эффективность коррекции метаболических нарушений после операции на основании специализированных методов обследований.
Результаты исследования: после проведения предоперационной нутритивной поддержки отмечено достоверное повышение (среднегрупповые значения) содержания общего белка — 67,3±1,2 г/л, альбумина — 33,5±2,3 г/л, трансферрина — 1,5±0,11 г/л (р<0,05), абсолютного числа лимфоцитов — 969±39 109/л (р≤0,05). Во 2-й группе отмечено уменьшение числа больных со 2-й степенью недостаточности питания (на 8,3±1,71%, р<0,05), в 3-й группе количество больных с положительной динамикой разрешения питательной недостаточности меньше в сравнении со 2-й группой на 4,5±1,1% (р<0,05). В послеоперационном периоде у пациентов с сахарным диабетом, дыхательной недостаточностью, гнойно-септическими осложнениями, нуждавшихся в персонализированной нутритивной терапии специализированными смесями, нормализация показателей метаболизма была достигнута к 7–10-м суткам послеоперационного периода, что подтверждается нормализацией биохимических показателей, снижением потребности в энергии.
Заключение: результаты выполненного исследования по использованию смесей для энтерального питания в комплексе периоперационной нутритивной поддержки у онкологических пациентов показали высокую клиническую эффективность, возможность выбора смеси на основании конкретной клинической ситуации с учетом персонифицированной программы нутритивной поддержки.
Ключевые слова: нутритивная поддержка, фармаконутриенты, энтеральное питание, жидкие смеси.
Для цитирования: Арыкан Н.Г., Евдокимов Е.А., Стец В.В., Зырянов В.А., Журавлев А.Г., Шестопалов А.Е. Энтеральное питание в периоперационной нутритивной поддержке и реабилитации при хирургическом лечении онкологических заболеваний. РМЖ. Медицинское обозрение. 2021;5(3):137-144. DOI: 10.32364/2587-6821-2021-5-3-137-144.
N.G. Arykan1, E.A. Evdokimov2, V.V. Stets3, V.A. Zyryanov3, A.G. Zhuravlev1, A.E. Shestopalov2,3
1F.I. Inozemtsev City Clinical Hospital, Moscow, Russian Federation
2Russian Medical Academy of Continuous Professional Education, Moscow, Russian Federation
3Main Military Clinical Hospital named after N.N. Burdenko, Moscow, Russian Federation
Aim: to evaluate the efficacy of metabolic disorders perioperative correction and the completeness of providing macronutrients in cancer patients when standard and specialized sterilized mixtures for enteral nutrition are included in the nutritional support program.
Patients and Methods: the analysis of the enteral nutrition clinical efficacy during the perioperative period in cancer patients using Nutrien line liquid sterilized mixtures was carried out. The treatment results of 89 patients with GIT neoplasms who were treated in the surgical department and ICU of the Main Military Clinical Hospital named after N.N. Burdenko and the F.I. Inozemtsev City Clinical Hospital were analyzed. Personalized metabolic and nutritional support was provided before and after surgery. The effectiveness of metabolic disorders correction after surgery was evaluated on the basis of specialized examination methods.
Results: after preoperative nutritional support, there was a significant increase (average group values) in total protein — 67.3±1.2 g/L, albumin — 33.5±2.3 g/L, transferrin — 1.5±0.11 g/L (p<0.05), and the absolute WBC count — 969±39 109/L (p≤0.05). Group 2 showed a decrease in the number of patients with grade 2 nutritional deficiency (by 8.3±1.71%, p<0.05); group 3 — the number of patients with positive dynamics of nutritional deficiency resolution was less (by 4.5±1.1%, p<0.05). In the postoperative period, in patients with diabetes mellitus, respiratory insufficiency, purulent-septic complications, who required personalized nutritional therapy with specialized mixtures, normalization of metabolic parameters was achieved by the 7–10 days of the postoperative period, which was confirmed by normalization of biochemical parameters and a decrease in nutritive demand.
Conclusion: the study results on the use of enteral nutrition mixtures in the complex of perioperative nutritional support in cancer patients showed high clinical efficacy and provided the possibility of choosing a mixture based on a specific clinical situation, taking into account a personalized nutritional support program.
Keywords: nutritional support, pharmaconutrients, enteral nutrition, liquid mixtures.
For citation: Arykan N.G., Evdokimov E.A., Stets V.V. et al. Enteral nutrition in perioperative nutritional support and rehabilitation during surgical treatment of oncological diseases. Russian Medical Inquiry. 2021;5(3):137–144. DOI: 10.32364/2587-6821-2021-5-3-137-144.
Введение
Совершенствование организации и повышение эффективности клинического питания в комплексном лечении больных с различными заболеваниями является одной из важнейших задач современной медицины [1, 2].
Наиболее важное значение питательная недостаточность и нарушение питания на всех этапах многокомпонентного лечения (от предоперационного периода до реабилитации) имеют в онкохирургии. Актуальность проблемы нутритивной поддержки в онкохирургии обусловлена влиянием опухолевого процесса на организм и агрессивным воздействием современных методов лечения, обширными и травматичными хирургическими вмешательствами, химиолучевой терапией [2–9].
По данным отечественных и зарубежных авторов, частота развития питательной недостаточности у онкологических пациентов составляет 46–88%, с преимущественно первичной локализацией в области желудка, поджелудочной железы, пищевода — 79–83%. При поступлении в стационар нарушения питания у больных раком органов ЖКТ выявляются в 61–87% случаев, в т. ч. в 46% случаев — нарушения тяжелой степени [1,10–13].
В послеоперационном периоде в формировании белково-энергетической недостаточности и метаболических нарушений существенное значение имеет развитие синдрома гиперметаболизма-гиперкатаболизма, являющегося не только проявлением опухолевого процесса, но и неспецифическим синдромом острого системного воспалительного ответа на агрессию — хирургическое вмешательство. Следует также отметить, что нарушение функций ЖКТ в виде синдрома кишечной недостаточности (СКН), обусловленное характером и объемом оперативных вмешательств на органах ЖКТ, не только формирует и поддерживает метаболические нарушения, полиорганную недостаточность, но и является лимитирующим фактором энтерального питания [1, 4, 14–19].
В работах S.L. Lim [20], Р. Kabata et al. [6], исследовании AIOM [21] показана прямая зависимость между предоперационной питательной недостаточностью, неадекватной коррекцией метаболических нарушений и частотой послеоперационных гнойно-септических осложнений, длительностью пребывания в отделении реанимации и интенсивной терапии (ОРИТ) и стационаре, неблагоприятными клиническими исходами заболевания, высокой летальностью [19].
Результаты многочисленных исследований последних лет [12, 22–26] свидетельствуют о том, что при тяжелых метаболических нарушениях и выраженной белково-энергетической недостаточности, обусловленных патогенетическими особенностями онкологического заболевания и метаболическим ответом на оперативные вмешательства, применение диетического питания из натуральных продуктов полностью не решает проблему адекватного субстратного обеспечения организма больного макро- и микронутриентами, витаминами, энергией. В связи с этим большой научный и практический интерес представляет не только организация полноценного обеспечения энергопластических потребностей, но и своевременная коррекция метаболических нарушений у онкологических больных путем включения в состав программы нутритивной поддержки специализированных продуктов для диетического лечебного (энтерального) питания [1, 3, 7, 10, 11, 15, 18, 21, 27–30].
С этих позиций клиническое питание (парентеральное, энтеральное) в настоящее время рассматривают как «фармакотерапию метаболических нарушений и единственный путь полноценного обеспечения энергопластических потребностей организма онкологического больного, требующих наличия специально подобранных композиций питательных веществ и способов их введения» [7, 10, 11, 13, 17, 24, 30–33].
Энтеральное питание, физиологичное, сохраняющее целостность слизистой оболочки кишечника, отличающееся низким уровнем осложнений, в последнее десятилетие привлекает к себе все большее внимание. Кроме того, одним из важнейших аспектов раннего энтерального питания является повышение активности анаболических процессов, восстановление гомеостаза, а также иммунной системы в ответ на заболевание и хирургическую агрессию [11, 14, 18, 19, 26, 27, 32, 33].
Современная концепция энтерального питания рассматривает его как «фармакологическое питание» [1, 26]:
Смеси адаптированы к функциональному состоянию органов пищеварения и заболеванию пациента, направлены на лечение кишечной недостаточности.
Смеси содержат специфические питательные вещества (нутрицевтики).
Нутритивная ценность, объем и путь введения смеси зависят от тяжести поражения ЖКТ и метаболических расстройств [19, 26, 29, 34].
Таким образом, полноценная нутритивно-метаболическая поддержка в периоперационном периоде требует выполнения программы энтерального питания, в которой должны быть учтены особенности метаболических нарушений, характерные для данного заболевания/состояния, ежедневного определения потребностей в питательных веществах и энергии, а также наличия набора питательных смесей как общего, так и специального назначения [26].
Цель исследования: оценить эффективность периоперационной коррекции метаболических нарушений и полноту обеспечения энергопластических потребностей у онкологических больных при включении в состав программы нутритивной поддержки стандартных и специализированных стерилизованных смесей энтерального питания.
Материал и методы
Характеристика пациентов
Проанализированы результаты лечения 89 пациентов с новообразованиями желудка (55%) и поджелудочной железы (45%), находившихся на лечении в хирургическом отделении и ОРИТ ФГБУ «ГВКГ им. Н.Н. Бурденко», ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ». Мужчин было 71 (79,8%), женщин — 18 (20,2%). Средний возраст пациентов составил 62,1±10,3 года. Наряду с онкологическим заболеванием 32 (35,9%) пациента страдали сахарным диабетом (СД) 2 типа, 39 пациентов (44,1%) — хроническими заболеваниями сердечно-сосудистой системы и легких.
Критерии включения: возраст старше 18 лет, подтвержденный диагноз рака желудка и/или головки поджелудочной железы; необходимость хирургического лечения; наличие питательной недостаточности. Критерии исключения: возраст старше 80 лет, множественные метастазы, интраоперационная кровопотеря более 30% объема циркулирующей крови.
Больным были выполнены следующие оперативные вмешательства: гастрэктомия — 27 (30,3%), субтотальная резекция желудка — 32 (36,0%), гастропанкреатодуоденальная резекция — 30 (33,7%).
Мониторинг эффективности нутритивной поддержки проводился при поступлении и на 1, 3, 5, 7–10-е сутки послеоперационного периода. Состояние метаболического и питательного статуса оценивали по данным биохимических исследований, результатам соматометрии, непрямой калориметрии. Кроме того, на всех этапах лечения контролировали состояние основных функций ЖКТ.
Характеристика смесей
Нутритивную поддержку в качестве предоперационной подготовки проводили всем пациентам в течение 7 сут до операции. Использовались жидкие стерилизованные смеси линии Нутриэн: Нутриэн Стандарт, Нутриэн Стандарт с пищевыми волокнами, Нутриэн Энергия, Нутриэн Энергия с пищевыми волокнами, Нутриэн Диабет, Нутриэн Пульмо.
В соответствии с методическими рекомендациями и регистрационными документами [26] смеси линии Нутриэн предназначены для энтерального питания, могут использоваться как единственный источник питания и энергии либо как дополнение к диетическому питанию взрослых и детей старше 1 года или 3 лет в зависимости от продукта. Количественный и качественный состав смесей обеспечивает суточные потребности организма в основных питательных веществах, энергии, минералах, витаминах и микроэлементах. Эти смеси отличаются хорошими вкусовыми качествами. Содержание в смесях сывороточного белка позволяет обеспечить полноценный аминокислотный состав, оптимальный коэффициент белковой эффективности способствует восстановлению двигательной активности желудка и кишечника [19].
Включение в смеси среднецепочечных триглицеридов (50% среднецепочечных триглицеридов, 50% длинноцепочечных триглицеридов) повышает их усвояемость в ЖКТ, что дает возможность применять данные смеси в раннем послеоперационном периоде, в т. ч. при вмешательствах на ЖКТ. Оптимальное соотношение полиненасыщенных жирных кислот, сбалансированный витаминно-минеральный комплекс обеспечивают выраженный антиоксидантный и иммуномодулирующий эффект [28, 29, 36–38].
Углеводы представлены смесью мальтодекстринов с различным декстрозным эквивалентом (степенью гидролиза), обеспечивают низкий гликемический индекс, что предотвращает возникновение гипергликемии. Наличие пищевых волокон в таких смесях, как Нутриэн Стандарт с пищевыми волокнами, Нутриэн Энергия с пищевыми волокнами, оказывает пребиотическое воздействие, способствует восстановлению функциональной целостности пищеварительного тракта, снижает частоту диареи, замедляет скорость всасывания углеводов, предотвращая повышение уровня глюкозы в крови [26, 34, 39, 40].
Смесь Нутриэн Диабет относится к группе метаболически ориентированных смесей и предназначена для нутритивной поддержки пациентов с СД 2 типа, стрессовой гипергликемией, что соответствует рекомендациям эндокринологов. К особенностям этой специализированной смеси относится также пониженное содержание углеводов, представленных в основном мальтодекстринами с низкой степенью гидролиза и фруктозой, метаболизируемой инсулинонезависимым путем, а также наличие пищевых волокон.
Нутриэн Пульмо — специализированная смесь для энтерального питания больных с острой и хронической дыхательной недостаточностью. Отличием данной смеси является повышенное содержание жиров — 58% (50% которых представлены среднецепочечными жирными кислотами), уменьшенная доля углеводов — 24,4% [28, 29, 36–38]. Наличие антиоксидантов (витаминов Е, С, каротина, селена, таурина) является определяющим эффективность смеси у больных с синдромом острого повреждения легких (СОЛП). Повышенное содержание липидов способствует уменьшению дыхательного коэффициента, минутного объема вентиляции легких и проницаемости легочного эпителия. Эссенциальные жирные кислоты восстанавливают активность ферментов, транспортные функции рецепторов и способствуют образованию простагландинов и лейкотриенов, оказывают регуляторное влияние на иммунный статус [26, 28].
Программа периоперационной нутритивной поддержки
До операции
В зависимости от степени питательной недостаточности и сопутствующей патологии программа нутритивной поддержки включала пероральный прием (сипинг) смесей: 1-я группа (34 пациента) с питательной недостаточностью легкой степени получала стандартную изокалорийную смесь (Нутриэн Стандарт) 600 мл/сут (600 ккал, белки — 24 г, жиры — 21,6 г, углеводы — 77,4 г) в 3 приема перорально в добавление к больничной диете; 2-я группа (25 пациентов) с питательной недостаточностью среднетяжелой степени получала стандартную гиперкалорийную смесь (Нутриэн Энергия) 1000 мл/сут (1500 ккал, белки — 60 г, жиры — 59 г, углеводы — 182 г) в 5–6 приемов перорально в добавление к больничной диете; 3-я группа (30 пациентов) с питательной недостаточностью средней степени и сопутствующим СД 2 типа получала специализированную стерилизованную смесь Нутриэн Диабет 1000 мл/сут (1000 ккал, белки — 43 г, жиры — 39 г, углеводы — 112 г, пищевые волокна — 15 г) в 5–6 приемов пер-орально в добавление к больничной диете (основной вариант стандартной диеты).
В соответствии с современной концепцией ERAS (Enhanced Recovery After Surgery — протокол быстрого восстановления после операции) [31, 32], последний прием твердой пищи осуществлялся за 6 ч до оперативного вмешательства, жидкости — за 2 ч. Интраоперационно устанавливали назогастроинтестинальный зонд, посредством которого проводили энтеральное питание.
После операции
По описанной ранее методике [18, 23, 26, 35] с первых часов послеоперационного периода через кишечный зонд проводили кишечный лаваж и энтеросорбцию.
Как правило, со 2-х суток послеоперационного периода начинали проведение парентерального питания (ПП) по общепринятым схемам [35] с использованием системы
«3 в 1», содержащего стандартный суточный набор витаминов и микроэлементов. Длительность ПП — 2–3 сут. Объем ПП в среднем составлял 25–30 мл/кг/24 ч (1800–2100 ккал/сут) и обеспечивал поступление 50,6–67,5 г белков, 60–80 г жиров, 150–200 г углеводов. При разрешении СКН переходили на энтеральное зондовое питание (ЭЗП), при восстановлении функций ЖКТ зонд удаляли и переводили больного на пероральный прием смесей энтерального питания (сипинг) в сочетании с диетическим питанием.
В послеоперационном периоде выделялись категории пациентов, нуждавшихся в специализированной нутритивной терапии вследствие развития осложнений. Тем самым реализовывался принцип персонификации нутритивной поддержки. Так, 68 пациентов получали специализированные смеси. В их число вошли пациенты 3-й группы (30 человек), которые (с учетом наличия у них СД 2 типа) получали смесь Нутриэн Диабет. Восстановление функций пищеварения позволяло на 6–7-е сутки нутритивную поддержку осуществлять за счет энтерального питания объемом 35,7±2,1 мл/кг/24 ч, что обеспечивало поступление 2500 ккал/сут, 107 г белков, 280 г углеводов, 97,5 г жиров.
У 15 больных послеоперационный период осложнился развитием острой дыхательной недостаточности (пневмония, СОЛП), что потребовало проведения продленной ИВЛ. Данные пациенты составили 4-ю группу, энтеральное питание которых осуществляли смесью Нутриэн Пульмо (в 100 мл — 125 ккал, белки — 5 г, жиры — 8 г, углеводы — 8,2 г). На фоне кишечного лаважа и интенсивной терапии СКН поэтапно переходили с ПП на ЭЗП. На 5–6-е сутки объем ЭЗП составлял 28,8±4,1–34,3 мл/кг/24 ч. В последующем на фоне разрешения дыхательной недостаточности, восстановления адекватного самостоятельного дыхания больного переводили на сипинговое питание смесью Нутриэн Энергия + диетическое питание, суточный
объем — 600–800 мл.
У 23 больных развились послеоперационные гнойно-септические осложнения (нагноение послеоперационной раны, несостоятельность анастомоза, внутрибрюшной абсцесс). Данные пациенты составили 5-ю группу, ЭЗП которой осуществляли с применением смесей Нутриэн Энергия. В большинстве наблюдений восстановление функций ЖКТ позволяло на 6–7-е сутки весь объем нутритивной поддержки обеспечить за счет ЭЗП указанной смесью. После удаления зонда (на 10–12-е сутки после операции) больного переводили на сипинговое питание смесью Нутриэн Энергия с пищевыми волокнами. Основными показаниями для применения гиперкалорийной смеси с пищевыми волокнами были длительное нахождение в отделении реанимации, ПИТ-синдром (синдром после интенсивной терапии), явления дисбактериоза.
Остальные пациенты (21 человек), не требовавшие применения специализированных смесей, получали Нутриэн стандарт (в 100 мл смеси 100 ккал, белки — 4 г, жиры — 3,6 г, углеводы — 12,9 г). Целевых значений по объему ЭЗП достигали на 4–5-е сутки — 1500–2500 мл: 1500–2500 ккал, белки — 100 г, жиры — 90 г, углеводы — 322 г. После удаления зонда переводили больного на пероральный прием смеси Нутриэн Стандарт с пищевыми волокнами в сочетании с диетическим питанием.
Статистическая обработка полученных данных проводилась с использованием методов вариационной статистики с помощью программ Microsoft Excel и MedCalc. Определяли значение среднего арифметического (M) ± стандартное отклонение (δ), медиану. Достоверность различий определяли с помощью t-критерия Стьюдента для малых рядов наблюдения, значимыми считали различия при р≤0,05.
Результаты и обсуждение
Предоперационный период
Результаты скрининга нутритивной недостаточности при поступлении в стационар: 1-я группа — 1-й степени, 2-я группа — 2–3-й степени, 3-я группа — 2-й степени. В 89,4% случаев имел место дефицит тощей массы тела, что еще раз подтвердило необходимость проведения адекватной нутритивной поддержки в предоперационном периоде [5, 15, 16, 34].
На фоне проводимой в течение 5–7 сут предоперационной нутритивной поддержки статистически достоверных как положительных, так и отрицательных изменений соматометрических показателей (индекс массы тела, окружность мышц плеча и толщина кожно-жировой складки трицепса) в 1-й группе не выявлено. Во 2-й группе при оценке этих показателей отмечена положительная динамика, уменьшение числа больных со 2-й степенью недостаточности питания на 8,3±1,71% (р<0,05). Аналогичная тенденция выявлена и в 3-й группе, однако количество больных с положительной динамикой разрешения питательной недостаточности по сравнению со 2-й группой достоверно меньше — на 4,5±1,1% (р<0,05), что, можно полагать, обусловлено сопутствующим заболеванием — СД 2 типа.
Определение показателей белкового обмена при поступлении в стационар показало наличие у всех больных гипопротеинемии, гипоальбуминемии, снижение абсолютного числа лимфоцитов в периферической крови: общий белок — 54,7±0,3 г/л, альбумин — 25,5±0,3 г/л, трансферрин — 1,61±0,13 г/л, абсолютное число лимфоцитов — 697±41 (среднегрупповые значения).
В результате проведения в течение 7 сут нутритивной поддержки отмечено достоверное повышение (среднегрупповые значения) общего белка — 67,3±1,2 г/л, альбумина — 33,5±2,3 г/л, трансферрина — 1,5±0,11 г/л (р<0,05), абсолютного числа лимфоцитов — 969±39 109/л (р≤0,05). Следует отметить, что, несмотря на проводимую нутритивную поддержку в соответствии с расчетными и рекомендуемыми величинами субстратного обеспечения, положительную динамику лабораторных показателей, ко дню оперативного вмешательства полностью скорригировать нарушения статуса питания у онкологических больных с поражением органов ЖКТ не удается. Таким образом, можно полагать, что нутритивная поддержка является обязательным компонентом предоперационной подготовки онкологических больных, имеющих в предоперационном периоде нутритивную недостаточность.
Послеоперационный период
В 3-й группе больных в ранние сроки после оперативного вмешательства (2–5–7-е сутки) нутритивную поддержку осуществляли за счет ЭЗП специальной смесью Нутриэн Диабет, соответственно, уменьшали объем ПП. При полном восстановлении функций ЖКТ больного переводили на ЭЗП смесью Нутриэн Диабет. В последующем, после удаления зонда, в коечном отделении 85% больных получали данную смесь перорально в сочетании с диетическим питанием (щадящая диета) — до 15–20 сут послеоперационного периода. Следует отметить, что декомпенсации СД, гипергликемии, увеличения суточной дозы инсулина отмечено не было, гликемический профиль оставался стабильным и не превышал 10 ммоль/л.
Об эффективности проведенной нутритивно-метаболической поддержки свидетельствует уже на 7–10-е сутки послеоперационного периода положительный баланс по белкам, нормализация показателей белкового обмена, снижение потребности в энергии (табл. 1).

Подтверждением адекватности проводимой нутритивно-метаболической поддержки является динамика стрессовых и анаболических гормонов. Так, с 3-х к 7-м суткам послеоперационного периода отмечено достоверное снижение содержания кортизола — с 28,9±2,31 мкг/дл до 13,2±1,4 мкг/дл (р<0,05) и повышение в этот же период концентрации соматотропного гормона — от 1,49±0,38 нг/мл
до 6,45±0,23 нг/мл (р<0,05).
В 4-й группе больных, по данным непрямой калориметрии, истинный расход энергии в динамике к 3-м суткам после оперативного вмешательства увеличился в среднем до 40–45 ккал / кг / 24 ч. На фоне проводимой нутритивно-метаболической поддержки к 7–10-м суткам интенсивной терапии энергозатраты уменьшались и составляли 30–35 ккал / кг / 24 ч (p<0,05). На этом же этапе послеоперационного периода отмечено повышение уровня общего белка до 60,1±0,9 г/л, альбумина — до 29,9±0,2 г/л, трансферрина — до 2,01±0,2 г/л, инверсия баланса азота от отрицательного к положительному — +3,1±0,5 г/сут (р<0,05).
Анализ полученных результатов свидетельствует об эффективности энтерального питания с применением специализированной смеси при острой дыхательной недостаточности. Повышенное содержание белков и жиров и пониженное содержание углеводов в смеси благоприятно для больных с дыхательной недостаточностью [16, 17, 33, 55]. В наших исследованиях получены аналогичные результаты — индекс оксигенации повысился с 192 до 357 (p<0,05), отмечается положительная динамика в разрешении гипоксемии (табл. 2). Это создает предпосылки для перевода больного на самостоятельное дыхание на 2–3 дня
раньше, чем при рутинном проведении нутритивной поддержки стандартными смесями энтерального питания.
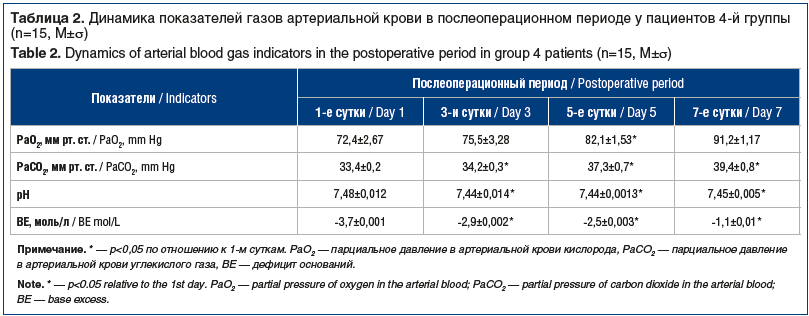
Следует также подчеркнуть, что избыточная нагрузка белком (больше 1,25 г / 100 мл) в остром периоде, особенно при СОЛП, приводит к усилению продукции острофазных белков и «цитокинового шторма», что нежелательно. Известно, что обогащение диеты омега-3-ПНЖК уменьшает СОЛП при сепсисе путем снижения легочной гипертензии, уменьшения формирования отека и миграции нейтрофилов в легкие, снижения продукции липидных медиаторов — производных арахидоновой кислоты [23, 26]. Таким образом, применение метаболически направленной специализированной смеси Нутриэн Пульмо определяет положительный результат разрешения дыхательной недостаточности и коррекции метаболических нарушений.
В 5-й группе больных с 1-х суток послеоперационного периода отмечался рост энергопотребности, который на 2–3-и сутки превысил в 3–4 раза исходные значения, что послужило необходимостью включать в программу нутритивной поддержки смесь Нутриэн Энергия. Истинный расход энергии от 1-х к 3-м суткам возрастал в среднем с 25,2±2,13 ккал/кг/24 ч до 45,3±8,1 ккал/кг/24 ч. В последующем на этапах исследования к 10–12-м суткам потребности в энергии снижались до 30–35 ккал/кг/24 ч.
Следует отметить, что если в 1-е сутки лейкоцитоз достигал 19,3±2,101×109/л, то к 7–10-м суткам — 11,2±1,1×109/л. Соответственно, величина лейкоцитарного индекса интоксикации снижалась с 10,98±0,9 до 4,1±0. Результаты исследования свидетельствуют о снижении уровня интоксикации, что происходило параллельно с разрешением белково-энергетической недостаточности за счет эффективности нутритивно-метаболической поддержки. Нормализация показателей метаболизма к 7–10-м суткам послеоперационного периода происходила благодаря полноценному обеспечению энергетических и пластических потребностей пациентов этой группы смесями Нутриэн Энергия и Нутриэн Энергия с пищевыми волокнами.
Заключение
Результаты выполненных исследований по эффективности использования смесей Нутриэн Стандарт, Нутриэн Стандарт с пищевыми волокнами, Нутриэн Энергия, Нутриэн Энергия с пищевыми волокнами, Нутриэн Пульмо, Нутриэн Диабет как средства энтерального питания в комплексе периоперационной нутритивной поддержки у онкологических пациентов свидетельствуют о высокой клинической эффективности применения этих смесей, возможности выбора смеси на основании конкретной клинической ситуации, что позволяет адекватно корригировать метаболические нарушения и полноценно удовлетворять энергопластические потребности организма, обеспечить наиболее естественный путь введения нутриентов, повысить эффективность реабилитационных мероприятий за счет персонифицированной программы нутритивной поддержки.
Благодарность
Редакция благодарит компанию АО «ИНФАПРИМ» за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgement
Editorial Board is grateful to JSC "INFAPRIM" for the assistance in technical edition of this publication.
Сведения об авторах:
Арыкан Нина Геннадьевна — к.м.н., врач анестезиолог-реаниматолог, ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ», 105187, Россия, г. Москва, ул. Фортунатовская, д. 1; ORCID iD 0000-0002-8731-6168.
Евдокимов Евгений Александрович — д.м.н., профессор, заведующий кафедрой анестезиологии и неотложной медицины ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1.
Стец Валерий Викторович — начальник Центра анестезиологии-реанимации, реанимации и интенсивной терапии, главный анестезиолог-реаниматолог ФГБУ «ГВКГ им. Н.Н. Бурденко»; 105094, Россия, г. Москва, Госпитальная пл., д. 3.
Зырянов Виталий Андреевич — начальник отделения реанимации и интенсивной терапии Центра анестезиологии-
реанимации, реанимации и интенсивной терапии ФГБУ «ГВКГ им. Н.Н. Бурденко»; 105094, Россия, г. Москва, Госпитальная пл., д. 3; ORCID iD 0000-0001-9931-8673.
Журавлев Андрей Григорьевич — к.м.н., начальник отделения реанимации и интенсивной терапии Центра анестезиологии-реанимации, реанимации и интенсивной терапии ФГБУ «ГВКГ им. Н.Н. Бурденко»; 105094, Россия, г. Москва, Госпитальная пл., д. 3; ORCID iD 0000-0002-8124-9320.
Шестопалов Александр Ефимович — д.м.н., профессор, заслуженный врач РФ, профессор кафедры анестезиологии и неотложной медицины РМАНПО, консультант анестезиолог-реаниматолог ГВКГ им. Н.Н. Бурденко, главный научный сотрудник ФНКЦ РР, вице-президент Национальной ассоциации клинического питания и метаболизма; ORCID iD 0000-0002-5278-7058.
Контактная информация: Шестопалов Александр Ефимович, e-mail: ashest@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 15.03.2021, поступила после рецензирования 16.04.2021, принята в печать 30.04.2021.
About the authors:
Nina G. Arykan — Cand. of Sci. (Med.), anesthesiologist-intensivist, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0002-8731-6168.
Evgeniy A. Evdokimov — Dr. of Sci. (Med.), Professor, Head of the Department of Anesthesiology and Intensive Care Medicine, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 123995, Russian Federation.
Valeriy V. Stets — Head of the Center of Anesthesiology and Intensive Care Medicine, Chief anesthesiologist-intensivist of the Main Military Clinical Hospital named after N.N. Burdenko; 3, Gospitalnaya square, Moscow, 105094, Russian Federation.
Vitaliy A. Zyryanov — Head of the Intensive Care Unit of the Center of Anesthesiology and Intensive Care Medicine, Main Military Clinical Hospital named after N.N. Burdenko; 3, Gospitalnaya square, Moscow, 105094, Russian Federation; ORCID iD 0000-0001-9931-8673.
Andrey G. Zhuravlev — Cand. of Sci. (Med.), Head of the Intensive Care Unit of the Center of Anesthesiology and Intensive Care Medicine, Main Military Clinical Hospital named after N.N. Burdenko; 3, Gospitalnaya square, Moscow, 105094, Russian Federation; ORCID iD 0000-0002-8124-9320.
Aleksandr E. Shestopalov — Dr. of Sci. (Med.), Professor, Honored Doctor of the Russian Federation, Professor of the Department of Anesthesiology and Emergency Medicine of the Russian Medical Academy of Continuous Professional Education, consultant anesthesiologist-intensivist of the Main Military Clinical Hospital named after N.N. Burdenko, Chief Researcher of the Federal Research and Clinical Center of Intensive Care Medicine and Rehabilitology, Vice-President of the Russian Society of Clinical Nutrition and Metabolism; ORCID iD 0000-0002-5278-7058.
Contact information: Aleksandr E. Shestopalov, e-mail: ashest@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.03.2021, revised 16.04.2021, accepted 30.04.2021.
2. Lim S.L., Ong K.C., Chan Y.H. et al. Malnutrition and its impact on cost of hospitalization, length of stay, readmission and 3-year mortality. Clin Nutr. 2012;31(3):345–350. DOI: 10.1016/j.clnu.2011.11.001.
3. Бойко А.В., Геворков А.Р., Волкова Е.Э. и др. Нутритивная поддержка как обязательный компонент терапии сопровождения при лучевом и химиолучевом лечении больных с опухолями головы и шеи. Опухоли головы и шеи. 2017;7(1):50–60. DOI: 10.17650/2222-1468-2017-7-1-50-60.
4. Сергиенко А.Д., Хороненко В.Э., Гамеева Е.В. и др. Влияние нутритивной терапии на показатели качества жизни больных раком желудка на этапе хирургического лечения. Исследования и практика в медицине. 2019;6(3):108–114. DOI: 10.17709/2409-2231-2019-6-3-10.
5. Хомяков В.М., Хороненко В.Э., Ермошина А.Д. Проблема нутритивной недостаточности и методы ее коррекции у больных со злокачественными опухолями пищевода и желудка. Онкология. Журнал им. П.А. Герцена. 2016;5(5):33–37.
6. Kabata Р., Jastrzębski Т., Kąkol М. et al. Preoperative nutritional support in cancer patients with no clinical signs of malnutrition — prospective randomized controlled trial. Support Care Cancer. 2015;23(2):365–370. DOI: 10.1007/s00520-014-2363-4.
7. Arends J., Baracos V., Bertz Н. et al. ESPEN expert group recommendations for action against cancer-related malnutrition. Clin Nutr. 2017;36:1187–1196. DOI: 10.1016/j.clnu.2017.06.017.
8. Martin L., Senesse P., Gioulbasanis I. et al. Diagnostic criteria for the classification of cancer-associated weight loss. J Clin Oncol. 2015;33:90–99. DOI: 10.1200/JCO.2014.56.1894.
9. Del Paggio J.C., Sullivan R., Schrag D. et al. Delivery of meaningful cancer care: a retrospective cohort study assessing cost and benefit with the ASCO and ESMO frameworks. Lancet Oncol. 2017;18(7):887–894. DOI: 10.1016/S1470-2045 (17) 30415-1.
10. Обухова О.А. Стратегия питательной поддержки при проведении противоопухолевого лечения. РМЖ. 2009;22:1500–1504. [Obukhova O.A. Nutritional support strategy for antitumor treatment. RMJ. 2009;22:1500–1504 (in Russ.).
11. Сытов А.В., Лейдерман И.Н., Ломидзе С.В. и др. Практические рекомендации по нутритивной поддержке онкологических больных. Злокачественные опухоли. 2019;9:639–647. DOI: 10.18027 / 2224-5057-2019-9-3s2-639-647.
12. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7–30. DOI: 10.3322/caac.21442.
13. Le Tourneau C., Delord J.P., Gonçalves A. et al. Molecularly targeted therapy based on tumour molecular profiling versus conventional therapy for advanced cancer (SHIVA): a multicentre, open-label, proof-of-concept, randomised, controlled phase 2 trial. Lancet Oncol. 2015;16(13):1324–1334. DOI: 10.1016/S1470-2045 (15) 00188-6.
14. Абдуллаев А.Г. Клинические рекомендации Ассоциации онкологов России. Рак желудка. М., 2018.
15. Хомяков В.М., Ермошина А.Д. Коррекция нутритивной недостаточности у онкологических больных с использованием готовых смесей для перорального питания (сипинга). Исследования и практика в медицине. 2015;2(3):82–88. DOI: 10.17709/2409-2231-2015-2-3-82-88.
16. Салтанов А.И., Лейдерман И.Н., Снеговой А.В. Искусственное питание в поддерживающей терапии онкологических больных. М.: МИА; 2012.
17. Боброва О.П., Зуков Р.А., Модестов А.А. Персонификация нутритивной поддержки при онкологических заболеваниях желудочно-кишечного тракта в периоперационном периоде. Сибирское медицинское обозрение. 2016;1:33–39.
18. Интенсивная терапия. Национальное руководство. Под ред. Б.Р. Гельфанда, И.Б. Заболотских. М.: ГЭОТАР-Медиа; 2019.
19. Хорошилов И.Е. Значение открытий А.М. Уголева для развития энтерального и парентерального питания. Экспериментальная и клиническая гастроэнтерология. 2016;126(2):14–17.
20. Lim S.L., Ong K.C., Chan Y.H. et al. Malnutrition and its impact on cost of hospitalization, length of stay, readmission and 3-year mortality. Clin Nutr. 2012;31(3):345–350. DOI: 10.1016/j.clnu.2011.11.001.
21. Caccialanza R., Pedrazzoli Р., Cereda Е. et al. Nutritional Support in Cancer Patients: A Position Paper from the Italian Society of Medical Oncology (AIOM) and the Italian Society of Artificial Nutrition and Metabolism (SINPE). J Cancer. 2016;7(2):131–135. DOI: 10.7150/jca.13818.
22. Feliciano E.M., Lee V.S., Prado C.M. et al. Muscle mass at the time of diagnosis of nonmetastatic colon cancer and early discontinuation of chemotherapy, delays, and dose reductions on adjuvant FOLFOX: the C-SCANS study. Cancer. 2017;123:4868–4877. DOI: 10.1002/cncr.30950.
23. Мачулина И.А., Шестопалов А.Е., Евдокимов Е.А. Терапия тяжелой кишечной недостаточности: основные этапы и роль фармаконутриентов. Медицинский алфавит. 2020;(7):49–52. DOI: 10.33667/2078-5631-2020-7-49-52.
24. Van Blarigan E.L., Fuchs C.S., Niedzwiecki D. et al. Association of survival with adherence to the American Cancer Society Nutrition and Physical Activity Guidelines for Cancer Survivors after colon cancer diagnosis — The CALGB 89803/alliance trial. JAMA Oncol. 2018;4:783–790. DOI: 10.1001/jamaoncol.2018.0126.
25. Cox S., Powell C., Carter B. et al. Role of nutritional status and intervention in oesophageal cancer treated with definitive chemoradiotherapy: outcomes from SCOPE1. Br J Cancer. 2016;115:172–177. DOI: 10.1038/bjc.2016.129.
26. Арутюнов Г.П., Бутров А.В., Евдокимов Е.А. и др. Методические рекомендации по применению продуктов Нутриэн для диетического (лечебного) питания. М.; 2015.
27. Снеговой А.В., Кононенко И.Б., Ларионова В.Б. и др. Практические рекомендации по коррекции синдрома анорексии-кахексии у онкологических больных. Злокачественные опухоли. 2016;4:469–473. DOI: 10.18027/2224-5057-2016-4s2-469-475.
28. Nakao M., Muramatsu H., Kagawa Y. et al. Immunological status may predict response to nivolumab in non-small cell lung cancer without driver mutations. Anticancer Res. 2017;37:3781–3786. DOI: 10.21873/anticanres.11753.
29. Chow R., Bruera Е., Chiu L. Enteral and parenteral nutrition in cancer patients: A systematic review and meta-analysis. Annals of Palliative Medicine. 2016;5(1):30–41. DOI: 10.3978/j.issn.2224-5820.2016.01.01.
30. Arends J., Bachmann Р., Baracos V. et al. ESPEN guidelines on nutrition in cancer patients, Clin Nutr. 2017;36:11–48. DOI: 10.1016/j.clnu.2016.07.015.
31. Weimann А., Braga М., Carli F. et al. ESPEN guideline: Clinical nutrition in surgery. Clin Nutr. 2017;36:623–650. DOI: 10.1016/j.clnu.2017.02.013.
32. Singer Р., Blager A.R., Berger M. et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clic Nutr. 2019;38(1):48–79. DOI: 10.1016/j.clnu.2018.08.037.
33. Sullivan R., Pramesh C.S., Booth C.M. Cancer patients need better care, not just more technology. Nature. 2017;549:325–328. DOI: 10.1038/549325a.
34. Nasrah R., Kanbalian M., Van Der Borch C. et al. Defining the role of dietary intake in determining weight change in patients with cancer cachexia. Clin Nutr. 2018;37:235–241. DOI: 10.1016/j.clnu.2016.12.012.
35. Мачулина И.А., Шестопалов А.Е., Петрова М.В. Диагностические критерии синдрома кишечной недостаточности как лимитирующего фактора энтерального питания. Инфекции в хирургии. 2019;3:20–31.
36. Song M., Zhang X., Meyerhardt J.A. et al. Marine ω-3 polyunsaturated fatty acid intake and survival after colorectal cancer diagnosis. Gut. 2017;66:1790–1796. DOI: 10.1136/gutjnl-2016-311990.
37. Van Blarigan E.L., Fuchs C.S., Niedzwiecki D. et al. Marine ω-3 polyunsaturated fatty acid and fish intake after colon cancer diagnosis and survival: CALGB 89803 (alliance). Cancer Epidemiol Biomarkers Prev. 2018;27:438–445. DOI: 10.1158/1055-9965. EPI-17-0689.
38. Shirai Y., Okugawa Y., Hishida A. et al. Fish oil-enriched nutrition combined with systemic chemotherapy for gastrointestinal cancer patients with cancer cachexia. Sci Rep. 2017;7:4826. DOI: 10.1038/s41598-017-05278-0.
39. Baracos V.E., Martin L., Korc M. et al. Cancer-associated cachexia. Nat Rev Dis Primers. 2018;4:17105. DOI: 10.1038/nrdp.2017.105.
40. Cespedes Feliciano E.M., Kroenke C.H., Bradshaw P.T. et al. Postdiagnosis weight change and survival following a diagnosis of early-stage breast cancer. Cancer Epidemiol Biomarkers Prev. 2017;26:44–50. DOI: 10.1158/1055-9965.EPI-16-0150.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
